木薯转录因子基因MeHDZ14的克隆与分析
2017-08-22于晓玲阮孟斌杨义伶王树昌彭
于晓玲 阮孟斌 王 斌 杨义伶 王树昌彭 明
中国热带农业科学院热带生物技术研究所 /农业部热带作物生物学与遗传资源利用重点实验室,海南海口 571101
木薯转录因子基因MeHDZ14的克隆与分析
于晓玲 阮孟斌 王 斌 杨义伶 王树昌*彭 明*
中国热带农业科学院热带生物技术研究所 /农业部热带作物生物学与遗传资源利用重点实验室,海南海口 571101
HD-Zip家族基因在植物生长发育和逆境胁迫中起重要作用。为了研究MeHDZ14基因在非生物胁迫(尤其是干旱)应答中的作用,选用对干旱信号反应灵敏、相对耐旱的木薯品种“SC124”作为实验材料,利用RT-PCR克隆了MeHDZ14基因。生物信息学分析发现,MeHDZ14基因编码的蛋白具有典型的HD-Zip保守结构域。将该基因编码的蛋白与GFP融合,亚细胞MeHDZ14:GFP重组蛋白定位于细胞核。同时,酵母Y187中的转录自激活试验结果也表明, MeHDZ14蛋白具有明显转录自激活功能。推断MeHDZ14是一个典型的HD-Zip I转录因子。MeHDZ14启动子区具有多个ABA响应元件ABRE(ABA response element)。基因差异表达分析结果表明,MeHDZ14基因在叶片和根中的表达受干旱胁迫的诱导,并对外源ABA具有明显的响应。因此,认为MeHDZ14基因通过ABA依赖信号传导途径参与调控木薯干旱响应。此外,还发现MeHDZ14基因的编码区虽然存在数个SNP,但表现出高度保守性,且在不同木薯品种中的表达对干旱胁迫均有明显的响应,为进一步研究该基因的功能奠定了基础。
木薯;MeHDZ14;结构特性;表达分析
干旱是导致作物减产的重要非生物胁迫因素,干旱胁迫引起植物体多种生理指标的复杂变化,对植物体造成多方面的伤害。植物在长期的进化过程中,逐渐演化生成感受或传导干旱胁迫因子的信号系统及一系列生物反应机制来应对胁迫,以尽可能减小对机体的伤害[1]。植物从干旱信号的感知、传递,到抵御干旱的应答过程中涉及一系列的抗逆相关基因/因子的表达,包括功能基因和转录因子基因[2]。
由于转录因子基因对胁迫因子反应迅速,植物抗旱相关转录因子基因被称为早期干旱响应基因[3]。研究表明,从低等的蕨类植物[4]及苔藓植物[5],到高等被子植物拟南芥[6]、水稻[7]、玉米[8]、烟草[9]、番茄[10]、大麦[11]、大豆[12]、向日葵[13]、菊花[14]等物种中都分离到HD-Zip(homeodomain-leucine zipper)类转录因子,它们与植物的生长发育密切相关。研究表明[15],HD-Zip家族成员在植物抵抗逆境反应中起重要作用,其中编码大约35 kD的蛋白的HD-Zip I亚家族成员作用尤其明显。HD-Zip I亚家族成员具有高度保守的HD结构域,以及相似度较低的LZ区域[16],可作为转录因子参与调控植物发育过程[13,17-18]。在应对干旱等非生物胁迫环境条件变化时,HD-Zip I类蛋白在植物中参与的生理功能主要包括非生物胁迫反应[19]、脱落酸(ABA)应答途径[20]、蔗糖信号转导途径[21]、去黄化反应[22]、蓝光感应[23]、胚胎发生等[24]。
干旱胁迫或外施ABA可诱使某些拟南芥HD-Zip I基因出现上调或下调表达[20]。拟南芥ATHB-5和ATHB-6呈下调表达[25-27],进一步的研究发现ATHB-6是通过调节丝氨酸磷酸酶基因(ABI1)的表达,从而在ABA信号通道中起作用,最终起到耐受逆境(干旱等渗透胁迫)的效果[28]。Himmelbach等[29]分析发现,ATHB6启动子的活性随着外源ABA浓度的升高而上升。这些证据说明ATHB-6基因在ABA通路中起重要作用。在干旱及盐胁迫处理下, ATHB-13与其下游目标基因表达量显著升高[19]。在干旱胁迫或ABA处理条件下ATHB-7和ATHB-12基因上调表达,同时ATHB-7的表达还受盐胁迫和渗透胁迫诱导。CPHB6和CPHB7基因的表达受水分胁迫与ABA的响应上调,而CPHB3、CPHB4、CPHB5下调表达[30]。玉米HD-Zip I基因(Zmhdz10)受干旱、盐和ABA的诱导,可以通过ABA信号途径来调节植物对干旱和盐的耐受性[31]。向日葵Hahb4基因在干旱诱导启动子的作用下,也可提高转基因拟南芥植株耐受干旱的能力[32]。
木薯是重要的粮食作物及新型能源作物,在热带和亚热带地区广泛种植,对热带地区间歇性干旱有很强的适应能力,是研究植物抗旱耐贫瘠的宝贵资源。关于木薯HD-Zip类转录因子家族的研究尚无报道。本研究从木薯中克隆得到一HD-Zip基因,命名为MeHDZ14,并分析了它的亚细胞定位/转录自激活活性,不同木薯品种/处理下该基因表达谱,及其抗逆功能,以期解析MeHDZ14与木薯耐干旱性状的关系,验证其基因功能。该研究有助于从理论上了解HD-Zip转录因子在木薯中作用的分子机制,其对木薯发育的影响,对于遗传育种工作有很好的指导意义。
1 材料与方法
1.1 植物材料
利用已经筛选到的对干旱信号反应灵敏(叶片萎蔫)、表型明显的耐旱品种SC124作为的试验材料[33-34],其他种质由中国热带农业科学院热带生物技术研究所种质资源圃种植保存。
采用海南常见地表红土与蛭石按1∶2比例混合,晒干后分装于塑料花盆中,称重(每盆3 kg)。每盆扦插1节木薯茎秆,充分浇水使土壤湿润保持最大持水量。将木薯盆置防雨大棚中,每周2次浇灌以补给营养,保证木薯植株正常生长约2个月,木薯株高约1 m左右时选取长势相似的植株作为干旱处理的样品。
1.2 宿主菌及载体
大肠杆菌(Escherichia coli)DH5α感受态细胞购自天根生物科技有限公司;根癌农杆菌(Agrobacterium tumefaciens)LBA4404菌株,由中国热带农业大学热带生物技术研究所实验室保存;Y187酵母菌株(带有LacZ报告基因)购自Clontech公司。PCAMBIA 1300::GFP由本实验室改造保存;克隆载体pMD18-T购自宝生物工程(大连)有限公司;pGBKT7载体购自Clontech公司。
1.3 各种酶及试剂
限制性内切酶购自Fermentas;SYBR Premix Ex Taq II(Tli RNaseH Plus)、SpeedSTARTM HS DNA Polymerase购自宝生物工程(大连)有限公司;RNA提取试剂盒购自Promega公司;植物基因组DNA提取试剂盒、氨苄霉素(Amp)、卡那霉素(Kan)、氯霉素(Cam)、利福平(Rif)、羧苄青霉素(Carb)、MOPS、IPTG等购自上海生工生物工程技术服务有限公司;胶回收试剂盒、质粒提取试剂盒为北京艾德莱生物科技有限公司产品。
1.4 目标基因的分离
根据植物HD-Zip蛋白保守结构域,利用Blast方法在木薯基因组Pfam数据库(http://www.phytozome. net/)中搜索相关序列,获取具有HD、Zip和START结构域的木薯HD-Zip基因序列;进一步将其与木薯干旱胁迫转录组数据结合分析获得目标基因。
以木薯SC124基因组cDNA为模板,以包含开放阅读框的引物(正向GATGAAGCAGAA-3¢;反向AGAAATCCCACCACT-3¢,其中下画线部分依次为Xba I和Kpn I酶切位点,斜体部分为保护碱基)扩增目标基因。PCR体系含:PrimerSTAR缓冲液 (2×)25 µL、10 mmol L–1双向引物各1µL、300 ngµL–1cDNA 2µL,以ddH2O补足至50µL。PCR程序为:98℃预变性1 min;98℃ 10 s;55℃ 15 s;72℃ 2 min;35个循环后72℃延伸7 min。反应结束后,回收特异片段,与pMD18-T载体连接后转化E.coli/DH5a感受态细胞,经Amp抗性筛选后提取质粒分别进行PCR及Bam H I和Nco I酶切鉴定,将鉴定为阳性克隆测序并与基因组所获得的序列比对分析,命名为MeHDZ14基因。
启动子克隆:根据JGI(http://www.phytozome. net/search.php)中收录的MeHDZ基因DNA序列及其上游1500 bp的序列为参考,设计特异性扩增引物(正向反向其中画线部分分别为Xba I和Kpn I酶切位点,斜体部分为保护碱基),以木薯栽培品种 SC124基因组DNA为模板,对MeHDZ14基因区起始密码子(ATG)前1500 bp序列进行特异性PCR扩增。
1.5 基因序列的生物信息学分析
利用 NCBI的 Spidey(http://www.ncbi.nlm.nih. gov/spidey/)和 Net-Gene2 V2.4(http://www.cbs.dtu. dk/services/NetGene-2/)分析基因结构[35]。用GSDS (http://gsds.cbi.pku.edu.cn/index.php?input=seq)[36]分析内含子相位。以木薯野生型品种W14及其他8个常见栽培品种DNA为模板,以候选基因完整阅读框两侧序列为引物,PCR扩增产物用作候选基因序列SNP多态性分析。
1.5.1 DNA序列对比分析 将所获得的木薯MeHDZ14目标基因的DNA序列与GenBank中的cDNA序列比对分析。
1.5.2 基因结构分析 克隆来自不同木薯品种的MeHDZ14基因DNA序列,利用NCBI出具的Spidey (http://www.ncbi.nlm.nih.gov/spide/) 和 NetGene2 V2.4(http://cbs.dtu.dk/services/NetGene2/)分析其基因结构;利用GSDS(http://gsds.cbi.pku.edu.cn/index. php)分析内含子相位;利用DNAMAN v6.0软件绘制基因结构图。
1.5.3 木薯MeHDZ14蛋白分析 将克隆所得MeHDZ14基因序列翻译成蛋白序列,用PeptideMass (http://web.expasy.org/cgi-bin/peptide_mass/peptidemass.pl)分析编码氨基酸的理化性质;利用http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=i ndex进行蛋白质三级结构预测;使用WoLF PSORT软件(http://www.genscript.com/tools/wolf-psort)预测蛋白亚细胞定位,设KNN为14。
1.5.4 启动子分析 使用在线PLACE分析工具(http://www.dna.affrc.go.jp/PLACE/signalscan.html)预测分析MeHDZ14基因的启动子元件及转录因子结合位点。
1.6 MeHDZ14基因转录活性及定位分析
将目标基因的开放阅读框插入pGBKT7载体相应多克隆位点,并转化酵母Y187细胞。将带有pGBKT7对照载体及鉴定为阳性的 pGBKTMeHDZ14载体的酵母菌液活化,将其浓度调整一致后,涂板(SD-Trp营养缺陷型培养基+40mg mL–1X-Gal),30℃倒置培养3~5 d后,观察酵母显色情况。
对应相应酶切位点,将MeHDZ14基因片段插入表达载体 pCAMBIA1300,构建 CaMV35S:: MeHDZ14::GFP::NOS工程载体。采用冻融法将工程载体导入农杆菌LBA4404菌株。将LBA4404/ MeHDZ14菌株活化后,用一次性注射器吸取菌液,从烟草叶片背面压送并渗透到叶片组织中,标记,培养48 h;以pG1300::GFP对照载体转化农杆菌注射的烟草为对照,对烟草注射部位进行压片,于激光扫描共聚焦显微镜下观察GFP荧光,激发光为488 nm和546 nm。
1.7 MeHDZ14基因表达谱分析
分别采集干旱处理各个时间点(停水8、10、12、14和20 d)的SC124的盆栽苗叶片、叶柄、根系组织,抽提木薯总RNA,–80℃超低温冰箱保存备用;以50µmol L–1ABA溶液胁迫处理木薯叶片0、1、3和6 h,并分别设置对照组;取不同木薯品种(Q10/ I582/南植199(NZ199)/C3/SC5/Arg7/SC124/SC205/蛋黄木薯(DAN)/海南红心(HN-hong)/新选 048 (X048))叶片组织,抽提其总RNA,并采用反转录试剂盒反转录成cDNA。
根据候选基因的序列设计引物(正向5¢-GGGAG GCAGCAGCTGTGAAT-3¢;反向5¢-CCAGGTTCCA TCATTCTCAT-3¢),选择Actin1基因(正向5¢-GGGA GGCAGCAGCTGTGAAT-3¢;反向5¢-CCTCCTACG ACCCAATCTCA-3¢)为内参,进行不同处理间基因表达差异的定量分析。反应体系为SYBR Premix Ex Taq II(2×)10µL,10 mmol L–1引物各0.8µL,ROX Reference Dye(50×)0.4µL,cDNA 1µL,以ddH2O补足至20µL。用AB Applied Biosystems StepOne Plus仪器进行PCR,程序为95℃预变性30 s;95℃ 5 s;60℃ 30 s;40个循环。采用DDCt法定量分析。设3次试验重复。
2 结果与分析
2.1 MeHDZ14基因克隆与分析
MeHDZ14的ORF包含726 bp核苷酸的完整阅读框,编码蛋白包含241个氨基酸,等电点为4.75,分子量约27.41 kD;MeHDZ14编码蛋白氨基酸在NCBI的保守结构域数据库进行比对发现,其具有HD-ZIP家族的保守结构域(图1-A),其蛋白三维空间结构(图1-B)具有典型HD-Zip三螺旋结构。Blastp结果MeHDZ14与野草莓属(Fragaria vesca)HD-ZIP家族基因ATHB-7(NCBI序列号为XP_004306630.1)具有较高的同源性(76%)、与杨树(Populus trichocarpa)HD-ZIP家族基因(NCBI序列号为XP_ 002320889.1)具有88%同源性。因此,MeHDZ14是属于HD-Zip I亚家族成员。
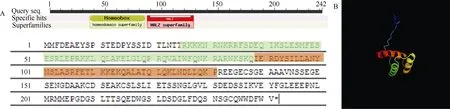
图1 MeHDZ14基因结构分析
2.2 MeHDZ14转录因子活性分析
MeHDZ14属于HD-Zip I亚家族成员,暗示着MeHDZ14可能作为一个转录因子在细胞中行使功能。蛋白定位预测分析显示,MeHDZ14蛋白可能定位于细胞核。为了验证MeHDZ14的亚细胞定位,将目标基因与GFP融合后(载体结构如图2-A所示),通过烟草叶片瞬时表达体系亚细胞定位分析(图2-B)表明,MeHDZ14基因编码蛋白位于细胞核内。为验证目标基因是否具备转录激活作用,以空白载体为阴性对照,将目标基因转化酵母感受态细胞,通过蛋白互作验证系统研究(图2-C)表明,MeHDZ14基因的表达产物能够激活酵母Y187菌株中LacZ基因的表达,在X-α-gal/–Trp平板上显示蓝色,说明MeHDZ14具备转录自激活功能。因此推断MeHDZ14是转录因子。
2.3 MeHDZ14参与的干旱等胁迫响应过程
采用在线软件PLANTCARE分析MeHDZ14基因上游约1500 bp长的启动子序列,预测该启动子可能具有的结构域位点。生物信息学分析显示(表1),启动子区域含有68个TATA-box,24个CAAT-box,多个光信号响应元件,以及ABA响应元件ABRE,MYBH结合位点、乙烯响应元件ERE、GA响应元件GARE-motif、胁迫响应相关元件TC-rich repeats。这些启动子元件可能在响应ABA以及非生物胁迫信号中发挥作用,从而调控MeHDZ14基因表达。
为了验证MeHDZ14转录因子在干旱等胁迫过程中的反应,采用半定量RT-PCR表达验证结果显示(图3),MeHDZ14基因在木薯叶片与根系组织中的表达水平很低,随干旱程度的加重MeHDZ14呈诱导上升表达趋势。图4显示,50 μmol L–1ABA处理木薯叶片时,MeHDZ14基因表达差异明显,因此选择50 μmol L–1ABA浓度继续进行时间梯度试验,随着处理时间的延长,MeHDZ14基因受到诱导表达上调,在3 h时达到最高峰。
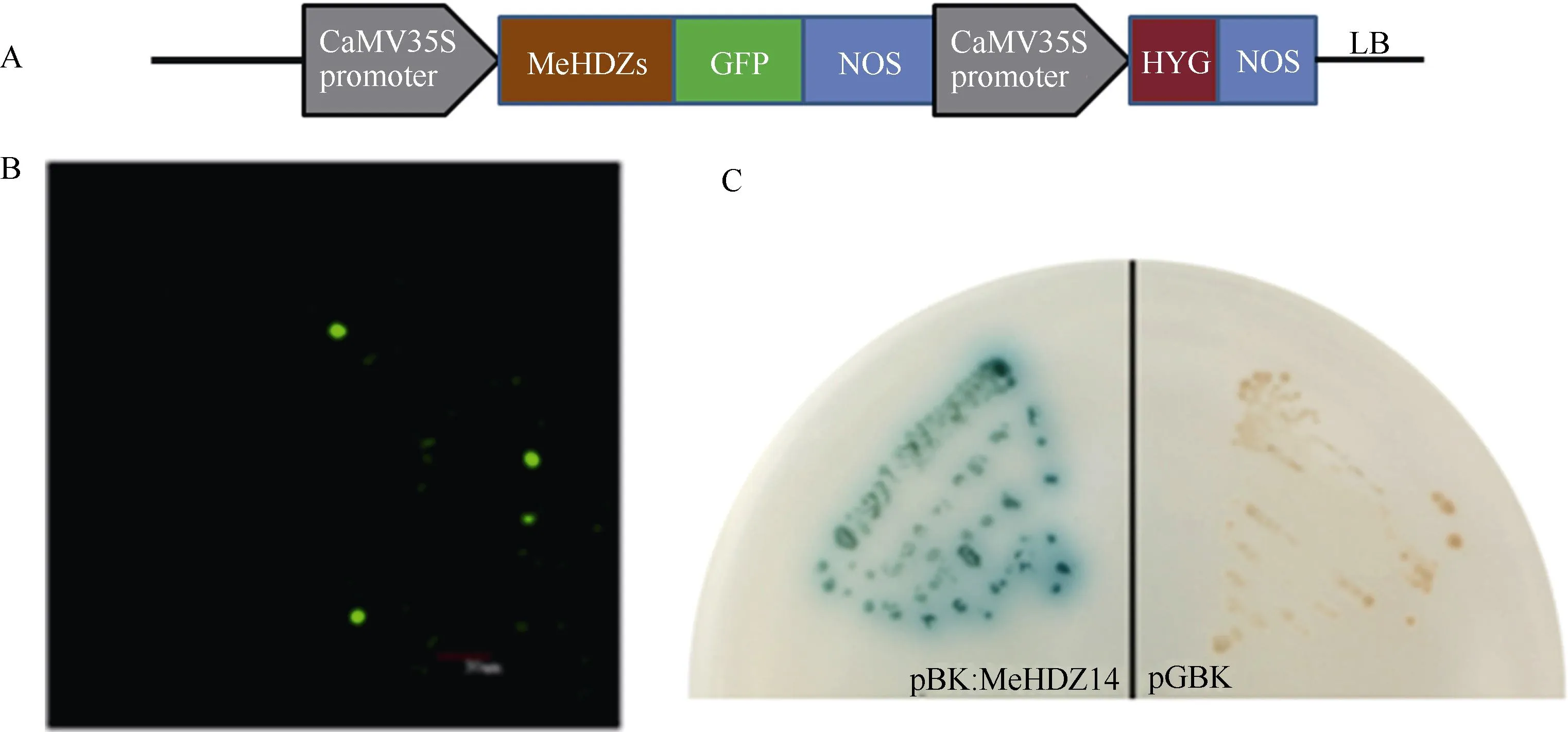
图2 转录因子验证结果

表1 启动子调控元件分析Table 1 cis-acting regulatory elements analysis of promoter sequence

图3 干旱胁迫处理下MeHDZ14基因的表达分析
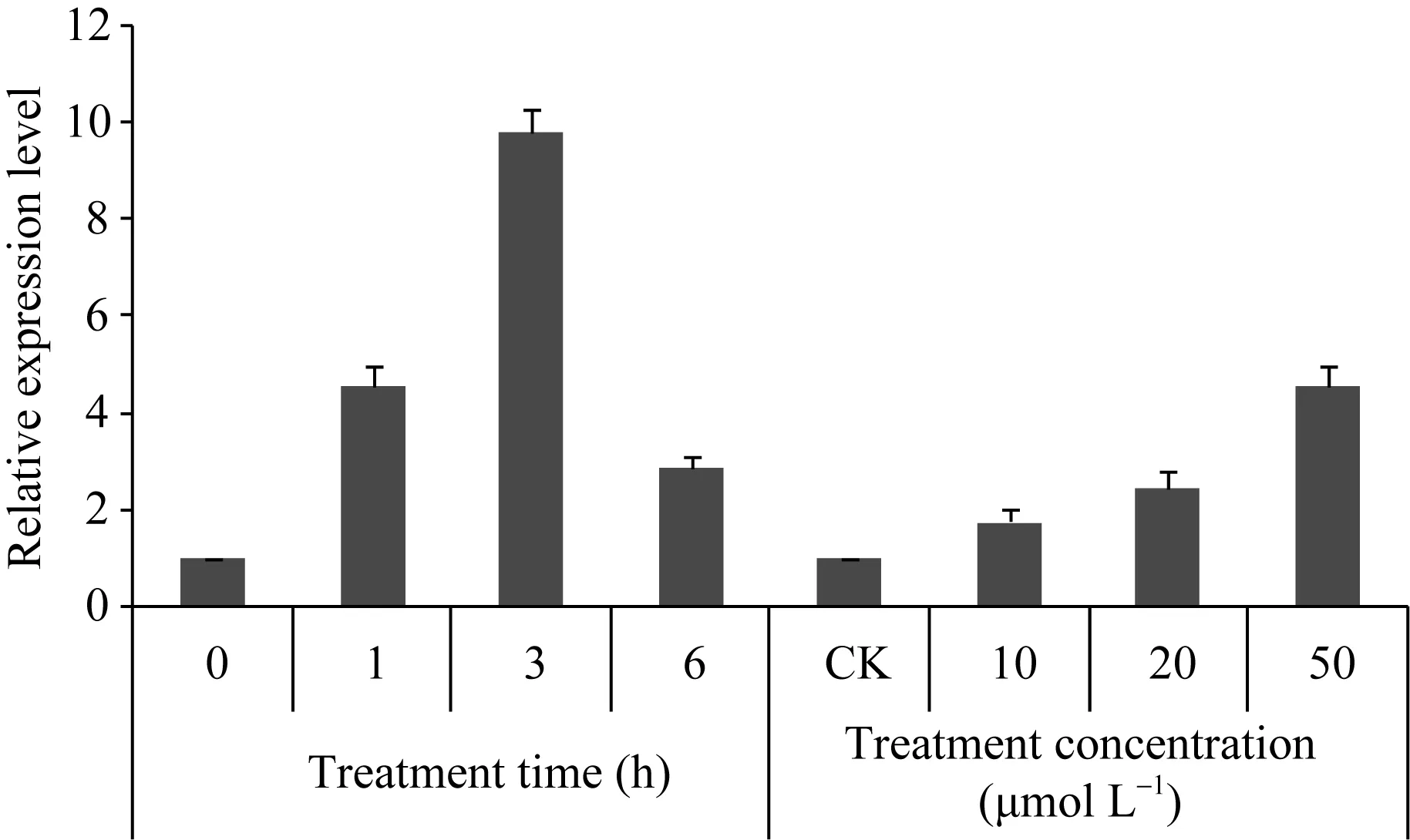
图4 ABA处理下MeHDZ14基因的表达分析
2.4 不同品种间MeHDZ14的表达
为考证MeHDZ14基因在物种驯化过程中基因结构是否产生变异,通过野生型品种W14和8个常规栽培品种的基因结构比较分析图5-A表明, MeHDZ14基因区DNA长度833 bp,CDS区长为726 bp,被1个107 bp的内含子隔为2个外显子。供测的9个木薯品种的基因区DNA序列为833 bp,长度一致,序列中没有InDel变异。品种间基因区DNA序列总计有17个SNP,外显子区有15个SNP,其中包括11个同义替换和4个非同义替换,序列一致性达99.75%。保守结构域中有3个同义替换和2个非同义替换(图5-B),MeHDZ14基因序列具有很高的保守性。
为研究MeHDZ14基因在不同类型木薯品种中的表达谱,本文结合课题组田间试验观察,对常见的不同类型木薯品种MeHDZ14基因表达谱进行了分析,包括:(1)相对耐/抗旱的品种(相关实验结果未发表)Arg7(干旱反应为落叶)、SC124(干旱反应为叶片萎蔫)[33]、SC7(生物量相对较高);(2)相对高产、种植面积广的SC5;(3)抗寒、耐贫瘠等综合农艺性状良好的SC205;(4)气孔密度相对较大的I582、海南红心(HN-hong)、新选048(X048);(5)气孔密度相对较低的蛋黄木薯(DAN);(6)富含多糖的Q10;(7)甜木薯品种南植199(NZ199);(8)遗传转化模式品种C3。MeHDZ14基因在供测试的11个木薯品种中(图6-A),以Q10叶片中表达量最低,SC205叶片中表达量最高,是Q10中的40多倍。不同品种中MeHDZ14基因表达差异显著。选择表达量相对较低的I582、表达量相对较高的新选048(X048),以及耐旱品种SC124和Arg 7,在对照(停水0 d)、中度干旱(4 d)、重度干旱(10 d)时进行基因表达差异分析(图6-B),结果显示,在不同的品种中,MeHDZ14基因虽然表达量存在显著差异,但都随着干旱程度的加强而表达量增加,且差异显著。结合前期SC124品种在干旱胁迫下(图3)及外施ABA下(图4)的表达谱,推断MeHDZ14基因是通过ABA依赖信号传导途径参与调控木薯干旱响应。
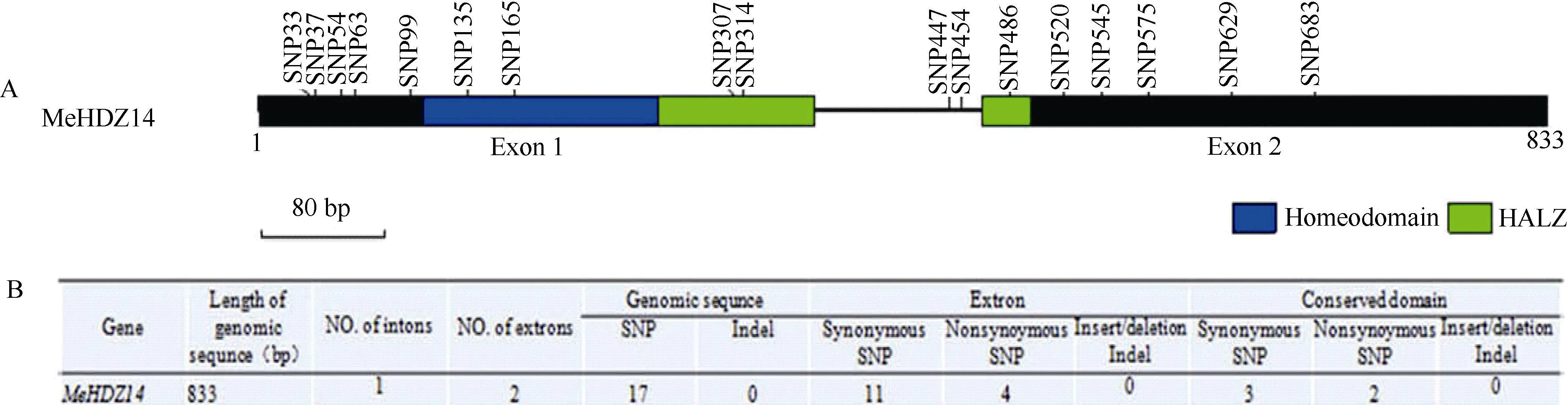
图5 MeHDZ14基因在不同木薯品种中的核酸差异分析
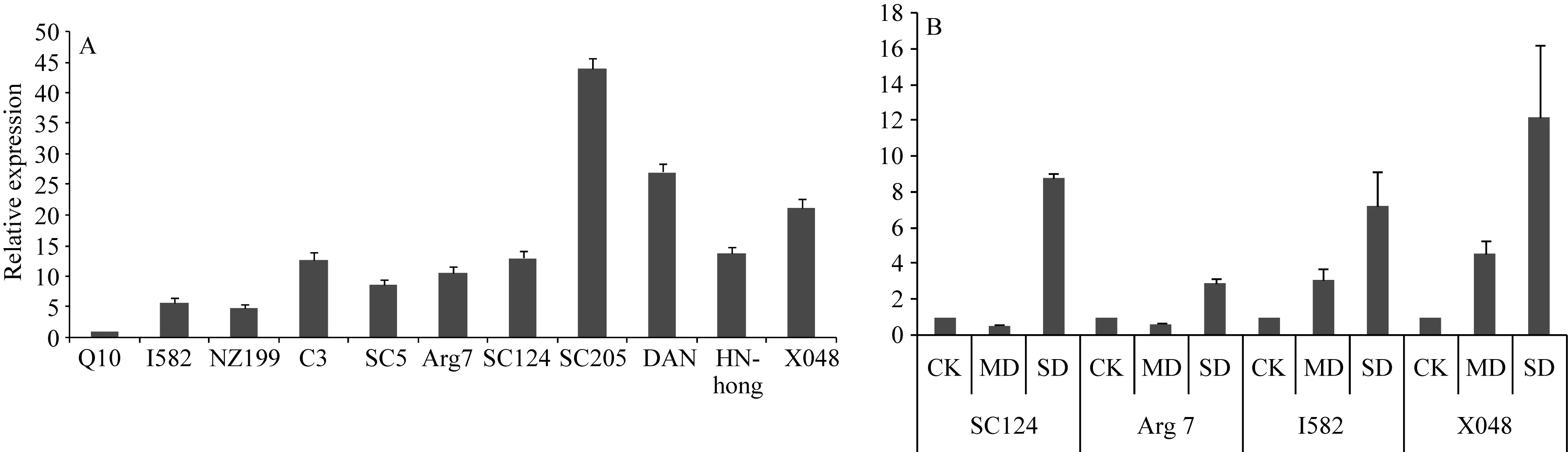
图6 不同品种木薯叶片中MeHDZ14基因的表达
3 讨论
HD-Zip是植物所特有的一类转录因子,在植物发育和逆境响应过程中扮演着重要的角色。目前已经从多个物种中分离得到HD-Zip基因,然而在抗逆性良好的木薯中还没有相关报道。本实验从木薯中克隆得到一个HD-Zip I家族成员基因MeHDZ14,该基因含有HD-Zip家族保守结构域和空间结构,这与其他物种[16]的报道一致。同源性分析表明,它与拟南芥ATHB-7基因亲缘关系最近。8个测试木薯品种间的MeHDZ14蛋白氨基酸序列一致性为99.75%,共有4个非同义替换,未发现野生种特有的氨基酸变异,其中这4个氨基酸变异均与极性有关。暗示MeHDZ14蛋白在进化上具有高度保守性。木薯MeHDZ14蛋白定位与细胞核中,具有转录自激活能力,推测它是作为转录因子参与植物生长过程的,这与已有的报道是相同的[15]。
木薯MeHDZ14在植物组织中表达量很低,受干旱或外施ABA诱导表达,且对ABA反应灵敏,这与MeHDZ14同源基因ATHB-7的表达情况一致[37],推测其功能可能也具有相似性。拟南芥ATHB-7基因是依赖ABA途径参与植物响应干旱应答的[37]。另外,ATHB-7还通过诱导PP2C基因的表达及下调ABA受体基因PYL/PYR的表达来反馈调节ABA信号途径[38]。那么,MeHDZ14基因在木薯干旱应答反应中如何发挥作用,这值得我们继续探讨。MeHDZ14基因在不同木薯品种中的相对表达量不同,在SC205品种中的表达量最高,这可能与它抗逆、高产性状关联。同时,不同木薯品种中MeHDZ14基因在干旱胁迫下的表达模式相同,都是随干旱程度的加深基因表达呈增强趋势。总之,MeHDZ14基因参与植物响应干旱的应答反应过程。
植物激素可能是抗逆基因表达的启动因素,其中ABA与非生物胁迫紧密关联[39]。植物接收到逆境信号后,体内ABA快速累积,进而启动级联反应,最终导致气孔关闭等一系列植物应答反应[40-41]。木薯MeHDZ14基因在逆境信号物质ABA施加后很快响应被诱导表达,在3 h表达水平最高,为对照的10倍。这表明MeHDZ14基因的表达是与植物体内ABA的积累相关联的。
植物体内启动子的驱动活性是下游基因是否表达及表达强度的重要影响因子,它含有的顺式作用元件的数量、种类及彼此的排列等都是影响下游基因表达的因素。MeHDZ14基因启动子区含有丰富的TATA-box(RNA聚合酶II结合位点)和CAAT-box (增强转录效率)等启动子基本元件;含有大量的光响应元件,可能与MeHDZ14基因参与植物光调控下的生长相关;生物/非生物胁迫相关的ABA响应元件、MYBH结合位点及乙烯响应元件ERE、以及胁迫响应相关元件TC-rich repeats的存在,暗示着MeHDZ14基因与木薯耐/抗逆境胁迫相关。未研究结果显示,在干旱及外施ABA的作用下,木薯叶片MeHDZ14基因表达量显著上调,这与该基因启动子区存在的顺式作用元件相一致。所以,MeHDZ14转录因子很可能参与了ABA介导的干旱胁迫应答反应,是依赖ABA信号响应干旱途径中的重要一员,在木薯耐/抗干旱反应中发挥着重要作用,但具体的作用机制尚需进一步研究。
4 结论
木薯MeHDZ14基因在不同木薯品种序列比对中有4个非同义替换,未发现野生种特有的氨基酸变异,其中这4个氨基酸变异均与极性有关,在进化上具有高度保守性。MeHDZ14蛋白序列有典型的HD-Zip I亚家族的保守结构域(HD结构域和LZ区域),定位于细胞核内,具备转录自激活功能,是一个转录因子。在外施ABA和干旱胁迫下MeHDZ14基因响应迅速,虽然在不同品种中表达量有差异,但在胁迫信号下的表达模式一致,呈上升趋势。MeHDZ14基因在木薯逆境胁迫应答中可能发挥着重要作用。
[1]Mizoi J,Shinozaki K,Yamaguchi-Shinozaki K.AP2/ERF family transcription factors in plant abiotic stress responses.Biochim Biophys Acta,2012,1819:86–96
[2]Shinozaki K,Yamaguchi-Shinozaki K.Gene networks involved in drought stress response and tolerance.J Exp Bot,2007,58: 221–227
[3]康宗利,杨玉红,张立军.植物响应干旱胁迫的分子机制.玉米科学,2006,14(2):96–100
Kang Z L,Yang Y H,Zhang L J.Molecular mechanism of responsing to drought stress in plants.Maize Sci,2006,14(2): 96–100(in Chinese with English abstract)
[4]Aso K,Kato M,Banks J A,Hasebe M.Characterization of homeodomain-leucine zipper genes in the fern Ceratopteris richardii and the evolution of the homeodomain-leucine zipper gene family in vascular plants.Mol Biol Evol,1999,16:544–552
[5]Sakakibara K,Nishiyama T,Kato M,Hasebe M.Isolation of homeodomain-leucine zipper genes from the moss Physcomitrella patens and the evolution of homeodomain-leucine zipper genes in land plants.Mol Biol Evol,2001,18:491–502
[6]Schena M,Davis R W.HD-Zip proteins:members of an Arabidopsis homeodomain protein superfamily.Proc Natl Acad Sci USA,1992,89:3894–3898
[7]Meijer A H,Scarpella E,van Dijk E L,Qin L,Taal A J,Rueb S, Harrington S E,McCouch S R,Schilperoort R A,Hoge J H. Transcriptional repression by Oshox1,a novel homeodomain leucine zipper protein from rice.Plant J,1997,11:263–276
[8]Zhao Y,Zhou Y,Jiang H,Li X,Gan D,Peng X,Zhu S,Cheng B. Systematic analysis of sequences and expression patterns of drought-responsive members of the HD-Zip gene family in maize. PLoS One,2011,6:e28488
[9]Re D A,Dezar C A,Chan R L,Baldwin I T,Bonaventure G. Nicotiana attenuata NaHD20 playsa role in leafABA accumulation during water stress,benzylacetone emission from flowers,and the timing of bolting and flower transitions.J Exp Bot,2011,62:155–166
[10]Zhang Z,Chen X,Guan X,Liu Y,Chen H,Wang T,Mouekouba LD,Li J,Wang A.A genome-wide survey of homeodomainleucine zipper genes and analysis of cold-responsive HD-Zip I members’expression in tomato.Biosci Biotechnol Biochem,2014, 78:1337–1349
[11]Matsumoto T,Morishige H,Tanaka T,Kanamori H,Komatsuda T, Sato K,Itoh T,Wu J,Nakamura S.Transcriptome analysis of barley identifies heat shock and HD-Zip I transcription factors up-regulated in response to multiple abiotic stresses.Mol Breed, 2014,34:761–768
[12]Chen X,Chen Z,Zhao H,Zhao Y,Cheng B,Xiang Y. Genome-wide analysis of soybean HD-Zip gene family and expression profiling under salinity and drought treatments.PLoS One,2014,9:e87156
[13]Rueda E C,Dezar C A,Gonzalez D H,Chan R L.Hahb-10,a sunflower homeobox-leucine zipper gene,is regulated by light quality and quantity,and promotesearly flowering when expressed in Arabidopsis.PlantCellPhysiol,2005,46: 1954–1963
[14]Song A,Li P,Xin J,Chen S,Zhao K,Wu D,Fan Q,Gao T,Chen F,Guan Z.Transcriptome-wide survey and expression profile analysis of putative chrysanthemum HD-Zip I and II genes. Genes,2016,7:19
[15]Ariel F D,Manavella P A,Dezar C A,Chan R L,Chan R L.The true story of the HD-Zip family.Trends Plant Sci,2007,12: 419–426
[16]Chan R L,Gago G M,Palena C M,Gonzalez D H.Homeoboxes in plant development.Biochim Biophys Acta,1998,1442:1–19
[17]Olsson A S,Engstrom P,Soderman E.The homeobox genes ATHB12 and ATHB7 encode potential regulators of growth in response to water deficit inArabidopsis.Plant Mol Biol,2004,55: 663–677
[18]Gago G M,Jordano C A J,Gonzalez D H,Chan R L.Hahb-4,a homeobox-leucine zipper gene potentially involved in abscisic acid-dependent responses to water stress in sunflower.Plant Cell Environ,2002,25:633–640
[19]Cabello J V,Arce A L,Chan R L.The homologous HD-Zip I transcription factors HaHB1 and AtHB13 confer cold tolerance via the induction of pathogenesis-related and glucanase proteins. Plant J,2012,69:141–153
[20]Agalou A,Purwantomo S,Overnas E,Johannesson H,Zhu X, Estiati A,de Kam R J,Engstrom P,Slamet-Loedin I H,Zhu Z Wang M,Xiong L,Meijer A,Ouwerkerk P.A genome-wide survey of HD-Zip genes in rice and analysis of drought-responsive family members.Plant Mol Biol,2008,66: 87–103
[21]Hanson J,Johannesson H,Engstrom P.Sugar-dependent alterations in cotyledon and leaf development in transgenic plants expressing the HD-Zip gene ATHB13.Plant Mol Biol,2001,45: 247–262
[22]Henriksson E,Olsson A S,Johannesson H,Johansson H,Hanson J,Engstrom P,Soderman E.Homeodomain leucine zipper class I genes in Arabidopsis.expression patterns and phylogenetic relationships.Plant Physiol,2005,139:509–518
[23]Wang Y,Henriksson E,Soderman E,Henriksson K N,Sundberg E,Engstrom P.The Arabidopsis homeobox gene,ATHB16, regulates leaf development and the sensitivity to photoperiod in Arabidopsis.Dev Biol,2003,264:228–239
[24]朱莹莹,于亮亮,汪杏芬,李来庚.HD-ZIP III转录因子家族与植物细胞分化.植物学报,2013,48:199–209
Zhu Y Y,Yu L L,Wang X F,Li L G.HD-Zip III transcription factor and cell differentiation in plants.Chin Bull Bot,2013,48:199–209(in Chinese with English abstract)
[25]Lechner E,Leonhardt N,Eisler H,Parmentier Y,Alioua M, Jacquet H,Leung J,Genschik P.MATH/BTB CRL3 receptors target the homeodomain-leucine zipper ATHB6 to modulate abscisic acid signaling.Dev Cell,2011,21:1116–1128
[26]Park J,Lee H J,Cheon C I,Kim S H,Hur Y S,Auh C K,Im K H, Yun D J,Lee S,Davis K R.The Arabidopsis thaliana homeobox gene ATHB12 is involved in symptom development caused by geminivirus infection.PLoS One,2011,6:e20054
[27]Son O,Hur Y S,Kim Y K,Lee H J,Kim S,Kim M R,Nam K H, Lee M S,Kim B Y,Park J.ATHB12,an ABA-inducible homeodomain-leucine zipper(HD-Zip)protein of Arabidopsis, negatively regulates the growth of the inflorescence stem by decreasing the expression of a gibberellin 20-oxidase gene.Plant Cell Physiol,2010,51:1537–1547
[28]Elhiti M,Stasolla C.Structure and function of homodomainleucine zipper(HD-Zip)proteins.Plant Signal Behav,2009,4: 86–88
[29]Himmelbach A,Hoffmann T,Leube M,Hohener B,Grill E. Homeodomain protein ATHB6 isatargetofthe protein phosphatase ABI1 and regulates hormone responses in Arabidopsis.EMBO J,2002,21:3029–3038
[30]Mayda E,Tornero P,Conejero V,Vera P.A tomato homeobox gene(HD-Zip)is involved in limiting the spread of programmed cell death.Plant J,1999,20:591–600
[31]Zhao Y,Ma Q,Jin X,Peng X,Liu J,Deng L,Yan H,Sheng L, Jiang H,Cheng B.A novel Maize homeodomain-leucine zipper (HD-Zip)I gene,Zmhdz10,positively regulates drought and salt tolerance in both rice and Arabidopsis.Plant Cell Physiol,2014, 55:1142–1156
[32]Manavella P A,Arce A L,Dezar C A,Bitton F,Renou J P,Crespi M,Chan R L.Cross-talk between ethylene and drought signalling pathways is mediated by the sunflower Hahb-4 transcription factor.Plant J,2006,48:125–137
[33]Zhao P,Liu P,Shao J,Li C,Wang B,Guo X,Yan B,Xia Y,Peng M.Analysis of different strategies adapted by two cassava cultivars in response to drought stress:ensuring survival or continuing growth.J Exp Bot,2015,66:1477–1488
[34]于晓玲,王淦,阮孟斌,刘恩世,彭明.水分胁迫对不同木薯品种叶片生理生化的影响.中国农学通报,2012,28(33):60–64
Yu X L,Wang G,Ruan M B,Liu E S,Peng M.Physiological and biochemical changes of leaves in different cassava varieties under water stress.Chin Agric Sci Bull,2012,28(33):60–64(in Chinese with English abstract)
[35]Hebsgaard S M,Korning P G,Tolstrup N,Engelbrecht J,Rouze P, Brunak S.Splice site prediction in Arabidopsisthaliana pre-mRNA by combining local and global sequence information. Nucl Acids Res,1996,24:3439–3452
[36]郭安源,朱其慧,陈新,罗静初.GSDS:基因结构显示系统.遗传,2007,29:1023–1026
Guo A Y,Zhu Q H,Chen X,Luo J C.GSDS:a gene structure display server.Hereditas(Beijing),2007,29:1023–1026
[37]Soderman E,Mattsson J,Engstrom P.The Arabidopsis homeobox gene ATHB-7 is induced by water deficit and by abscisic acid. Plant J,1996,10:375–381
[38]Van Hove J,Stefanowicz K,De Schutter K,Eggermont L, Lannoo N,Al Atalah B,Van Damme E J.Transcriptional profiling of the lectin ArathEULS3 from Arabidopsis thaliana toward abiotic stresses.J Plant Physiol,2014,171:1763–1773
[39]Raghavendra A S,Gonugunta V K,Christmann A,Grill E.ABA perception and signaling.Trends Plant Sci,2010,15:395–401
[40]Christmann A,Weiler E W,Steudle E,Grill E.A hydraulic signal in root-to-shoot signaling of water shortage.Plant J,2007,52: 167–174
[41]Zeller G,Henz S R,Widmer C K,Sachsenberg T,Ratsch G, WeigelD,Laubinger S.Stress-induced changes in the Arabidopsis thaliana transcriptome analyzed using whole-genome tiling arrays.Plant J,2009,58:1068–1082
Cloning and Analysis of the Transcription Factor Gene MeHDZ14 in Cassava
YU Xiao-Ling,RUAN Meng-Bin,WANG Bin,YANG Yi-Ling,WANG Shu-Chang*,and PENG Ming*
Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Science/Key Laboratory of Biology and Genetic Resources of Tropical Crops,Ministry of Agriculture,Haikou 571101,China
HD-Zip family genes play important roles in plant growth and stress response.To reveal the role of MeHDZ14 gene in abiotic stresses(e.g.drought)in cassava,we cloned MeHDZ14 gene by using RT-PCR from cassava cultivar SC124,which was relatively more resistant to drought stress.Bioinformatics methods were used to analyze its structural characteristics,and semi-quantitative RT-PCR/qRT-PCR was used to explore its expression patterns in response to abiotic stresses in different plant tissues and varieties.MeHDZ14 has a 726 bp open reading frame,encoding 241 amino acids,and contains the typical HD and ZIP domain.Blastp analysis showed that MeHDZ14 has close genetic relationship with ATHB-7,which is a member of the family I HD-Zip gene.Yeast and subcellular localization test showed that the MeHDZ14 gene is a transcription factor and specifically expresses in the nucleus.Genetic structural variation analysis revealed a total of four mis-sense mutations in eight tested varieties. However,amino acid mutations were not found between wild and cultivated cassavas.This indicates the MeHDZ14 proteins are highly conserved.Semi-quantitative RT PCR analysis revealed that MeHDZ14 was specifically expressed in petioles,and induced by drought stress in root and leaf,suggesting that MeHDZ14 plays an important role in the early drought stage.Analysis by qRT-PCR showed that MeHDZ14 gene had different expression levels in different cassava varieties,but the same mode under drought stress and ABA treatment.These data indicate that MeHDZ14 is a member of the ABA pathway responding to drought. Our results showed that MeHDZ14 plays an important role in the molecular pathways of cassava drought resistance,underlining its potential in genetic improvement of cassava drought tolerance.
Cassava;MeHDZ14;Structure characteristics;Expression analysis
(
):2016-12-09;Accepted(接受日期):2017-04-20;Published online(网络出版日期):2017-05-11.
10.3724/SP.J.1006.2017.01181
本研究由国际科技合作与交流项目(31561143012,2013DFA32020)和国家自然科学基金项目(31501378)资助。
This study was supported by the International Science&Technology Cooperation Program of China(31561143012,2013DFA32020)and the National Natural Science Foundation of China(31501378).
*通讯作者(Corresponding authors):王树昌,E-mail:wangshuchang2001@163.com;彭明,E-mail:pengming@itbb.org.cn
联系方式:E-mail:yuxiaoling@itbb.org.cn
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20170511.1152.008.html
