色瑞替尼对精子制动作用和质膜损伤的体外研究
2017-08-21舒妮燕于合国王玉柱李卫华施惠娟
舒妮燕 于合国 王玉柱 李卫华 施惠娟 刁 华△
(1复旦大学上海医学院生殖生物学研究室 上海 200032; 2复旦大学生殖与发育研究院,上海市计划生育科学研究所,国家人口和计划生育委员会计划生育药具重点实验室 上海 200032)
色瑞替尼对精子制动作用和质膜损伤的体外研究
舒妮燕1,2于合国2王玉柱2李卫华2施惠娟2刁 华2△
(1复旦大学上海医学院生殖生物学研究室 上海 200032;2复旦大学生殖与发育研究院,上海市计划生育科学研究所,国家人口和计划生育委员会计划生育药具重点实验室 上海 200032)
目的 研究前期筛选到的精子功能调节候选化合物色瑞替尼的体外精子制动作用和机制。方法 计算机辅助精液分析(computer assistant sperm analysis,CASA)系统测定色瑞替尼对人和小鼠高活力精子20 s内的制动效果;低渗膨胀(hypo-osmotic swelling,HOS)实验、SYBR-14/PI染色探究精子质膜的完整性;用电镜观察色瑞替尼处理后精子质膜的变化;用色瑞替尼处理VK2/E6E7、End1/E6E7、Ect1/E6E7细胞,CCK-8及荧光染色法检测细胞活性。结果 色瑞替尼对于(5~10)×106/mL人精子的20 s瞬间杀精最小有效浓度(minimal effective concentration,MEC)为(74.87±31.46) μmol/L,而相同条件下测到的杀精药物壬苯醇醚(nonoxynol-9,N-9)的MEC为(219.75±20.89) μmol/L。CASA系统分析表明,色瑞替尼对精子的制动作用有时间-浓度依赖关系。HOS实验及SYBR-14/PI染色法验证色瑞替尼对精子质膜有一定的损伤,并可致精子死亡。电镜显示色瑞替尼处理后的精子质膜破裂,头尾分离较多。色瑞替尼对上皮细胞有一定损伤。结论 色瑞替尼对精子有快速的制动作用,具有潜在的避孕药效。
色瑞替尼; 精子制动; 避孕潜能; 小鼠
精子功能调控已成为不孕不育和安全避孕相关的重要生殖健康课题。随着社会工业化程度的提高和环境污染的加重,不孕不育率显著增加。我国不孕不育率已高达15%~20%,其中与男性因素相关的约占50%。男性不育的主要原因是精子数量的减少和质量的下降。另一方面,如何安全避孕也是全球性的问题。目前,主要是女性负担了避孕的重任,而男性仅可采用性交中断(体外排精)、避孕套(阴茎套)和输精管绝育术。调查显示,男性可以也愿意承担更多的责任。不论男性还是女性,对男性避孕药的态度都相当积极[1]。当前迫切需要发展安全、有效、可逆的针对精子的避孕药物。目前男性节育药物包括激素类和非激素类,男性避孕措施中激素避孕方法和新的外科节育方法最接近临床应用[2]。但是,非激素类的男性避孕方法因特异针对睾丸、附睾或者精子特异的靶标,可能具有较少的不良反应和较好的可逆性,因而成为研究开发的趋势。
我们在前期研究中发现翻译后修饰如乙酰化、磷酸化等对精子功能调控有重要作用,在此基础上针对性地从化合物库中筛选出一系列乙酰化、磷酸化相关的抑制剂且具有显著的调控精子功能活性的非激素类作为候选化合物。其中色瑞替尼(ceritinib)对人精子运动抑制效应非常明显,表现为20 s内使所有精子失去运动活性所需的药物最小浓度(minmal effective concentration,MEC)比经典的杀精药物壬苯醇醚(nonoxynol-9,N-9)还要低3倍左右。色瑞替尼是治疗间变性淋巴瘤激酶-阳性转移且对克唑替尼进展或不能耐受的非小细胞肺癌患者的二线药物,2014年获美国FDA加速审批程序批准上市。FDA的研究报告了色瑞替尼导致孕鼠少量胚胎发育异常,但推荐剂量下用猴、大鼠进行的毒理学研究未发现其对雄性和雌性生殖器官有不良效应[3-4]。我们对色瑞替尼体外精子制动作用及其机制进行了探索,并参照N-9的杀精效果进行了比较,初步探究了色瑞替尼作为外用杀精剂的潜力,同时提示育龄男性色瑞替尼用药潜在的精子毒性风险。
材 料 和 方 法
主要试剂及仪器 色瑞替尼(美国Selleck公司)溶解在DMSO (美国Sigma公司)中制备成10 mmol/L储液;N-9(西安瑞联生物技术有限公司)溶解在超纯水中制备成40 mg/mL储液;精子细胞BWW培养液(以下简称为BWW培养液)按WHO第5版配方配制,所需试剂均购自美国Sigma公司;LIVE/DEAD精子存活测定试剂盒(L-7011,美国Invitrogen公司);细胞增殖分析试剂盒(CCK-8,上海同仁药业股份有限公司);角质细胞无血清培养基(美国Gibco公司);计算机辅助精液分析(computer assistant spermanalysis,CASA,HTM-TOX IVOS版本12.3A)系统为瑞士汉密尔顿有限公司产品;扫描电子显微镜(Quanta 250 FEG,荷兰FEI公司);高级溅射镀膜仪(Leica EM SCD050,上海电子光学技术研究所);透射电子显微镜CM 120 (荷兰Philips公司)。流式细胞仪(Accuri C6,美国BD公司);酶标仪(ELx800,美国BioTek公司);倒置相差显微镜(DMi1,德国Leica公司);激光共聚焦显微镜(A1R,日本Nikon公司)。
细胞株及细胞培养基 VK2/E6E7阴道上皮细胞系购自美国ATCC细胞库;End1/E6E7宫颈细胞系、Ect1/E6E7宫颈阴道细胞系均获赠于南京大学。所有细胞株均采用角质细胞培养基培养,37 ℃、5% CO2条件下使细胞呈单层贴壁生长,取对数生长期细胞用于实验。
实验动物 SPF级C57小鼠购自上海西普尔-必凯实验动物有限公司,饲养至8~10周进行实验。
精子制动实验
精液标本的采集 选取2016年3~9月就诊于上海计生所医院门诊部的男性患者,年龄25~35岁,平均年龄(30.0±5.0)岁,禁欲3~8天,手淫法收集精液,选取的精液样本应在0.5 h内液化,精子密度≥15×106/mL,精子活率>70%,pH值为7.2~8.0,精液量>2 mL,(a+b)级精子≥50%或a级精子≥25%,白细胞<1×106/mL,血清和精浆抗精子抗体均为阴性,符合《WHO人类精液检查与处理实验室手册》(第5版)标准。本研究经上海市计划生育科学研究所伦理委员会批准,精液标本捐献者知情同意,标本在完成实验后,全部煮沸,高温杀灭。
高活力精子的获取 采用精子上游法获得高活力精子[5]:将500 μL液化的精液标本加在1 000 μL BWW培养液下方,在37 ℃、5% CO2培养箱中孵育45~60 min。取上层600 μL培养液,可获高活力精子,用精子培养液调整精子浓度至(10~20)×106/mL。
小鼠的高活力精子获取:将小鼠以颈椎脱臼法处死,取出小鼠附睾尾部并剪开一道小口,以镊子挤出里面的精液放入37 ℃预热的1 mL BWW培养液中,在37℃、5% CO2条件下培养15 min,取上层清液即得高活力小鼠精子。
瞬间杀精效果测定 瞬间杀精效果,即20 s能够100%制动精子的最低药物浓度(minimal effective concentration,MEC)。
实验共设空白对照组、阳性对照组(N-9)和色瑞替尼组。室温条件下在96孔板内用BWW培养液逐孔倍比稀释药物,每孔为50 μL。 96孔板放置在37 ℃、5% CO2培养箱孵育30 min。逐孔加入50 μL精子悬浮液,匀速吹打5次混匀,镜下(×100)观察在20 s内精子是否全部失活。最终测出MEC。对小鼠精子MEC的测定方法同上。
CASA系统分析化合物制动精子的运动参数 (10~20)×106/mL高活力精子悬浮液分别置入各EP管中,与500 μL各浓度的药物分别充分混匀,置于37 ℃培养箱0.5~3 h后用CASA分析(每样品记录5个视野)。绘制药物对精子制动效果的时间-剂量曲线。
精子复活试验 选择经MEC色瑞替尼处理后的精子样本,以BWW培养液300×g离心5 min,洗涤2次去除色瑞替尼,加入0.5 mL BWW培养液,并在37 ℃、5% CO2条件下培养30~60 min,显微镜下观察10个视野,记录是否有活动精子。
低渗膨胀实验 300×g离心5 min去除精子悬液中的药液,200 μL BWW培养液重悬后取100 μL加入1 mL低渗膨胀(hypo-osmotic swelling,HOS)溶液(75 mmol/L果糖,20 mmol/L柠檬酸钠)混合,置于37 ℃温箱中30 min。将混合液滴加在载玻片上,盖玻片封盖,倒置相差显微镜下计数显示特征尾部卷曲或肿胀的精子数目。
精子尾部肿胀率=尾部肿胀数/精子计数的总数×100%。对照组中有60%以上的精子出现尾部肿胀,则认为HOS实验正常。
流式细胞仪法检测精子存活率 采用SYBR-14/PI双染法观察精子存活情况及质膜完整性。取5 μL SYBR-14加入1 mL精子悬浮液中(终浓度为100 nmol/L),混匀后37 ℃、5% CO2避光孵育5~10 min。BWW培养液300×g离心5 min,洗涤2次后重悬沉淀,加入5 μL碘化丙啶(propidium iodide,PI)(终浓度为12 μmol/L),37 ℃、5% CO2避光孵育5~10 min。流式细胞仪检测SYBR-14/PI染色后的各组精子,精子计数>10 000,计SYBR-14+/PI-的精子数为质膜完整精子数。
电子显微镜观察精子质膜的损伤 取精子悬液制作涂片,晾干后在2.5%的戊二醛中固定2 h,PBS 300×g离心5 min,洗3次,用1%锇酸固定,PBS 300×g离心5 min,洗3次,不同浓度酒精梯度脱水,离子溅射仪镀金后扫描电子显微镜观察并记录。300×g离心5 min,沉淀精子,固定脱水,加包埋液浸透固化,切片,染色,透射电子显微镜下观察拍片。
色瑞替尼对阴道上皮细胞的影响
CCK-8测定药物对细胞的抑制作用 收集对数生长期的VK2/E6E7、End1/E6E7、Ect1/E6E7细胞接种到96孔细胞培养板中,每孔接种约5 000个细胞。待细胞贴壁后吸去培养液,PBS洗涤1次,将各培养孔分为对照组和药物处理组。在药物处理组中加入200 μL预先配置好的各浓度梯度的色瑞替尼或N-9溶液,对照孔加入200 μL培养液,分别培养24 h、48 h后去除培养液,加入不含血清的培养液100 μL和10 μL的CCK-8试剂。静置30 min后,37 ℃ 继续培养2 h,采用酶标仪测定450 nm处吸光度(D)值,测得细胞抑制率,计算半抑制浓度(half maximal inhibitory concentration,IC50)。细胞抑制率(%)=1-(实验孔D值-空白孔D值)/(对照孔D值-空白孔D值)×100%。
药物对细胞形态的影响 将VK2/E6E7、Ect1/E6E7和End1/E6E7细胞分别接种在细胞培养皿中,培养至贴壁细胞长至90%,更换培养液,分别用含和不含药物的角质培养基培养6 h。用钙黄绿素-AM(Calcein-AM)、PI、Hoechst 33342溶液分别进行细胞染色(终浓度分别为2 μmol/L、4 μmol/L和0.5 μg/mL)。用激光共聚焦显微镜对活细胞和死细胞进行观察。
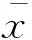
结 果
色瑞替尼对精子运动的抑制
色瑞替尼20s内100%制动精子的MEC精子运动能力是精子最易观察的活性指标,在观察到色瑞替尼的体外精子运动抑制活性的基础上,我们参考Sander-Cramer方法[6]进行了定量的观察。色瑞替尼20s内制动人和小鼠精子的MEC分别为(74.87±31.46)μmol/L(n=4)和(72.00±9.70)μmol/L(n=5),具有相似的快速制动作用(图1)。为了评估色瑞替尼对精子运动抑制的相对毒性,我们采用经典的体外杀精剂N-9作为对照进行比较研究。相同条件下实验测得N-9 20s内制动人和小鼠精子的MEC分别为(219.75±20.89)μmol/L和(310.80±36.42)μmol/L。数据表明色瑞替尼的MEC数值显著低于N-9,提示色瑞替尼具有很强的制动精子运动的活性。
色瑞替尼对精子的制动效果 为了探究色瑞替尼对精子的制动作用是否有时间-浓度的依赖关系,我们利用CASA系统持续测定加药处理后精子的运动参数。

non-paired student’sttest.
图1 色瑞替尼20 s内使精子制动的最小有效浓度
Fig 1 MEC of ceritinib required to cause permostasis spermatozoa within 20 s
色瑞替尼对人和小鼠精子运动的抑制作用表现为随着浓度增加和时间延长,精子活力(a+b+c级,a+b级)逐渐降低直至无活动精子(图2)。随着色瑞替尼浓度的升高,精子活力(a+b+c级,a+b级)降低的越快。当色瑞替尼浓度恒定时,随着给药时间的延长,活动精子数量逐渐下降(图2A、2A′)。可知色瑞替尼对人类及小鼠精子运动的抑制作用随着浓度增加而增强,且随着作用时间延长而增强,具有明显的剂量-时间依赖关系。由图2可见,30 min处理使人和小鼠精子100%制动所需的色瑞替尼浓度分别为5和25 μmol/L。而相同条件下,使人和小鼠精子100%制动所需的N-9浓度为200 μmol/L,这表明色瑞替尼对精子的制动活性大于杀精剂N-9。色瑞替尼在2 h内100%制动人精子的浓度低至5 μmol/L。
精子复活试验 选取20 s MEC色瑞替尼处理的100%精子制动的样本,洗去色瑞替尼并加入0.5 mL BWW培养液,孵育30~60 min,显微镜下未观察到活动精子,即色瑞替尼对精子的制动作用是不可逆的。
HOS实验 为了探究色瑞替尼抑制精子运动的机制,先以HOS实验来确定色瑞替尼作用于精子后精子的质膜是否完整。
空白对照组中精子尾部84%发生肿胀蜷曲,证明精液标本及HOS低渗液正常。用N-9处理精子20 s后HOS实验可见精子尾部几乎不发生肿胀(0.62%),提示膜已通透。色瑞替尼组的肿胀发生率低至4.67% (图3),提示色瑞替尼MEC在20 s内能破坏精子质膜。
The impact of ceritinib (A) and N-9 (B) on human sperm motility and progressive motility (A’ and B’),respectively.The impact of ceritinib (C) and N-9 (D) on mouse sperm motility and progressive motility (C’ and D’),respectively.Motility (%):The percentage of motile sperm [(a+b+c)%];Progressive (%):The percentage of forward spermatozoa [(a+b)%].CN:Blank control.
图2 低于MEC浓度的色瑞替尼对精子的制动效果与时间-浓度关系曲线
Fig 2 The time-dose related spermostatic effects of ceritinib below MEC

A:Untreated human sperm (control);B:N-9-treated (MEC with in 20 s) human sperm; C:Ceritinib-treated (MEC with in 20 s) human sperm;D:The percentage of HOS-positive sperm after treatments.CN:Blank control.(1)P<0.01,(2)P<0.05 (Chi-square test).
图3 色瑞替尼及N-9对精子质膜的影响(HOS实验)
Fig 3 The effects of ceritinib and N-9 on the sperm plasma membrane integrity (HOS assay)
流式细胞仪测定精子存活率 绿色荧光标记质膜完整的活精子,红色荧光标记质膜遭破坏的死亡精子,发出两种荧光的双阳性精子为正处于濒死的过渡状态。空白对照组活精子比率达到84% (图4A),阳性对照N-9 处理精子的死亡率达96.1% (图4B)。以50 μmol/L色瑞替尼处理精子20 s,精子膜通透,死亡率达93.9% (图4C),5 μmol/L色瑞替尼处理精子30 min的死亡率达96.2% (图4D)。表明色瑞替尼制动的精子质膜已经遭到破坏,并致细胞死亡。提示与N-9类似,色瑞替尼可能是通过破坏精子质膜而对精子产生制动效应。
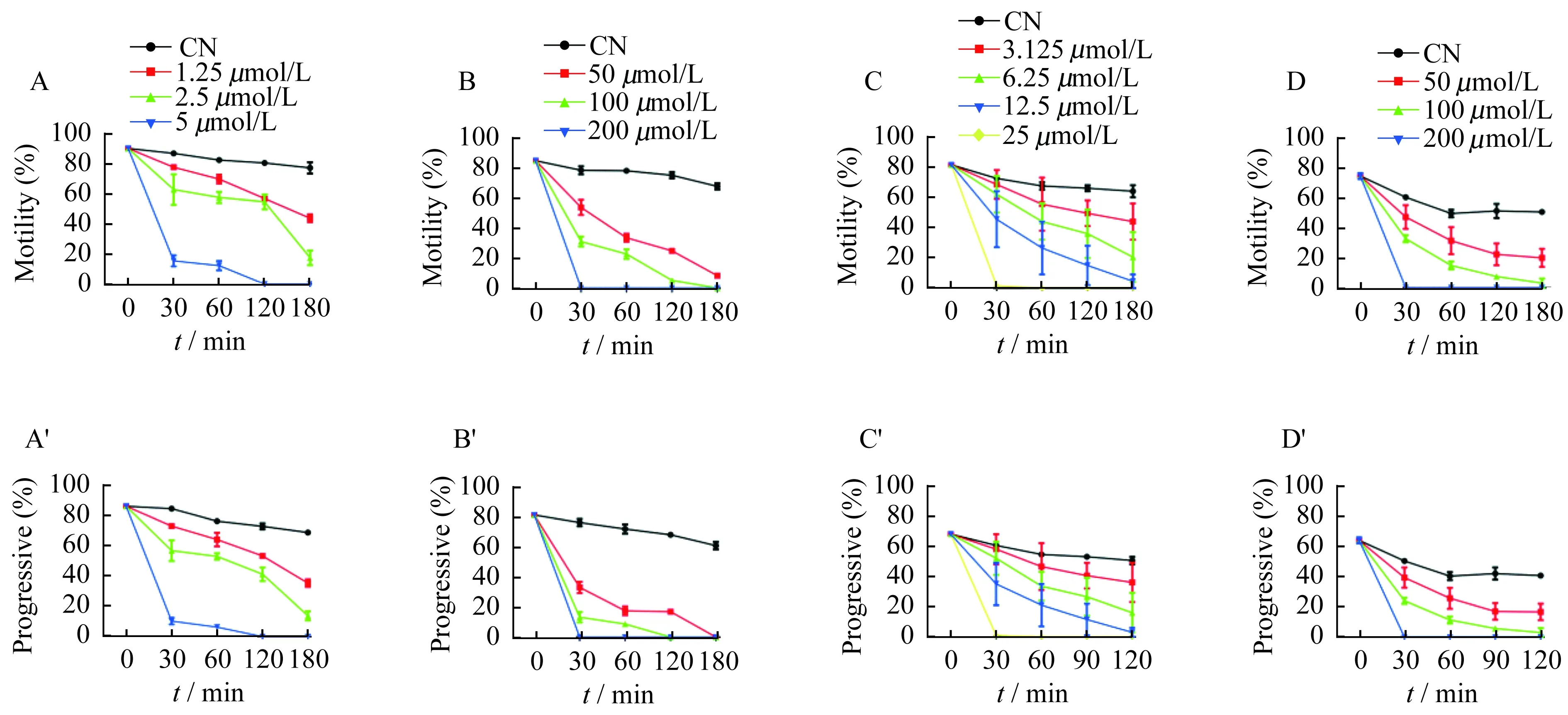
扫描及透射电子显微镜观察精子质膜改变 扫描及透射电子显微镜观察空白对照组精子头部呈椭圆形,质膜表面光滑(图5A),质膜完整(图5C)。而用20 s MEC的色瑞替尼处理精子头部与尾部结合处断裂较多,头部质膜有溶解性改变,尾部有起泡样改变(图5B);透射电镜下可见顶体轻微损伤,头颈部有断裂,头部质膜明显破裂,线粒体部分有明显损伤(图5D)。而N-9处理后精子质膜破坏严重,大部分精子顶体膜呈溶解性改变[7]。
色瑞替尼对上皮细胞的影响 色瑞替尼对上皮细胞具有细胞增殖抑制作用(图6)。色瑞替尼和N-9对VK2/E6E7细胞IC50值分别为(2.507±0.159) μmol/L和(2.552±0.145) μmol/L,对End1/E6E7细胞IC50值分别为(1.758±0.215) μmol/L和(2.343±0.243) μmol/L,对Ect1/E6E7细胞IC50值分别为(3.705±0.351) μmol/L和(2.401±0.199) μmol/L,两者差异无统计学意义,表明色瑞替尼和N-9对上皮细胞增殖抑制效果类似。

A:Control,untreated human sperm;B:Human sperm treated with 162 μmol/L N-9 for 20 s;C:Human sperm treated with 50 μmol/L ceritinib for 20 s;D:Human sperm treated with 5 μmol/L ceritinib for 30 min.
图4 SYBR-14/PI双染法和流式细胞术测定色瑞替尼对精子质膜的影响
Fig 4 Flow cytometry analysis of the impact of ceritinib on sperm plasma membrane integrity after SYBR-14/PI staining
A and C:Untreated normal spermatozoa;B and D:Spermatozoa treated with 50 μmol/L ceritinib for 20 s.The red arrow indicates the damage of plasma membrane in comparison to normal spermatozoa.
图5 扫描电镜和透射电镜下观察色瑞替尼处理后人精子质膜损伤
Fig 5 Sperm membrane damages caused by ceritinib were observed with scanning electron microscopy and transmission electron microscopy
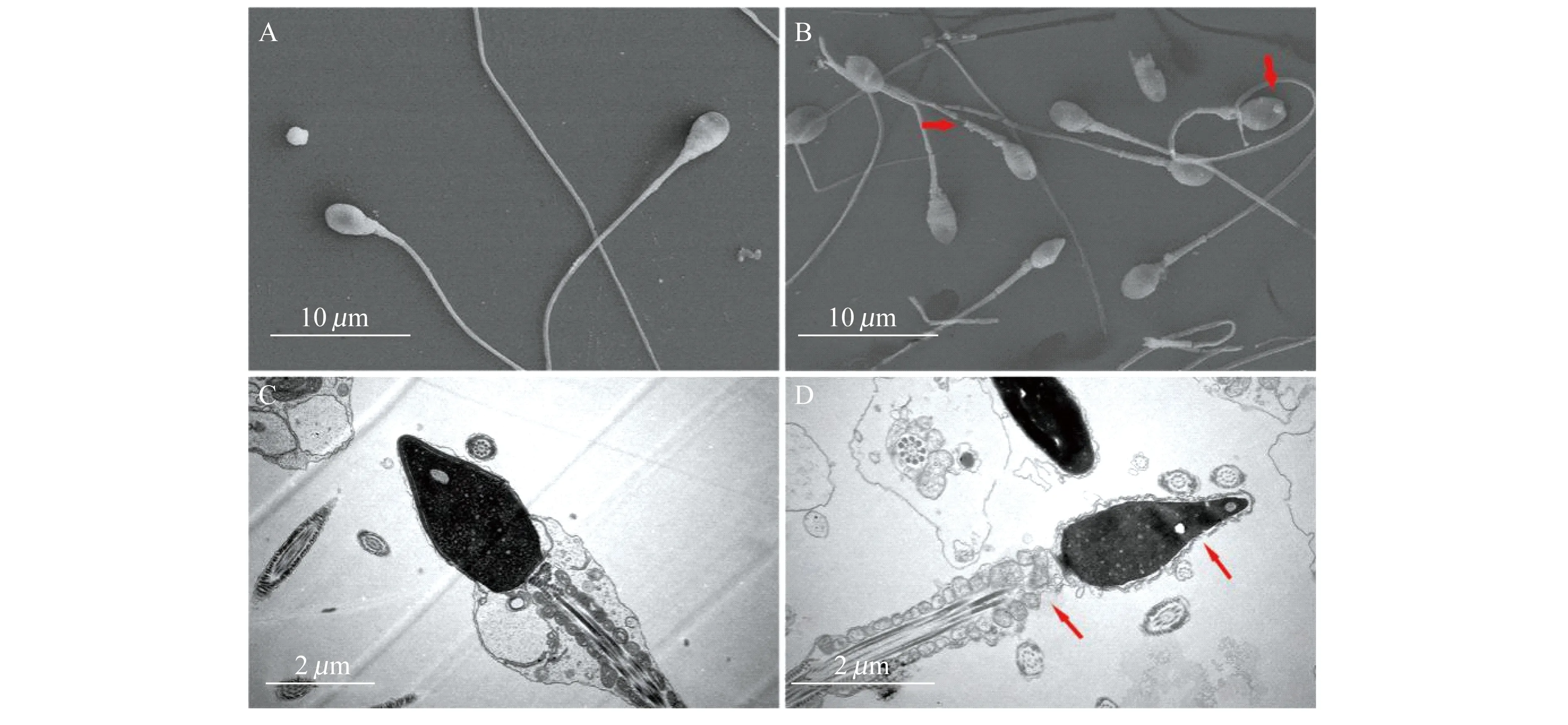
色瑞替尼和N-9分别处理VK2/E6E7细胞6 h后,以钙绿黄素-AM/PI/Hoechst 33342三重染色后放在激光共聚焦显微镜下观察,钙绿黄素-AM染活细胞发出绿色荧光,PI染死细胞发出红色荧光;Hoechst 33342染细胞核发出蓝色荧光。空白对照组中VK2/E6E7绿色荧光较多,细胞形态完整,细胞生长良好;N-9处理后几乎没有绿色荧光,细胞大部分破裂死亡,细胞形态遭到破坏;色瑞替尼处理6 h后,有的出现绿色荧光,但形态不完整(图7)。可见色瑞替尼对上皮细胞膜有一定的损伤。

The average cell inhibition (%) of control is viewed as 0%.
图6 色瑞替尼和N-9对VK2/E6E7 (A、A’)、End1/E6E7 (B、B’)、Ect1/E6E7 (C、C’)细胞抑制率的比较
Fig 6 Comparison of the inhibitory effects of ceritinib and N-9 on VK2/E6E7 cells (A,A’),End1/E6E7 cells (B,B’) and Ect1/E6E7 cells (C,C’)
After treatments for 6 h,VK2/E6E7 cells were stained with Calcein-AM/PI/Hoechst33342.A:Untreated blank control;B:Treated with 100 μmol/L N-9;C:Treated with 100 μmol/L ceritinib.
图7 激光共聚焦显微镜观察化合物处理后的VK2/E6E7细胞存活情况及形态
Fig 7 Survival rates and cell morphology of VK2/E6E7 was observed under laser confocal microscope
讨 论
我们首次报道色瑞替尼对精子的运动具有快速制动能力。色瑞替尼20 s内100%制动人精子的MEC为(74.87±31.46) μmol/L,与经典杀精剂N-9的MEC [(219.75±20.89 μmol/L)]比较,色瑞替尼具有更好的杀精制动效果。此外,色瑞替尼对人类和小鼠的精子均具有类似的精子制动作用,提示可能具有共同的作用机制。我们初步揭示了色瑞替尼体外制动精子运动活性的机制主要是通过破坏精子膜的完整性。N-9作用于精子的机制是由于表面活性剂的亲脂性与精子顶体膜和中段的脂质相互作用,裂解精子膜,导致精子的制动和死亡[8]。观测色瑞替尼处理组精子的存活率及质膜完整性实验表明,色瑞替尼能破坏精子质膜的完整性,导致绝大部分精子死亡。电镜观测显示色瑞替尼作用下精子顶体膜发生脱落,精子颈部细胞膜破裂,精子头尾分离。证明了色瑞替尼对精子质膜有很强的破坏作用。精子复活实验也证明色瑞替尼对精子造成了不可逆的功能损伤。但是其通过何种方式对质膜造成损伤还有待研究。
色瑞替尼较N-9具有更优良的杀精效果,提示其还有作为外用杀精剂的潜能。通过定量比较,我们证明色瑞替尼的精子制动作用比经典的体外杀精剂N-9强,且在低剂量如5 μmol/L以下,仍有时间和剂量依赖的效应。N-9是目前国内外最常用的外用阴道杀精剂,能非特异性的破坏精子细胞膜而起杀精作用。虽然N-9有较大的刺激性及感染HIV风险增加等缺陷[9-10],但目前还没有其他杀精剂可以取代N-9。所以在研究降低N-9刺激性、提高安全性的剂型[如安芳欣(壬苯醇醚缓释凝胶剂)[11]]之外,还有必要开发具有优良杀精效果的新化合物。色瑞替尼具有一定的潜力,但还需进行成药性的更详细评估。将色瑞替尼与N-9比较时,N-9的20 s制动浓度与文献[12]所述0.20~0.25 mg/mL (约为324.24~405.30 μmol/L)有微小差距,主要原因可能有:N-9药品来源不同;测定精子活力的方法虽然都使用Sander-Cramer方法,但溶液与精液比例不完全一致。
色瑞替尼在治疗非小细胞肺癌时应答性非常好,解决了对克唑替尼耐受的问题[13],根据美国FDA的研究报告,色瑞替尼的生殖毒性实验发现其可通过雌性怀孕动物影响胚胎发育,造成骨异常、脏器异常、锁骨下动脉异常等[3-4]。建议女性在完成色瑞替尼用药治疗后至少两周进行有效避孕[3],但没有对育龄男性用药进行足够的生殖风险提示。我们在体外观察到色瑞替尼有明显的精子毒性,这是此前未见报道的,提示育龄男性患者精子接触色瑞替尼可能具有精子毒性的潜在风险。由于色瑞替尼是口服药物,在体内可能发生代谢转化,且体内有血睾屏障的存在,其是否会对睾丸、附睾中不同发育阶段的精子具有毒性,还需进一步研究。
[1] EBERHARDT J,VAN WERSCH A,MEIKLE N.Attitudes towards the male contraceptive pill in men and women in casual and stable sexual relationships[J].JFamPlannReprodHealthCare,2009,35(3):161-165.
[2] 谷翊群.男性避孕的研究进展[EB/OL].[2017-01-04].中华全科医师杂志,2010,9(5):324-326.
[3] FDA.Ceritinib[EB/OL].[2017-01-14].http://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/205755 Orig1s000CrossRpdf.2014.
[4] 陈本川.治疗小细胞肺癌新药——舍瑞替尼[J].医药导报,2015,34(1):134-137.
[5] 谷翊群,陈振文,卢文红.世界卫生组织人类精液检查与处理实验室手册[M].北京:人民卫生出版社,2011:137-138.
[6] SUTYAK KE,ANDERSON RA,DOVER SE,etal.Spermicidal activity of the safe natural antimicrobial peptide subtilosin[J].InfectDisObstetGynecol,2008,2008:540758.
[7] JAIN RK,MAIKHURI JP,KIRAN KS,etal.Novel disulphide esters of carbothioic acid as potent,non-detergent spermicides with low toxicity to Lactobacillus and HeLa cellsinvitro[J].HumReprod,2007,22(3):708-716.
[8] IYER V,PODDAR SS.Update on nonoxynol-9 as vaginalspermicide[J].EurJContraceptReprodHealthCare,2008,13(4):339-350.
[9] GUAN H,FANG F,XIONG Z,etal.n-Butanol extract of rhynchosia volubilis lour:a potent spermicidal agentinvitro[J].JHuazhongUnivSciTechnologMedSci,2014,34(3):398-402.
[10] LAKSHMI V,SAXENA A,MISHRA SK,etal.Spermicidal activity of bivittoside D from bohadschia vitiensis[J].ArchMedRes,2008,39(7):631-638.
[11] 吴莹,陈庆华.女性外用避孕技术的研究应用进展[J].世界临床药物,2008,29(7):414-417.
[12] 胡宜彰,王玉梅,陈绮,等.壬苯醇醚—9外用避孕药药理和毒理研究[J].中国计划生育学杂志,1994,11(3):160-161.
[13] KHOZIN S,BLUMENTHAL GM,ZHANG L,etal.FDA approval:ceritinib for the treatment of metastatic anaplastic lymphoma kinase-positive non-small cell lung cancer[J].ClinCanRes,2015,21(11):2436-2439.
The spermostatic and plasma membrane injury effects of ceritinibinvitro
SHU Ni-yan1,2, YU He-guo2, WANG Yu-zhu2, LI Wei-hua2, SHI Hui-juan2, DIAO Hua2△
(1DepartmentofReproductiveBiology,ShanghaiMedicalCollege,Shanghai200032,China;2KeyLabofReproductionRegulationofNPFPC,SIPPR,IRD,FudanUniversity,Shanghai200032,China)
Objective To explore theinvitrospermostatic effects and the mechanisms of ceritinib,a novel candidate from the active compound pools previously screened for the regulation of sperm function. Methods The vigor sperm of human and mouse were incubated with ceritinib for 20 seconds,and the sperm motility was evaluated by computer assistant sperm analysis (CASA).The integrity of the sperm plasma membrane and the survival ratio of sperm was assessed by hypo-osmotic swelling (HOS) assay and SYBR-14/PI staining.The damage of sperm plasma membrane was detected by electron microscope.The cytotoxicity of ceritinib to VK2/E6E7,End1/E6E7 and Ect1/E6E7 cells was measured by CCK-8 assay and fluorescent staining. Results The minimal effective concentration (MEC) of ceritinib to (5-10)×106/mL human sperm within 20 seconds was (74.87±31.46)μmol/L,which was significantly lower than the MEC of nonoxynol-9 (219.75±20.89) μmol/L measured in the same condition.The time-dose related spermostatic effects of ceritinib were measured by CASA system.Ceritinib was able to damage sperm membrane and caused sperm death with HOS and SYBR-14/PI staining.With electron microscopy,the sperm membrane was observed to be ruptured,and the heads and tails of sperm were separated by ceritinib.Ceritinib was also able to damage the epithelial cells. Conclusions Ceritinib has acute spermostatic effects and potential contraceptive effects.
ceritinib; spermostatic effects; contraceptive potential; mouse
国家重点研发计划(2016YFC1000905);国家自然科学基金面上项目(81671508);上海市科技创新行动计划项目(15431903000)
R697
A
10.3969/j.issn.1672-8467.2017.04.001
2017-02-16;编辑:王蔚)
△Corresponding author E-mail:diaohua@sippr.org.cn
*This work was supported by the State′s Key Project of Research and Development Plan of China (2016YFC1000905),the General Program of National Natural Science Foundation of China (81671508) and the Shanghai Science and Technology Innovation Program (15431903000).
