内科重症监护病房铜绿假单胞菌医院感染同源性及临床特点
2017-08-17刘红梅赵思宏李玉荣宋争昌
张 萍, 刘红梅, 陈 愉, 赵思宏, 李玉荣, 宋争昌, 赵 立
(1 中国医科大学附属盛京医院, 辽宁 沈阳 110004; 2 沈阳市第四人民医院, 辽宁 沈阳 110031; 3 朝阳市第四人民医院, 辽宁 朝阳 122000; 4 泰山医学院附属医院, 山东 泰山 271000)
·论著·
内科重症监护病房铜绿假单胞菌医院感染同源性及临床特点
张 萍1, 2, 刘红梅3, 陈 愉1, 赵思宏1, 李玉荣2, 宋争昌4, 赵 立1
(1 中国医科大学附属盛京医院, 辽宁 沈阳 110004; 2 沈阳市第四人民医院, 辽宁 沈阳 110031; 3 朝阳市第四人民医院, 辽宁 朝阳 122000; 4 泰山医学院附属医院, 山东 泰山 271000)
目的 研究内科重症监护病房(MICU)铜绿假单胞菌(PA)医院感染的同源性及临床特点,以指导临床预防PA传播,提高治疗效果。方法 对某院2014年1—12月MICU发生医院感染的25例患者分离的55株PA进行脉冲场凝胶电泳(PFGE)同源性分析及聚类分析,对其临床特点、耐药性及其传播特点进行分析。结果 共调查25例患者,平均年龄为(69.62±2.13)岁,平均住院时间(49.34±3.18)d;在分离出PA之前,84.00%的患者应用广谱抗菌药物>2 周,76.00%的患者入住过MICU,52.00%的患者使用呼吸机辅助通气。55株PA主要以A、F、H、K、N、V、W型为主要的流行菌株;感染A型、F型、H型及K型菌株的患者在各自住院时间上均存在交叉;有4例患者不同时期分离菌株的PFGE图谱分析显示不同菌型;PA对头孢他啶(72.73%)、哌拉西林/他唑巴坦(70.91%)、亚胺培南(70.91%)耐药率高,对阿米卡星耐药率最低(25.45%)。结论 医疗机构应加强抗菌药物管理,加强医院感染控制措施,防止多重耐药和泛耐药细菌在医院内的播散。
重症监护病房; 铜绿假单胞菌; 脉冲场凝胶电泳; 同源性; 传播特点; 临床分析
[Chin J Infect Control,2017,16(7):600-605]
铜绿假单胞菌(Pseudomonasaeruginosa,PA)属于非发酵菌类假单胞菌属。广泛分布于自然界及人和动物体表、肠道中,是一种常见的条件致病菌,尤其在医院环境中PA检出率很高。由于PA具有易定植、易变异、易耐药等特征,防治多重耐药铜绿假单胞菌(MDR-PA)感染已成为医院感染监测的重点。根据美国医院流行病学协会[1]推荐的常见病原菌分型鉴定方法,PA推荐分型是使用脉冲场凝胶电泳(PFGE),此技术具有很高的特异性和分辨力,能够较好的反映流行病学相关性,是公认的医院感染调查最好的分型方法。本研究对某院2014年1—12月内科重症监护病房(MICU)发生医院感染的25例患者分离出的55株PA进行PFGE同源性分析及聚类分析,对其临床特点、耐药性及传播特点进行分析,以指导临床预防PA的传播,提高治疗效果。
1 资料与方法
1.1 资料来源 选取2014年1—12月某院MICU发生医院感染的25例患者,共分离55株PA,其中52株来自痰,3株来自导管引流液。收集并分析25例MICU患者的临床资料。医院感染诊断标准依据卫生部2001年颁发的《医院感染诊断标准(试行)》[2]。
1.2 试剂和仪器 蛋白酶K(日本TaKaRa 公司),SpeI限制性内切酶(美国Promega 公司),λMarker、低熔点琼脂糖、CHEF-Mapper XA 型脉冲电泳仪、GIS-700D 数码图像扫描分析系统(美国Bio-Rad 公司),低温高速台式离心机(美国科峻公司)。
1.3 PFGE检测 将细菌接种于LB肉汤振荡培养过夜,12 000 r/min 离心1 min;CSB缓冲液1 mL洗涤后,8 000 r/min离心5 min,弃去上清;应用EC缓冲液调整菌液浊度,用2%的低熔点琼脂糖迅速混匀加入模具,用蛋白酶K进行裂解;加入限制性内切酶SpeI,37 ℃、24 h进行酶切;酶切后小胶块包埋于1%琼脂糖凝胶中,使用CHEF Mapper XA系统进行电泳;将凝胶置于EB溶液中染色,应用紫外透射仪进行拍照。结果参照Tenover等[3]方法,如PFGE图谱一致,说明为相同菌株;1~3条带不同说明菌株间有相近关系,只有单基因的改变;4~6条带不同说明菌株间可能有相近关系,有2个基因的改变;6条及以上条带不同,说明有3个或更多基因的变化,视为无相关性。
1.4 聚类分析 根据PFGE电泳的基因图谱将条带转换为二进制数据,其中“1”代表有,“0”代表无。将数据导入SPSS 16.0统计软件中,应用谱系聚类分析绘制树状图。
1.5 药敏试验 采用美国临床实验室标准化协会(CLSI)2014年版推荐的纸片扩散(K-B)法测定55株PA对9种抗菌药物的耐药率。敏感性判定根据CLSI的标准进行判读。
2 结果
2.1 一般情况 共调查25例患者,其中男性18例,女性7例;平均年龄为(69.62±2.13)岁,平均住院时间(49.34±3.18)d;既往有高血压、糖尿病及冠心病等不同基础疾病的患者19例。
2.2 临床资料 20例患者有发热,体温为37.4~40.0 ℃。23例患者伴有咳嗽、咳痰,其中1例患者痰中带血,所有患者肺部听诊均为呼吸音粗或散在干湿啰音。实验室检查结果显示18例患者白细胞升高,11例患者丙氨酸氨基转移酶升高,11例患者有低蛋白血症。所有患者胸部放射线检查均提示肺部多叶段炎症。患者在分离PA之前,均使用过广谱抗菌药物,在分离PA之后,根据药敏结果选用抗菌药物治疗,同时还给予化痰及调节免疫等治疗。经系统诊治,3例患者死亡,年龄均>60岁,既往均有基础疾病。18例患者病情好转出院,2例患者未待病情稳定自行出院,2例患者病情相对平稳,仍呼吸机辅助通气继续住院治疗。
2.3 危险因素 25例患者中19例(76.00%)患者既往有基础疾病;17例(68.00%)患者年龄>60岁;既往有手术史患者12例(48.00%),其中气管切开术后患者6例。在分离出PA之前,21例(84.00%)患者应用广谱抗菌药物2 周以上;19例(76.00%)患者入住过MICU;13例(52.00%)患者行呼吸机辅助通气;12例(48.00%)患者使用呼吸机超过1 周;11例(44.00%)患者有低蛋白血症;7例(28.00%)患者留置导尿管;4例(16.00%)患者应用糖皮质激素。
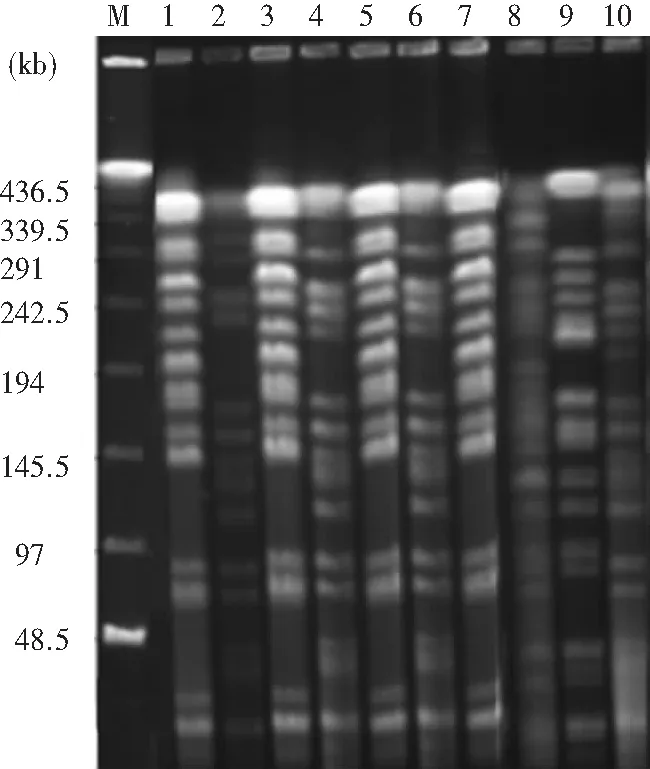
M:Marker;1、3、5、7为A型菌株;2、4、6为F型菌株;8为H型菌株;9为K型菌株;10为V型菌株
图1 铜绿假单胞菌PFGE图谱
Figure 1 PFGE map ofP.aeruginosa
2.4 PFGE电泳结果 55株PA染色体经酶切后,产生15~23条DNA片段,片段大小约为20~420 kb,见图1。聚类分析结果可见,PA为A~W共23型,其中A、F、H、K、N、V、W型为主要的流行菌株;其中A型6株,分2个亚型(48号、51号、52号、54号及55号为同一亚型),F型5株,H型4株,K型7株,N型3株,V型7株;W型3株,分2个亚型(28号和30号为同一亚型)。见图2。
2.5 药敏结果 55株PA对头孢他啶的耐药率为72.73%、对哌拉西林/他唑巴坦、亚胺培南的耐药率均为70.91%;对阿米卡星的耐药率最低,为25.45%。对其他常见抗菌药物的耐药情况见表1。

图2 铜绿假单胞菌PFGE的聚类分析
Table 1 Resistance of 55 strains ofP.aeruginosato 9 commonly used antimicrobial agents
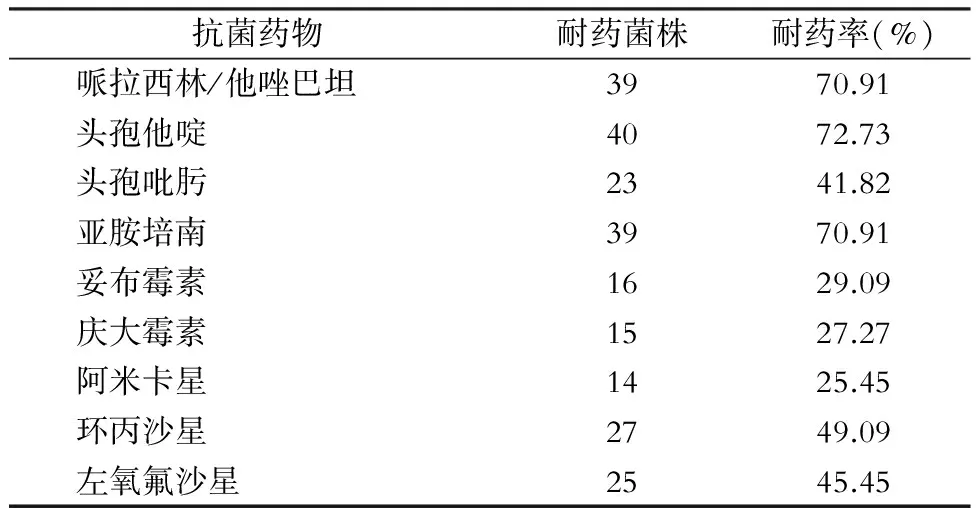
抗菌药物耐药菌株耐药率(%)哌拉西林/他唑巴坦3970.91头孢他啶4072.73头孢吡肟2341.82亚胺培南3970.91妥布霉素1629.09庆大霉素1527.27阿米卡星1425.45环丙沙星2749.09左氧氟沙星2545.45
2.6 传播特点 25例患者分离的55株PA主要包括A、F、H、K、N、V、W 7种基因型。A型菌株中5例患者在住院时间上存在交叉,其中51号、52号为同一患者分离的菌株,见图3。F型菌株中3例患者在住院时间上存在交叉,其中4号、6号、9号为同一患者分离的菌株,见图4。H型菌株中2例患者在住院时间上存在交叉,其中5号、8号、10号为同一患者先后分离的菌株,见图5。K型菌株中5例患者在住院时间上存在交叉,其中41号与42号、43号与44号为同一患者分离菌株,见图6。N型菌株、V型菌、W型菌为同一患者分离菌株。
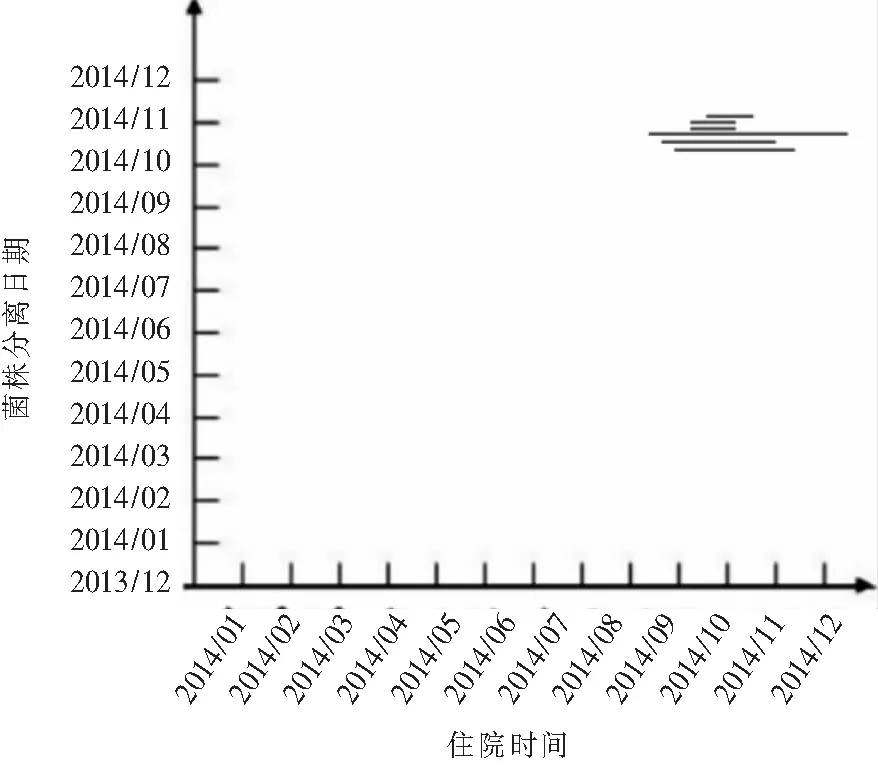
注:从上至下依次为48、51、52、50、54、55号菌株,其中51、52号菌株来源于同一患者
图3 A型PA分离日期及来源患者住院时间分布图
Figure 3 Distribution of isolation date of type AP.aeruginosaand hospitalization time of source patients
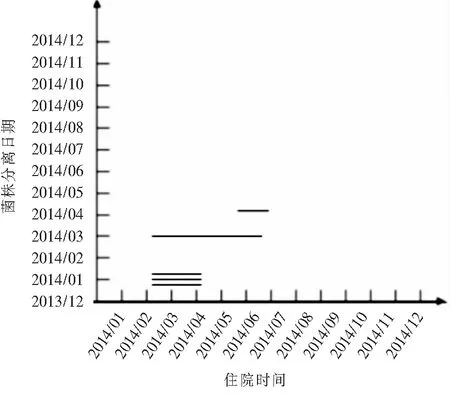
注:从上至下依次为12、16、4、6、9号菌株,其中4、6、9号菌株来源于同一患者
图4 F型PA分离日期及来源患者住院时间分布图
Figure 4 Distribution of isolation date of type FP.aeruginosaand hospitalization time of source patients
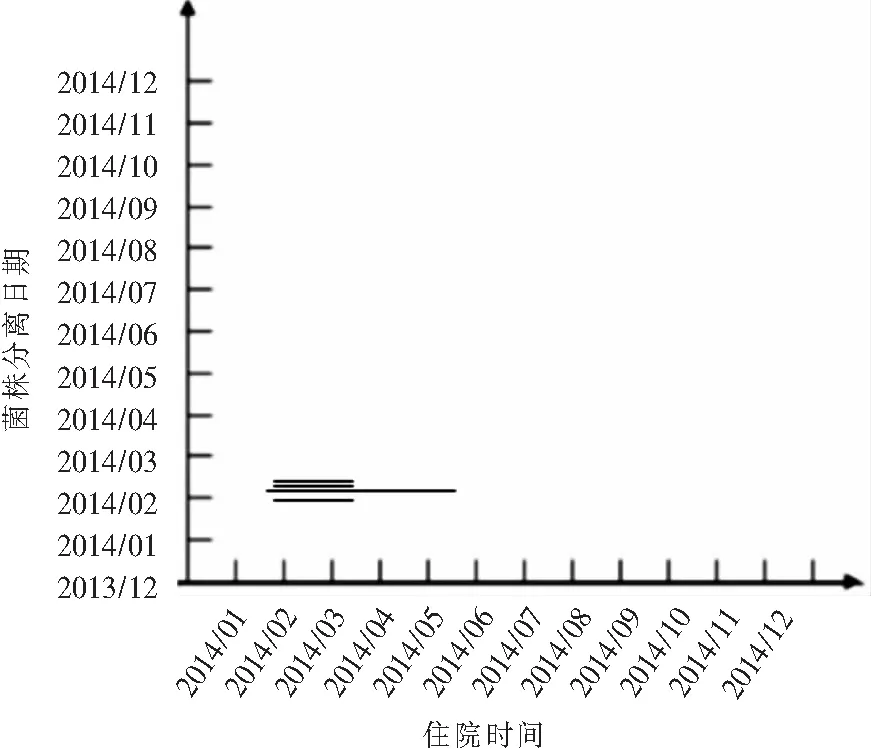
注:从上至下依次为8、10、7、5号菌株,其中5、8、10号菌株来源于同一患者
图5 H型PA分离日期及来源患者住院时间分布图
Figure 5 Distribution of isolation date of type HP.aeruginosaand hospitalization time of source patients
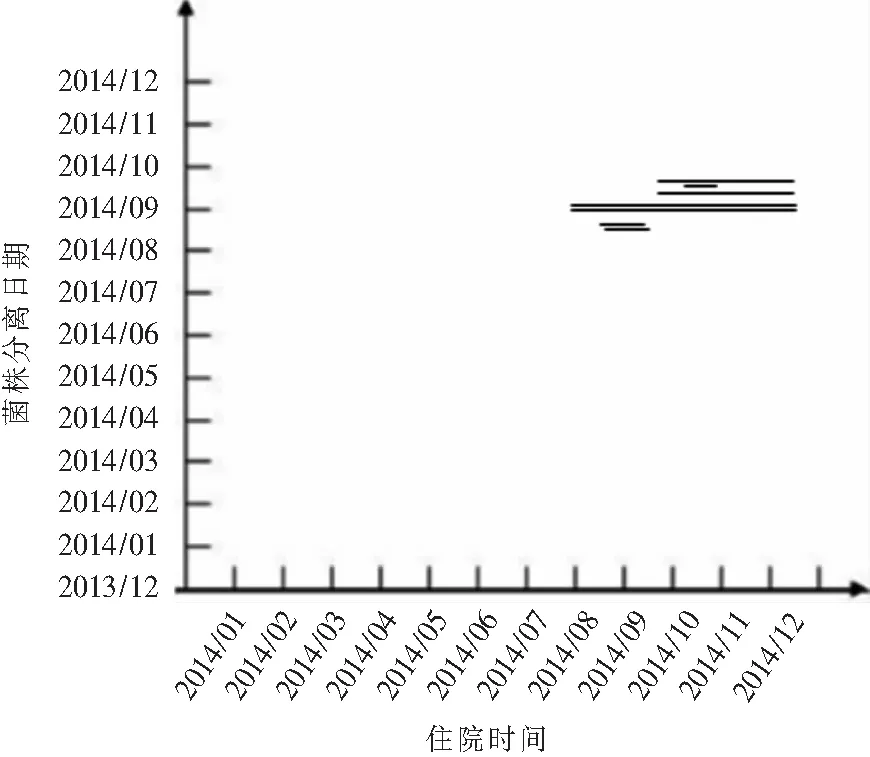
注:从上至下依次为41、45、42、43、44、40、39号菌株,其中41号与42号、43号与44号分别来源于同一患者
图6 K型PA分离日期及来源患者住院时间分布图
Figure 6 Distribution of isolation date of type KP.aeruginosaand hospitalization time of source patients
3 讨论
PA是医院感染最常见的革兰阴性条件致病菌之一。2013年我国CHINET细菌耐药性监测[4]数据显示,PA在临床分离的不发酵糖革兰阴性杆菌中占第2位。全球性细菌耐药监测SENTRY连续多年监测数据也显示,PA是引起医院获得性肺炎和呼吸机相关肺炎最多见的革兰阴性杆菌[5]。近年来,随着各种抗菌药物在临床的广泛使用,出现了多重耐药PA,甚至全耐药PA。MDR-PA已经成为各地区临床治疗的棘手问题。
本文研究的25例PA医院感染患者,平均年龄为(69.62±2.13)岁,平均住院时间为(49.34±3.18)d,76.00%的患者有基础疾病。在分离出PA之前,19例患者入住过MICU;84.00%的患者应用广谱抗菌药物大于2 周 ;13例患者病情危重需行呼吸机治疗,其中7例为气管插管,6例为气管切开术后,患者气道开放,肺损伤加重,更容易感染病原菌。4例患者使用过糖皮质激素,44.00%的患者为低蛋白血症;病情危重患者机体免疫力低下,糖皮质激素的应用,也降低了机体免疫力,使其极易发生医院感染,以上结果与Falagas等[6]报道相一致。虽经积极治疗,仍有3例患者死亡,年龄均大于60岁,既往均有基础疾病。
本研究的药敏试验结果显示,PA对头孢他啶、哌拉西林/他唑巴坦、亚胺培南呈高耐药性,耐药率均达70%以上,高于杨旭辉等[7]的报道,也高于2011年我国CHINET 铜绿假单胞菌耐药监测[8]报道PA的耐药率。分析其原因考虑一是由于25例患者来自MICU,既往基础疾病重,需要长期应用广谱抗菌药物,并且存在留置多种导管、机械通气、人工吸痰等因素,使感染耐药菌的机会大大增加[9-11];二是可能与医院近年来广泛使用该类药物有关,所以近期应该限制性使用该类药物,待其敏感性恢复。2010年我国CHINET铜绿假单胞菌耐药监测报道不同临床科室分离的PA耐药率不同,ICU病房分离PA耐药率高于其他科室[12]。PA临床感染逐渐增多,其对碳青霉烯类抗生素耐药率亦有逐年上升的趋势[13]。
此外,本研究也发现PA对一些抗菌药物较敏感,如喹诺酮类(环丙沙星和左氧氟沙星)、β-内酰胺类(头孢吡肟)、氨基糖苷类(阿米卡星、庆大霉素和妥布霉素),其中阿米卡星耐药率最低。多个全球性耐药监测,如SENTRY、SMART及SERNIR等数据也显示,PA对阿米卡星耐药率最低,原因可能是该类药物对多数氨基糖苷类钝化酶稳定,并且在临床中的用量较其他类药物少[5,14-15]。临床应依照药敏试验结果,选用抗菌活性强的药物,对严重感染者需联合用药,防止或减慢耐药菌株的产生[16]。轮换使用抗菌药物可以分散抗菌药物选择性压力,选择耐药率低的抗菌药物进行轮换,亦有助于恢复细菌的耐药性[17]。
本文PFGE图谱及聚类分析树图显示,55株PA以A、F、H、K、N、V、W基因型为主要流行株,说明MICU中存在PA的克隆传播。由传播特点可见,A型、F型、H型及K型菌株在各自住院时间上均存在交叉,表明出现了同一医疗单元即同病房的同型菌株的克隆传播,通过医疗器械及治疗处置时造成交叉感染的可能性大。另外,有4例患者不同时期分离菌株的PFGE图谱分析显示不同菌型, 43号、44号、47号、48号为同一患者感染菌株检出K型、P型及A型,药敏试验结果提示对左氧氟沙星由敏感转为耐药;23号、26号、28号、30号、38号为同一患者感染菌株检出C型和W型,药敏试验结果提示对左氧氟沙星、环丙沙星由敏感转为耐药;14号、16号为同一患者感染菌株检出I型和F型,为全耐药菌型;51号、52号、53号为同一患者感染菌株检出A型和E型,药敏试验结果提示对头孢吡肟及阿米卡星由敏感转为耐药,这与王继东等[18]报道患者PA医院感染存在多克隆感染或反复不同株感染相类似。由于广谱抗菌药物在临床上广泛使用,容易导致出现MDR-PA,甚至泛耐药铜绿假单胞菌(PDR-PA)。PDR-PA大多分离来自ICU,且多为克隆传播[11],易引起医院感染暴发流行。
本文通过PFGE方法分析PA菌株之间的亲缘关系,监测是否有克隆播散,可追踪暴发流行来源及传播途径,有效控制医院感染。因此,医疗机构应加强细菌耐药监测,关注我国细菌耐药性的发展趋势,加强抗菌药物管理,加强医院感染控制措施,防止多重耐药和泛耐药细菌在医院内的播散。
[1] Tenover FC, Arbeit RD, Goering RV. How to select and interpret molecular strain typing methods for epidemiological studies of bacterial infections: a review for healthcare epidemiologists. Molecular Typing Working Group of the Society for Healthcare Epidemiology of America[J]. Infect Control Hosp Epidemiol, 1997, 18(6): 426-439.
[2] 中华人民共和国卫生部.医院感染诊断标准(试行)[S].北京, 2001.
[3] Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing [J]. J Clin Microbiol,1995, 33(9): 2233-2239.
[4] 胡付品, 朱德妹, 汪复, 等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志, 2014, 14(5):365-374.
[5] Jones RN. Microbial etiologies of hospital-acquired bacterial pneumonia and ventilator-associated bacterial pneumonia[J].Clin Infect Dis, 2010, 51 (Suppl 1): S 81-S 87.
[6] Falagas ME, Kopterides P. Risk factors for the isolation of multi-drug-resistantAcinetobacterbaumanniiandPseudomonasaeruginosa: a systematic review of the literature[J]. J Hosp Infect, 2006, 64(1): 7-15.
[7] 杨旭辉, 赵勇.创伤外科62株铜绿假单胞菌体外抗菌药物敏感性分析[J].检验医学与临床, 2012, 9(15):1913-1914.
[8] 施晓群, 孙景勇, 倪语星, 等. 2011年中国CHINET铜绿假单胞菌耐药性监测[J].中国感染与化疗杂志, 2013, 13(3):218-221.
[9] Master RN, Clark RB, Karlowsky JA, et al. Analysis of resistance, cross-resistance and antimicrobial combinations forPseudomonasaeruginosaisolates from 1997 to 2009[J]. Int J Antimicrob Agents, 2011, 38(4): 291-295.
[10] Lee K, Kim MN, Kim JS, et al. Further increases in carbapenem-, amikacin-, and fluoroquinolone-resistant isolates ofAcinetobacterspp. andP.aeruginosain Korea: KONSAR study 2009[J]. Yonsei Med J, 2011, 52(5): 793-802.
[11] Harris AD, Johnson JK, Thom KA, et al. Risk factors for development of intestinal colonization with imipenem-resistantPseudomonasaeruginosain the intensive care unit setting[J]. Infect Control Hosp Epidemiol, 2011, 32(7): 719-722.
[12] 张祎博, 倪语星, 孙景勇, 等. 2010年中国CHINET铜绿假单胞菌耐药性监测[J].中国感染与化疗杂志, 2012, 12(3):161-166.
[13] 许宏涛, 陈东科, 俞云松, 等.多重耐药铜绿假单胞菌产β-内酰胺酶耐药机制研究[J].中华医院感染学杂志, 2005, 15(1):20-22.
[14] Liu YM, Chen YS, Toh HS, et al. In vitro susceptibilities of non-Enterobacteriaceae isolate from patients with intra-abdominal infections in the Asia-Pacific region from 2003 to 2010: results from the Study for Monitoring Antimicrobial Resistance Trends(SMART)[J]. Int J Antimicrob Agents, 2012, 40 (Suppl): S11-S17.
[15] Xiao M, Wang Y, Yang QW, et al. Antimicrobial susceptibility ofPseudomonasaeruginosain China: a review of two multicentre surveillance programmes, and application of revised CLSI susceptibility breakpoints[J]. Int J Antimicrob Agents, 2012, 40(5): 445-449.
[16] 张鸿, 申建维, 孙秀琴, 等.医院感染铜绿假单胞菌的耐药性变迁分析[J].中华医院感染学杂志, 2013, 23(2):449-451.
[17] 展冠军, 詹莹, 邵华.铜绿假单胞菌对抗菌药物耐药性研究[J].中华医院感染学杂志, 2014, 24(20):5025-5026, 5032.
[18] 王继东, 金辉, 糜祖煌, 等.医院感染铜绿假单胞菌菌株亲缘性分析[J].中华医院感染学杂志, 2006, 16(12):1337-1339.
(本文编辑:刘思娣)
Homology and clinical characteristics of healthcare-associated infection withPseudomonasaeruginosain medical intensive care unit
ZHANGPing1,2,LIUHong-mei3,CHENYu1,ZHAOSi-hong1,LIYu-rong2,SONGZheng-chang4,ZHAOLi1
(1ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China; 2TheFourthPeople’sHospitalofShenyang,Shenyang110031,China; 3TheFourthPeople’sHospitalofChaoyang,Chaoyang122000,China; 4AffiliatedHospitalofTaishanMedicalUniversity,Taishan271000,China)
Objective To study the homology and clinical characteristics of healthcare-associated infection(HAI) due toPseudomonasaeruginosa(P.aeruginosa) in medical intensive care unit (MICU), so as to guide the clinical prevention ofP.aeruginosatransmission and improve therapeutic effect. Methods 55P.aeruginosastrains isolated from 25 patients with HAI in the MICU of a hospital in January-December 2014 were performed pulsed-field gel electrophoresis (PFGE) homology analysis and clustering analysis, clinical characteristics, antimicrobial resistance, and transmission characteristics were analyzed.Results A total of 25 patients were investigated, with an average age of (69.62±2.13) years, mean hospital stay (49.34±3.18) days; prior to the isolation ofP.aeruginosa, 84.00% of patients were treated with broad-spectrum antimicrobial agents for >2 weeks, 76.00% of patients had been admitted to MICU, and 52.00% had a ventilator-assisted ventilation. 55 strains ofP.aeruginosawere mainly A, F, H, K, N, V, and W, which were the main epidemic strains; patients infected with A, F, H and K strains all had cross in their hospital stay; PFGE profiles of isolates from 4 patients during different periods showed different strain patterns; resistance rates ofP.aeruginosato ceftazidime (72.73%), piperacillin/tazobactam (70.91%), and imipenem(70.91%) were all high, resistance rate to amikacin was the lowest(25.45%). Conclusion Management of antimicrobial agents should be strengthened in medical institutions, HAI control measures should be strengthened, so as to prevent the transmission of multidrug-resistant and extensively drug-resistant bacteria in hospitals.
intensive care unit;Pseudomonasaeruginosa; pulsed-field gel electrophoresis; homology; spread characteristic; clinical analysis
2016-07-24
张萍(1987-),女(汉族),辽宁省铁岭市人,医师,主要从事老年患者肺部感染性疾病的防治研究。
陈愉 E-mail:chenyusy@hotmail.com
10.3969/j.issn.1671-9638.2017.07.003
R378.99+1
A
1671-9638(2017)07-0600-06
