基于深井原位采集技术的塔里木油田内源微生物多样性研究
2017-08-16孟祥娟欧阳国强曾有信杨忠武徐海霞
孟祥娟, 欧阳国强, 曾有信, 杨忠武, 徐海霞
(中国石油天然气股份有限公司 塔里木油田分公司 油气工程研究院, 库尔勒 841000)
基于深井原位采集技术的塔里木油田内源微生物多样性研究
孟祥娟, 欧阳国强, 曾有信, 杨忠武, 徐海霞
(中国石油天然气股份有限公司 塔里木油田分公司 油气工程研究院, 库尔勒 841000)
为深入了解塔里木油田高温高压环境中内源微生物的群落组成及潜在功能,利用原油高压物性仪在轮南和塔中区块分别选择LN-A井和TZ-B井进行深井原位采样和井口采样,比较油水样品中微生物群落多样性的差异。环境基因组技术分析结果显示:在深井原位采集样品中,LN-A井优势菌群为Bacillus(芽孢杆菌属,56%),TZ-B井为Pseudomonas(假单胞菌属,50%);井口样品中优势菌群与原位样品一致,但比例偏高。原位采集组的样品中微生物群落结构更为丰富(LN-A井原位和井口采集样品中分别为14种和3种;TZ-B井分别为12种和3种),优势菌群分散,同时还发现多种新型功能微生物。深井原位采集技术、环境基因组技术和微生物群落分析技术的有机结合,对于充分认识并深度挖掘高温高压油藏中功能微生物资源,并应用于微生物采油技术中具有现实的指导意义和推广价值。
塔里木油田;深井原位采集技术;环境基因组学;微生物多样性分析;微生物采油
塔里木油田油藏环境条件复杂苛刻,多数油井埋深超过5000 m,内部温度高达110℃~150℃,矿化度高达11×104~26×104mg/L[1],开发新型高效的采油新材料也颇具挑战性。然而西部地区复杂多样的极端生态环境下有大量宝贵的微生物资源,在已有的微生物提高原油采收率技术(Microbial enhanced oil recovery, MEOR)理论依据和实践经验的基础上开展微生物采油可行性研究,是塔里木油田提高采收率的一个重要技术方向。
目前已有文献报道从西部地区各大油田中筛选功能微生物,进行室内驱油效率评价并应用于现场提高采收率[2-3]。新疆陆梁油田微生物种群及其多样性研究结果显示:16S rDNA序列分析证实该油藏具有大量微生物类群(155个细菌属和7个古生菌属),如此丰富的微生物菌群,表明该油藏具有广阔的MEOR潜力[4]。选取新疆克拉玛依油田某区块,进行稠油降黏菌株BT-003的MEOR现场试验,共应用10余井次,措施有效率达85%,累积增油量高于1500 t[5]。在新疆油田七中区克上组实施微生物驱实验和陆梁油田陆9井区微生物驱先导实验,采用4注9采,单泵对双井集中注入微生物激活剂,压风机连续或段塞式注入空气工艺施工两年,累计增油量高于1.3×104t。MEOR在新疆区域矿场实施的成功案例,对于塔里木油田开展微生物的群落结构、功能、多样性、调控等方面的深入研究,开发新型MEOR技术体系和产品具有重要的指导意义[6-7]。
塔里木油田极端的油藏环境条件下存在大量不为人知的极端微生物,独特的基因类型、特殊的生理机制及代谢产物,使它们具有成为未来石油工程新材料的无限可能;但是由于极端生活条件的限制,传统采样方法很难获得原始内源微生物样品并加以研究,即使应用较先进的环境基因组学分析方法,由于采集过程中,压力、温度等环境条件的变化,有可能使内源微生物死亡,甚至连残存的DNA片段也无法有效提取。因此,保持稳定的环境条件采集方式是研究人员面临的一个难题。目前国内非自喷井的高压物性采样技术分为常规采样(包括自然沉降法、捞油筒采样法、江斯顿地层测试器采样法、灌轻质油法)和电控式采样[8]。其中电控式采样中的高压物性仪(压力-温度-体积测试仪,Pressure-volume-temperature,PVT)原位采集系统具有油、气、水界面测量功能,能在采样前掌握地层流体相态、气油比、流体类型、压力与体积系数、压力与原油黏度关系等,从而避免盲目采样。PVT原位样品采集过程封闭,至地面无菌操作间开启后导出流体,迅速过滤并冷却,可最大程度地保留内源微生物遗传信息以便于后续分析[9]。
本文在塔里木油田的LN-A和TZ-B两口油井进行PVT深井原位采样,结合环境基因组技术,研究油藏内源环境中的微生物群落,完成微生物种类的鉴定和定量分析。本文是国内首次利用PVT仪进行深井采集并开展微生物多样性分析,为深度挖掘适应高温高压(High pressure and high temperature, HPHT)油藏等极端环境的潜在采油微生物资源提供新的方法,该技术体系可全面精准地反映油藏内源微生物群落特征,并为塔里木油田MEOR的开发和应用提供最直接的理论支持。
1 材料与方法
1.1 材料
用于内源微生物研究的PVT样品采集与常规PVT样品采集选井原则略有不同。常规PVT样品采集井要求选择产水率小于5%的油气井。用于微生物研究的PVT采集为排除外来微生物的干扰,要求选择的油井是未注水层位的油井,或注水后间隔30 d以上未再行注水的油井,对产水率没有要求。通过严格筛选,样品分别采集自新疆塔里木油田轮南和塔中两区块的LN-A井和TZ-B井。两口井基本地层参数见表1。LN-A井埋深5252.80 m,地层温度121.30℃,压力为51.00 MPa,地层水矿化度为1.90×105mg/L,偏酸性。TZ-B井埋深4093.00 m,地层温度106.09℃,压力为42.53 MPa,地层水矿化度为5.61×104mg/L,偏碱性。两口井的油藏物性存在明显差别,具有一定差异性和区块代表性,可以进行深井原位采集和环境基因组分析。

表1 LN-A井和TZ-B井基本地质信息
1.2 方法
1.2.1 采样方法 利用PVT仪分别在候选深井进行原位采样,可以实现一次性采集目标油藏特定埋深处的油水样品。PVT深井采样现场包括作业车、PVT仪、井上无菌微生物收集系统、微生物分筛所需设备仪器。采样过程首先根据数值模拟结果、采样所需的埋藏深度,结合PVT所连钢缆的下放速度,调节PVT仪上的开启时间,由井口入井下。本实验设定采集埋深为4500 m,下放速度为100 m/min,PVT自动开启及收集定时为1 h,收集时间为10 min;连续油管总长度6200 m,实际下连续油管至预定位置4590 m,此时连续油管内压力为56 MPa。待PVT仪完成开启、收集、关闭程序后,由作业车在设定时间内提升并收回钢缆,回收PVT仪;在地面无菌操作间迅速开启PVT仪处理样品。
1.2.2 微生物多样性分析方法
1)基因组总DNA提取:取PVT仪中的100 mL水样于70℃水浴30 min,滤纸过滤油水混合物,收集水相。留在滤纸上方的原油与2倍体积无菌PBS混合,充分搅拌,用滤纸过滤收集水相,重复3次。合并过滤后水相用0.22 μm微孔滤膜真空抽滤,富集菌体于滤膜上。使用TaKaRa细菌基因组DNA小量纯化试剂盒提取已富集菌体的基因组DNA。按照文献[10]中方法进行琼脂糖凝胶电泳,可获得基因组DNA相对分子质量。
2)16S rDNA扩增 使用细菌16S rDNA通用引物8F(5′-TTTGATCCTGGCTCAG-3′)及1492R(5′-GGTTACCTTGTTACGACTT-3′)从深井及井口样品基因组DNA中扩增细菌16S rDNA片段。使用TaKaRa TP600 PCR仪(宝生物,大连)进行PCR反应,反应体系为50 μL,反应条件为94℃预变性4 min;94℃变性45 s,50℃退火45 s,72℃延伸90 s,共30个循环;72℃再延伸10 min,4℃保存。
3)RIS Library分析 使用TaKaRa DNA Ligation Kit中的Solution I,将纯化后的PCR产物和pMD19-T Vector连接,连接产物命名为CTD414,热转化至E.coli感受态细胞JM109中,涂布平板,37℃过夜培养。待转化子长出后,挑选白色菌落(原位采集组每井50个克隆,井口采集组每组40个克隆)进行重组子的PCR鉴定和重组载体酶切鉴定[10-11],委托宝生物工程(大连)有限公司测序,与GenBank中已知序列进行同源性比较,确定微生物种属。
2 结果
2.1 原油物性分析
深井原位采集和井口采集(对照)所获样品表观性状观察与含油量测定结果显示:深井采集样品为淡黄色油水混合物,含水率较高,含油量小于10%;井口样品为暗褐色油水混合物,相对含油增多至40%~50%,含水量为50%~60%。表明原油在举升过程中,逐渐运移、聚导致含水相对减少。但是通过对脱水原油组分的检测,发现深井和井口采集成分变化不显著。LN-A井和TZ-B井深井与井口样品原油组分见表2所示。

表2 LN-A井和TZ-B井原油组分分析
2.2 PVT深井原位采集样品的微生物多样性分析
深井采集的油样通过基因组总DNA提取,获得相对分子质量约为23 ku的细菌全基因组组分,证实深井原位采集技术可获取完整的微生物遗传信息资源,表明井下采样操作对微生物的活性不会造成显著影响。以所获基因组DNA为模板,进行16S rDNA全序列扩增,所获PCR产物经纯化后连接于pGEM-T载体中构建基因文库,用于后续多样性分析。使用RIS Library分析方法对16S rDNA插入序列进行随机测序,通过与GenBank中已知序列进行同源性比较,确定微生物种属。
LN-A井与TZ-B井深井原位采集样品的群落多样性结果见图1所示。LN-A井中优势菌群为Bacillus(芽孢杆菌属),占微生物总数的56%,包括8个种:Bacillussubtilis(枯草芽孢杆菌)、Bacilluslicheniformis(地衣芽孢杆菌)、Bacillushalodurans(盐芽孢杆菌)、Bacilluscereus(蜡状芽孢杆菌)、Bacillusmethylotrophicus(甲醇芽孢杆菌)、Bacillusokhensis(奥哈芽孢杆菌)、Bacilluspermians(二叠纪芽孢杆菌)和Bacilluspumilus(短小芽孢杆菌),所占比例分别为38%、6%、2%、2%、2%、2%、2%和2%;其次为Pseudomonas(假单胞菌属),占微生物总数的16%,包含两个种,Pseudomonasaeruginosa(铜绿假单胞菌)和Pseudomonasputida(恶臭假单胞菌),所占比例分别为12%和4%;除此之外还有2%的Acinetobacter(不动杆菌属)、2%的Chryseobacterium(金黄杆菌属)和18%的未可培养微生物(图1-a)。
TZ-B井中优势菌群为Pseudomonas,占微生物总数的50%,其下分为P.aeruginosa46%、P.putida4%;其次为Bacillus,占微生物总数的10%,其中B.subtilis和Bacillusniacini(烟酸芽孢杆菌)所占比例分别为8%和2%;除此之外还有6%的Acinetobacter、2%的Burkholderia(伯克霍尔德菌属)、14%的未可培养微生物和其他5种微生物(图1-b)。
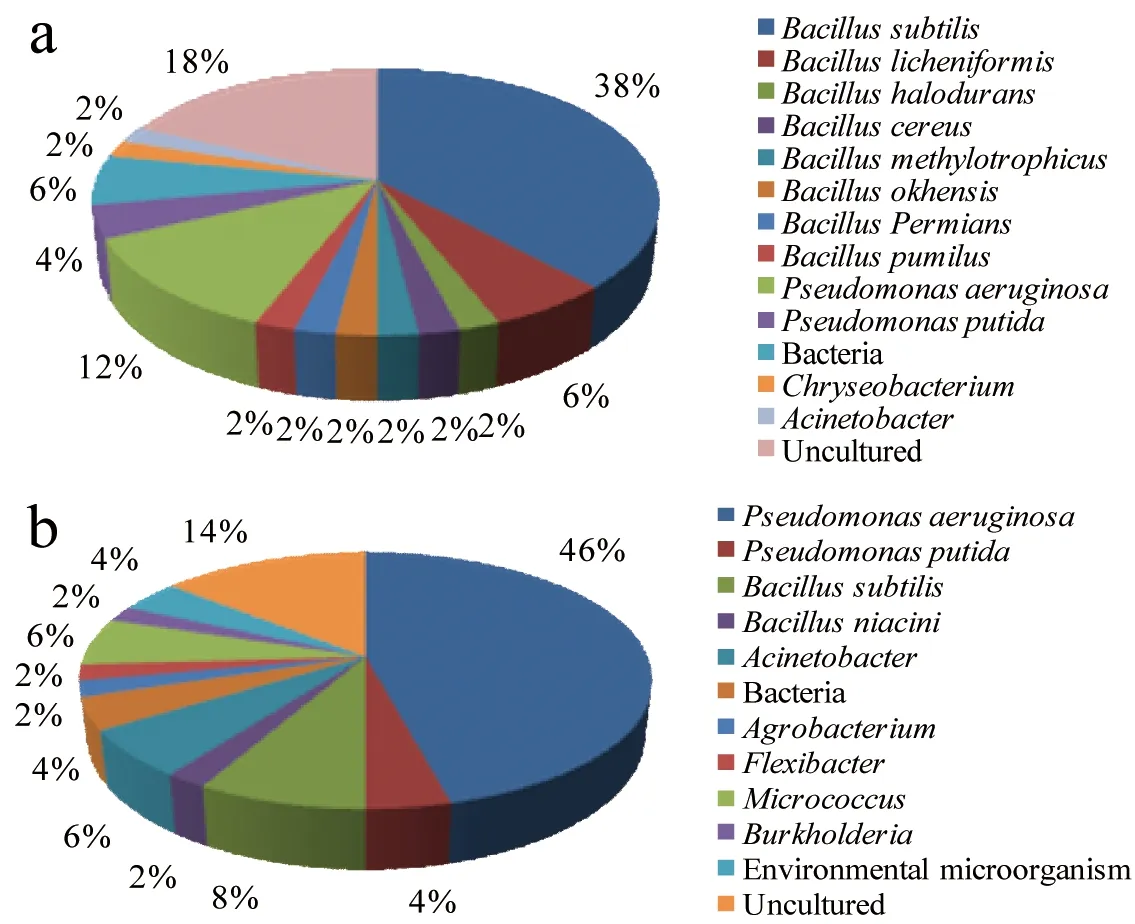
图1 深井原位采集微生物群落多样性(a: LN-A井;b: TZ-B井)
A: well LN-A; b: well TZ-B
2.3 井口采集样品的微生物多样性分析
井口采集样品组通过基因组总DNA提取,同样获得相对分子质量约为23 ku的细菌全基因组组分。微生物多样性分析同PVT深井原位采集样品分析方法。
LN-A井与TZ-B井井口样品群落多样性结果如图2所示。LN-A井中优势菌群为Bacillus,占微生物总数的82.5%,其中分别为B.subtilis(80%)和B.licheniformis(2.5%);除此之外还有12.5%的不可培养微生物(图2-a)。TZ-B井中优势菌群为Pseudomonas,占微生物总数的80%,其次为Bacillus,占微生物总数的16.7%,同时存在3.3%的未可培养微生物(图2-b)。
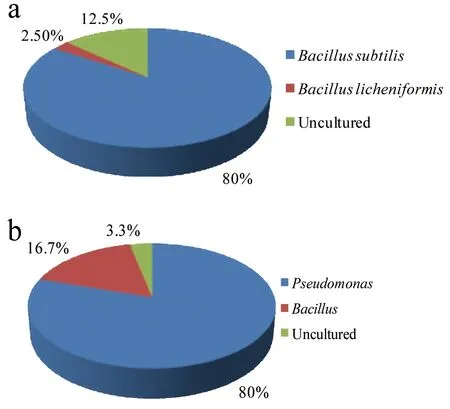
图2 井口采集微生物群落多样性(a: LN-A井;b: TZ-B)
A: well LN-A; b: well TZ-B
2.4 两种采集方式的微生物群落对照
LN-A井和TZ-B井深井原位采集和井口采集方式的环境基因组和微生物群落对照分别见图3和表3。将两种采集方式的油样通过基因组总DNA提取,获得相对分子质量约为23 ku的细菌全基因组组分;再比较同样体积油水样品中所获得的基因组总DNA量(图3),凝胶电泳图上结果显示:PVT采集方式得到的微生物群落多样性显著高于井口采集方式,证明该技术可以最大限度地保持油藏内部微生物群落的真实状态。

图3 油水样品中环境基因组凝胶电泳图
Line1:LN-A井深井采集样品微生物基因组;Line2:LN-A井口采集样品微生物基因组;Line3:TZ-B井深井采集样品微生物基因组;Line4:TZ-B井口采集样品微生物基因组;Marker为分子量标记
3 讨论
LN-A井与TZ-B井深井原位采集样品的群落多样性对比结果显示:LN-A井中Bacillus占优势地位,B.subtilis所占比例远高于其他微生物种群,其他12种微生物所占比例为2%~18%;TZ-B井中则以Pseudomonas占主导地位,可培养微生物丰度略低于LN-A井样品,P.aeruginosa比例接近总数一半,其余菌种比例为2%~14%。种群结构出现显著差异性的原因在于轮南和塔中两个区块油藏特点存在较大差别:轮南区块是由超深、多层砂岩组成的水驱油田,目前处于高含水阶段;塔中区块岩性以细砂岩为主,属中孔、中渗储集层,油藏类型主要为底水块状油藏[1]。油藏环境和原油物性差别造成微生物种类及分布不同。
已有文献报道Bacillus和Pseudomonas是MEOR的重要功能微生物。实验室环境下,以烃类为碳源从油井产出液中分离得到的主要是Bacillus[12]。Bacillus通过产生生物表面活性剂降低原油与水以及岩石之间的界面张力;或通过降解长链烃类降低原油黏度[13]、增加原油流动性;或产生生物聚合物选择性地堵塞油藏中的高渗孔道,增加注入水的波及系数从而达到提高原油采收率的目的[12]。P.aeruginosa是油田中最常见且应用最多的石油微生物,能降解长碳链烃、非烃类和芳香烃类等,尤其对非烃类和芳香烃类含量较高的原油降解效果显著[14-15]。此外,P.aeruginosa产生的鼠李糖脂生物表面活性剂,具有乳化、润湿、增溶、吸附、发泡、破乳、絮凝、渗透等性能[16-18],广泛用于MEOR和石油污染修复。P.aeruginosa和B.subtilis复合菌株发酵液可将水的表面张力降低到25.1 mN/m,室内驱油模拟实验表明,复合微生物驱替可使采收率提高17.38%[19]。
LN-A井与TZ-B井的井口采集样品群落多样性对比分析结果显示:LN-A井样品中可培养微生物只有Bacillus,TZ-B井样品中可培养微生物则以Pseudomonas占主要地位,此外为少量Bacillus。两口井井口样品所含菌种单一,无法准确反应油藏环境微生物资源的丰度。井口样品中微生物组成种类较少,主要原因可能为微生物在原油开采过程由深井带入井口附近,压力、温度、矿化度和pH等条件的改变,导致大量微生物因环境改变而死亡。此外,掺稀等增产措施的污染及地表浅层微生物污染同样会造成大量菌株死亡,导致井口微生物组成单一。
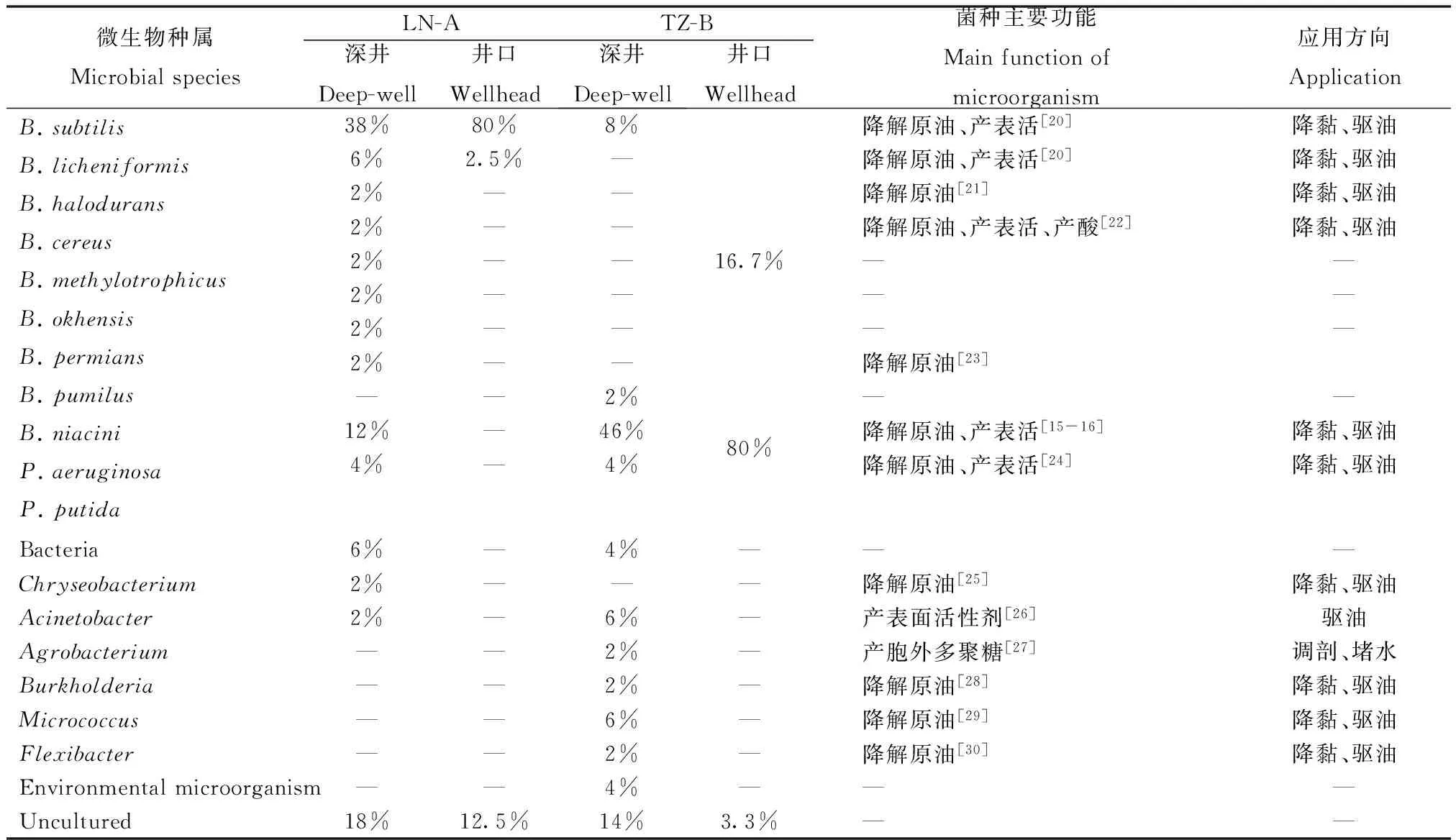
表3 塔里木油田LN-A井和TZ-B井两种采集方式微生物群落对照
通过对两口井微生物群落多样性分析,可全面了解深井原位采集和井口采集的样品中微生物的种属组成(表3),分析如下。
1)深井原位采集样品与井口采集样品群落结构中的优势菌属大体相似,但井口采集组的微生物多样性较深井原位采集组简单,且呈现优势菌群相对密集的现象。
2)两口井的优势菌属均为Bacillus和Pseudomonas,为油田常见的MEOR工程微生物,可实施于微生物降黏、驱油及选择性封堵等工艺措施[31]。两个菌属的绝大多数微生物与已知的嗜热菌具有95%以上的同源性(结果未显示),对应的嗜热菌经文献调研,理论上至少可耐受100°C以上的高温。
3)深井原位采集组中的B.subtilis、P.aeruginosa和P.putida通常可表达高效生物表面活性剂和聚合物,用于稠油降黏、微生物驱油、调剖和清防蜡等[32];Acinetobacter所表达的生物表面活性剂emulsan是目前已知的最有效的生物乳化剂[26]。
4)在矿化度较高的LN-A井中,深井原位采集样品组检测出少量盐芽孢杆菌,该菌为耐盐菌种,在MEOR应用中可作为高矿化度油藏微生物工程菌的潜在分子载体。
两种采集方法分析结果显示:深井原位采集技术与传统井口采集技术相比,可获得更为详尽精准的微生物资源信息,表明塔里木油田LN-A井和TZ-B井具有激发内源微生物,进而提高原油采收率的潜力。
4 结论
1)塔里木油田的大多数油藏属于HPHT油藏,油藏深层蕴藏着丰富的极端微生物资源。地表采集样品往往不能充分反映油藏深层情况,为充分利用内源微生物资源,有必要进行深井原位采集样品。
2)PVT深井原位采集技术的微生物多样性分析结果显示:LN-A井深井原位采集与井口样品中优势菌群均为Bacillus,原位组微生物多样性(14种)显著多于井口样品(3种);TZ-B井原位采集与井口样品中优势菌群均为Pseudomonas,原位组微生物多样性(12种)显著多于井口组(3种)。基于此,深井原位采集技术有望为塔里木油田开展MEOR提供坚实的物质基础。
3)通过PVT深井原位采集技术,结合微生物学、分子生物学、环境基因组学以及基因工程的技术手段,可以大大缩短微生物菌种及代谢产物的开发周期,加深对HPHT油藏内源微生物的认识,在微生物及功能分子筛选过程中可做到有的放矢。
[1]周 明, 冯积累, 江同文, 等. 塔里木油田高温高矿化度油藏三次采油初步研究[J]. 新疆石油地质, 2010, 31(2): 163-166.
[2]BROWN L R. Microbial enhanced oil recovery (MEOR) [J]. Current Opinion in Microbiology, 2010, 13(3): 316-320.
[3]汪卫东. 微生物采油技术研究及试验[J]. 石油钻采工艺, 2012, 34(1): 107-113.
[4]GAO P, TIAN H, LI G, et al. Microbial diversity and abundance in the Xinjiang Luliang long-term water-flooding petroleum reservoir [J]. Microbiology Open, 2015, 4(2): 332-342.
[5]赵玲莉, 高 雁, 张 涛, 等. 微生物驱油技术在克拉玛依油田的应用[J]. 石油化工应用, 2015, 34(9): 40-42.
[6]向廷生, 王 莉, 张 敏. 油藏微生物及其在石油工业中的应用[J]. 生物技术, 2005, 15(4): 87-90.
[7]谷 峻, 石成芳, 吴晓磊, 等. 油藏微生物群落研究的方法学[J]. 生态学报, 2013, 27(1): 323-328.
[8]李志文, 李春生, 周志江. PVT电控式高压物性取样研究[J]. 油气井测试, 2002, 11(6): 51-53.
[9]谢 英, 周理志, 刘建勋, 等. 一种油藏内源微生物原位采集方法: CN, 102952846 A [P]. 2011.
[10]SAMBROOK J, RUSSELL D W. Molecular Cloning: A Laboratory Manual [M]. New York: Cold Spring Harbor Laboratory Press, 2001: 96-99.
[11]王 君, 马 挺, 刘 静, 等. 利用PCR-DGGE技术指导高温油藏中功能微生物的分离[J]. 环境科学, 2008, 29(2): 462-468.
[12]YOUSSEF N, ELSHAHED M S, MC-INERNEY M J. Microbial process in oil field: culprits, problems, and opportunities [J]. Advances in Applied Microbiology, 2009, 66: 141-251.
[13]CERQUEIRA V S, HOLLENBACH E B, MABONI F, et al. Biodegradation potential of oily sludge by pure and mixed bacterial cultures [J]. Bioresource Technology, 2011, 102(23): 11003-11010.
[14]王娟娟, 张 宇, 付 娜, 等. 超低渗油藏微生物吞吐技术的矿场试验[J]. 微生物学通报, 2016, 43(2):241-253.
[15]夏文杰, 董汉平, 俞 理, 等. 铜绿假单胞菌WJ-1降解原油特性[J]. 化工学报, 2011, 62(7): 2013-2019.
[16]SALWA M S, ASSHIFA M N N, AMIRUL A A, et al. Different feeding strategy for the production of biosurfactant fromPseudomonasaeruginosaUSM AR2 in modified bioreactor [J]. Biotechnology & Bioprocess Engineering, 2009, 14(6): 763-768.
[17]REN H Y, ZHANG X J, SONG Z Y, et al. Comparison of microbial community compositions of injection and production well samples in a long-term water-flooded petroleum reservoir [J]. Plos One, 2011, 6(8): e23258.
[18]ZHANG F, SHE Y H, LI H M, et al. Impact of an indigenous microbial enhanced oil recovery field trial on microbial community structure in a high pour-point oil reservoir [J]. Applied Microbiology & Biotechnology, 2012, 95(3): 811-821.
[19]赵 文, 杨 剑, 黄先利, 等. 复合驱油菌株提高安塞低渗透油田采收率实验[J]. 新疆石油地质, 2014, 35(6): 699-702.
[20]李俊峰, 刘 丽. 脂肽类生物表面活性剂的研究进展[J]. 化学与生物工程, 2015, 32(1): 12-15.
[21]吴福顺, 王 龙, 黄泽瑜, 等. 海洋石油降解菌的筛选鉴定及其功能基因研究[J]. 中国海洋大学学报(自然科学版), 2014, 44(9): 58-65.
[22]郭万奎, 侯兆伟, 石 梅, 等. 短短芽孢杆菌和蜡状芽孢杆菌采油机理及其在大庆特低渗透油藏的应用[J]. 石油勘探与开发, 2007, 34(1): 73-78.
[23]王中华, 梁静儿, 杨建强, 等. 原油微生物群落构成及降解菌降解特性的研究[J]. 生物技术通报, 2013(1): 178-185.
[24]余 薇. 石油降解微生物的筛选及其降解特性的研究[D]. 武汉: 华中农业大学, 2013.
[25]孟 帆. 石油烃降解菌群富集及其在石油污染土壤修复中的应用研究[D]. 杭州: 浙江大学, 2015.
[26]罗 强, 蒲万芬, 滕小兰, 等. 高分子生物表面活性剂Emulsan的研究进展[J]. 日用化学工业, 2008, 38(3): 185-188.
[27]王正良, 李向前, 周玲革, 等. 克拉玛依油田产出液中一株产多糖本源细菌及所产多糖的研究[J]. 油田化学, 2007, 24(2): 163-166.
[28]周金葵, 王大威, 廖明清, 等. 一株石油烃降解菌的筛选及性能评价[J]. 大庆石油地质与开发, 2007, 26(6): 119-123.
[29]张鲁进, 杨 谦, 李 妍, 等. 石油降解菌株的分离筛选及降解性能研究[J]. 黑龙江大学自然科学学报, 2007, 24(6): 743-746.
[30]贾洪柏. 石油污染土壤的微生物修复及对相关土壤细菌群落多样性的影响[D]. 哈尔滨: 东北林业大学, 2013.
[31]张雪梅, 佘跃惠, 黄金凤等. 大庆油田聚合物驱后油藏微生物多样性研究[J]. 应用与环境生物学报, 2008, 14(5): 668-672.
[32]孟祥娟, 陈德飞, 曹献平, 等. 生物技术在老化油处理中的研究与应用进展[J]. 化工进展, 2016, 35(8):2406-2411.
Endogenous microbial diversity in Tarim oilfield based on deep well in-situ sampling technique
MENG Xiang-juan, OUYANG Guo-qiang, ZENG You-xin, YANG Zhong-wu, XU Hai-xia
( Institute of Oil and Gas Engineering, Traim Oilfield Company, PetroChina, Korla 841000, China)
To insight into the endogenous microbial communities and potential functions living in high pressure and high temperature (HPHT) reservoirs of Tarim Oilfield, crude oil pressure-volume-temperature (PVT) properties equipment was operated for deep wellsin-situsampling in both LN-A and TZ-B wells selected in Lunnan and Tazhong zone, respectively. Meanwhile, wellhead samples were collected as the control. The differences of microbial community diversity in oil-water samples were compared and analyzed. The metagenomics results showed that the dominant microorganism frominsitusamples of LN-A well wasBacillus(56%), which of TZ-B well wasPseudomonas(50%). Comparing with samples from wellhead, the dominant microorganism was in accord with that ofin-situ, however, the percentage was a little bit higher. The results of the two sampling methods showed that the microbial community structure was richer, dominant bacteria was dispersed, and more new functional microorganisms were found in deep well group (in-situand wellhead samples were 14 and 3 species from LN-A well, respectively, while those of TZ-B well were 12 and 3 species). In this study, deep wellin-situcollection, metagenomics and microbial community analysis technologies were integrated, which can help us fully understand and probe in-depth the functional microbial resource in HPHT reservoir. Additionally, this article can provide practical instructions and application value in microbial enhanced oil recovery technology performed in HPHT reservoir.
Tarim oilfield; deep wellin-situsampling; metagenomics; microbial diversity analysis; microbial enhanced oil recovery
2016-08-09;
2016-12-26
中国石油股份公司重大科技专项《塔里木油田勘探开发关键技术研究》
孟祥娟,工程师,研究方向为化学工程与采油工艺,E-mail:mengxj-tlm@petrochina.com.cn
X172
A
2095-1736(2017)04-0082-06
doi∶10.3969/j.issn.2095-1736.2017.04.082
