血乳酸浓度对急性A型主动脉夹层术后患者预后的影响
2017-08-16周楚芝李春燕吕春燕李静茹陈伟新温隽珉
周楚芝,李春燕,吕春燕,李静茹,陈伟新,温隽珉
(深圳市孙逸仙心血管医院心外科重症监护室深圳市心血管病研究所,广东深圳520018)
·论著·
血乳酸浓度对急性A型主动脉夹层术后患者预后的影响
周楚芝,李春燕,吕春燕,李静茹,陈伟新,温隽珉
(深圳市孙逸仙心血管医院心外科重症监护室深圳市心血管病研究所,广东深圳520018)
目的回顾性研究血乳酸浓度测定在预测急性A型主动脉夹层术后患者预后的价值。方法对144例在深圳市孙逸仙心血管医院接受急性A型主动脉夹层手术,术后转入重症监护病房(intensive care unit,ICU)监护治疗的患者进行回顾性研究。收集这些患者复苏、入ICU初始及每26 h监测的血乳酸浓度,根据氧合指数和改善全球肾脏病预后组织(kidney disease:improving global outcomes,KDIGO)关于急性肾损伤的标准,患者被分为低氧血症组、非低氧血症组和急性肾损伤组、正常肾功能组。记录各组患者平均机械通气时间、ICU滞留时间及病死率,比较各组间乳酸和乳酸清除率的差别。并绘制受试者工作特征曲线(receiver operator characteristic curve,ROC)分析血乳酸浓度预测主动脉夹层手术患者院内病死率的最佳界值及其敏感度和特异度。结果低氧血症组入室血乳酸浓度、26 h血乳酸浓度、乳酸清除率与对照组比较,差异有统计学意义(P<0.01);急性肾损伤组初始血乳酸浓度、26 h血乳酸浓度、乳酸清除率与正常肾功能组比较,差异有统计学意义(P<0.01)。ROC曲线下面积为0.88。对于预测院内病死率,血乳酸最佳临界值为6.0 mmol/L,灵敏度为85%,特异性为77%。结论主动脉夹层手术患者血乳酸浓度可作为病情严重程度及预后的监测指标,值得临床关注。
主动脉夹层;乳酸;病死率;预后
急性斯坦福A型主动脉夹层(acute type A aortic dissection,AAAD)是一种常见且危及生命的疾病,未临床干预的AAAD病死率每小时递增1%至2%。即使经手术治疗,医院内病死率仍高达15%47%[1]。导致高病死率的术前危险因素包括肾功能衰竭,高龄,休克,心肺复苏,心肌梗死以及全身灌注不良的潜在指标,如神经系统改变、晕厥、低血压、肠系膜缺血和肢体缺血[2]。术中和术后死亡预测因子包括需要肾脏替代治疗、体外循环、阻断时间、出血和主动脉弓替换。血乳酸浓度增高反映了细胞氧供、氧耗的失衡,提示组织灌注不良和氧债的存在,往往预示着疾病的危重状态。已有研究报道,血乳酸可作为感染性休克、先天性心脏病死亡的预测因素[3]。本文就术后早期血乳酸浓度与主动脉夹层手术预后关系进行研究。
1资料和方法
1.1一般资料
选取2012年1月至2016年1月深圳市孙逸仙心血管医院心外科AAAD术后患者144例为研究对象。其中男134例、女10例,年龄(46.8±10.3)岁。所有患者入院后经行主动脉计算机断层扫描(computed tomography,CT)血管成像、心脏超声检查确诊为Stanford A型主动脉夹层,手术均在全身麻醉和深低温停循环(DHCA)下进行。诱导鼻咽温度降至20℃,肛温25℃,停循环下采用四分支人工血管重建主动脉弓部,降主动脉真腔内植入支架血管,即孙氏手术。收集复苏后血乳酸浓度,入重症监护病房(intensive care unit,ICU)即刻血乳酸浓度,之后2 h、3 h、6 h、12 h、24 h、48 h各监测1次,直至转出ICU。收集两组患者的年龄、性别、体质量、体外循环时间、主动脉阻断时间、深低温停循环时间、左心室射血分数(left ventricular ejection fraction,LVEF)、呼吸机辅助时间、氧合指数、血肌酐浓度、尿量、输血量、术后ICU滞留时间、住院时间。
1.2方法
根据全球肾脏病预后组织(kidney disease:improving global outcomes,KDIGO)指南急性肾损伤(acute kidney injury,AKI)的定义:48 h内血肌酐浓度增高≥26.5 μmol/L;或7 d内血肌酐浓度增高至≥基础值的1.5倍;或持续6 h尿量<0.5 mL/(kg·h)[4],将患者分为AKI组和肾功能正常值,比较两组血乳酸浓度和乳酸清除率的差别。根据氧合指数将患者分为两组:低氧血症组[氧合指数(PaO2/FiO2)≤200 mmHg,1 mmHg=0.133 kPa],非低氧血症组(氧合指数>200 mmHg);比较两组血乳酸浓度和乳酸清除率的差别。所有患者均动态观察血乳酸浓度及乳酸清除率至转出ICU或死亡,比较危重症患者早期不同时段血乳酸浓度及血乳酸清除率在其预后评估中的临床意义。
1.3数据计算公式
乳酸清除率的定义公式:6 h乳酸清除率=Lac(T0)-Lac(T6)/Lac(T0)×100%,12 h乳酸清除率=[Lac(T0)-Lac(12 h)]/Lac(T0)×100%(Lac=乳酸浓度)。高乳酸血症的诊断标准:正常血乳酸浓度在1.3 mmol/L左右,既往的研究表明体外循环术后血乳酸浓度>3.0 mmol/L时提示预后较差[5],因此,本研究将血乳酸浓度平均值>3.0 mmol/L作为术后高乳酸血症的诊断标准。
1.4统计学分析
采用SPSS 22.0统计学软件进行分析。计量资料以()表示,组间比较采用t检验或方差分析。计数资料以[n(%)]表示,组间比较采用χ2检验或Fisher′s确切概率法。对于连续变量,绘制受试者工作特征曲线(receiver operator characteristic curve,ROC)分析评估预测病死率的最佳血乳酸临界值,将曲线下面积(area under curve,AUC)描述为AUC±s。以P<0.05为差异有统计学意义。
2结果
2.1低氧血症组与非低氧血症组不同时间点乳酸浓度比较
回顾性研究144例患者的临床资料,其中93%是男性,住院病死率为9%(13/144)。低氧血症组与非低氧血症组不同时间点乳酸浓度比较,见表1。
2.2急性肾损伤组与正常肾功能组不同时间点乳酸浓度比较
AKI组与正常肾功能组不同时间点乳酸浓度比较,见表2。
表1 低氧血症组与非低氧血症组不同时间点乳酸浓度及其他观察指标比较 [±s]
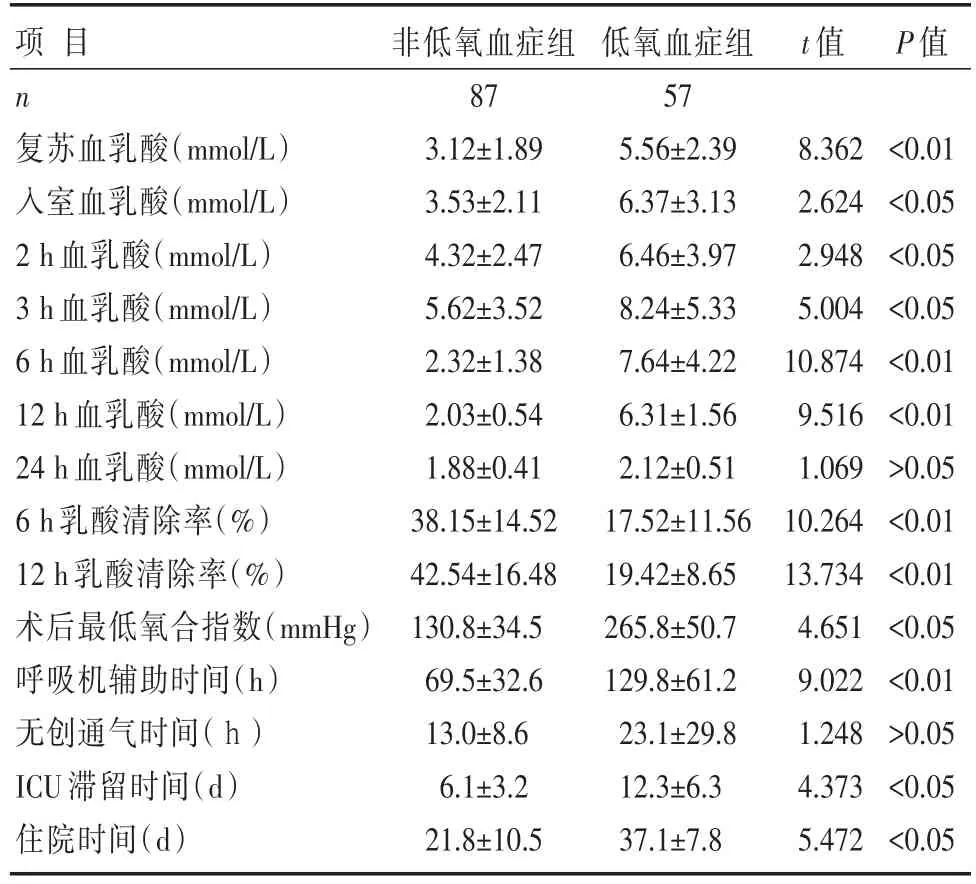
表1 低氧血症组与非低氧血症组不同时间点乳酸浓度及其他观察指标比较 [±s]
项目n复苏血乳酸(mmol/L)入室血乳酸(mmol/L)2 h血乳酸(mmol/L)3 h血乳酸(mmol/L)6 h血乳酸(mmol/L)12 h血乳酸(mmol/L)24 h血乳酸(mmol/L)6 h乳酸清除率(%)12 h乳酸清除率(%)术后最低氧合指数(mmHg)呼吸机辅助时间(h)无创通气时间(h)ICU滞留时间(d)住院时间(d)非低氧血症组87 3.12±1.89 3.53±2.11 4.32±2.47 5.62±3.52 2.32±1.38 2.03±0.54 1.88±0.41 38.15±14.52 42.54±16.48 130.8±34.5 69.5±32.6 13.0±8.6 6.1±3.2 21.8±10.5低氧血症组57 5.56±2.39 6.37±3.13 6.46±3.97 8.24±5.33 7.64±4.22 6.31±1.56 2.12±0.51 17.52±11.56 19.42±8.65 265.8±50.7 129.8±61.2 23.1±29.8 12.3±6.3 37.1±7.8 t值P值8.362 2.624 2.948 5.004 10.874 9.516 1.069 10.264 13.734 4.651 9.022 1.248 4.373 5.472<0.01<0.05<0.05<0.05<0.01<0.01>0.05<0.01<0.01<0.05<0.01>0.05<0.05<0.05
表2 AKI组与正常肾功能组不同时间点乳酸浓度及血肌酐浓度比较 [±s]
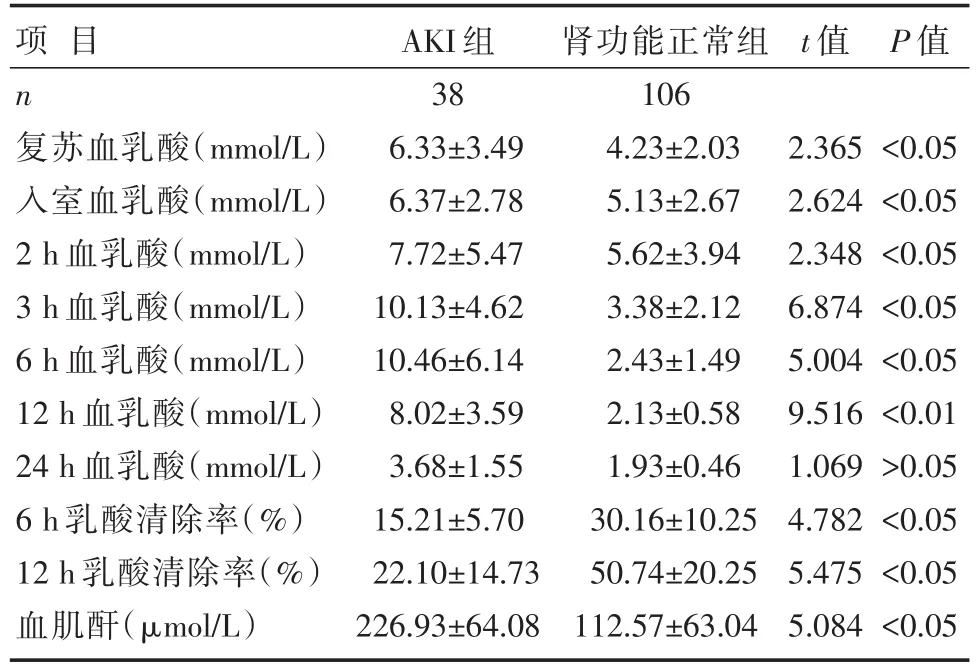
表2 AKI组与正常肾功能组不同时间点乳酸浓度及血肌酐浓度比较 [±s]
项目n复苏血乳酸(mmol/L)入室血乳酸(mmol/L)2 h血乳酸(mmol/L)3 h血乳酸(mmol/L)6 h血乳酸(mmol/L)12 h血乳酸(mmol/L)24 h血乳酸(mmol/L)6 h乳酸清除率(%)12 h乳酸清除率(%)血肌酐(μmol/L)AKI组38 6.33±3.49 6.37±2.78 7.72±5.47 10.13±4.62 10.46±6.14 8.02±3.59 3.68±1.55 15.21±5.70 22.10±14.73 226.93±64.08肾功能正常组106 4.23±2.03 5.13±2.67 5.62±3.94 3.38±2.12 2.43±1.49 2.13±0.58 1.93±0.46 30.16±10.25 50.74±20.25 112.57±63.04 t值P值2.365 2.624 2.348 6.874 5.004 9.516 1.069 4.782 5.475 5.084<0.05<0.05<0.05<0.05<0.05<0.01>0.05<0.05<0.05<0.05
2.3受试者工作特征曲线分析结果
绘制ROC以评估在预测院内病死率中血清乳酸浓度的最佳临界值(图1)。ROC的AUC为0.88。对于预测院内病死率,选择约登指数(Youden)最大原则(灵敏度+特异度1)确定血乳酸最佳临界值为6.0 mmol/L,灵敏度为85%,特异性为77%。
3讨论
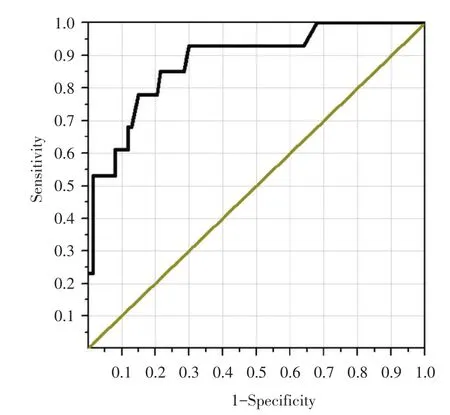
图1 入ICU24 h血乳酸浓度预测患者死亡的ROC图
葡萄糖在细胞质无氧条件下转化成丙酮酸,丙酮酸在有氧条件下进入三羧酸循环最终生成三磷酸腺苷(ATP)、二氧化碳和水。正常情况下,通过体内的调节机理,乳酸波动在正常范围内,在组织低灌注、应激状态、动脉血氧含量降低等情况下,糖的有氧过程受阻,三羧酸循环无法顺利完成,使得无氧酵解的途径被激活,产生大量乳酸,糖原转化为强酸性的丙酮酸、乳酸[6]。当乳酸生成速度超过清除时,血乳酸浓度就会升高,危重症患者血乳酸升高常见并与病死率增加相关。血乳酸浓度及血乳酸浓度增高的速度已被视为监测休克或脏器灌注不良的重要指标,高乳酸血症及代谢性酸中毒是否被纠正,也成为预后改善与否的重要指标之一[7]。重症患者,如果初始血乳酸浓度越高、12 h乳酸清除率越低,则患者出现预后不良几率高。本研究也发现高乳酸血症在体外循环术后很常见,尤其经历深低温停循环,术后34 h乳酸浓度往往达到高峰,24 h基本恢复到正常范围,但在12 h内,血乳酸浓度最高值仍>6 mmol/L,对术后病死率预测有显著意义。
低氧血症是急性主动脉夹层,尤其是孙氏术后常见的并发症,通常因长期呼吸机支持引起许多不良后果,术后持续低氧血症可能导致除了肺部以外其他器官功能障碍。这明显增加了术后病死率,相关病死率占总体病死率的30%~55%[8],而且延长机械通气和ICU滞留时间。急性主动脉夹层内膜撕裂,中层组织暴露于血液中,导致中性粒细胞和单核细胞大量聚集激活,释放大量炎性因子入血,而细胞因子能够放大炎症级联反应,发生全身炎症反应[9]。体外循环时的低灌注压力、低温和血液稀释可以使组织无氧代谢增加,导致乳酸浓度的明显升高。深低温停循环的肺损伤是中性粒细胞介导的,肺血管内皮细胞缺氧后线粒体肿胀和水肿。氧自由基大量形成,钙超载和能量代谢紊乱加重再灌注损伤,缺血再灌注损伤后活性氧和炎症介质释放进入循环[10],中性粒细胞、血小板、补体和凝血系统的激活,以及继发于血液与体外循环管道接触的炎性因子释放,上述大量炎性介质及缩血管因子引起组织和器官灌注不良,加上低氧血症本身引起的组织缺血、缺氧,无氧代谢增加,乳酸形成。肾脏是机体供血量最丰富的器官之一,因此,肾脏对缺血缺氧的损伤高度敏感,各种原因所致的AKI病理生理过程中都可能出现缺氧。本研究结果发现,AKI组血乳酸浓度升高明显,乳酸清除率降低,与正常肾功能组比较,差异有统计学意义(P<0.05),动脉血乳酸浓度对提示肾脏缺血性损伤有重要意义。
既往研究描述增加AAAD术后患者的院内病死率危险因素包括低血压,灌注不良并发症(下肢、心肌、肠系膜),神经系统异常,肾功能障碍(肾小球滤过率≤60 mL/min),白细胞或中性粒细胞计数升高,C反应蛋白浓度增加和高龄[11]。单变量队列研究显示增加院内病死率的预测因素,包括乳酸浓度、射血分数低、毛细血管渗漏、神经系统改变、重度主动脉瓣关闭不全和心肺复苏。Kawase等[12]对754例急性心力衰竭患者行ROC分析,显示入院早期24 h血乳酸浓度可预测患者死亡,ROC的AUC=0.71,最佳临界值3.2 mmol/L时的敏感度与特异度分别为60.2%和74.6%。本研究中,144例研究的患者在综合围术期期间监测动脉血气获得的乳酸浓度,ROC的AUC为0.88。对于预测院内病死率,血乳酸最佳临界值为6.0 mmol/L,灵敏度为85%,特异性为77%。表明早期血乳酸浓度可作为预测院内病死率的可靠因子。研究发现高乳酸血症的存在增加了院内病死率的风险,其证据强度高于其他因素,乳酸酸中毒导致死亡风险显着增加(风险比为1.1每mmol/L单位,95%CI:1.0~1.1,P=0.006)[13]。因此,乳酸浓度是AAAD术后的院内病死率优异的预测因子。
高乳酸血症作为AAAD病死率的重要标志物此前少见报道,虽然尚未被证实作为AAAD的独立危险因素,但乳酸酸中毒成为全身低灌注或灌注不良的标志替代物正越来越受重视,并用来独立预测疾病严重性及存活率[14]。当将灌注不良并发症的AAAD患者从分析中排除时,手术死亡率可从23.9%降至9.3%[12]。肠系膜、冠状动脉和肾缺血已显示增加手术死亡率风险[15]。一些客观测量,如成像研究,能监测血流量和灌注压,但无法提供对肠系膜和终末器官血流量的最佳评估。而当存在灌注不良的实验室标记物时,再使用经胸超声或食道超声评价主动脉分支血管血流,可以指导手术治疗[16]。因此,对于所有病情严重或灌注不良的患者,血乳酸浓度可快速获取且是一种物美价廉的临床标记物。尽管手术技巧改进了,AAAD围术期死亡风险仍居高不下,术后器官灌注不良增加死亡和功能衰竭的风险[17],识别高危患者可以指导治疗策略和可能的二次手术,尤其是出现神经系统、肠系膜或冠状动脉缺血[18]。最近一项评估AAAD杂交手术方法的研究显示,在开胸手术时,23%的患者发生主动脉闭塞或灌注不良,需要同时进行血管腔内修复[13]。32%的患者发生冠状动脉灌注不良后需要行冠状动脉旁路移植术。鉴于对灌注不良增加病死率的持续关注,仍需认真监测以评估高危患者的术后院内病死率。由于对医疗成本和社会影响的热议,临床医生越来越需要认识到某些患者外科手术具有非常高的死亡风险,要指导提前做好干预措施。血乳酸浓度可以准确地评估主动脉夹层术后最常见、最危险的循环系统并发症,对死亡的预测具有重要意义。
本研究中血乳酸浓度和临床终点事件间直接和独立的关系尚不能得出结论。血乳酸浓度还受肝功能的影响,这可能影响高乳酸血症与AAAD术后病死率的关联。另外,数据受到回顾性研究固有的选择偏倚,非标准化的诊疗偏差,还进一步受样本量的限制。
[1]ZHANG J,JIANG Y,GAO C,et alRisk factors for hospital death in patients with acute aortic dissection[J]Heart Lung Circ,2014,24(3):348-353
[2]ANDERSEN N D,GANAPATHI A M,HANNA J M,et al Outcomes of acute type A dissection repair before and after implementation of a multidisciplinary thoracic aortic surgery program[J]J Am Coll Cardiol,2014,63(17):17961803
[3]HOUWINK A P,RIJKENBERG S,BOSMAN R J,et alThe association between lactate,mean arterial pressure,central venousoxygensaturationandperipheraltemperatureand mortality in severe sepsis:a retrospective cohort analysis[J]Crit Care,2016,20(1):18
[4]Kidney Disease:Improving Global Outcomes(KDIGO)Acute Kidney Injury Work GroupKDIGO clinical practice guideline for acute kidney injury[J]Kidney Inter,2012,2(Suppl):1 138
[5]MAILLET J M,LE B P,CANTONI M,et alFrequency,risk factors,and outcome of hyperlactatemia after cardiac surgery[J]Chest,2003,123(5):13611366
[6]丁凡,王新宽,支萍,等.体外循环心脏手术围术期相关因素与乳酸的关系[J]当代医学,2015,21(3):6365
[7]JONES A ELactate clearance for assessing response to resuscitation in severe sepsis[J]Acad Emerg Med,2013,20(8):844847
[8]XU L,BURKE AAcute medial dissection of the ascending aorta:evolution of reactive histologic changes[J]Am J Surg Pathol,2013,37(1):12751282
[9]GU J,HU J,ZHANG H W,et alTimedependent changes of plasma inflammatory biomarkers in type A aortic dissection patients without optimal medical management[J]Cardiothorac Surg,2015,10(10):17
[10] MERRY H E,PHELAN P,DOAK M R,et alRole of tolllike receptor-4 in lung ischemiareperfusion injury[J]Ann Thorac Surg,2015,99(4):1193-1199.
[11] BEKKERS J A,RAAP G B,TAKKENBERG J J,et alAcute type A aortic dissection:long-term results and reoperations[J]Eur J Cardiothorac Surg,2013,43(2):389396
[12] KAWASE T,TOYOFUKU M,HIGASHIHARA T,et al Validation of lactate level as a predictor of early mortality in acutedecompensatedheartfailurepatientswhoentered intensive care unit[J]Cardiol,2015,65(2):164170.
[13] BENNETTJM, WISEES, HOCKINGKM, etal Hyperlactemia predicts surgical mortality in patients presenting with acute Stanford type A aortic dissection[J]J Cardiothor Vasc Anesth,2016,16(3):16
[14] KRUSE O,GRUNNET N,BARFOD C,et alBlood lactate as a predictor for inhospital mortality in patients admitted acutely to hospital:a systematic review[J]Scandin J Trauma Resuscit Emerg Med,2011,19(1):196199
[15] PACINI D,LEONE A,BELOTTI L M,et alAcute type A aortic dissection:significance of multiorgan malperfusion[J]Eur J Cardiothorac Surg,2013,43(4):820-826
[16] ORIHASHI KMesenteric ischemia in acute aortic dissection[J]Surg Today,2016,46(5):509.
[17] AUGOUSTIDESJ, GEIRSSONA, SZETO WY, etal Observational study of mortality risk stratification by ischemic presentation in patients with acute type A aortic dissection:the Penn classification[J]Nat Clin Pract Cardiovasc Med,2009,6(2):140-146
[18] CZERNYM, SCHÖNHOFFF, ETZC, etalReply:reconsidering the impact of preoperative malperfusion on acute type A dissection:The Modified Penn Classification[J]J Am Coll Cardiol,2016,67(1):121122
Effect of blood lactic acid concentration on prognosis of patients with acute A-type aortic dissection after surgery
ZHOU Chuzhi,LI Chunyan,LÜ Chunyan,LI Jing-ru,CHEN Weixin,WEN Junmin
(Cardiac Surgery Intensive Care Unit,Shenzhen Cardiovascular Institute,Shenzhen Sun Yat-sen Cardiovascular Hospital,Shenzhen,Guangdong 520018,China)
ObjectivesTo study the value of blood lactic acid concentration in predicting the prognosis of patients with acute Atype aortic dissection after surgeryMethodsRetrospective study was conducted on the 144 patients who were undergone acute A-type aortic dissection surgery in Shenzhen Sun Yat-sen Cardiovascular Hospital and transferred to intensive care unit(ICU)Lactic acid concentrations at resuscitation,initial ICU and each 2-6 h were collectedAccording to the oxygenation index and kidney disease:improving global outcomes(KDIGO)acute renal injury standard,the patients were divided into hypoxemia group,non-hypoxemia group and acute renal injury group,normal renal function groupDuration of mechanical ventilation,duration of ICU stay and mortality of the patients were recordedLactic acid concentration and lactic acid clearance rate were compared between the groupsReceiver operator characteristic curve(ROC) was drawn to analyze the optimal cutoff value,sensitivity and specificity of blood lactic acid concentration to predict the hospital mortality in patients with aortic dissection after surgery.ResultsThere were significant differences of home blood lactic acid concentration,26 h lactic acid concentration and lactic acid clearance rate between hypoxemia group and control group(P<0.01)There were significant differences of home blood lactic acid concentration,2-6 h lactic acid concentration and lactic acid clearance rate between acute renal injury group and normal renal function group(P<0.01)The area under the ROC was 0.88For predicting inhospital mortality,the optimal cutoff value of blood lactic acid was 6.0 mmol/L,sensitivity was 85%and specificity was 77%ConclusionsBlood lactic acid concentration in patients with aortic dissection can be used as a monitoring indicator of disease severity and prognosisIt is worthy of clinical attention
aortic dissection;blood lactic acid;mortality;prognosis
R543.1+6
A
10079688(2017)04041704
20170116)
10.3969/j.issn.1007-9688.2017.04.14
周楚芝(1983),男,主治医师,研究方向为心脏重症,循环辅助。
温隽珉,Email:239196788@qq.com
