川西北高寒沙地红柳灌丛内外有机碳及腐殖质碳组分变化特征
2017-08-16刘小菁胡玉福舒向阳徐浩洋何剑锋
刘小菁,胡玉福,舒向阳,徐浩洋,何剑锋,王 倩
(四川农业大学资源学院, 四川 成都 611130)
川西北高寒沙地红柳灌丛内外有机碳及腐殖质碳组分变化特征
刘小菁,胡玉福,舒向阳,徐浩洋,何剑锋,王 倩
(四川农业大学资源学院, 四川 成都 611130)
为了解川西北高寒沙地红柳对土壤有机碳及腐殖质碳组分的影响,选取了沙地上修复24 a的红柳灌丛作为研究对象,通过野外调查并结合土壤样品采集和室内分析,研究了川西北沙地红柳灌丛根区(SR)、灌丛中部(SM)、灌丛边缘(SE)、灌丛外部(SO)的0~20,20~40 cm和40~60 cm土层土壤有机碳及腐殖质碳组分变化特征。结果表明:随着距灌丛植株水平距离的增加,土壤有机碳(SOC)、胡敏酸碳(HAC)、富里酸碳(FAC)和胡敏素碳(HMC)含量均呈现下降的特征;0~20 cm表层土壤,灌丛根区、灌丛中部和灌丛边缘土壤有机碳含量分别为灌丛外部的1.86倍、2.35倍和1.63倍,灌丛根区、灌丛中部和灌丛边缘土壤腐殖质碳含量分别为灌丛外部的1.96倍、0.68倍和1.22倍;在距灌丛植株水平距离相同条件下,随土层深度增加,土壤有机碳及腐殖质碳各组分含量呈降低趋势;在灌丛根区,20~40 cm和40~60 cm土层土壤有机碳相对于0~20 cm土层分别降低了32.31%和38.38%,20~40 cm和40~60 cm土层土壤腐殖质碳相对于0~20 cm土层分别降低了49.34%和53.40%。研究得出,红柳灌丛内外土壤有机碳及腐殖质碳组分存在空间异质性分布。
川西北;沙地;红柳灌丛;有机碳;腐殖质碳
川西北高寒草原地处青藏高原东部边缘半湿润地区,是我国长江、黄河两大水系的重要水源涵养地,还是世界上最大的高原泥炭沼泽湿地,对我国气候调节有极为重要的作用[1-2]。川西北高寒地区气候条件多变、人类活动强度大,是典型的生态环境脆弱区。研究表明,2009年沙化土地面积达到82.19万hm2,预计2020年草地沙化面积将达到95.38万hm2[3-5]。草地沙化形式严峻,严重影响到长江、黄河上游的生态屏障建设和民族地区的经济社会发展[6]。
由于灌丛具有种类繁多、生命力强等特点,因此在区域生态环境保护方面有着重要的作用[7]。赵哈林等[8]研究科尔沁沙地灌丛表明,沙地灌丛具有降低风速,遮蔽阳光暴晒,拦截大气降尘和地面凋落物,改善局地小环境的作用;岳兴玲等[9]对灌丛研究表明其能改善沙地土壤机械组成,增加土壤碳、氮含量,提高土壤肥力;Doblas等[10]研究表明灌丛下的土壤环境利于增加土壤的生物量。近年来灌丛所引起的“肥岛效应”[11]日益受到重视。研究表明,不同种类的灌丛对土壤改善的能力存在一定差异[12]。目前,对灌丛的研究主要集中于干旱和半干旱沙化地区,而较少涉及半湿润地区流动沙地灌丛[13-16]。因此,对川西北流动沙地灌丛的研究有助于该区域的生态修复。
土壤有机碳是影响土壤质量的重要因素[17-18],它不仅影响土壤理化特性和生物特性,而且与生态系统的发育密切相关[19-20]。腐殖质碳是土壤有机质的重要组分之一,它们是深色的、非均匀的化合物[21],其组成结构和性质的变化与土壤保肥和供肥性质相关[22]。川西北高寒地区沙地土壤有机碳及腐殖质碳组分的分布、质量和周转特征,影响了这一地区土壤结构和特性,也对人类干扰和气候变化做出响应。
本研究以川西北高寒地区红柳灌丛内外的流动沙地为研究对象,通过对红柳灌丛不同距离(灌丛根区(SR)、灌丛内部(SM)、灌丛边缘(SE)和灌丛外部(SO))流动沙地以及不同土层的腐殖质碳组分的研究,初步揭示高寒草地土壤有机碳、腐殖质碳、胡敏酸碳、富里酸碳和胡敏素碳的变化特征,进而为治理高寒草地沙化工作提供理论依据。
1 研究区域与研究方法
1.1 研究区域概况
研究区位于四川省阿坝州藏族羌族自治州红原县瓦切乡内川西北草地沙化治理示范项目区,地理坐标为31°51′~33°19′N,101°51′~103°23′E。红原县地处青藏高原东南边缘,平均海拔在3 600 m以上,属大陆性高原寒带季风气候,年平均气温0.9℃,年平均降雨量751.95 mm,雨季主要集中于5—10月,绝对无霜期为16~25 d,年均日照时间2 158.7 h,太阳辐射年总量为6 194 MJ·m-2。多年来,由于过度放牧,人类活动强度加大,以及受风蚀气候的影响,川西北高寒草原出现部分草地沙化。该沙地土壤理化性质如下:有机碳0.9 g·kg-1,全氮0.1 g·kg-1,沙粒98.4%,粉粒0.7%,粘粒0.9%。
1.2 样方设置
本研究于2015年8月,对研究区域进行资料收集和初步调查,并在四川省沙化草地治理重点示范区红原县瓦切乡进行调查采样,种植红柳是示范区沙化土地生态修复和治理的主要措施之一,该区域植株间距2.5 m,在试验样地内选择半固定沙地上6株栽植24 a的红柳灌木作为研究对象,红柳灌丛内外的基本信息由6株红柳生物量的平均值表示(表1)。对红柳灌丛内外不同水平距离(灌丛根区(SR),距灌丛根区1/4灌幅处为灌丛中部(SM),距灌丛根区1/4~1/2灌幅处为灌丛边缘(SE),距灌丛1/2~3/4灌幅处为灌丛外部(SO))的不同深度(0~20,20~40,40~60 cm)土层进行采样,见图1。本研究共选取6株相同年限灌丛,灌丛平均高度2.74 m,灌丛平均冠幅达5.31 m,灌丛内外植物生物量理化性质见表1。每株灌丛的不同距离按照东、南、西、北4个方向采集,每个方向随机采集3个点,每个点的不同土层采集3个重复,混合为1个样品,样品经自然风干,除去死根、枯落物后,进行室内分析。
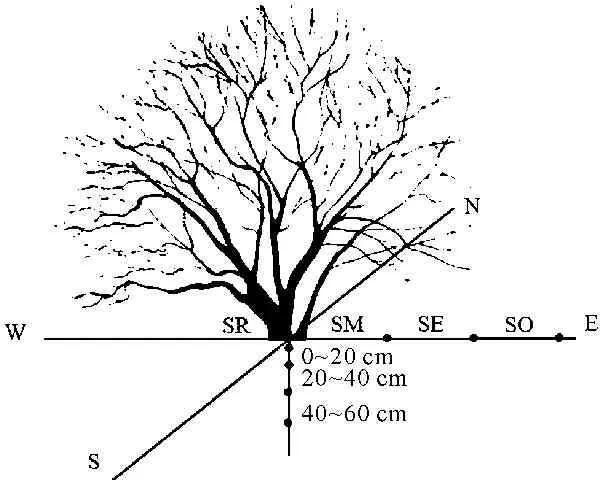
图1 灌丛内外土样采集方案
Fig.1 The sampling method of soil under or outside the canopy
1.3 测定方法
土壤有机碳测定采用重铬酸钾外加热法[23]。
腐殖质碳测定采用焦磷酸钠-氢氧化钠提取重铬酸钾法[23]。称取5.00 g风干土样于100 ml离心管中,准确加入0.1 mol·L-1焦磷酸钠、0.1 mol·L-1氢氧化钠混合液50 ml,震荡5 min后静置13~14 h(温度控制在20℃左右),随后离心;吸取清亮滤液5.00 ml移入150 ml三角瓶中,加3 mol·L-1H2SO4(调节pH为7)至溶液出现浑浊,于水浴锅上蒸干、测碳;加0.2000 mol·L-1(1/6 K2Cr2O7)标准液5 ml,迅速注入5 ml浓H2SO4,盖上小漏斗并经沸水浴加热15 min,冷却后加蒸馏水50 ml稀释,加邻啡罗啉指示剂3滴后用0.05 mol·L-1Fe2SO4滴定,同时作空白实验。

表1 灌丛内外生物量状况
胡敏酸碳测定:吸取上述滤液20.00 ml于小烧杯中,置于沸水浴上加热,在玻璃棒搅拌下滴加3 mol·L-1H2SO4酸化,至絮状沉淀析出。继续加热10 min使HAC完全沉淀。过滤后,以0.01 mol·L-1H2SO4、洗涤滤纸和沉淀至滤液无色为止(即完全洗去富里酸)。以热的0.02 mol·L-1NaOH溶解沉淀,仔细收集溶解液于250 ml三角瓶中,如前法酸化、蒸干、测碳。
富里酸碳:用差减法求得,即FAC=HC-HAC。
胡敏素碳:用差减法求得,即HMC=SOC-HC。
1.4 数据处理
采用SPSS 19.0和Excel 2013进行数据预处理与图表绘制。
2 结果与分析
2.1 土壤有机碳含量特征
灌丛内外土壤有机碳含量变化特征见图2,由图2可知,沙地0~60 cm范围内各土层土壤的有机碳含量随距灌丛植株水平距离增加,土壤有机碳含量呈先升后降的趋势。其中在灌丛中部处0~20 cm土壤有机碳含量最高,灌丛外部处40~60 cm土层有机碳含量最低。在0~20 cm土层,灌丛根区、中部和边缘土壤有机碳含量分别为灌丛外部的1.86倍、2.35倍和1.63倍;在20~40 cm土层,随着距灌丛植株水平距离的增加,灌丛内外土壤有机碳含量减少趋势最为明显,灌丛根区、中部和边缘有机碳含量分别为灌丛外部的2.27倍、2.89倍和1.66倍;在40~60 cm土层,灌丛根区、中部和边缘有机碳含量分别为灌丛外部的2.04倍、0.65倍和0.05倍。可见,灌丛土壤有机碳在根际与灌丛中部含量较高,在边缘与外部较低,其原因是灌丛内部丰富的枯枝落叶以及灌丛内部对植被生长繁殖提供了保护,使得内部植被生物量高于外部,进而土壤有机碳含量高于外部,而边缘与外部易受外部环境因素扰动使得土壤环境不稳定。

图2 灌丛内外土壤有机碳含量变化特征
Fig.2 Varying characteristics of SOC under or outside the canopy
注:不同字母代表差异性显著(P<0.05),下同。
Note: different letters indicate significant differences atP<0.05, the same below.
在距灌丛植株水平距离相同条件下,随土层加深,土壤有机碳含量呈不断降低趋势。其中,灌丛根区的20~40 cm和40~60 cm土层土壤有机碳相对于0~20 cm分别降低了32.31%和38.38%;灌丛中部处20~40 cm土层土壤有机碳相对于0~20 cm土层土壤降低幅度最小,为31.20%,其40~60 cm土层土壤有机碳相对于0~20 cm土层土壤降低了71.43%;灌丛边缘处20~40 cm和40~60 cm土层土壤有机碳相对于0~20 cm土层土壤的降低幅度均为最大,分别为40.16%和76.91%;灌丛外部处20~40 cm和40~60 cm土层土壤有机碳相对0~20 cm土层土壤分别降低了40.77%和41.99%。
2.2 土壤腐殖质态碳的特征
灌丛内外土壤腐殖质碳含量变化特征见图3a,由图3a可知,沙地0~60 cm土层土壤腐殖质碳随距灌丛植株水平距离增加,呈现降低的变化特征。土壤腐殖质碳含量大小次序与有机碳含量趋势一致。各个土层灌丛根区较灌丛外部土壤腐殖质碳的变化特征明显,其中,0~20 cm土层, 灌丛根区、中部和边缘土壤腐殖质碳含量分别为灌丛外部的 1.96倍、0.68倍和1.22倍;20~40 cm土层,灌丛根区、中部和边缘土壤腐殖质碳含量分别为灌丛外部的1.17倍、1.22倍和0.47倍;40~60 cm土层,灌丛根区、中部和边缘土壤腐殖质碳含量分别为灌丛外部的1.41倍、1.02倍和0.68倍。
在距灌丛植株水平距离相同条件下,随土层加深,土壤腐殖质碳含量极显著下降。其中,灌丛根区的20~40 cm和40~60 cm土层土壤腐殖质碳相对于0~20 cm土层分别降低了49.34%和53.40%;灌丛中部的20~40 cm和40~60 cm土层土壤腐殖质碳相对于0~20 cm土层分别降低了46.90%和60.00%,灌丛中部的40~60 cm土层是土壤腐殖质碳下降幅度最大的土层;灌丛边缘的20~40 cm土层土壤腐殖质碳相对于0~20 cm土层下降幅值为最高54.05%,其40~60 cm土层土壤腐殖质碳相对于0~20 cm土层下降值为56.75%;灌丛外部的20~40 cm和40~60 cm土层土壤腐殖质碳相对于0~20 cm土层下降幅度均为最低,分别降低了30.78%和42.70%。
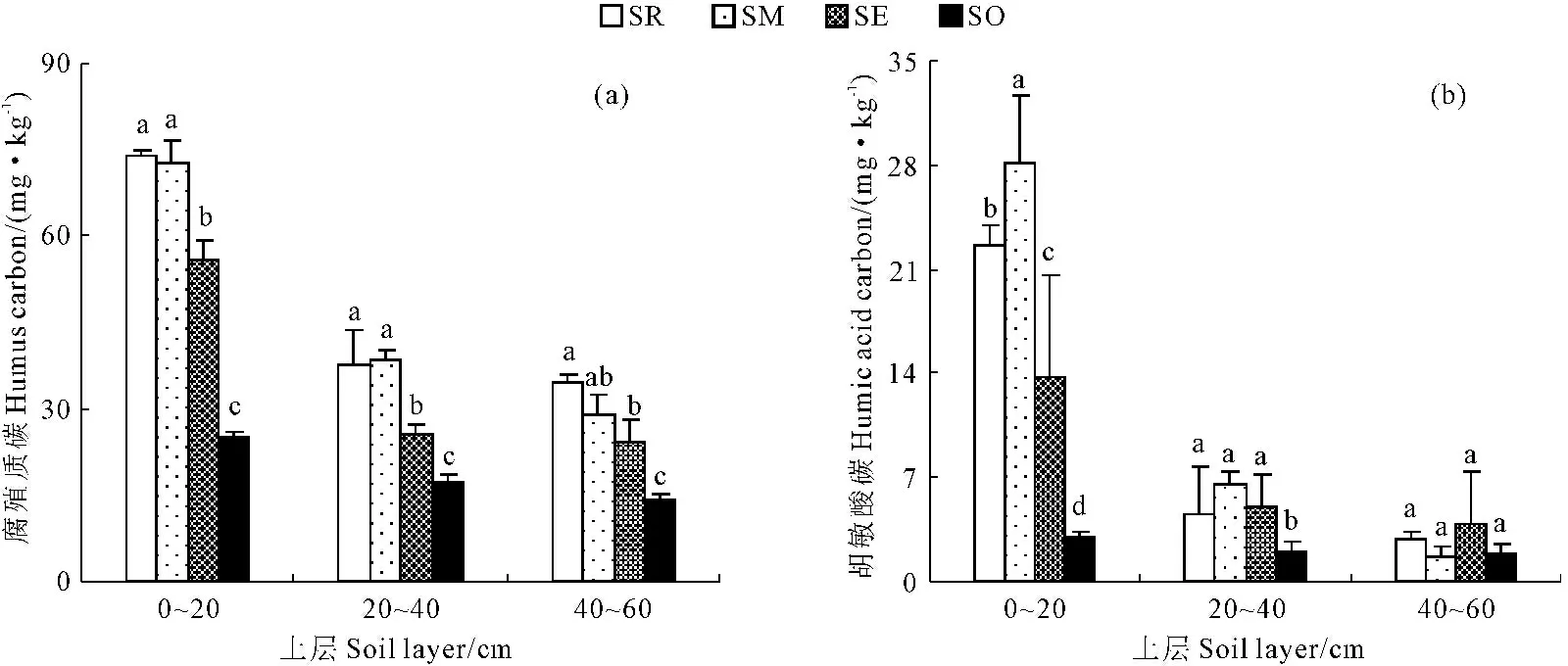
图3 灌丛内外土壤腐殖质碳和胡敏酸碳变化特征
Fig.3 Varying characteristics of humus carbon(HC) and humic acid carbon(HAC) under or outside the canopy
2.3 土壤胡敏酸态碳的特征
灌丛内外土壤胡敏酸碳变化特征见图3b,由图3b可知,沙地0~60 cm土层胡敏酸碳随距灌丛植株水平距离增加,土壤胡敏酸碳含量呈大幅度下降,其中灌丛中部距离0~20 cm土层土壤胡敏酸碳含量最高,灌丛外部距离40~60 cm土层土壤胡敏酸碳含量最低。其中,灌丛内外0~20 cm土层的土壤胡敏酸碳含量变化特征最为明显,其灌丛根区、中部和边缘土壤胡敏酸碳含量分别为灌丛外部的6.63倍、8.53倍和3.65倍;20~40 cm土层,灌丛根区、中部和边缘土壤胡敏酸碳含量分别为灌丛外部的1.25倍、2.27倍和1.54倍;40~60 cm土层,灌丛根区、中部和边缘土壤胡敏酸碳含量分别为灌丛外部的 0.60倍、-0.08倍和1.12倍。
在距灌丛植株水平距离相同条件下,随土层加深,土壤胡敏酸碳含量呈不断降低趋势。其中,灌丛根区的20~40 cm和40~60 cm土层土壤胡敏酸碳相对于0~20 cm土层土壤分别降低了80.10%和87.27%;灌丛中部的20~40 cm和40~60 cm土层土壤胡敏酸碳相对于0~20 cm土层土壤分别降低了76.81%和94.17%;灌丛边缘的20~40 cm和40~60 cm土层土壤胡敏酸碳相对于0~20 cm土层土壤分别降低了63.04%和72.30%;相对于灌丛其他位置灌丛外部20~40 cm和40~60 cm土层的土壤胡敏酸碳降低幅度均最小,灌丛外部的20~40 cm和40~60 cm土壤胡敏酸碳相对于0~20 cm土层土壤分别降低了32.33%和39.33%。
2.4 土壤富里酸态碳的特征
灌丛内外土壤富里酸变化特征见图4a,由图可知,流动沙地0~60 cm土层土壤的富里酸碳随距离增加,土壤富里酸碳含量逐渐降低,其中灌丛根区0~20 cm土层土壤富里酸碳含量最高,灌丛外部40~60 cm土层土壤富里酸碳含量最低。0~20 cm土层, 灌丛根区、中部和边缘土壤富里酸碳含量分别为灌丛外部的1.34倍、1.01倍和0.90倍;20~40 cm土层,灌丛根区、中部和边缘土壤富里酸碳含量分别为灌丛外部的0.80倍、0.75倍和0.12倍;40~60 cm土层,灌丛根区、中部和边缘土壤富里酸碳含量分别为灌丛外部的0.80倍、0.56倍和0.15倍。
在距灌丛植株水平距离相同条件下,随土层加深,土壤富里酸碳含量呈不断降低趋势。其中,灌丛根区的20~40 cm和40~60 cm土层土壤富里酸碳相对于0~20 cm土层土壤分别降低了35.89%和38.59%;灌丛中部的20~40 cm和40~60 cm土层土壤富里酸碳相对于0~20 cm土层土壤分别降低了27.97%和38.36%;灌丛边缘的20~40 cm和40~60 cm土壤富里酸碳相对于0~20 cm土层土壤分别降低了51.10%和51.66%,在20~40 cm和40~60 cm的土层中,灌丛边缘土壤富里酸碳的降低幅度均为最大;灌丛外部的20~40 cm和40~60 cm土层土壤富里酸碳相对于0~20 cm土层土壤分别降低了17.01%和20.54%,在20~40 cm和40~60 cm的土层中,灌丛外部土壤富里酸碳的降低幅度均为最小。
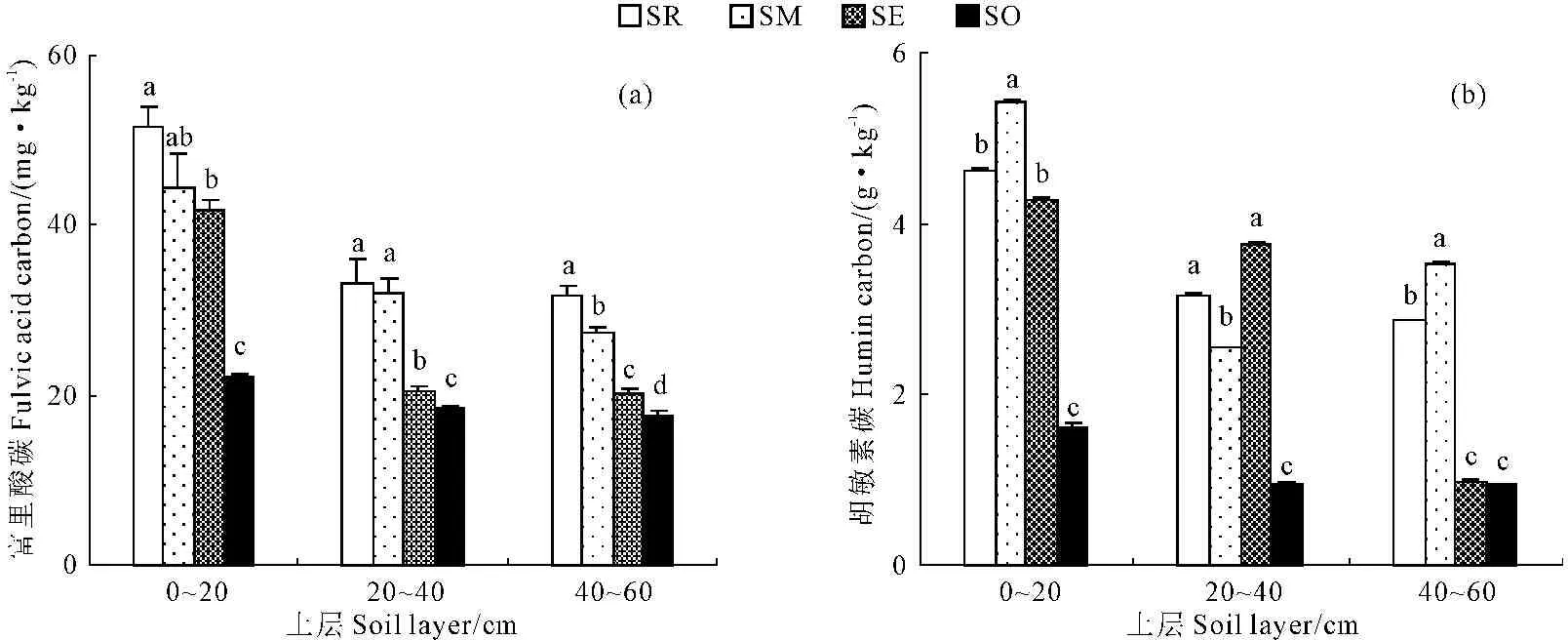
图4 灌丛内外土壤富里酸碳和胡敏素碳变化特征
Fig.4 Varying characteristics of fulvic acid carbon(FAC) and humin carbon(HMC) under or outside the canopy
2.5 土壤胡敏素碳的特征
灌丛内外土壤胡敏素碳变化特征见图4b,由图可知,流动沙地0~60 cm土层土壤的富里酸碳随距离增加,土壤胡敏素碳含量呈降低趋势,其中灌丛中部距离0~20 cm土层土壤胡敏素碳含量最高,灌丛外部距离40~60 cm土层土壤胡敏素碳含量最低。0~20 cm土层, 灌丛根区、灌丛中部和灌丛边缘土壤胡敏素碳含量分别为灌丛外部的1.86倍、2.35倍和1.64倍;20~40 cm土层,灌丛根区、灌丛中部和灌丛边缘土壤胡敏素碳含量分别为灌丛外部的2.29倍、1.67倍和2.93倍;40~60 cm土层,灌丛根区、灌丛中部和灌丛边缘土壤胡敏素碳含量分别为灌丛外部的2.05倍、2.77倍和0.04倍,在40~60 cm的土层中,灌丛边缘相对于灌丛外部的土壤胡敏素碳的变化不明显。
在距灌丛植株水平距离相同条件下,随土层加深,土壤胡敏素碳含量呈不断降低趋势。其中,灌丛根区的20~40 cm和40~60 cm土层土壤胡敏素碳相对于0~20 cm土层土壤分别降低了32.04%和38.14%;灌丛中部的20~40 cm和40~60 cm土层土壤胡敏素碳相对于0~20 cm土层土壤分别降低了52.99%和34.76%;灌丛边缘的20~40 cm和40~60 cm土层土壤胡敏素碳相对于0~20 cm土层土壤分别降低了12.04%和77.17%;灌丛外部的20~40 cm和40~60 cm土层土壤胡敏素碳相对于0~20 cm土层土壤分别降低了40.93%和41.98%。
3 讨 论
土壤是陆地生态系统最大的碳库,土壤有机碳库变化将极大影响全球碳循环[24-25]。土壤有机碳作为土壤中重要组成部分,其对土壤理化性质、热学特征生物活性有着重要影响[26]。研究表明,土壤有机碳增加可改善土壤团聚体结构,增强土壤结构稳定与抗蚀性,提高土壤保水保肥能力,因此其对维持土壤质量与品质有着重要作用[27]。本文研究表明,灌丛内部有机碳含量较灌丛外部明显上升,且灌丛内部与外部相同土层比较结果表明,灌丛内部有机碳含量明显高于外层。灌丛不同土层对土壤有机碳的富集存在层次间的差异,随着土层的加深,有机碳含量逐渐降低。
张璞进等[28]研究不同大小锦鸡儿灌丛沙堆表明,不同大小灌丛沙堆土壤表层土壤有机质、全磷和土壤质量含水量存在显著差异,而沙地地面下差异不显著。这可能与锦鸡儿在生长发育过程中的形态特征差异以及灌丛沙地中风蚀物质颗粒组成有关[29]。刘任滔等[30]通过研究流动沙地灌丛内外土壤得出,灌丛内部有机碳含量显著高于灌丛外流动沙地土壤。赵哈林等[8]研究流动沙地灌丛得出,灌丛内外土壤化学和生物特性存在较大差异,与灌丛外相比灌丛下土壤的有机质明显较高,沙地灌丛下有大量凋落物,而在流动沙地凋落物数量很少,灌丛有机质含量随着土层的加深而减少。任雪等[31]研究绿洲-沙漠过渡带灌丛得出,灌丛周围的土壤养分明显向灌幅下聚集,随着土层的加深土壤有机质含量不断下降。姜广争等[32]研究岷江上游干旱河谷地区灌丛植被有机碳得出,土壤有机碳呈现出随着土层深度的递加而递减的规律。其原因可能是灌丛在生长过程中形成的“肥岛”效应[33],灌丛在生长过程中通过拦截风蚀中富含大量养分的流动碎屑沉积体[34],为灌丛内植物生长以及动物的生存繁殖提供有利条件,吸引动物在其灌幅下栖息,同时它们的排泄物还会在灌幅下聚集,使土壤养分富集,进而使得土壤有机碳含量升高,利于土壤微生物的活动,灌丛内大量的凋敝物通过土壤微生物分解进入土壤,反过来又促进“肥岛”效应的发生[35-38]。与此同时,灌丛根际对土壤的物理穿插作用及其根系分泌物对根际土壤的生物化学作用都能使土壤有机物含量增加,改变灌木周围土壤的理化性质[8,31,39]。
土壤腐殖质是土壤有机质的重要组成部分,约占土壤有机质的65%,腐殖质的形成是以微生物为主导的生物化学过程,其作为土壤中特有的高分子化合物,对土壤肥力、结构与性质具有十分重要的调节作用[40]。本研究表明,灌丛内部腐殖质碳高于灌丛外部,土壤表层腐殖质碳含量高于底层。蔡晓布[41]等研究高寒草地土壤腐殖质碳得出,土壤腐殖质碳含量与土壤环境密切相关,随土壤环境恶化,土壤腐殖质碳及土壤腐殖质品质均呈降低趋势,且土壤腐殖质碳主要以胡敏素碳为主,这与本文研究结果一致。也有研究表明,随着土层深度的增加,土壤腐殖质碳含量也随之降低,其原因可能是随土层深度增加土壤有机质含量降低[42-43]。Nepstad[44]和Trumbore[45]等得出植物根系是深层土壤腐殖质碳的主要来源,控制着深层土壤腐殖质碳的循环和分布。而随土层深度增加,植被地下生物量会降低,同时微生物数量也会降低,这不利于土壤腐殖质的积累与转化。土壤表层除大量的植被根系外,灌丛的枯枝落叶成为表层的重要碳源,同时表层微生物活动活跃,有利于土壤腐殖质的转化与积累。
4 结 论
随着灌丛距离的增加,沙地土壤有机碳含量呈现下降趋势,土壤有机碳、胡敏酸碳、富里酸碳和胡敏素碳含量随距离灌丛根区增加而不断降低。其中,0~20 cm表层,灌丛根区、灌丛中部和灌丛边缘土壤有机碳含量分别为灌丛外部的1.86倍、2.35倍和1.63倍;灌丛根区、灌丛中部和灌丛边缘土壤胡敏酸碳含量分别为灌丛外部的1.96倍、0.68倍和1.22倍;灌丛根区、灌丛中部和灌丛边缘土壤富里酸碳含量分别为灌丛外部的1.34倍、1.01倍和0.90倍;灌丛根区、灌丛中部和灌丛边缘土壤胡敏素碳含量分别为灌丛外部的1.86倍、2.35倍和1.64倍。
随土层深度增加,灌丛内外土壤有机碳及腐殖质碳组分均呈降低趋势。其中,在灌丛根区,20~40 cm和40~60 cm土层土壤有机碳相对于0~20 cm土层土壤分别降低了32.31%和38.38%;20~40 cm和40~60 cm土层土壤腐殖质碳相对于0~20 cm土层土壤分别降低了49.34%和53.40%;20~40 cm和40~60 cm土层土壤胡敏酸碳相对于0~20 cm土层土壤分别降低了80.10%和87.27%;20~40 cm和40~60 cm土层土壤富里酸碳相对于0~20 cm土层土壤分别降低了35.89%和38.59%;20~40 cm和40~60 cm土层土壤胡敏素碳相对于0~20 cm土层土壤分别降低了32.04%和38.14%。
[1] 文勇立,李 辉,李学伟,等.川西北草原土壤及冷暖季牧草微量元素含量比较[J].生态学报,2007,27(7):2837-2846.
[2] 吴鹏飞,陈智华.若尔盖草地生态系统研究[J].西南民族大学学报:自然科学版,2008,34(3):482-486.
[3] 雍国玮,石承苍,邱鹏飞.川西北高原若尔盖草地沙化及湿地萎缩动态遥感监测[J].山地学报,2003,21(6):758-762.
[4] 廖雅萍,王军厚,付 蓉.川西北阿坝地区沙化土地动态变化及驱动力分析[J].水土保持研究,2011,18(3):51-54.
[5] 刘 朔,蔡凡隆,杨建勇,等.川西北沙化治理现状及治理区划[J].林业调查规划,2011,36(3):122-126.
[6] 胡玉福,彭佳佳,邓良基,等.围栏种植红柳对川西北高寒沙地土壤颗粒组成和矿质养分的影响[J].土壤通报,2015,(1):54-61.
[7] 胡会峰,王志恒,刘国华,等.中国主要灌丛植被碳储量[J].植物生态学报,2006,30(4):539-544.
[8] 赵哈林,苏永中,张 华,等.灌丛对流动沙地土壤特性和草本植物的影响[J].中国沙漠,2007,27(3):385-390.
[9] 岳兴玲,哈 斯,庄燕美,等.沙质草原灌丛沙堆研究综述[J].中国沙漠,2005,25(5):738-743.
[10] Doblas-Miranda E. Ecology of soil macroinvertebrates in a Mediterranean arid ecosystem[D]. Granada: Universidad de Granada, 2007.
[11] 瞿王龙,杨小鹏,张存涛,等.干旱、半干旱地区天然草原灌木及其肥岛效应研究进展[J].草业学报,2015,24(4):201-207.
[12] 丁越岿,杨 吉力,宋炳煜,等.不同植被类型对毛乌素沙地土壤有机碳的影响[J].草业学报,2012,21(2):18-25.
[13] 赵哈林,郭轶瑞,周瑞莲.灌丛对沙质草地土壤结皮形成发育的影响及其作用机制[J].中国沙漠,2011,31(5):1105-1111.
[14] Pei S F, Fu H, Cen Y M, et al. Influence of Z. xanthoxylum shrubs on soil fertility in enclosure and grazing conditions[J]. J Desert Res, 2004,24:763-767.
[15] 王恩苓.落实《决定》精神,加快干旱、半干旱地区灌木林发展[J].防护林科技,2004,(1):22-24.
[16] Pérez F L. Plant-induced spatial patterns of surface soil properties near caulescent Andean rosettes[J]. Geoderma, 1995,68(1):101-121.
[17] 蔡晓布,周 进.退化高寒草原土壤有机碳时空变化及其与土壤物理性质的关系[J].应用生态学报,2009,20(11):2639-2645.
[18] Lal R. Global potential of soil carbon sequestration to mitigate the greenhouse effect[J]. Critical Reviews in Plant Sciences, 2003,22(2):151-184.
[19] Six J, Conant R T, Paul E A, et al. Stabilization mechanisms of soil organic matter: implications for C-saturation of soils[J]. Plant and soil, 2002,241(2):155-176.
[20] Coban H, Miltner A, Kstner M. Fate of fatty acids derived from biogas residues in arable soil[J]. Soil Biology and Biochemistry, 2015,91:58-64.
[21] Vergnoux A, Guiliano M, Di Rocco R, et al. Quantitative and mid-infrared changes of humic substances from burned soils[J]. Environmental research, 2011,111(2):205-214.
[22] Shindo H, Yoshida M, Yamamoto A, et al. δ13C values of organic constituents and possible source of humic substances in Japanese volcanic ash soils[J]. Soil science, 2005,170(3):175-182.
[23] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999:231-260.
[24] Reeves D W. The role of soil organic matter in maintaining soil quality in continuous cropping systems[J]. Soil and Tillage Research, 1997,43(1):131-167.
[25] Franzluebbers A J. Soil organic matter stratification ratio as an indicator of soil quality[J]. Soil and Tillage Research, 2002,66(2):95-106.
[26] 李潮海,王 群,郝四平.土壤物理性质对土壤生物活性及作物生长的影响研究进展[J].河南农业大学学报,2002,36(1):32-37.

[28] 张璞进,杨 吉力,宋炳煜,等.藏锦鸡儿群落土壤资源空间异质性[J].植物生态学报,2009,33(2):338-346.
[29] 金云翔,徐 斌,杨秀春,等.不同沙化程度草原地下生物量及其环境因素特征[J].草业学报,2013,22(5):44-51.
[30] 刘任涛,赵哈林,赵学勇.流动沙地灌丛内外生境中土壤动物群落结构研究[J].中国沙漠,2013,33(1):167-173.
[31] 任 雪,褚贵新,王国栋,等.准噶尔盆地南缘绿洲-沙漠过渡带“肥岛”形成过程中土壤颗粒的分形研究[J].中国沙漠,2009,29(2):298-304.
[32] 姜广争,宫渊波,陈林武,等.岷江上游干旱河谷区灌丛植被土壤有机碳稳定性特征[J].水土保持学报,2011,25(5):209-214.
[33] 刘任涛.沙地灌丛的“肥岛”和“虫岛”形成过程, 特征及其与生态系统演替的关系[J].生态学杂志,2014,33(12):3463-3469.
[34] 陈鸿洋,尚振艳,傅 华,等.荒漠区不同大小灌丛周围土壤微生物生物量及活性特征[J].草业学报,2015,24(2):70-76.
[35] Kellman M. Soil enrichment by neotropical savanna trees[J]. The Journal of Ecology, 1979,67(2):565-577.
[36] Bernhard-Reversat F. Biogeochemical cycle of nitrogen in a semi-arid savanna[J]. Oikos, 1982,38(3):321-332.
[37] Belsky A J, Amundson R G, Duxbury J M, et al. The effects of trees on their physical, chemical and biological environments in a semi-arid savanna in Kenya[J]. Journal of applied ecology, 1989,26(3):1005-1024.
[38] Weltzin J F, Coughenour M B. Savanna tree influence on understory vegetation and soil nutrients in northwestern Kenya[J]. Journal of Vegetation Science, 1990,1(3):325-334.
[39] 王彦荣,曾彦军,付 华,等.过牧及封育对红砂荒漠植被演替的影响[J].中国沙漠,2002,22(4):321-327.
[40] 蔡晓布,张永青,邵 伟.不同退化程度高寒草原土壤肥力变化特征[J].生态学报,2008,28(3):1034-1044.
[41] 蔡晓布,彭岳林,魏素珍,等.高寒草原土壤有机碳与腐殖质碳变化及其微生物效应[J].土壤学报,2014,51(4):834-844.
[42] Lavado R S, Sierra J O, Hashimoto P N. Impact of grazing on soil nutrients in a Pampean grassland[J]. Journal of Range Management, 1996,49(5):452-457.
[43] Terrestrial Biospheric Carbon Fluxes Quantification of Sinks and Sources of CO2[M]. New York:Springer Science & Business Media, 2012.
[44] Nepstad D C, de Carvalho C R, Davidson E A, et al. The role of deep roots in the hydrological and carbon cycles of Amazonian forests and pastures[J]. Nature,1994,372(6507):666-669.
[45] Trumbore S E, Davidson E A, Barbosa de Camargo P, et al. Belowground cycling of carbon in forests and pastures of Eastern Amazonia[J]. Global Biogeochemical Cycles, 1995,9(4):515-528.
Varying characteristics of organic carbon and humus carbon under or outside the branchy tamarisk canopy in sand land in Northwest Sichuan
LIU Xiao-jing, HU Yu-fu, SHU Xiang-yang, XU Hao-yang, HE Jian-feng, WANG Qian
(CollegeofResources,SichuanAgriculturalUniversity,Chengdu,Sichuan611130,China)
In order to identify the effect of organic carbon and humus carbon under or outside the branchy tamarisk canopy in sand land in Northwest Sichuan province, the semi-restored sand with 24-year ecological restoration age was taken as sample. We studied the varying characteristics of soil organic carbon and humus carbon of shrub rhizosphere (SR), shrub middle (SM), shrub edge (SE) and shrub without (SO) at different sand land layers. Field investigation, sample collection and laboratory analysis were employed. The results are as follows. The content of soil organic carbon(SOC), humic acid carbon(HAC), fulvic acid carbon(FAC) and humin carbon(HMC) decreased with the increase of the horizontal distance from the shrub. The content of SOC in SR, SM, and SE in 0-20cm depth was respectively 1.86, 2.35 and 1.63 times of that in SO. HC in SR, SM, and SE in 0~20 cm depth was respectively 1.96, 0.68 and 1.22 times of that in SO. Under the same conditions of the horizontal distance from the shrub, soil organic carbon and humus carbon contents showed a trend of decrease with the increase of soil depth. In SR, SOC in 20~40 cm and 40~60 cm soil layer decreased by 32.31% and 38.38% respectively compared with 0~20 cm. HC in 20~40 cm and 40~60 cm soil decreased by 49.34% and 53.40% respectively in relation to the 0~20 cm soil. We found that spatial heterogeneity of SOC and HC was high.
Northwest Sichuan; sand land; branchy tamarisk canopy; soil organic carbon; humus carbon
1000-7601(2017)04-0015-07
10.7606/j.issn.1000-7601.2017.04.03
2016-05-10
四川省科技支撑计划项目(2013SZ0110);四川省科技计划项目“川西北沙化生态治理施肥关键技术及土壤生态治理施肥关键技术及土壤生态环境效应研究”(2013SZ0110);四川省科技计划项目“川西北高寒草地沙化防治新模式的研究与示范”(2014SZ0159)
刘小菁(1995—),重庆垫江人,硕士研究生,主要从事土壤生态环境研究。E-mail:jing602987688@qq.com。
胡玉福(1977—),四川西昌人,博士,副教授,主要从事3S技术在资源环境中的应用研究。E-mail:66433119@qq.com。
S153.6+2
A
