外源一氧化氮对玉米幼苗抗低温胁迫的影响
2017-08-16李永生彭云玲王汉宁方永丰
王 芳,李永生,彭云玲,王汉宁,方永丰,王 威
(甘肃农业大学农学院,甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070)
外源一氧化氮对玉米幼苗抗低温胁迫的影响
王 芳,李永生,彭云玲,王汉宁,方永丰,王 威
(甘肃农业大学农学院,甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070)
利用盆栽试验,用不同浓度的外源NO处理低温胁迫下的玉米幼苗,研究外源NO对玉米幼苗抗低温胁迫的影响。结果表明:低温明显抑制了玉米幼苗的生长,与常温对照相比,玉米幼苗叶片相对含水量下降了46.7%,叶绿素含量降低了19.19%,细胞膜的通透性增大,相对电导率增加了44.2%,丙二醛(MDA)含量增加了35.1%,可溶性蛋白含量下降了22.0%,可溶性糖含量下降了72.3%;适当浓度的外源NO可缓解低温胁迫造成伤害,其中浓度为0.10 mmol·L-1SNP处理效果最明显,与低温对照相比,MDA含量和相对电导率分别减少了24.4%和11.1%,相对含水量、叶绿素含量、可溶性蛋白和可溶性糖含量分别增加了40.2%、11.0%、19.25%、123.0%;外源NO能有效改善低温胁迫下玉米幼苗的光合作用,其净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)均较低温胁迫条件下未加NO处理有明显的增加,细胞间隙CO2浓度(Ci)则明显下降。表明适当浓度的外源NO可以缓解低温胁迫对玉米幼苗生长的抑制效应。
玉米幼苗;外源NO;低温胁迫;生理特性
非生物逆境是造成作物产量潜力不能充分发挥的主要原因,低温胁迫是影响植物生长和产量的一个重要的非生物胁迫因素,特别是在喜温作物中影响作物的发芽、生长、发育及产量等指标。玉米(Zeamays)是典型的喜温作物,整个生育期间都要求10℃以上的温度。有研究表明,低温是限制玉米产量和品质的主要因素之一,低温胁迫下玉米幼苗除表现不良反应还会对其生长发育、生理变化机制产生严重影响,尤其在苗期和灌浆期,玉米对低温更敏感。据统计,每3~4年我国北方地区玉米就会遭受1次低温冷害,减产20%~30%[1]。Fan[2]、Dumer[3]等研究表明,一氧化氮(Nitrogen oxide, NO)是一种新型植物生长抗病调节物质和植物信号传递成员,大量存在于植物组织中。近年来植物生物学研究表明[1],植物可以通过与动物NO合酶类似酶或者硝酸还原酶产生NO,在植物体内参与一系列生理代谢过程并对植物抗逆性起到非常重要的调控作用。例如,调节种子萌发、幼苗生长和光合作用、植物成熟和衰老、植物呼吸作用、抵抗病害、盐害、干旱、低温等一些生物与非生物胁迫的反应[4-5]。
本研究以玉米品种“郑单958”为材料,在苗期进行低温胁迫处理,探讨外源NO对低温胁迫下玉米幼苗生理特性和叶绿素荧光参数的影响,揭示低温下外源NO提高玉米幼苗抗冷性的生理机制,为玉米耐低温栽培提供理论依据。
1 材料与方法
1.1 材料和试剂
供试的玉米品种为“郑单958”,NO供体硝普钠(Sodium nitropprusside,SNP,购自德国Merck公司),先用蒸馏水配制10 mmol·L-1的母液,4℃保存,用时再按试验所需的浓度进行稀释。
1.2 试验设计
1.2.1 种子处理 选取颗粒饱满,大小均匀,无病害“郑单958”玉米种子,用0.5%次氯酸钠(NaClO)消毒10 min,然后用蒸馏水冲洗3~4次,浸种5 h后播于铺有两层滤纸的发芽盒内,在培养箱(光/暗:14 h/10 h,光强250 μmol·m-2·s-1;温度,白天/晚上:25℃/20℃)进行发芽试验。
1.2.2 幼苗处理 待玉米幼苗生长一周后,选取生长一致的幼苗转移到直径8 cm,高30 cm的塑料花盆内,每盆移植8株,每个处理5个重复,每2 d用20%浓度Hoagland营养液浇灌,待幼苗长到三叶一心后,选择长势良好和长势相对一致的幼苗进行不同的处理。
通过前期试验浓度梯度的筛选,参考王芳等[6]方法进行低温胁迫处理,本试验共设6个处理:Hoagland营养液+常温(对照);Hoagland营养液+4℃;Hoagland营养液+0.050 mmol·L-1SNP+4℃;Hoagland营养液+0.100 mmol·L-1SNP+4℃;Hoagland营养液+0.150 mmol·L-1SNP+4℃;Hoagland营养液+0.200 mmol·L-1SNP+4℃。
各处理液以Hoagland营养液为基础培养液配置最终浓度为0、0.05、0.10、0.15、0.20 mmol·L-1SNP溶液,以Hoagland营养液为对照(CK)。将常温处理从培养箱中取出,置常温下自然生长,将培养箱的温度调制10℃,使玉米幼苗适应4 h,再调到4℃进行低温处理,每隔2 d更换一次相应处理液。处理一周后进行各项指标的测定,每个指标至少测3次重复,结果取平均值。
1.3 玉米幼苗各项指标的测定方法
叶片相对含水量的测定采用烘干差减法[7]。叶片膜透性的测定采用相对电导率的方法[7]。丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法[7]。可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[7],以牛血清白蛋白做标准曲线,计算各样品的蛋白质质量分数(μg·mL-1),以鲜物质量计算。可溶性糖的测定采用蒽酮比色法[7]。玉米幼苗光合指标测定选用Li-6400型光合仪测定,测定过程中光强约为1 000 μmol·m-2·s-1,大气温度为25℃±1℃,大气CO2浓度变化范围为400 μmol·mol-1±15 μmol·mol-1,测定玉米幼苗完全展开的第3叶的净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr),随机选取3盆,每盆中随机选取3株,在晴天9∶00—11∶00进行测定。玉米叶片荧光参数的测定选用荧光仪(Junior-PAM2000)测定,先暗适应30 min,然后测量荧光指标。测定暗适应下的初始荧光(Fo)、最大荧光(Fm),设置在0~2 000 μmol·m-2·s-1之间11个光强梯度,测定光适应下的最大荧光(Fm')、最小荧光(Fo')、稳态荧光(Fs)等荧光参数[8]。参照Demming-Adams等[9]方法计算实际量子产量φPSⅡ=(Fm'-FS)/Fm',电子传递速率ETR=φPSⅡ×PAR×0.84×0.42,光化学猝灭系数qP=(Fm'-FS)/(Fm'-Fo'),非光化学猝灭系数qN=(Fm-Fm')/(Fm-Fo)。玉米叶绿素含量用叶绿素测定仪(SPAD502,日本MINLTA公司)测定。
1.4 数据处理
数据采用Microsoft Office Excel 2003软件进行绘图,用SPSS 16.0软件进行方差分析。
2 结果与分析
2.1 外源NO对低温胁迫下玉米幼苗叶片相对含水量的影响
玉米幼苗的相对含水量明显受低温影响,常温处理下幼苗的相对水含量明显高于低温处理和SNP处理组,随SNP浓度的增加叶片相对水含量呈先增加后减小的趋势。与常温对照相比,单独低温胁迫下玉米幼苗相对含水量下降了46.7%,与低温胁迫相比,添加浓度为0.05、0.10、0.15、0.20 mmol·L-1SNP后相对含水量分别增加了8.0%、40.2%、24.5%、13.5%,在浓度为0.10 mmol·L-1时,叶片相对含水量增加最多,且达到显著水平(P<0.05)(图1)。
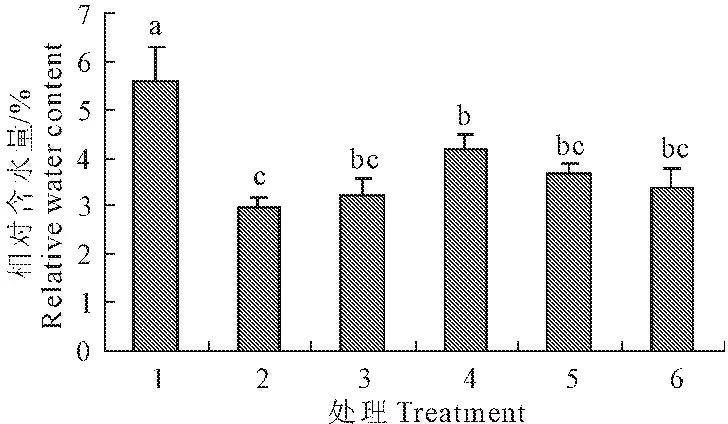
图1 外源NO对低温胁迫下玉米幼苗叶片相对含水量的影响(平均值±SE)
Fig.1 Effect of exogenous NO on the relative water content in maize seedling under low temperature stress (mean±SE)
注:图中小写英文字母表示P<0.05差异显著水平;1—Hoagland营养液+常温(对照), 2—Hoagland营养液+4℃, 3—Hoagland营养液+0.050 mmol·L-1SNP+4℃, 4—Hoagland营养液+0.100 mmol·L-1SNP+4℃, 5—Hoagland营养液+0.150 mmol·L-1SNP+4℃, 6—Hoagland营养液+0.200 mmol·L-1SNP+4℃;下同。
Note:different lowercase letters indicate significant difference atP<0.05 level. 1—Hoagland nutrient solution+normal temperature(Control), 2—Hoagland nutrient solution+4℃, 3—Hoagland nutrient solution+0.050 mmol·L-1SNP+4℃, 4—Hoagland nutrient solution+0.100 mmol·L-1SNP+4℃, 5—Hoagland nutrient solution+0.150 mmol·L-1SNP+4℃, 6—Hoagland nutrient solution+0.200 mmol·L-1SNP+4℃; the same below.
2.2 外源NO对低温胁迫下玉米幼苗叶片叶绿素含量的影响
与常温处理1相比,低温处理2使玉米幼苗叶片的叶绿素含量下降了19.19%,差异达显著水平(P<0.05)。与低温处理2相比,添加0.05~0.20 mmol·L-1SNP后,玉米幼苗叶绿素含量分别增加了4.8%、11.0%、6.8%、4.4%。且浓度为0.10 mmol·L-1SNP处理时叶绿素含量增加最为明显,与低温处理2差异达显著水平(图2)。
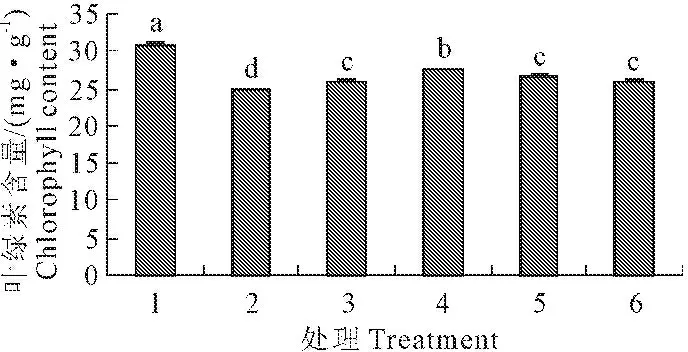
图2 外源NO对低温胁迫下玉米幼苗叶片叶绿素含量的影响(平均值±SE)
Fig.2 Effect of exogenous NO on the chlorophyll content inmaize seedling under low temperature stress (mean±SE)
2.3 外源NO对低温胁迫下玉米幼苗叶片质膜透性的影响
当玉米幼苗受到低温胁迫时(处理2),叶片电导率明显增大,低温处理2与常温对照1相比增加了44.2%。低温胁迫下的玉米幼苗外施不同浓度的SNP处理后,叶片电导率均比低温胁迫时小。当SNP浓度为0.10 mmol·L-1SNP时,比单独的低温处理电导率降低了11.1%,达显著差异水平(图3)。
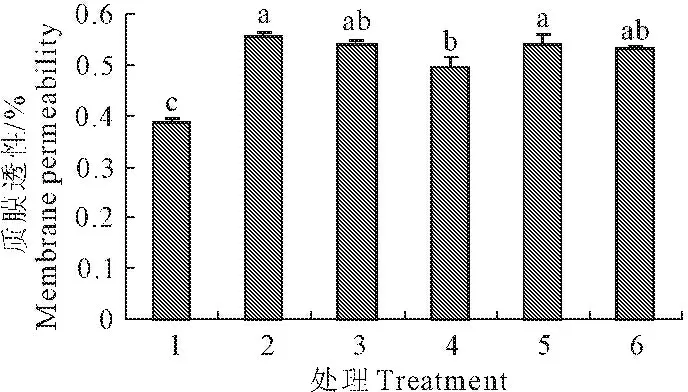
图3 外源NO对低温胁迫下玉米幼苗叶片质膜透性的影响(平均值±SE)
Fig.3 Effect of exogenous NO on the membrane permeability content in maize seedling under low temperature stress (mean±SE)
2.4 外源NO对低温胁迫下玉米幼苗丙二醛(MDA)含量的影响
与常温对照(处理1)相比,玉米幼苗在低温胁迫后,MDA含量增加了35.1%,当低温胁迫下外施SNP处理后,幼苗MDA增加有所缓解,与低温处理相比,处理3~处理6分别下降了10.7%、24.4%、15.4%、1.2%,在浓度为0.10 mmol·L-1含量下降最显著。说明SNP处理在低温胁迫条件下玉米幼苗叶片的膜脂过氧化程度降低,缓解低温迫害,利于保持叶片细胞膜的完整性(图4)。
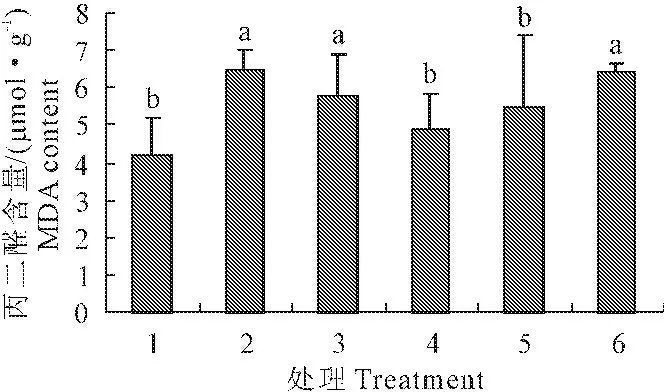
图4 外源NO对低温胁迫下玉米幼苗叶片丙二醛含量的影响(平均值±SE)
Fig.4 Effect of exogenous NO on the MDA content in maizeseedling under low temperature stress (mean±SE)
2.5 外源NO对低温胁迫下玉米幼苗叶片可溶性蛋白含量的影响
与常温处理相比,低温处理后玉米幼苗叶片可溶性蛋白含量降低了22.0%,差异达显著水平,表明低温胁迫在一定程度上降低了蛋白质的合成。经不同浓度的SNP处理后可溶性蛋白均有不同程度的增加,0.05~0.15 mmol·L-1SNP的作用下,玉米幼苗叶片中的可溶性蛋白含量与低温胁迫相比分别增加了10.4%、19.25%,11.4%,在添加0.10 mmol·L-1SNP时差异达到显著水平(P<0.05)(图5)。
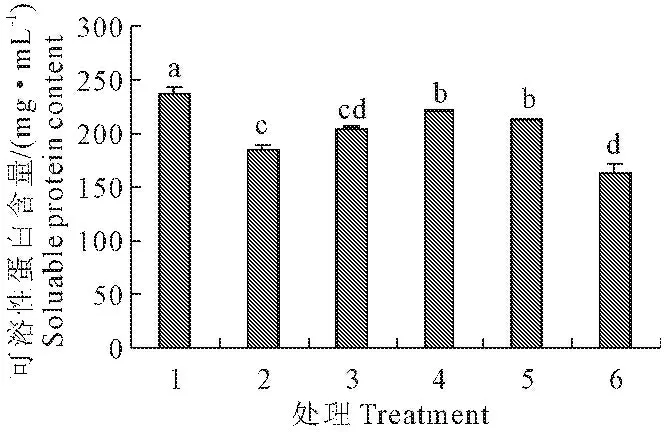
图5 外源NO对低温胁迫下玉米幼苗叶片可溶性蛋白含量的影响(平均值±SE)
Fig.5 Effect of exogenous NO on the soluable protein content in maize seedling under low temperature stress (mean±SE)
2.6 外源NO对低温胁迫下玉米幼苗叶片可溶性糖含量的影响
与常温处理相比,低温胁迫下玉米幼苗叶片可溶性糖含量下降了72.3%,差异达到显著水平(P<0.05)。外施SNP处理的玉米幼苗叶片可溶性糖含量较低温单独处理相比有所提高,SNP浓度为0.05~0.15 mmol·L-1时,分别提高了96.9%、123.0%、95.6%,在0.10 mmol·L-1SNP时可溶性糖含量增加最显著(图6)。
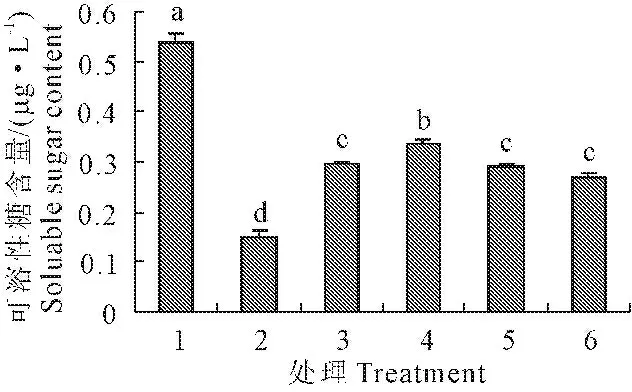
图6 外源NO对低温胁迫下玉米幼苗叶片可溶性糖含量的影响(平均值±SE)
Fig.6 Effect of exogenous NO on the soluable sugar content in maize seedling under low temperature stress (mean±SE)
2.7 外源NO对低温胁迫下玉米幼苗叶片光合参数的影响
由表1可以看出,玉米幼苗受低温胁迫后,叶片胞间CO2浓度(Ci)较常温对照增加了14.76%,达到差异显著水平。添加了0~0.200 mmol·L-1SNP后,Ci含量逐渐减小,在0.10 mmol·L-1SNP(处理4)处理时达到最小,较低温单独处理,降低了18.45%。随着SNP浓度的逐渐增大,叶片Ci的值又开始增加。
与常温对照相比,玉米幼苗受低温胁迫后Gs和Tr显著下降,分别降低了59.19%和49.97%,添加0~0.20 mmol·L-1SNP后,Gs和Tr含量增加,0.10 mmol·L-1SNP处理(处理4)达到最大值,较低温单独处理,分别增加了68.19%和56.08%,且差异达到显著水平(P<0.05)。
低温胁迫处理下玉米幼苗的光合作用受到严重抑制,净光合速率(Pn)显著下降,为常温对照的24.81%。低温胁迫下施加外源NO供体SNP叶片净光合速率升高,0.10 mmol·L-1SNP处理(处理4)值最大,较单独低温处理,增加了11.30%,且差异达到显著水平。
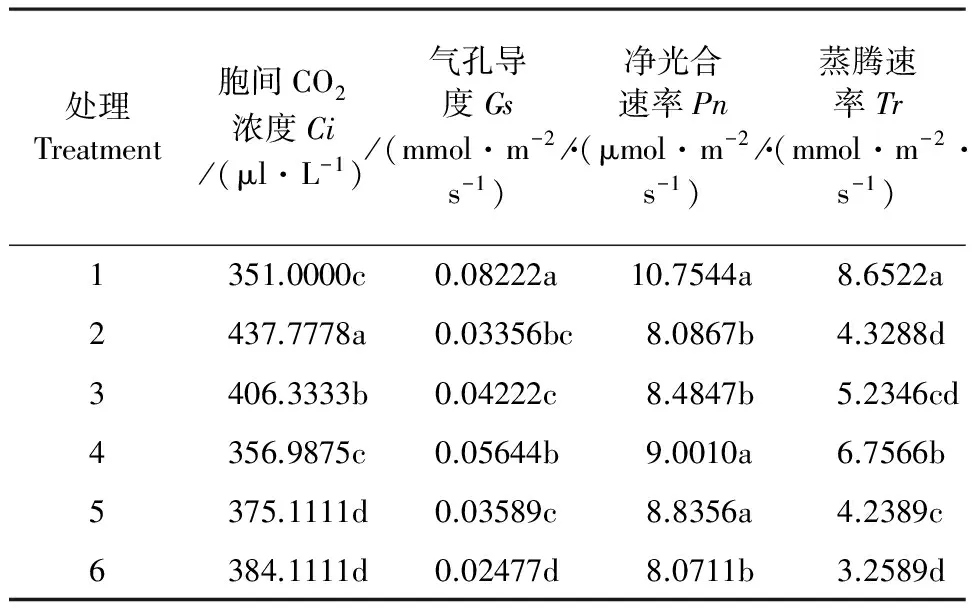
表1 外源NO对低温胁迫下玉米幼苗叶片气体交换参数的影响
2.8 外源NO对低温胁迫下玉米幼苗叶片叶绿素荧光参数的影响
由表2可以看出,玉米幼苗受低温胁迫后,玉米叶片qP和NPQ较常温对照分别减少了42.07%和42.86%,差异达到显著水平,说明低温胁迫使PSⅡ反应中心捕获能量转化为化学能的能力降低,PSⅡ的电子传递活性减小,从而降低了光合效率和对光能的利用。添加SNP后,qP与低温单独处理相比依次减少了15.01%、51.55%、42.30%、38.33%,NPQ含量与低温单独处理相比依次减少了11.36%、46.01%、11.74%、9.54%,且差异达到显著水平(P<0.05)。
玉米幼苗受低温胁迫后,玉米叶片最小初始荧光(Fo)较常温对照显著增加了70.92%,低温处理下Fo的迅速上升,表明低温胁迫降低了原初光能转化效率,引起了光抑制,造成PSII反应中心失活或伤害。添加SNP后,Fo含量与低温单独处理相比依次减少了28.65%、55.81%、53.51%、50.77%,且差异达到显著水平(P<0.05)。
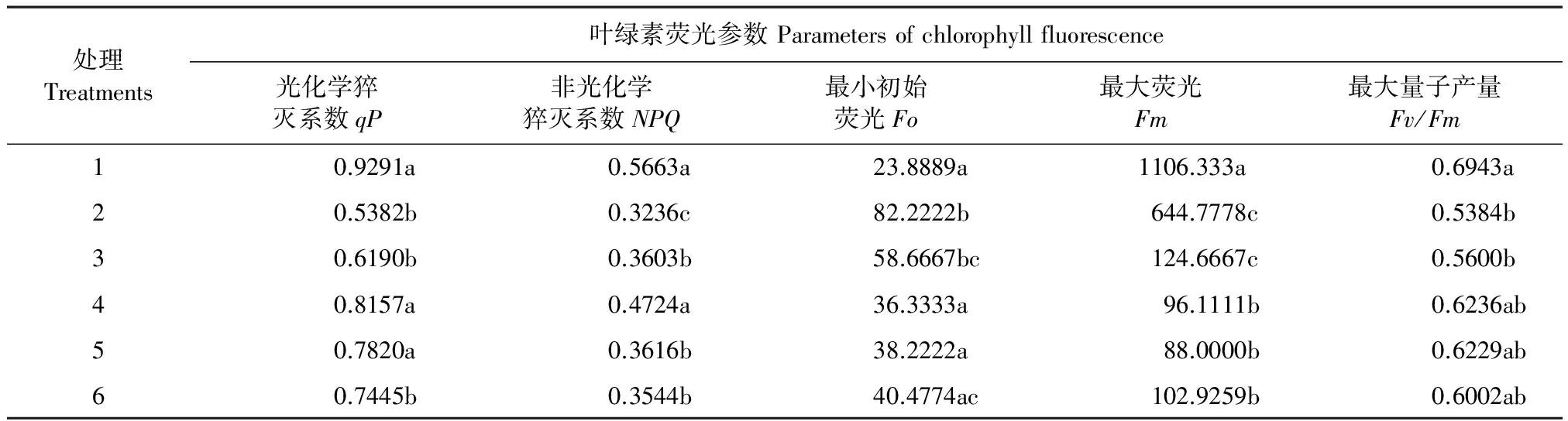
表2 外源NO对低温胁迫下玉米幼苗叶片叶绿素荧光参数的影响
低温胁迫后,玉米叶片最大荧光(Fm)较常温对照降低58.94%,且差异达到显著水平。表明低温对玉米幼苗叶片PSII反应中心的电子传递潜力产生明显的抑制作用。添加SNP后,Fm含量与低温单独处理相比依次升高了8.67%、72.90%、45.41%、36.65%,且差异达到显著水平(P<0.05)。
低温胁迫后,玉米叶片最大量子产量(Fv/Fm)较常温对照降低22.45%,添加SNP后,最大量子产量与低温单独处理相比依次升高了4.00%、15.80%、15.68%、9.10%,且差异达到显著水平(P<0.05)。
3 讨 论
植物通过改变细胞代谢和激发不同的防御机制来应对生物胁迫和非生物胁迫,在胁迫条件下植物的生存能力依赖于对外界刺激的识别、产生和传递信号、基因表达、代谢调节[10-11]。NO作为信号分子,在植物的抗逆过程中起重要作用。本研究表明,低温条件下玉米幼苗植株的生长受到明显的影响,幼苗的生长势削弱,低温胁迫下添加0.10 mmol·L-1SNP处理在一定程度上缓解了低温胁迫对玉米幼苗生长的抑制作用。
NO作为一种新的植物生长调节物质,在植物的生理活动中起到了枢纽作用,广泛参与种子萌发及逆境适应等生理过程[12]。相对含水量能直观地反映植物的生长状态正常与否,是衡量植物体水分状况的重要指标之一。植物体受到低温胁迫后,植物叶片对水分的吸收和利用均发生变化。MDA是膜脂过氧化的产物,它能破坏细胞膜的结构,使细胞内溶物扩散到细胞外,低温胁迫下会大量积累。细胞膜是细胞对外界的屏障,在逆境低温胁迫下细胞需要进行渗透调节以维持细胞内外渗透平衡,因此必然会使机体内积累参与渗透调节的物质如可溶性糖、可溶性蛋白质等[13]。本研究表明,在低温胁迫下,玉米叶片的相对含水量显著减少,可溶性蛋白和可溶性糖的含量降低,细胞质膜透性增加,但施加SNP后的幼苗叶片相对含水量的减少量明显降低,相对电导率和丙二醛的含量下降,可溶性蛋白和可溶性糖的含量增加[14]。说明外源NO对细胞膜具有良好的保护作用并且可诱导可溶性糖和可溶性蛋白的积累,减轻低温胁迫对其造成的伤害,提高玉米对低温的适应性。这与杜卓涛等[15]对低温胁迫下外源NO影响黄瓜幼苗生长的研究结果一致。
叶绿素是光合作用的主要物质,植物光合作用能力的大小与其含量的高低有关。在植物体内叶绿素含量的多少,在很大程度上决定着光合作用的强弱,并与植物生长和生理状况紧密相关[15]。而低温胁迫对植物色素及其蛋白复合体的合成和代谢的抑制作用是造成植物缺绿和叶片发黄的原因。许多研究表明,低温可使高等植物的叶绿素含量明显降低[16]。本试验中低温胁迫使得叶片内叶绿素含量明显降低,而添加一定浓度的外源NO显著增加了低温胁迫下叶绿素含量,从而缓解了低温胁迫造成的氧化损伤,一定程度上保护了叶绿体结构的完整,这可能也与除叶绿素之外的其他酶类有关。这一结果与刘建新等[16]的NO提高镉胁迫下黑麦草幼苗叶片叶绿素的研究结果一致。
净光合速率是光合作用特性的重要指标,也是影响植物生物产量的重要因素[17]。与正常生长下幼苗相比,低温处理对植物的Gs、Ci、Pn等光合作用指标均具有明显的影响,Gs可能是导致净光合速率下降的主要原因[18]。本研究表明,外源NO可以显著减轻低温胁迫下玉米幼苗叶片Pn、Gs的下降。其中以0.1 mmol·L-1的SNP处理效果最好。这与孙海丽等[20]的研究一致。叶绿素荧光参数由于是以植物体内叶绿素为内在探针,包含了丰富的光合作用信息,极易受逆境的影响,是快速、灵敏无损伤的研究和探测低温对植物光合作用影响的理想方法。qP和NPQ是叶绿体耗散能量的两种形式,qP反映植物吸收的光能用于光化学反应部分的大小,是PSⅡ反应中心捕获能量转化为化学能的过程,反映了植物的光合效率和对光能的利用。NPQ是PSⅡ天线色素吸收的不能用于光合电子传递而以热形式耗散掉的光能部分,它是一种自我保护机制,对光合机构起一定的保护作用[19]。Fo为初始荧光,指反应中心未能发生光化学反应时的叶绿素荧光,可反映逆境对植物叶片PSⅡ永久性伤害程度,其值大小主要与激发光的强度及叶绿素含量有关。Fv/Fm是PSⅡ最大光化学量子产量,是表示植物光抑制程度的指标,反映PSⅡ反应中心原初光能转换效率或称最大PSⅡ的光能转换效率。非胁迫条件下该参数的变化极小,不受物种和生长条件的影响,胁迫条件下该参数明显下降[20]。本研究表明,低温降低了玉米幼苗PSⅡ的潜在活性和原初光能转化效率。在低温胁迫条件下,玉米幼苗叶片叶绿素荧光参数Fm、Fv/Fm、NPQ、qP均呈下降的变化趋势,而Fo却上升了。qP和NPQ降低,说明低温胁迫也直接影响了光合作用的碳同化[21]。但当加入适宜浓度的外源NO后缓解了玉米幼苗叶片叶绿素荧光参数Fo、Fm、qP、Fv/Fm、NPQ含量的下降,说明外源NO可有效缓解玉米幼苗叶片的冷害,增强玉米幼苗对低温的抗性。这与牟雪姣等[22]对低温胁迫下外源NO缓解蝴蝶兰伤害的生理机制结果一致。
4 结 论
外源NO对缓解低温胁迫下玉米幼苗生长具有显著效应,以0.10 mmol·L-1SNP的效果最好,显著缓解了玉米幼苗相对含水量、叶绿素含量、可溶性蛋白和可溶性糖含量的降低,抑制了MDA含量、叶片膜透性等的增加,有效改善低温胁迫下玉米幼苗的光合作用,减缓了低温冷害对植物造成的伤害,从而增强植株的抗冷性。
[1] 王小丽,裴玉贺,郭新梅,等.低温胁迫下玉米幼苗的几种生理生化指标的变化[J].植物生理学通讯,2009,45(5):487-490.
[2] Fan Huaifu, Du Changxia, Xu Yanli, et al. Exogenous nitric oxide improves chilling tolerance of chinese cabbage seedlings by affecting antioxidant enzymes in leaves[J]. Hort. Environ. Biotechnol, 2014,(3):159-165.
[3] Durner J, Klessig D F. Nitric oxide as a singal in plants[J]. Current Opinion Plant Biology, 1999,394:369-374.
[4] 张 华,孙永刚,张 帆,等.外源一氧化氮供体对渗透胁迫下小麦种子萌发和水解酶活性的影响[J].植物生理与分子生物学学报,2005,31(3):241-246.
[5] 陈银萍,王晓梅,杨宗娟,等.NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响[J].农业环境科学学报,2012,31(2):270-277.
[6] 王 芳,王丹丹,赵 娟.钙对低温胁迫下玉米幼苗氧化损伤的保护作用[J].干旱地区农业研究,2014,32(1):155-160.
[7] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[8] 徐田军,董志强,兰宏亮,等.低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报,2012,38(2):352-359.
[9] Demmig-Adams B, Adams W W, Baker D H, et al. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J]. Physiologia Plantarum, 1996,98(2):253-264.
[10] Xu L L, Fan Z Y, Dong Y J, et al. Effects of exogenous salicylic acid and nitric oxide on physiological characteristics of two peanut cultivars under cadmium stress[J]. Biologia Plantarum, 2015,59(1):171-182.
[11] Wang Dafei, Liu Yunguo, Tan Xiaofei, et al. Effect of exogenous nitric oxide on antioxidative system and Snitrosylation in leaves ofBoehmerianivea(L.) Gaud under cadmium stress[J]. Environ Sci Pollut Res, 2015,22:3489-3497.
[12] 刘开力,凌腾芳,刘志兵,等.外源NO供体SNP浸种对盐胁迫下水稻幼苗生长的影响[J].植物生理学通讯,2004,40(4):675-679.
[13] 曾乃燕,何军贤,赵 文,等.低温胁迫期间水稻光合膜色素与蛋白水平的变化[J].西北植物学报,2004,20(1):8-14.
[14] 任 洁,王慧梅,王文杰,等.温度升高对杨树树皮绿色组织和叶片光合作用、叶绿素荧光特性的影响[J].植物研究,2014,(6):758-764.
[15] 杜卓涛,商 桑,朱白婢,等.外源NO对低温胁迫下苦瓜幼苗生长和几个生理指标的影响[J].热带作物学报,2016,37(3):482-487.
[16] 刘建新,胡浩斌,王 鑫.外源一氧化氮供体对镉胁迫下黑麦草幼苗活性氧代谢、光合作用和叶黄素循环的影响[J].环境科学学报,2009,29(3):626-633.
[17] 王满莲,韦 霄,唐 辉,等.光强对三种喀斯特植物幼苗生长和光合特性的影响[J].生态学杂志,2015,(3):604-610.
[18] 孙海丽,李 婷,张 华,等.外源NO对缺铁豌豆幼苗生长以及光合作用的影响[J].西北植物学报,2011,31(4):739-745.
[19] 张仁和,郑友军,马国胜,等.干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J].生态学报,2011,31(5):1303-1311.
[20] 张永平,陈幼源,杨少军,等.外源水杨酸对镉胁迫甜瓜幼苗生长与光合气体交换和叶绿素荧光特性的影响[J].西北植物学报,2014,34(4):778-785.
[21] 周 建,杨立峰,郝峰鸽,等.低温胁迫对广玉兰幼苗光合及叶绿素荧光特性的影响[J].西北植物学报,2009,29(1):136-142.
[22] 牟雪姣,刘理想,孟鹏鹏,等.外源NO缓解蝴蝶兰低温胁迫伤害的生理机制研究[J].西北植物学报,2015,35(5):978-984.
Effects of exogenous nitric oxide on low temperature stress of maize seedlings
WANG Fang, LI Yong-sheng, PENG Yun-ling, WANG Han-ning, FANG Yong-feng, WANG Wei
(DepartmentofAgronomy,GansuAgriculturalUniversity,DroughtEnvironmentCropCultivationofKeyLaboratoryinGansuProvince,Lanzhou,Gansu730070,China)
This study aims to evaluate the effects of exogenous NO on low temperature stress of maize seedlings under low temperature stress by pot experiment. The results showed that low temperature significantly inhibited the growth of maize seedlings. The relative water content, chlorophyll content, soluble protein content, soluble sugar content were decreased by 46.7%, 19.19%, 22.0%, 72.3%, respectively under low temperature stress. The cell membrane permeability was increased, with the relative conductivity and malondialdehyde (MDA) content increased by 44.2% and 35.1%. The appropriate concentration of exogenous NO can alleviate the damage caused by low temperature stress, especially at the concentration of 0.10 mmol·L-1SNP. Under this optimization treatment, MDA content and relative conductivity were decreased by 24.4% and 11.1% but the relative water content, chlorophyll content, soluble protein and soluble sugar were increased by 40.2%, 11.0%, 19.25% and 123.0%, respectively. The photosynthesis of maize seedling was effectively improved by exogenous NO under low temperature stress. Compared with the condition of without NO treatment, the net photosynthetic rate (Pn), stomatal conductance (Gs), transpiration rate (Tr) were significantly increased under low temperature stress, but the CO2concentration (Ci) was obviously declined. These results suggested that appropriate application of exogenous NO could relieve the inhibitory effect of maize seedling growth under low temperature stress.
maize seedlings; exogenous NO; low temperature stress; physiological characteristics
1000-7601(2017)04-0270-06
10.7606/j.issn.1000-7601.2017.04.41
2016-06-10
“973”计划前期研究专项(2012CB722902);国家自然科学基金(31260330)
王 芳(1980—),女,甘肃民勤人,副教授,博士,主要研究方向为种子生理及玉米分子育种。 E-mail:wangfang@gsau.edu.cn。
S513.01
A
