DCE01菌株大麻韧皮脱胶过程中有机酸的变化规律
2017-08-16冯湘沅成莉凤曾洁刘志远杨琦郑科王瑞君段盛文彭源德
冯湘沅,成莉凤,曾洁,刘志远,杨琦,郑科,王瑞君,段盛文,彭源德
(中国农业科学院麻类研究所,长沙410205)
原料生产·生态环保
DCE01菌株大麻韧皮脱胶过程中有机酸的变化规律
冯湘沅,成莉凤,曾洁,刘志远,杨琦,郑科,王瑞君,段盛文*,彭源德*
(中国农业科学院麻类研究所,长沙410205)
为阐明大麻韧皮生物脱胶机理,研究采用DCE01菌株对大麻韧皮进行浸泡振荡发酵10.5 h,从0.5 h开始,每隔2 h取样,采用高效液相色谱法分析发酵过程中有机酸的变化规律。结果表明:在降解大麻韧皮发酵过程中发酵液主要含有草酸、甲酸、苹果酸、乳酸、柠檬酸、乙酸、琥珀酸、丙酸和其它未知有机酸组分。草酸、甲酸、琥珀酸的含量在发酵过程中均呈先升后降的变化趋势,发酵最终变化率分别为降低93.69%、升高65.37%、降低26.01%;乙酸呈先升后降再回升再下降的变化过程,发酵最终变化率为降低84.58%;苹果酸、乳酸含量呈先升后降再回升变化状态,发酵最终变化率分别为升高52.03%、升高31.97%;柠檬酸含量呈缓慢上升至平稳趋势,发酵最终变化率为升高44.31%;丙酸含量呈不规则变化趋势,发酵最终变化率为升高0.11%。
DCE01菌株;大麻韧皮;发酵液;有机酸;变化规律
Key words:strain DCE01,hemp bast,fermentation broth,organic acids,change rule
由于大麻韧皮的非纤维素物质(果胶、半纤维素、木质素等胶质)含量较高,必需去除在纤维束内部和外围组织的键合型非纤维素物质,所以,去除胶质是生产中的重要环节[1-3]。传统水沤麻法存在着环境污染大、脱胶时间长、劳动强度大等问题,而化学脱胶法、各种物理方法等存在着成本高、能耗大、纤维损伤严重等弊端,已成为产业发展的制约因子[4-5]。为了寻找最佳脱胶方法,研究发现生物脱胶法具有克服上述脱胶法缺点的优势。生物脱胶主要是选用高产果胶酶、甘露聚糖酶、木聚糖酶等有降解胶质能力的菌株来处理大麻韧皮获得纯净纤维。菌株在脱胶过程中的酶解胶质及酶解产物的生化反应所产生的有机酸类、醛类等产物浓度积累的多少会使发酵条件发生变化,从而影响菌株脱胶,因此,掌握有机酸与菌株脱胶的协调性很有必要[6-8]。
高效菌株DCE01具有易操作、生长繁殖速度快、培养基要求简单等特点,故本研究采用DCE01菌株对大麻韧皮进行浸泡振荡发酵,检测分析发酵过程中有机酸的变化规律,旨在为阐明大麻韧皮生物脱胶机理提供一定的科学依据。
1 材料与方法
1.1 材料
DCE01菌株:菊果胶杆菌变异菌株(保藏号:CGMCC5522)。大麻韧皮:2014年长沙基地收获后晒干的大麻韧皮原麻。
1.2 主要仪器与试剂
Dionex Ultimate 3000液相色谱仪,Thermo Hypersil BDS C18柱(250 mm×4.6 mm,5μm),VWD-3400紫外检测器,图谱和数据采集处理为变色龙软件。
全温振荡器(RH-Q型)为宁波赛茵仪器有限公司产品。
草酸、甲酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸、丙酸均为Aladdin公司产品(分析纯),磷酸二氢钾、蛋白胨、葡萄糖、氯化钠、牛肉浸膏、营养琼脂均为国药集团化学试剂有限公司产品(分析纯),甲醇为国药集团化学试剂有限公司产品(色谱纯)。
1.3 菌悬液制备
取保存菌株DCE01菌苔1环接于5 mL液体培养基,混匀,35℃静置培养5 h;取1 mL稀释涂布于固体培养基平皿,35℃静置培养20 h;挑取活化菌落1个接于5 mL液体培养基,35℃培养4 h;倒入100 mL液体培养基,35℃,180 r/min培养6 h;取6 mL接于300 mL液体培养基,35℃,180 r/min培养6 h。
1.4 接种与发酵
准确称取15 g大麻韧皮(去除基、梢部各约10 cm,剩余部分剪切为约3 cm长的片段)于500 mL锥形瓶中,倒入浴比1∶10、接种量为2%的菌悬液,混匀,置于35℃,180 r/min全温振荡器发酵,设置3个重复。同时设置空白(不加菌悬液)对照组。
1.5 取样
大麻韧皮接种振荡0.5 h开始取样,直至10.5 h结束,每隔2 h取样一次。每瓶取样10 mL(麻瓶立即补充等量自来水)。
1.6 有机酸测定
混合标准单糖类溶液配制:准确配制浓度为草酸0.5 g/L、甲酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸、丙酸均为5 g/L的标准溶液,分别取上述各标准溶液混合,0.45μm滤膜过滤,适度稀释倍数用作HPLC检测分析[9-10]。
样品处理:取样品发酵液5 mL,10000 r/min离心10 min,去沉淀,取上清用0.22μm微孔膜过滤,待测。
有机酸发酵过程中指标计算方法表示为变化率。发酵最终变化率(%)=|发酵终止含量-发酵起始含量|÷发酵终止含量×100%。
1.7 色谱条件[11]
紫外检测波长:210 nm;柱温:25℃;流速:0.6mL/min;流动相:V(甲醇)∶V(0.01 mol/L磷酸二氢钾缓冲液,pH 2.7)=3∶97;进样量:20μL。
2 结果与讨论
2.1 发酵过程中有机酸的组成分析
通过对大麻韧皮发酵过程中采集的样品进行适当稀释,用高效液相色谱仪分析有机酸组分和含量,结果见图1。对照混合标准曲线可以看出:按出峰顺序,大麻韧皮的DCE01菌株发酵液含有草酸、甲酸、苹果酸、乳酸、柠檬酸、乙酸、琥珀酸、丙酸和其它未知有机酸成分,其中草酸含量最高,甲酸含量次之。例如:2.5 h时发酵产物中的草酸、甲酸、苹果酸、乳酸、柠檬酸、乙酸、琥珀酸、丙酸分别占已知有机酸总量的72.18%、9.54%、5.06%、4.72%、3.21%、0.97%、2.13%、2.19%。
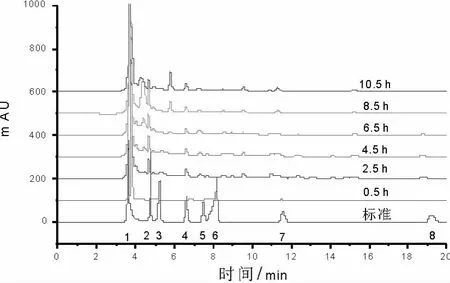
图1 大麻韧皮发酵过程中有机酸变化色谱图Fig.1 Chromatogram on the organic acids during the fermentation for hemp bast
2.2 发酵过程中有机酸的变化规律
2.2.1 草酸
从图2可看出,DCE01菌株发酵液草酸含量在0.5~2.5 h呈缓慢上升趋势,2.5 h之后呈下降趋势。而CK发酵液草酸含量在0.5~2.5 h呈下降趋势,2.5 h后呈平稳状态。DCE01菌株发酵液、CK发酵液草酸起始(0.5 h)含量分别为3299.1、902.3 mg/L,10.5 h发酵终止后两者草酸含量变化率分别降低为93.69%、3.11%。结果表明,原料浸泡产生草酸,而随着时间延长,微生物含量增加,草酸逐渐被消耗。
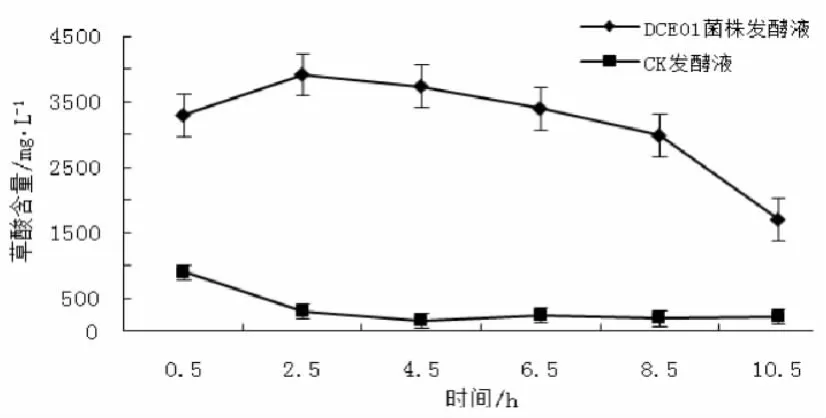
图2 草酸的变化规律Fig.2 The change rule of oxalic acid during the fermentation for hemp bast
2.2.2 甲酸
由图3可见,DCE01菌株发酵液的甲酸含量由初始的290.3 mg/L上升到8.5 h的最高峰值1572.1 mg/L,随后出现下降,终止含量为841.7 mg/L,发酵最终变化率为升高65.37%。CK发酵液甲酸含量从0.5~10.5 h呈比较平稳状态,在77.6 mg/L左右波动。从变化情况可以看出,甲酸来源于脱胶过程中菌株的代谢产物或大麻原料分解产物。
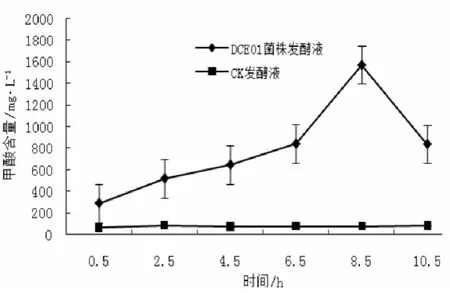
图3 甲酸的变化规律Fig.3 The change rule ofmethanoic acid during the fermentation for hemp bast
2.2.3 苹果酸
图4表明,DCE01菌株发酵液苹果酸含量的变化情况为0.5~4.5 h呈上升趋势,4.5~6.5 h呈下降趋势,6.5~10.5 h又回升,从起始含量52.1 mg/L到终止含量108.6 mg/L,整个发酵过程中,虽然苹果酸含量最终变化率为升高52.03%,但增加量不高(只有50 mg/L左右)。而CK发酵液苹果酸含量从0.5~10.5 h一直在24.1 mg/L左右波动。
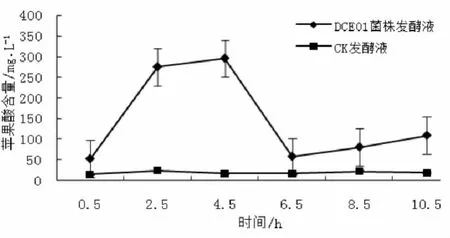
图4 苹果酸的变化规律Fig.4 The change rule ofmalic acid in the fermentation broth
2.2.4 乳酸
从图5可以得出,DCE01菌株发酵液乳酸含量的变化规律为0.5~4.5 h缓慢上升,4.5~6.5 h出现下降,6.5~10.5 h又回升,整个发酵过程的变化趋势呈“N”型,终止含量(256.8 mg/L)是起始含量(174.7 mg/L)的1.47倍,变化率为升高31.97%。而CK发酵液的苹果酸含量从4.5 h开始出现上升,8.5 h后呈缓慢下降趋势。从整体变化情况来说,菌株在发酵过程中分泌积累乳酸。
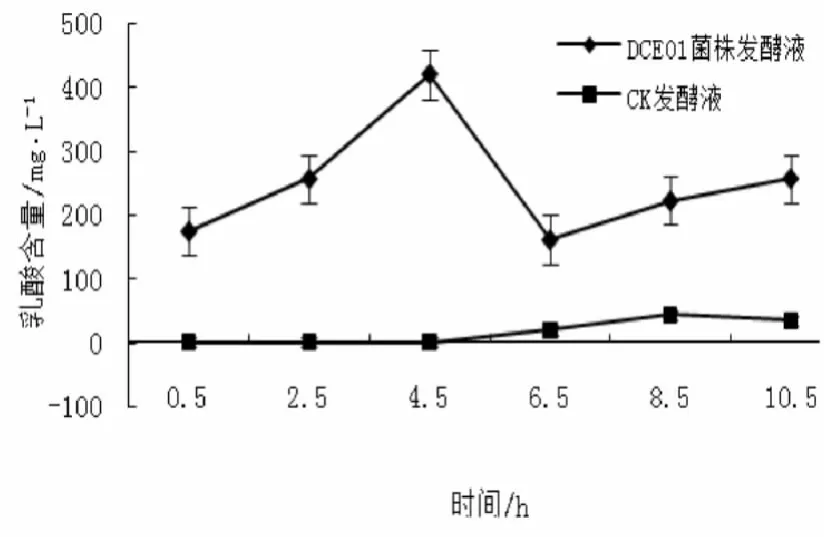
图5 乳酸的变化规律Fig.5 The change rule of lactic acid during the fermentation for hemp bast
2.2.5 乙酸
通过图6可看出,DCE01菌株发酵液、CK发酵液的草酸含量大致呈现“M”型的变化趋势。DCE01菌株发酵液乙酸起始含量(120.9 mg/L)高于终止含量(65.5 mg/L),乙酸的最终变化率为降低84.58%。发酵过程中两者的乙酸含量均在2.5、6.5 h出现峰高。整体变化规律可以归结为,菌株分泌的胞外酶降解溶出物及胶质时不断产生乙酸及转化、分解的循环过程。
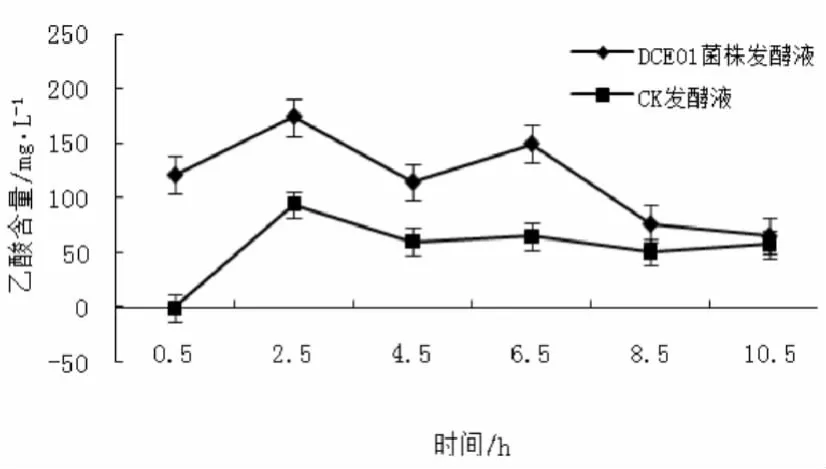
图6 乙酸的变化规律Fig.6 The change rule of acetic acid during the fermentation for hemp bast
2.2.6 柠檬酸
由图7可知,DCE01菌株发酵液、CK发酵液的柠檬酸含量变化趋势近乎相同。DCE01菌株发酵液的柠檬酸含量从0.5 h(50.9 mg/L)缓慢上升至8.5 h(92.5 mg/L),之后基本平稳,整个发酵过程中,柠檬酸含量的最终变化率为升高44.31%。而CK发酵液的柠檬酸含量从6.5 h开始呈现上升趋势,8.5 h后含量基本维持在38 mg/L左右。从变化规律可得,柠檬酸随着发酵时间的延长而逐渐积累并趋于平稳,但含量不高。

图7 柠檬酸的变化规律Fig.7 The change rule of citric acid during the fermentation for hemp bast
2.2.7 琥珀酸
由图8显示,DCE01菌株发酵液、CK发酵液的琥珀酸含量均在4.5 h出现最高,含量分别为121.6、51.7 mg/L,之后含量缓慢下降,8.5~10.5 h含量处于平稳状态,整个过程中,两者的变化趋势相近。但DCE01菌株发酵过程中的琥珀酸含量最终变化率为降低26.01%。这一现象可以认为,琥珀酸在发酵初期被逐步积累,随着发酵的延续而趋于平稳。

图8 琥珀酸的变化规律Fig.8 The change rule of succinic acid during the fermentation for hemp bast
2.2.8 丙酸
如图9所示,DCE01菌株发酵液、CK发酵液的丙酸含量呈不规则变化趋势。DCE01菌株发酵液的丙酸含量从起始到终止变化不大(变化率为升高0.11%),一直在80 mg/L左右波动。CK发酵液的丙酸含量从起始到终止也是增加的。

图9 丙酸的变化规律Fig.9 The change rule of propionic acid during the fermentation for hemp bast
3 结论
采用DCE01菌株对大麻韧皮进行浸泡振荡发酵10.5 h,利用高效液相色谱法分析发酵过程中有机酸含量的变化规律,获得主要结论如下:
(1)DCE01菌株在降解大麻韧皮发酵过程中发酵液含有草酸、甲酸、苹果酸、乳酸、柠檬酸、乙酸、琥珀酸、丙酸和其它未知有机酸组分。
(2)发酵过程中的草酸、甲酸、琥珀酸含量均呈先升后降的变化趋势;乙酸呈先升后降再回升再下降的变化过程,类似于“M”型的变化趋势;苹果酸、乳酸含量呈先升后降再回升变化状态,呈“N”型;柠檬酸含量呈缓慢上升至平稳趋势;丙酸含量呈不规则变化趋势。
(3)发酵过程中含量最终变化率出现降低的有机酸有草酸、乙酸、琥珀酸,变化率分别降低为93.69%、84.58%、26.01%;含量最终变化率出现升高的有机酸有甲酸、苹果酸、柠檬酸、乳酸、丙酸,变化率分别升高为65.37%、52.03%、44.31%、31.97%、0.11%。而对照组中,草酸、甲酸、苹果酸、乳酸、柠檬酸、乙酸、琥珀酸、丙酸等含量明显偏低,说明大麻韧皮生物脱胶过程中,有机酸种类及含量发生了系列变化,这些变化反映了菌株的代谢产物及原料降解产物的变化规律,对进一步探讨大麻脱胶机理具有积极意义。
[1]刘健,陈洪章,李佐虎.大麻纤维脱胶研究综述[J].中国麻作,2002,24(4):39-42.
[2]俞春华,冯新星,贾长兰,等.高温脱胶对大麻纤维成分与结构的影响[J].纺织学报,2006,27(10):80-83.
[3]孙小寅,管映亭,温桂清,等.大麻纤维的性能及其研究[J].纺织学报,2001,22(4):234-236.
[4]罗远莉.苎麻生物脱胶的研究[D].重庆:重庆大学,2007,10-38.
[5]彭源德,严理,唐守伟,等.大麻快速生物脱胶过程中发酵液成分变化[J].纺织学报,2009,30(3):48-52.
[6]黄彦君.啤酒发酵过程有机酸代谢特征变化规律的研究[J].酿酒,2009,36(6):53-55.
[7]韩芳,吴秋燕,赵雪.有机酸在发酵过程中的变化规律[J].啤酒科技,2015(8):9-12.
[8]冯湘沅,成莉凤,段盛文.DCE01菌株降解大麻韧皮的发酵液成分变化规律[J].中国麻业科学,2016,38(5):202-206.
[9]黄慧,张伟国.反相高效液相色谱法测定苹果酸发酵液中的有机酸[J].食品与发酵工业,2012,38(5):180-183.
[10]马瑞,欧阳嘉,李鑫,等.高效液相色谱法同时测定生物质乳酸发酵液中有机酸及糖类化合物[J].色谱,2012,30(1):62-66.
[11]曹雨莉,刘瑞芳,苏利红.应用高效液相色谱法测定青贮饲料中有机酸含量的研究[J].黑龙江畜牧兽医,2013(21):86-87.
The Change Rule of Organic Acids during the Degumming of Hemp Bast with the Strain of DCE01
FENG Xiangyuan,CHENG Lifeng,ZENG Jie,LIU Zhiyuan,YANG Qi,ZHENG Ke,WANG Ruijun,DUAN Shengwen*,PENG Yuande*
(Institute of Bast Fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410205,China)
To elucidate the mechanism of bio-degumming of hemp bast,the hemp bast was degummed with the strain of DCE01 for 10.5 h.After 0.5 h,the samples were analyzed by HPLC every 2 h.Themain resultswere as follow:Themain constituteswere oxalic acid,methanoic acid,malic acid,lactic acid,citric acid,acetic acid,succinic acid,propionic acid and some other unknown organic acids.The content of oxalic acid,methanoic acid,and succinic acid increased and then decreased,the resultswere 93.69%decreasement,65.37%increasement and 26.01%decreasement,respectively. The content of acetic acid increased firstly and then decreased,and subsequently increased firstly and then decreased again,and the resultswas 84.58%decreasement.The content of lactic acid and malic acid increased firstly and then decreased,subsequently increased again,the results were 52.03%increasement and 31.97%increasement,respectively.The content of citric acid increased steadily then reached themaximum,the resultwas 4.31%increasement.The content of propionic acid was not regular,and the resultwas 0.11%increasement.
S563.3
A
1671-3532(2017)04-0183-06
2017-05-23
中国农业科学院科技创新工程(ASTIP-IBFC08);国家麻类产业技术建设专项(No.CARS-19-E24);湖南省自然科学基金(No.2016 jj3126)
冯湘沅(1964-),女,高级实验师,主要从事农产品加工微生物研究。E-mail:fxysun@163.com
*通讯作者:彭源德(1965-),男,研究员,主要从事农产品加工微生物研究。E-mail:pengyuande@caas.cn;段盛文(1975-),男,副研究员,主要从事微生物资源与利用研究。E-mail:hunandsw@163.com
