血管内皮生长因子受体抑制剂用于晚期胃癌的系统评价Δ
2017-08-12林海珊
张 玥,刘 莲,林海珊,杨 凡,俞 静
(首都医科大学附属北京友谊医院肿瘤中心,北京 100050)
·本期特稿·
血管内皮生长因子受体抑制剂用于晚期胃癌的系统评价Δ
张 玥*,刘 莲,林海珊,杨 凡,俞 静#
(首都医科大学附属北京友谊医院肿瘤中心,北京 100050)
目的:系统评价血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)抑制剂在晚期胃癌治疗中的疗效及安全性。方法:检索PubMed、Cochrane Library、EMBase、ClinicalTrials.gov、万方数据库、中国知网、维普数据库等,查找含VEGFR抑制剂的治疗方案(试验组)与其他抗肿瘤药(对照组)治疗晚期胃癌的随机对照试验(randomized controlled trial,RCT),对符合标准的临床研究进行资料提取,应用 Stata 12.0软件进行文献荟萃(Meta)分析。其中,疗效的评价指标为总生存期、无进展生存期、疾病控制率、客观缓解率;安全性评价指标为Ⅲ级及以上不良反应发生情况。结果:最终入选8篇文献,共1 883例晚期胃癌患者。Meta分析结果显示,含VEGFR抑制剂组患者的总生存期(HR=0.74,P=0.035)和无进展生存期(HR=0.62,P=0.007)均较对照组明显延长,疾病控制率(RR=1.65,P<0.001)明显提高。不良反应方面,VEGFR抑制剂主要增加了患者蛋白尿(RR=4.43,P=0.043)、白细胞减少症(RR=2.29,P<0.001)和手足综合征(RR=7.70,P=0.005)的发生率。结论:VEGFR抑制剂可显著延长晚期胃癌患者的总生存期及无进展生存期,使患者有较大的生存获益,并可提高疾病控制率,但同时增加了蛋白尿、白细胞减少症和手足综合征的发生概率。
血管内皮生长因子受体抑制剂; 晚期胃癌; Meta分析
随着分子生物学的快速发展,以靶向治疗为主的新型治疗策略的出现为晚期胃癌患者的治疗提供了新的选择,其中抗肿瘤血管生成治疗是肿瘤治疗的重要进展之一。血管内皮生长因子(vascular endothelial growth factor receptor,VEGF)及其受体(vascular endothelial growth factor receptor,VEGFR)所激活的信号传导通路是促血管内皮细胞增殖和血管生成的重要通路,因而,该通路是抗肿瘤血管生成治疗中最重要的靶点[1-2]。目前,被批准用于胃癌领域的血管生成抑制剂主要有单克隆抗体和酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),前者包括雷莫芦单抗,后者主要有阿帕替尼、舒尼替尼等。近年来,已针对VEGFR抑制剂开展了多项相关随机对照试验(randomized controlled trial,RCT),其中REGARD试验[3]和RAINBOW试验[4]结果显示,含雷莫芦单抗的治疗方案能使晚期胃癌患者有生存获益;但另有研究结果表明,雷莫芦单抗联合FOLFOX(奥沙利铂+亚叶酸钙+氟尿嘧啶)一线治疗晚期胃癌,并不能使胃癌患者有生存获益[5]。阿帕替尼为针对VEGFR-2的小分子TKI,临床研究结果显示,其可延长二线治疗失败的晚期胃癌患者的生存期[6-7]。而另一种血管生成抑制剂——多靶点的小分子TKI舒尼替尼的相关临床研究却得出阴性结果[8-9]。目前,关于VEGFR抑制剂在晚期胃癌治疗中有效性及安全性的临床研究结果并不完全一致,且各临床研究对药品不良反应的报道也没有统一的结论,因此,本研究拟应用文献荟萃(Meta)分析方法系统评价VEGFR抑制剂在晚期胃癌患者治疗中的疗效与安全性。
1 资料与方法
1.1 文献检索策略
通过计算机检索PubMed、Cochrane Library、EMBase、ClinicalTrials.gov、万方数据库、知网数据库、维普数据库等,检索国内外发表的有关VEGFR抑制剂治疗晚期胃癌的RCT。主要检索词包括“血管内皮生长因子受体抑制剂”“vascular endothelial growth factor receptor inhibitors”“靶向治疗”“targeted therapy”“晚期胃癌”“advanced gastric cancer or AGC”“雷莫芦单抗”“Ramucirumab”“阿帕替尼”“Apatinib”“索拉非尼”“Sorafenib”“舒尼替尼”“Sunitinib”“阿西替尼”“Axitinib”“帕唑帕尼”“Pazopanib”。通过阅读文献题目排除重复文献,再通过文献摘要排除明显不相关的文献,剩余文献初步预览,最后根据纳入与排除标准纳入研究文献。
1.2 文献纳入与数据提取
1.2.1 纳入标准:有关VEGFR抑制剂治疗晚期胃癌的RCT,中英文不限。
1.2.2 排除标准:非RCT;主要观察指标不全或缺失的文献。
1.2.3 结局指标:(1)总生存期(overall survival,OS)及无进展生存期(progression-free survival,PFS),OS及PFS通过风险比(hazard ratio,HR)及其95%可信区间(confidence interval,CI)提取。(2)客观缓解率(objective response rate,ORR)及疾病控制率(disease control rate,DCR),ORR及DCR通过相对危险度(relative risk,RR)及其95%CI提取。ORR=[完全缓解(complete response,CR)病例数+部分缓解(partial response,PR)病例数]/总病例数×100%;DCR=[CR病例数+PR病例数+疾病稳定(stable disease,SD)病例数]/总病例数×100%。(3)Ⅲ级及以上不良反应(根据美国国立肿瘤研究院毒性分级标准3.0进行分级)发生率。
1.3 质量评估
采用Jadad质量计分法对纳入文献进行评价。(1)随机分组序列的产生方法:正确的随机分配方法为2分;试验提到随机但未交待具体方法为1分;半随机或准随机试验为0分;(2)双盲法:描述具体的双盲实施方法为2分;仅提及采用双盲法为1分;未使用或双盲方法不当为0分;(3)退出与失访:详细描述随访过程中失访或退出研究的人数、时间及原因为1分;无上述失访的相关记录为0分。总评分1~5分,3分以上为高质量研究,1~2分为低质量研究。
1.4 统计学方法
使用Stata 12.0软件对收集的数据进行Meta分析,采用HR及其95%CI作为OS及PFS的效应分析统计量,采用RR及其95%CI作为ORR、DCR、Ⅲ级及以上不良反应的效应分析统计量。对纳入文献的数据采用I2对异质性进行定量分析,I2<50%时,表明各研究见无统计学异质性,采用固定效应模型进行统计分析。I2>50%时,表明各研究间存在统计学异质性,首先分析产生异质性的原因,如果存在临床异质性则进一步进行亚组分析;如果经过处理后异质性仍无法消除,则采用随机效应模型进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 纳入研究的基本特征
经检索初步获得90篇文献,剔除45篇重复文献,剩余45篇通过阅读文献题目及摘要排除明显不相关的文献后,共对30篇文献进行全文阅读。排除非RCT、主要观察指标不全或缺失等文献,最终纳入8篇文献[3-10]、共18 853例患者。其中,2篇文献[5,10]中VEGFR抑制剂为一线治疗方案,6篇文献[3- 4,6-9]中为二线以上治疗方案;3篇文献[3,6-7]为VEGF抑制剂单药治疗晚期胃癌患者,5篇文献[4-5,8-10]为VEGFR抑制剂联合化疗治疗方案。所有纳入的研究均为RCT,6篇文献[3-4,6-7,9-10]提及随机分组;3篇文献[3,6-7]提及采用双盲法;6篇文献[3-4,6-8,10]报道了失访数及全部试验结果,并详细描述了纳入对象的基本信息、干预措施、主要结局指标及相关统计学方法。6篇文献为高质量研究[3-7,10],2篇文献[8-9]为低质量研究。文献筛选流程见图1;纳入文献的基本特征见表1。
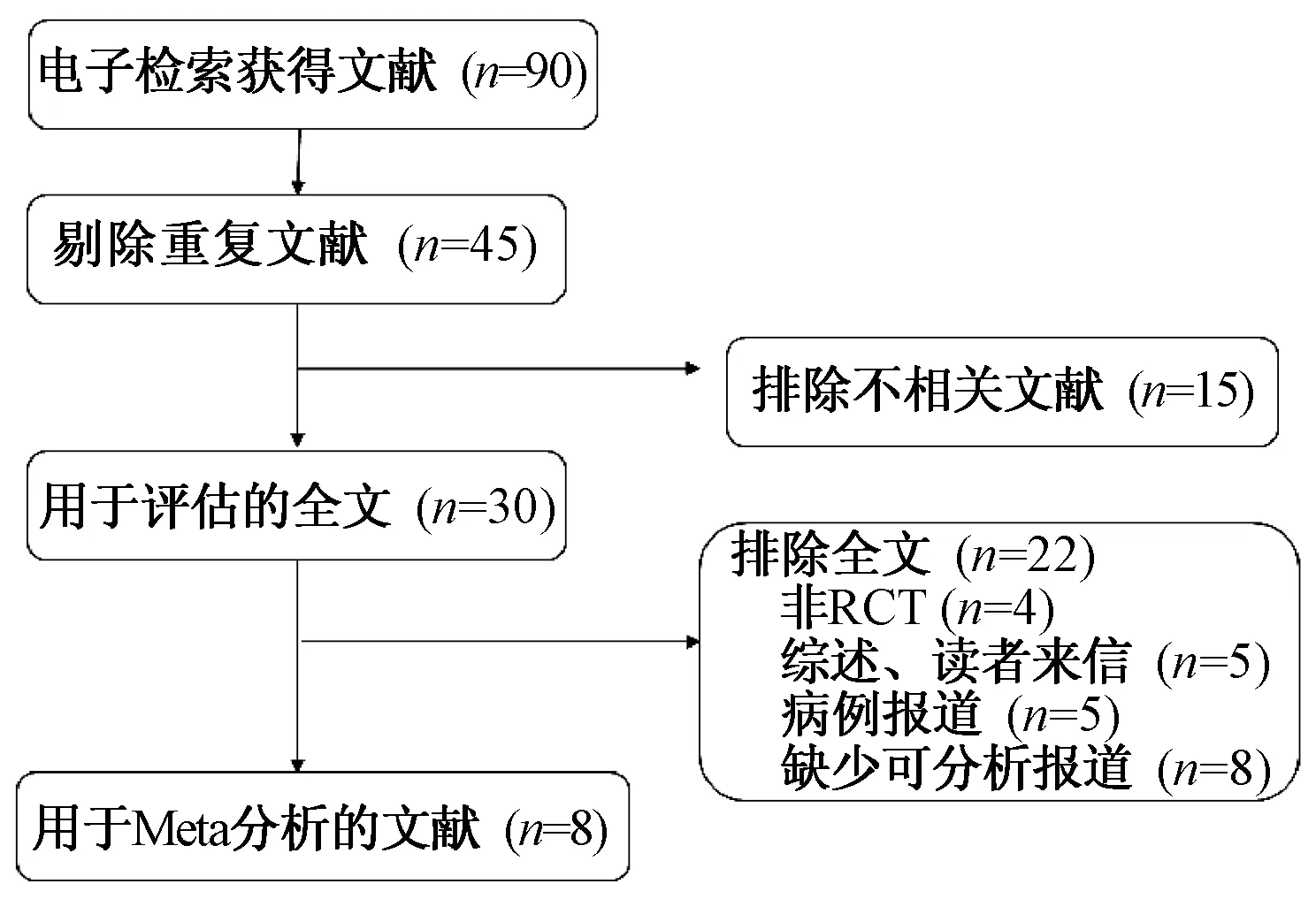
图1 文献筛选流程Fig 1 Literature screening process
2.2 Meta分析结果
2.2.1 OS及PFS:(1)8篇文献[3-10]均报道了OS,含VEGFR抑制剂治疗组患者的OS为4.27~16.6个月,对照组为3.8~15.45个月。异质性检验结果显示,各研究间存在统计学异质性(P<0.001,I2=85.2%),故采用随机效应模型进行Meta分析。结果显示,VEGFR抑制剂可明显延长晚期胃癌患者的OS(HR=0.74,95%CI=0.56~0.98,P=0.035),使其有生存获益,见图2(A)。(2)7篇文献[3-9]报道了PFS,1篇文献[10]报道的为TTP。异质性检验结果显示,各研究间存在统计学异质性(P<0.001,I2=88.9%),故采用随机效应模型进行Meta分析。结果显示,两组患者PFS的差异有统计学意义(HR=0.62,95%CI=0.43~0.85,P=0.007),VEGFR抑制剂可明显降低晚期胃癌患者的疾病进展风险,见图2(B)。
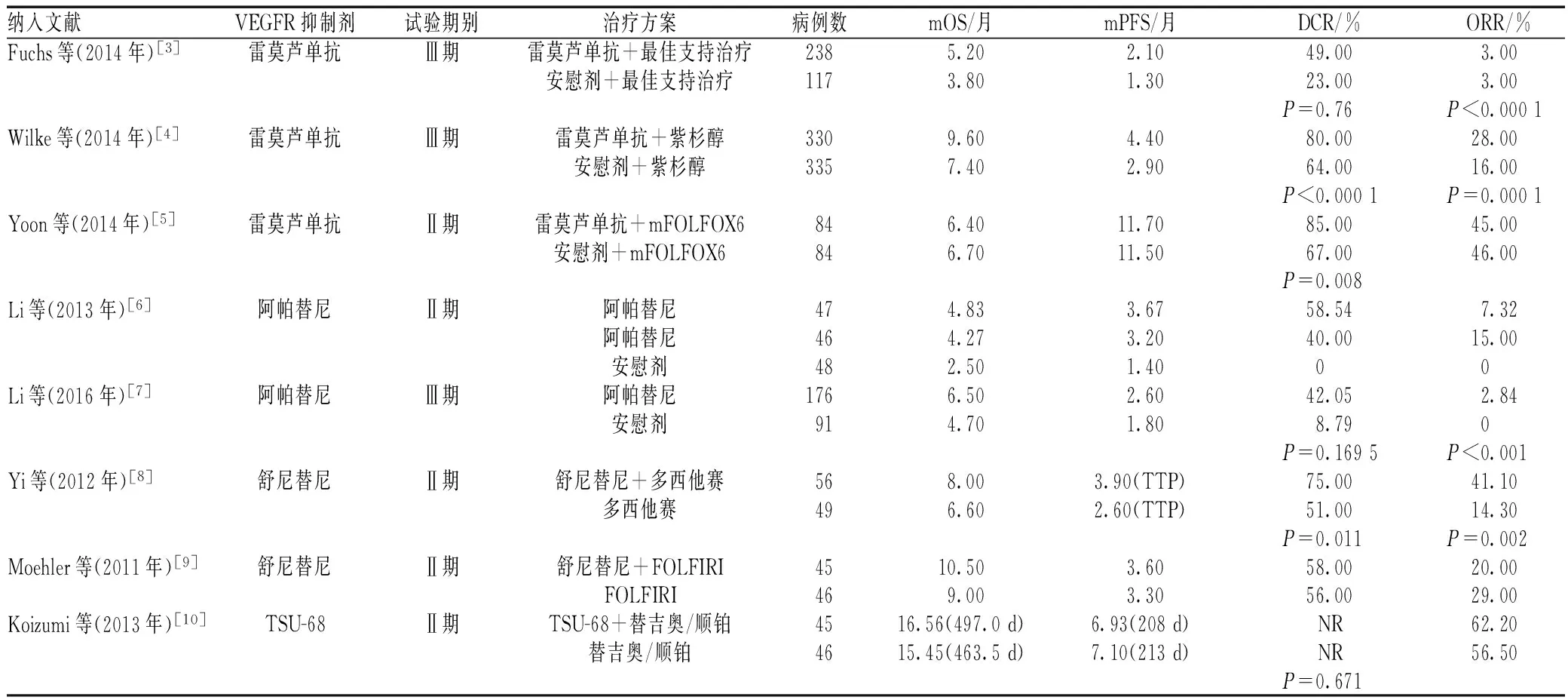
表1 纳入文献的基本特征
注:mOS为中位OS;mPFS为中位PFS;mFOLFOX6为简化FOLFOX6方案,用药为奥沙利铂+亚叶酸钙+氟尿嘧啶;TTP为疾病进展时间;FOLFIRI方案用药为伊立替康+氟尿嘧啶+亚叶酸钙;NR为未提及
Note:mOS means median OS; mPFS means median PFS; mFOLFOX6 means simplify FOLFOX6, medication are oxaliplatinum+folic acid calcium+fluorouracil; TTP means time to progression; FOLFIRI medication are irinotecan+fluorouracil+calcium folinate; NR means not mentioned
2.2.2 ORR及DCR:7篇文献[3-9]报道了ORR和DCR。(1)VEGFR抑制剂组患者的ORR为18%,对照组为15%。Meta分析 结果显示,两组患者ORR的差异无统计学意义(RR=1.45,95%CI=0.92~2.29,P=0.109),见图2(C)。(2)VEGFR抑制剂组患者的DCR为62%,对照组为47%。Meta分析结果显示,VEGFR抑制剂组患者的DCR明显高于对照组,差异有统计学意义(RR=1.65,95%CI=1.26~2.16,P<0.001),见图2(D)。
2.2.3 安全性:本研究仅对各文献报道的Ⅲ级及以上不良反应进行Meta分析,其中包括高血压、蛋白尿、白细胞减少症等。结果显示,与对照组比较,VEGFR抑制剂组患者蛋白尿(RR=4.43,95%CI=1.05~18.75,P=0.043)、白细胞减少症(RR=2.29,95%CI=1.54~3.40,P<0.001)及手足综合征(RR=7.70,95%CI=1.83~32.39,P=0.005)的发生率明显升高,差异均有统计学意义;两组患者高血压(RR=2.61,95%CI=0.65~10.50,P=0.178)、血小板减少症(RR=1.70,95%CI=0.91~3.19,P=0.098)、消化道反应(RR=0.99,95%CI=0.77~1.27,P=0.933)、贫血(RR=0.96,95%CI=0.51~1.80,P=0.891)等不良反应发生率的差异无统计学意义,见表2。
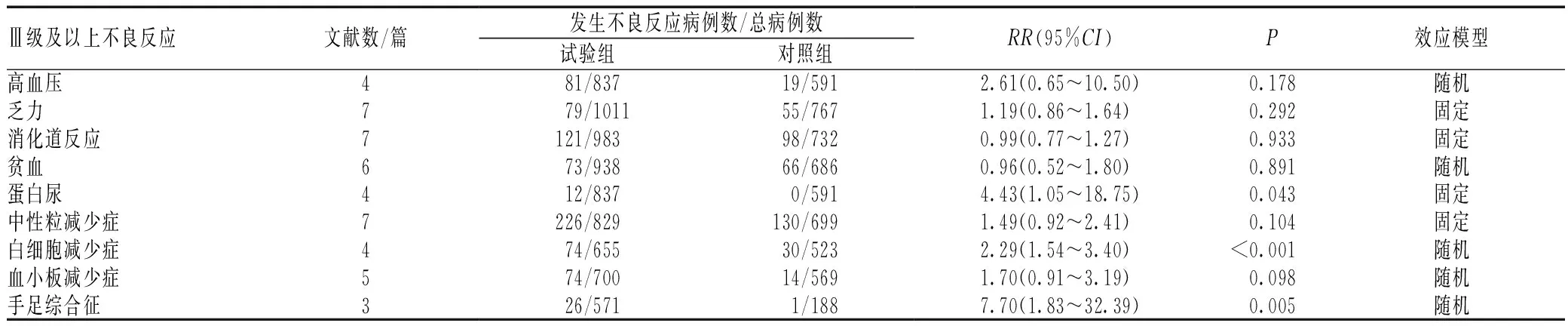
表2 两组患者Ⅲ级及以上不良反应发生率比较的Meta分析结果

A.OS;B.PFS;C.ORR;D.DCR图2 两组患者OS、PFS、ORR、DCR比较的Meta分析森林图Fig 2 Comparison of Meta-analysis forest of OS, PFS, ORR and DCR between two groups
2.3 发表偏倚
采取ORR指标相关数据绘制漏斗图。结果显示,各散点基本对称分布于中线两侧,提示本Meta分析的结果偏倚可能性较小,见图3。

图3 ORR的倒漏斗图Fig 3 Funnel plot of ORR
3 讨论
近年来,虽然胃癌的诊治取得了巨大的进展,但胃癌患者的预后仍很差,晚期胃癌患者的mOS仅为12个月。随着基因组技术的进展,抗血管生成药的研发在一定程度上弥补了传统化疗药的不足。VEGF与其受体结合后可调控血管内皮细胞的增殖、迁移,调控血管的新生。研究结果表明,VEGFR-2过表达与胃癌患者的不良预后呈正相关[2,11-12]。因此,VEGFR-2抑制剂是抗血管药的研究重点。雷莫芦单抗、阿帕替尼均可阻断VEGFR-2与VEGF的相互作用,阻断下游的信号转导通路及内皮细胞的迁移,最终阻断肿瘤新生血管的生成。目前,雷莫芦单抗已被批准用于治疗进展期胃癌患者,阿帕替尼被批准用于治疗2线及以上全身化疗失败后进展或复发的晚期胃癌患者。已有研究[13-14]对雷莫芦单抗在晚期胃癌中的疗效及安全性进行了系统评价,但其仅单独分析了雷莫芦单抗的疗效,对探究VEGFR抑制剂在治疗晚期胃癌中的临床价值较片面。因此,全面、系统地评估VEGFR抑制剂在晚期胃癌治疗中的整体疗效和安全性,对明确VEGFR抑制剂在晚期胃癌中的临床应用价值十分必要。
本研究对已正式发表的VEGFR抑制剂联合各种治疗方案治疗晚期胃癌的RCT进行了Meta分析。结果显示,VEGFR抑制剂能够明显延长晚期胃癌患者的PFS(HR=0.62,95%CI=0.43~0.85,P=0.007)和OS(HR=0.74,95%CI=0.56~0.98,P=0.035),使胃癌患者有生存获益;同时,可明显提高晚期胃癌患者的DCR(RR=1.65,95%CI=1.26~2.16,P<0.001),提示VEGFR抑制剂单独应用或与化疗药联合应用均能使晚期胃癌患者有临床获益。
关于VEGFR抑制剂使用中的安全性和耐受性问题,本研究对纳入文献所报道的不良反应进行了分析。结果显示,与对照组比较,VEGFR抑制剂组患者蛋白尿(RR=4.43,95%CI=1.05~18.75,P=0.043)、白细胞减少症(RR=2.29,95%CI=1.54~3.40,P<0.001)和手足综合征(RR=7.70,95%CI=1.83~32.39,P=0.005)的发生率均明显升高。手足综合征是VEGFR抑制剂常见的皮肤毒性反应,采取中西医相结合的治疗方法可以减轻药物造成的瘙痒、皮疹等症状[15]。相关研究报道,抗血管生成相关药物亦可增加蛋白尿的发生概率[16-17],本研究结果与既往报道结果相符。尿常规、尿蛋白定量等检查可及时发现蛋白尿,可通过减量、暂停用药、应用中成药等措施进行对症治疗。VEGFR抑制剂可引起白细胞减少症等血液系统不良反应,因此,在应用此类药物过程中需密切监测白细胞计数的变化,必要时可应用抗菌药物预防感染,同时暂停VEGFR抑制剂、给予集落刺激因子类药物等措施进行治疗[18]。
本研究纳入的文献总体质量较高,但存在一定的局限性:(1)本研究纳入的RCT样本量大小不一,且各研究中入组患者的基线情况及采取的治疗方案不同,这些在一定程度上降低了研究的准确性。(2)本研究纳入文献的异质性较大,在一定程度上影响了本研究结果的可信性。因此,希望今后能开展大样本、高质量的RCT,以进一步明确VEGFR抑制剂在胃癌治疗中的疗效和安全性。
综上所述,目前已发表的RCT研究结果证实,VEGFR抑制剂能够提升晚期胃癌患者对治疗的反应率,能够延长患者的PFS和OS,使患者有生存获益。但与对照组比较,VEGFR抑制剂增加了高血压、蛋白尿、白细胞减少症和手足综合征的发生概率,但未增加血小板减少症及腹泻、乏力、恶心呕吐等消化道反应的发生概率。 故在应用VEGFR抑制剂时,需注意手足综合征、蛋白尿等不良反应。
[1]Hanahan D,Weinberg RA.Hallmarks of cancer: the next generation[J].Cell,2011,144(5):646-674.
[2]Wu WK,Cho CH,Lee CW,et al.Dysregulation of cellular signaling in gastric cancer[J].Cancer Lett,2010,295(2):144-153.
[3]Fuchs CS,Tomasek J,Yong CJ,et al.Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(REGARD):an international,randomised,multice-ntre,placebo-controlled,phase 3 trial[J].Lancet,2014,383(9911):31-39.
[4]Wilke H,Muro K,Van CE,et al.Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(RAINBOW):a double-blind,randomised phase 3 trial[J].Lancet Oncol,2014,15(11):1224-1235.
[5]Yoon HH,Bendell JC,Braiteh FS,et al.Ramucirumab(RAM) plus FOLFOX as front-line therapy (Rx) for advanced gastric or esophageal adenocarcinoma(GE-AC): Randomized, double-blind, multicenter phase 2 trial[EB/OL].https://www.researchgate.net/publication/284692117_Ramucirumab_RAM_plus_FOLFOX_as_front-line_therapy_Rx_for_advanced_gastric_or_esophageal_adenocarcinoma_GE-AC_Randomized_double-blind_multicenter_phase_2_trial.
[6]Li J,Qin S,Xu J,et al.Apatinib for chemotherapy-refractory adva-nced metastatic gastric cancer: results from a randomized,placebocontr-olled,parallel-arm,phase Ⅱ trial[J].Clin Oncol,2013,31(26):3219-3225.
[7]Li J,Qin S,Xu J,et al.Randomized,Double-Blind,Placebo-Contr-olled Phase Ⅲ Trial of Apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroe-sophageal Junction[J].J Clin Oncol,2016,34(13):1448-1454.
[8]Yi JH,Lee J,Park SH,et al.Randomised phase Ⅱ trial of docetaxel and sunitinib in patients with metastatic gastric cancer who were previously treated with fluoropyrimidine and platinum[J].Br J Cancer,2012,106(9):1469-1474.
[9]Moehler M,Mueller A,Hartmann JT,et al.An open-label,multicentre biomarker-oriented AIO phase Ⅱ trial of sunitinib for patients with chemo-refractory advanced gastric cancer[J].Eur J Cancer,2011,47(10):1511-1520.
[10] Koizumi W,Yamaguchi K,Hosaka H,et al.Randomised phase Ⅱ study of S-1/cisplatin plus TSU-68 vs S-1/cisplatin in patients with advanced gastric cancer[J].Br J Cancer,2013,109(8):2079-2086.
[11] Kim SE,Shim KN,Jung SA,et al.The clinicopathological significance of tissue levels of hypoxia-inducible factor-1alpha and vascular endothelial growth factor in gastric cancer[J].Gut Liver,2009,3(2):88-94.
[12] Abdel-Rahman O.Targeting vascular endothelial growth factor(VEGF)pathway in gastric cancer: preclinical and clinical aspects[J].Crit Rev Oncol Hematol,2015,93(1):18-27.
[13] 杨婷,王国俊,冯碧敏,等.雷莫芦单抗治疗胃或胃食管结合部腺癌疗效与安全性的Meta分析[J].中国药房,2016,27(6):789-792.
[14] 陈川,刘明月,夏太玉,等.含雷莫卢单抗方案治疗晚期实体瘤安全性的Meta分析[J].中国新药与临床杂志,2016,35(1):64-70.
[15] 吴军,王婧,曹邦伟.抗肿瘤血管生成药物不良反应的发生机制及处理[J].医学综述,2016,22(16):3154-3157.
[16] Zhu X,Wu S,Dahut WL,et al.Risks of proteinuria and hypertension with bevacizumab, an antibody against vascular endothelial growth factor: systematic review and meta-analysis[J].Am J Kidney Dis,2007,49(2):186-193.
[17] Kappers MH,Smedts FM,Horn T,et al.The vascular endothelial growth factor receptor inhibitor sunitinib causes a preeclampsia-like syndrome with activation of the endothelin system[J].Hypertension,2011,58(2):295-302.
[18] 蔡林,张崔建,李学松,等.舒尼替尼治疗转移性肾细胞癌的疗效和不良反应及其相关性分析[J].中华泌尿外科杂志,2014,35(6):425-428.
Meta-analysis on Vascular Endothelial Growth Factor Receptor Inhibitor in Advanced Gastric CancerΔ
ZHANG Yue, LIU Lian, LIN Haishan, YANG Fan, YU Jing
(Cancer Center, Beijing Friendship Hospital,Capital Medical University,Beijing 100050, China)
OBJECTIVE: To systematically review the efficacy and safety of vascular endothelial growth factor receptor inhibitor (VEGFR) in advanced gastric cancer. METHODS: Randomized controlled trials (RCTs) in treatment of advanced gastric cancer in treatment regimen consist of VEGFR inhibitor (experimental group) and other antitumor drugs(control group) were retrieved from PubMed, Cochrane Library, EMBase, ClinicalTrials.gov, Wanfang, CNKI and VIP database, clinical research accordance with the criteria were extracted, Stata 12.0 was adopted to conducted the Meta-analysis. Meanwhile, the evaluation indicators of efficacy were respectively overall survival, progression free survival, disease control rate and objective remission rate; while the evaluation indicators of safety were incidences of adverse drug reactions of third-level or above. RESULTS: Totally 8 literatures were involved, including 1 883 cases of advanced gastric cancer. According to Meta-analysis, the overall survival and progression free survival of VEGFR inhibitor were respectively (HR=0.74,P=0.035) and (HR=0.62,P=0.007), significantly longer than those of control group, the disease control rate increased significantly (RR=1.65,P<0.001). In term of adverse drug reactions, VEGFR inhibitor mainly increased the incidence of proteinuria (RR=4.43,P=0.043), leukopenia (RR=2.29,P<0.001) and hand-foot syndrome (RR=7.70,P=0.005). CONCLUSIONS: VEGFR inhibitor can effectively prolong the overall survival, progression free survival, which can make patients get larger survival benefits, and increase the disease control rate, yet also increase the incidence of proteinuria, leukopenia and hand-foot syndrome.
VEGFR inhibitors; Advanced gastric cancer; Meta analysis
国家自然科学基金(No.81101737);北京市“215”高层次卫生人才资助项目(No.2014-3-004)
R979.1
A
1672-2124(2017)07-0865-05
2017-04-05)
*硕士研究生。研究方向:恶性肿瘤的综合治疗。E-mail:zyoynn@163.com
#通信作者:副主任医师,硕士生导师。研究方向:恶性肿瘤的综合治疗。E-mail:yujing026@ccmu.edu.cn
DOI 10.14009/j.issn.1672-2124.2017.07.001
