血管生成素1对大鼠血-脊髓屏障功能的增强作用
2017-08-11徐婉茹
徐婉茹
血管生成素1对大鼠血-脊髓屏障功能的增强作用
徐婉茹
目的:探讨血管生成素1(Ang1)对大鼠血-脊髓屏障功能的增强作用,及表皮生长因子受体通路底物8(Eps8)在此增强过程的作用。方法:分离、培养大鼠脊髓微血管内皮细胞(SCMEC),建立体外血-脊髓屏障模型。以Ang 1处理的SCMEC为Ang1处理组,未处理的为对照组。于Ang1处理后于不同时间点(0 h、4 h、8 h、12 h)测定各组跨内皮电阻(TEER)值,比较2组Eps8蛋白的表达水平。再将SCMEC分为对照siRNA组、对照siRNA+Ang1组、Eps8 siRNA组及Eps8 siRNA+Angl组,分别给予siRNA干扰Eps8表达及Ang 1处理,比较不同组间Eps8蛋白的表达水平与TEER值。结果:Ang1处理组4 h、8 h、12 h SCMEC的TEER值均明显高于对照组(P<0.05),Eps8蛋白的表达水平均高于对照组(P<0.05)。Eps8 siRNA组SCMEC中Eps8蛋白的表达水平明显低于对照siRNA组(P<0.05),而与Eps8 siRNA+Ang1组间差异无统计学意义(P>0.05);Eps8 siRNA组不同时间点TEER值均明显低于对照siRNA组(P<0.05);Eps8 siRNA+Ang1组与Eps8 siRNA组间TEER值差异无统计学意义(P>0.05)。结论:Ang1可增强大鼠血-脊髓屏障的功能,其机制可能与Eps8有关。
表皮生长因子受体通路底物8;血管生成素1;血-脊髓屏障功能;大鼠
血-脊髓屏障是血-脑屏障的延伸,主要由微血管内皮细胞间及星形胶质细胞构成,能有效阻止细胞旁路的物质交换,维持中枢神经系统内环境稳定。血-脊髓屏障功能的异常可导致多种脊髓病变[1]。内皮细胞间连接蛋白及细胞骨架表达量、分布等均可增高内皮细胞的通透性,进而引发相关疾病[2]。血管生成素1(Angiopoietin,Ang1)是1种血管生成因子,可在多种条件下诱导新血管生成。Ang1在血-脊髓屏障中,可与相关受体结合,以维持屏障完整性的稳定[3]。表皮生长因子受体通路底物8(EGF receptor pathway substrate 8,Eps8)与血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)结合后,可使细胞的DNA合成和癌化能力增加。Eps8在多种实体肿瘤中异常高表达,并通过各种通路调节促使肿瘤细胞生长和迁移,被认为是肿瘤预后不良的指标之一[4]。本研究以大鼠脊髓微血管内皮细胞(spinal cord microvascularendothelial cell,SCMEC)为研究对象,建立体外血-脊髓屏障模型,以探讨Ang1对血-脊髓屏障的通透性的影响及Eps8在此过程中可能发挥的作用。
1 材料与方法
1.1 实验动物与主要试剂设备
成年SD大鼠80只,体质量275~300 g,由中国医科大学实验动物部提供,动物合格证书编号为SCXK(辽)2008-0005。DMEM/F12培养基购于美国Sigma公司,碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、Angl、血管内皮生长因子(vascular endothelial growth factor,VEGF)购于美国Peprotech公司;山羊抗大鼠β-actin抗体、牛抗山羊IgG购于美国Santa Cruz公司;DC蛋白定量试剂盒购于美国Bio-Rad公司;小鼠抗Eps8抗体购于美国BD公司;化学发光试剂盒购于美国Pierce公司。Millicell ERS-2细胞电阻仪、细胞培养皿购于美国Millicell公司;5417-R台式低温离心机购于德国Eppendorf公司;CO2细胞培养箱购于美国Thermo Scientific公司;VS-1300U超净工作台购于浙江苏净净化设备有限公司;BX51荧光显微镜购于日本Olympus公司。
1.2 方法
1.2.1 大鼠SCMEC的分离培养与鉴定 成年SD大鼠CO2窒息处死后手术分离椎管,分离脊髓组织,去除脑脊膜及大血管。冷DMEM/F12培养液中将组织剪碎至1 mm3左右,冰上匀浆,置于37℃Ⅱ型胶原酶中消化0.5 h。低速离心5 min,22%BSA重悬组织沉淀,再次离心后弃留下层血管组织,并用DMEM/F12培养液清洗。用无菌滤器过滤,以收集微血管组分。置于37℃、0.1%胶原酶及脂肪酶中消化30 min,待内皮细胞呈串珠样时低速离心5 min后终止消化。SCMEC培养液(成分包括DMEM/F12、10%胎牛血清、1 mg/mL肝素、3µmol/L嘌呤霉素、2 mmol/L谷氨酸钠、10%马血清、10 ng/mL VEGF、1 ng/mLbFGF、50 mg/mL庆大霉素),微血管组分接种于纤连蛋白及预铺Ⅳ型胶原的培养平板。培养6 d后采用免疫荧光法观察因子Ⅷ表达,待SCMEC培养纯度在95%以上时进行后续试验。
1.25g/L胰酶消化SCMEC,按不同密度分别传代:1:1接种于6孔培养板用于蛋白样品制备以进行Western blotting检测;1:1接种于Millicell插入式细胞培养皿,建立体外血-脊髓屏障模型,用于跨内皮电阻(TEER)值及通透性检测;1:5接种于盖玻片用于纤维型肌动蛋白(F-actin)荧光染色。
1.2.2 Ang1处理培养SCMEC 于培养的第7天用含100 ng/mL Ang1的培养液处理SCMEC12 h,设置为Angl处理组,于不同时间点(0、4、8、12 h)测定处理后TEER值的变化;其余未用Ang1处理者设置为对照组。
1.2.3 TEER值测定 在Angl处理后不同时间(每个时间点设置3个平行孔),于培养内室及外室连接细胞电阻仪(Millicell ERS-2)的正负电极,记录待测孔电阻值(Ru),并计算各组TEER值,其中未接种细胞空白孔电阻值、培养面积分别计为Rc、S。
1.2.4 Western blot检测 分别收集Angl处理组及对照组各时间点SCMEC,NP-40裂解液处理后提取总蛋白,蛋白浓度用BCA定量法测定后制备样品。SDSPAGE电泳上样量30µg,分离蛋白成分,转印至PVDF膜、封闭,依次经小鼠抗Eps8抗体(1:1000)、HRP标记的牛抗小鼠IgG(1:3000)孵育后进行ECL显色(β-actin为内参);将0 h时刻样品Eps8与β-actin灰度值比值设定为1。
1.2.5 siRNA转染 靶向大鼠Eps8的siRNA(5’-TTCGTGCCAAATAACATTCTGGATA-3’)及对照siRNA(5’-TTCTTCTCCGAACGTGTCACGTCCA-3’)均由上海吉凯基因化学技术有限公司设计并合成。于SCMEC培养第4天时进行siRNA转染:在Opti-MEM培养液中混匀siRNA及Lipofectamine 2000转染试剂,以终浓度100 nmol/L转染,12 h后更换为正常培养液;继续培养至第7天时对部分细胞进行Ang1(100 ng/mL)处理,分为对照siRNA组、对照siRNA+Ang1组、Eps8 siRNA组及Eps8 siRNA+Ang1组。处理4 h后收集细胞,Westem blotting检测Eps8蛋白的表达水平及TEER值。
1.3 统计学处理
2 结果
2.1 SCMECs的形态学鉴定
培养的第1天,微血管片段呈串珠状或分支状,见图1A;2 d后SCMECs从微血管片段中爬出,细胞呈梭形单层贴壁生长,见图1B;第5天起细胞数量明显增多,呈“鹅卵石”状,见图1C;第7天起细胞汇合紧密,呈“漩涡状”,见图1D。因子Ⅷ相关抗原免疫荧光染色验证所培养细胞为SCMECs,见图1E。
2.2 Ang1处理后SCMEC屏障模型功能的变化
Ang1处理组4 h、8 h、12 h SCMEC的TEER值均明显高于对照组,差异有统计学意义(P<0.05),见表1。
2.3 Angl处理后Eps8表达水平的变化
Angl处理组4 h、8 h、12 h SCMEC的Eps8蛋白的表达水平均高于对照组,差异有统计学意义(P<0.05),见表2,图2。
2.4 Eps8沉默对Ang1增强SCMEC屏障模型功能作用的影响
Eps8沉默处理后,各组SCMEC中Eps8蛋白的表达存在显著性差异(P<0.05);Eps8 siRNA组Eps8蛋白的表达水平明显低于对照siRNA组(P<0.05),而与Eps8 siRNA+Ang1组间差异无统计学意义(P>0.05);对照siRNA+Ang1组SCMEC中Eps8蛋白的表达水平明显高于其他各组(P<0.05),见表3。各组F-actin荧光染色结果见图4。
2.5 Eps8沉默对TEER测定结果的影响
Eps8沉默处理后,各组间TEER值存在显著性差异(P<0.05);Eps8 siRNA组不同时间点TEER值均明显低于对照siRNA组(P<0.05);Eps8表达减少后,TEER值对Ang1丧失敏感性,Eps8 siRNA+Ang1组与Eps8 siRNA组间TEER值差异无统计学意义(P>0.05),见表4。
3 讨论

图2 对照组与Ang1处理组不同时间点Eps8蛋白免疫印迹条带
表1 Ang1处理后SCMEC的TEER值比较(Ω·cm2,±s)
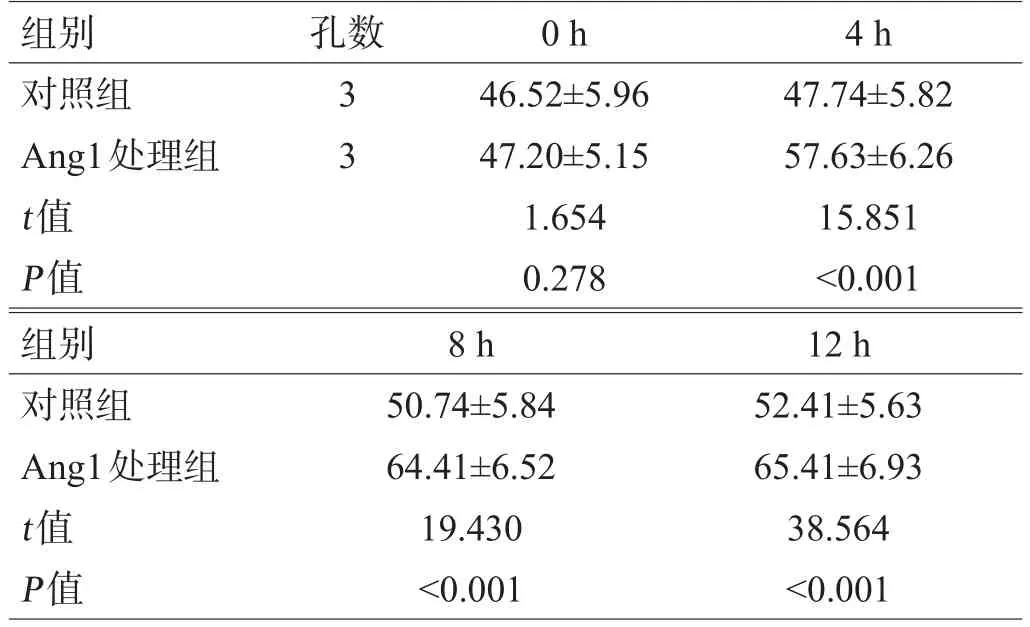
表1 Ang1处理后SCMEC的TEER值比较(Ω·cm2,±s)
组别对照组Ang1处理组t值P值孔数33 0 h 46.52±5.96 47.20±5.15 1.654 0.278 4 h 47.74±5.82 57.63±6.26 15.851<0.001组别对照组Ang1处理组t值P值8 h 50.74±5.84 64.41±6.52 19.430<0.001 12 h 52.41±5.63 65.41±6.93 38.564<0.001
表2 Angl处理后Eps8表达水平的变化(±s)

表2 Angl处理后Eps8表达水平的变化(±s)
组别对照组Ang1处理组t值P值孔数33 0 h 1.00±0.00 1.04±0.35 0.263 0.634 4 h 1.32±0.41 1.93±0.86 13.620<0.001组别对照组Ang1处理组t值P值8 h 1.42±0.64 1.91±0.92 15.513<0.001 12 h 1.46±0.63 2.90±1.01 29.120<0.001
表3 Eps8沉默后各组Eps8蛋白表达量比较(±s)

表3 Eps8沉默后各组Eps8蛋白表达量比较(±s)
组别对照siRNA组对照siRNA+Ang1组Eps8 siRNA组Eps8 siRNA+Ang1组F值P值孔数15 15 15 15相对灰度值1.00±0.00 2.01±0.24 0.26±0.05 0.28±0.08 29.120<0.001
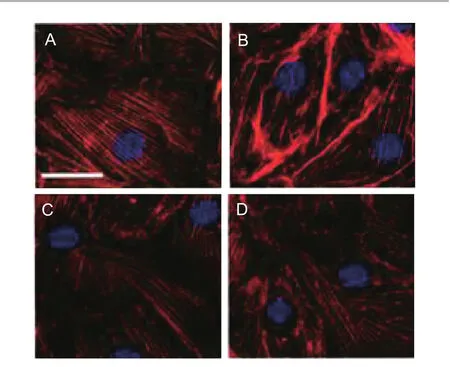
图4 各组F-actin荧光染色结果
表4 Eps8沉默对TEER各组的影响(Ω·cm2,±s)

表4 Eps8沉默对TEER各组的影响(Ω·cm2,±s)
组别 孔数0 h 4 h对照siRNA组对照siRNA+Ang1组Eps8 siRNA组Eps8 siRNA+Ang1组F值P值15 15 15 15 27.96±3.20 28.03±3.35 21.84±2.84 21.96±2.93 5.002 0.024 35.63±4.21 46.61±5.20 25.41±3.28 27.14±3.19 15.521<0.001组别对照siRNA组对照siRNA+Ang1组Eps8 siRNA组Eps8 siRNA+Ang1组F值P值8 h 41.65±5.17 50.30±5.82 33.20±4.01 34.08±4.15 21.249<0.001 12 h 42.10±5.09 49.74±5.42 32.85±3.41 33.10±3.20 18.413<0.001
近年来人们已经成功建立了模拟血-脊髓屏障的体外模型。本研究通过对培养成熟SD大鼠脊髓微血管进行分离,并消化培养SCMEC,并于双室培养系统中共培养将SCMEC和胶质细胞,通过测定TEER值反映内皮屏障功能,验证了Ang1对血-脊髓屏障功能的影响。
Ang1基因位于染色体8q22,主要在周细胞及血管平滑肌细胞可见,在维持血管稳定、血管发生及分支形成中发挥着重要的作用。转基因研究证实,血管增生变粗的转基因动物Ang1呈过度表达,且内皮细胞与周细胞的连接完整;而小鼠在出现Ang1基因缺失后会出现血管通透性增高且无法连续形成血管网[5-7]。由此推断Ang1在维持血管稳定性方面具有重要作用。此外,Ang1可通过将磷脂酰肌醇激酶(PI3K)激活,使柱蛋白磷酸化,使内皮-基质间的相互作用增强,从而维持血管结构的完整性[8]。另有研究发现,Ang1可限制小分子物质通透,从而参与维持了血-脑屏障的功能完整[9]。本研究结果显示,Ang1处理组4 h、8 h、12h SCMEC的TEER值均明显高于对照组有显著升高(P<0.05)。提示Ang1处理后,血-脊髓屏障功能明显增强。
在血-脑屏障或血-脊髓屏障的构成中,细胞间连接结构及相应的细胞骨架网络在屏障结构和功能的完整性具有重要作用。其中F-actin参与形成了多种类型的骨架结构,依赖于与之结合的各种调节蛋白(actin binding proteins,ABPs),从多方面影响着内皮的屏障功能[10,11]。Eps8是一种已知的促进F-actin成束的ABP。在关于大鼠血-睾屏障的研究中发现,Eps8参与维持了睾丸支持细胞上皮屏障的完整性,并对生精细胞与支持细胞间的粘附发挥着调节作用[12]。本研究通过应用Ang1处理SCMEC后,Ang1处理组4 h、8 h、12 h SCMEC的Eps8蛋白的表达水平均高于对照组(P<0.05)。
进一步的F-actin荧光染色显示,对照siRNA+Angl组SCMEC中F-actin在细胞接触及连接处的分布明显强于对照siRNA组明显增强,Eps8siRNA+Angl组与Eps8siRNA组则无显著差别。提示Ang1有可能通过影响Eps8的表达而改变F-actin在SCMEC连接处的分布,进而影响血-脊髓屏障功能。为了进一步加以验证,在随后的实验中,使用siRNA对SCMEC中Eps8的表达进行了干扰,再次使用Ang1处理,结果显示ps8 siRNA组SCMEC中Eps8蛋白的表达水平明显低于对照siRNA组(P<0.05),而与Eps8 siRNA+Ang1组间并无显著性差异;此外,Eps8 siRNA组不同时间点TEER值均明显低于对照siRNA组(P<0.05);Eps8 siRNA+ Ang1组与Eps8 siRNA组间TEER值无显著性差异。说明Eps8的水平升高是Ang1增强血-脊髓屏障功能的必要因素。
综上所述,Ang1可通过影响SCMEC中Eps8的表达水平改变连接蛋白在大鼠血-脊髓屏障内皮细胞连接处的分布,从而影响血-脊髓屏障的通透性及屏障功能。但关于Eps8表达增高的具体发生机制及Eps8沉默在SCMEC中所引起的其他与血-脊髓屏障功能相关的分子变化仍需进一步的研究加以阐明。
[1]张秋佳,杨锦珊,刘阳,等.MRS2179对大鼠缺血性脑卒中后MMP-9表达及血脑屏障通透性的影响[J].神经损伤与功能重建,2014,9:369-372.
[2]Abbott NJ,Patabendige AA,Dolman DE,et al.Structure and function of the blood-brainbarrier[J].Neurobiol Dis,2010,37:13-25.
[3]王磊.PI3K/Akt抑制剂和传统化疗药物对急性髓系白血病中Eps8的作用及分子机制研究[D].南方医科大学,2013.
[4]甘金莹,李玉华.EPS8与肿瘤关系的研究进展[J].中国免疫学杂志, 2013,41:439-442,448.
[5]Zhang J,Fukuhara S,Sako K,et al.Angiopoietin-1/Tie2 signal augments basal Notch signal controlling vascular quiescence by inducing deltalike 4 expression through AKT-mediated activation of beta-catenin[J].J Biol Chem,2011,286:8055-8066..
[6]甘金莹,熊文艳,王磊,等.柔红霉素对KG1a细胞增殖及肿瘤相关抗原Eps8表达的影响[J].中国实验血液学杂志,2013,39:49-52.
[7]孙婧,金卢阳,王慧莹,等.Eps8与恶性肿瘤增殖、转移和预后的相关研究进展[J].中国实验血液学杂志,2013,39:493-497.
[8]Watson PM,Paterson JC,Thom G,et al.Modelling the endothelial blood-CNS barriers:a method for the production of robust in vitro modes of the rat blood-brain barrier and blood-spinal cord barrier[J].BMC Neuroscience,2013,14:59-66.
[9]李新鑫,陈成,王芳妹,等.miR-124和miR-520b下调Eps8表达并抑制HeLa细胞增殖[J].中国生物化学与分子生物学报,2013,38:1145-1152.
[10]王丹.Rnd3与Eps8蛋白在子宫腺肌病中的表达及意义[D].四川医科大学,2015.
[11]熊文艳,陆志刚,涂三芳,等.Eps8在恶性血液肿瘤细胞株中的表达分析[J].山东医药,2011,35:9-11.
[12]李倩,吴丹,鲍伟,等.宫颈鳞癌中Eps8、E-cadherin和Vimentin的表达及其意义[J].现代妇产科进展,2015,24:646-650.
(本文编辑:唐颖馨)
Effect of Erythropoietin1 on the Function of Blood Spinal Cord Barrier in Rats
XU Wan-ru.
Department of Neurology,Heze city hospital,Shandong 274000,China
Objective:To investigate the effect of Angiopoietin 1(Ang1)on the function of blood spinal cord barrier(BSB)in rats.Methods:Spinal cord microvessel endothelial cells(SCMECs)of rats were separated and cultured to build the three-dimensional external blood spinal cord barrier model.SCMECs in Ang 1 group were treated with Ang 1 and those in control group were not treated with Ang 1.And then,SCMECs were divided into control siRNA group,control siRNA+Ang group 1,Eps8 siRNA group and Eps8 siRNA+Angl group,in which siRNA was added to interfere Eps8 expression and/or Ang 1 treatment.The transepithelial electrical resistance (TEER)values and the expression of EGF receptor pathway substrate 8(Eps8)were detected at 0,4,8 and 12 h after treatment.Results:The TEER values and the Eps8 expression of Ang1 group at 4 h,8 h and 12 h were significantly higher than those in the control group(P<0.05).The Eps8 expression in the Eps8 siRNA group was significantly lower than that in the control siRNA group(P<0.05).The TEER values of siRNA group at 4 h,8 h and 12 h were significantly lower than those in the control siRNA group(P<0.05).Conclusion:Ang1 has an effect on the permeability and barrier function of BSB.Eps8 maybe plays an important role in it.
EGF receptor pathway substrate 8;Angiopoietin 1;blood spinal cord barrier function;rat
R741;R741.02
ADOI10.16780/j.cnki.sjssgncj.2017.04.003
菏泽市立医院神经内 山东 菏泽 274000
2016-12-15
徐婉茹490983190@qq. com
