可溶性环氧化物水解酶抑制剂TPPU对大鼠局灶脑缺血后血脑屏障的保护作用
2017-08-11胡晓静张贵斌谢敏杰
胡晓静,张贵斌,谢敏杰
可溶性环氧化物水解酶抑制剂TPPU对大鼠局灶脑缺血后血脑屏障的保护作用
胡晓静1,张贵斌1,谢敏杰2
目的:研究可溶性表氧化物水解酶抑制剂(sEHi)TPPU对脑缺血/再灌注损伤所致血脑屏障(BBB)破坏的作用。方法:线栓法建立大鼠大脑中动脉缺血(MCAO)模型;45只大鼠随机分为3组,假手术组、模型组(制作MCAO模型)、TPPU组(于MCAO术前24 h、缺血再灌注后0、24及48 h经大鼠尾静脉注射TPPU),各15只。Garcia评分法评估神经功能缺损及恢复情况;TTC法检测大鼠脑梗死体积;干湿重法评估脑水肿程度;伊文氏蓝(EB)法检测BBB通透性;免疫荧光染色、western blot等方法检测BBB相关蛋白含量的变化。结果:与模型组比较,TPPU能够改善大鼠脑梗死后神经功能缺损症状(P<0.01),减小脑皮质梗死体积,减少EB向脑组织渗漏,减轻血管性脑水肿,减轻MCAO后BBB紧密连接蛋白的丢失(均P<0.05)。结论:TPPU能够保护MCAO大鼠BBB完整性,减轻脑水肿,减小脑梗死体积,减轻神经功能缺损症状。
TPPU;血脑屏障;紧密连接蛋白;脑缺血
缺血性脑卒中常伴随血脑屏障(bloodbrain barrier,BBB)的开放或破坏,进一步加重脑组织的损伤[1]。表氧化二十碳三烯酸(epoxyeicosatrienoic acids,EETs)是一类具有生物活性的内源性小分子物质[2-4],具有保护血管内皮细胞、星形胶质细胞和神经元、促进皮质神经元轴突生长、血管平滑肌迁移、抗血管炎症损伤等作用[5,6]。EETs在体内产生后会迅速被表氧化物水解酶(soluble epoxidehydrolase,sEH)水解为无生物活性的二氢二十碳三烯酸(DHETs)[7]。抑制sEH的功能可间接提高体内EETs含量。本实验通过sEH抑制剂1-三氟甲氧基苯基-3-(1-丙酰基哌啶-4-基)脲(1-trifluoromethoxyphenyl-3-(1-propionylpiperidin-4-yl)urea,TPPU)对脑缺血模型大鼠进行干预,探讨EETs对缺血性脑卒中BBB是否具有保护作用。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 健康成年SPF级SD大鼠45只,雄性,体质量(250±10)g,随机分为:假手术组、模型组、TPPU组各15只。
1.1.2 主要试剂 2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)、伊文思蓝购自美国sigma公司;兔抗ZO-1多克隆抗体(61-7300)、兔抗Occludin多克隆抗体(71-1500)、小鼠抗Claudin-5(4C3C2)(35-2500)购自美国Invitrogen公司;FITC标记山羊抗小鼠IgG、Cy3标记驴抗兔IgG、HRP羊抗兔IgG、HRP羊抗小鼠IgG购自美国Jackson ImmunoResearch公司;小鼠抗β-actin多克隆抗体、BCA蛋白定量试剂盒、western凝胶试剂盒、ECL超敏发光液购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 模型制备 模型组及TPPU组采用常规线栓法制作大鼠大脑中动脉缺血(middle cerebral artery occlusion,MCAO)模型。线栓包被端直径(0.38±0.02)mm,进线深度(20±2)mm;阻断血流1 h后拔出线栓实现再灌注。入组标准:激光多普勒血流仪检测,进栓后血流下降至基线值的10%~20%,拔去线栓后血流恢复至基线值,且动物清醒后Longa评分1~2分。剔除标准:评分0分、3分、4分;手术时间过长;出血较多;发生蛛网膜下腔出血。
1.2.2 药物干预 TPPU组于术前24 h、缺血再灌注后0、24及48 h经大鼠尾静脉注射TPPU(1.0 mg/kg)。其它2组注射等剂量溶剂。
1.2.3 神经行为学评分 双人双盲,于术前及再灌注后0、24、48及72 h采用Garcia18分制评分法,进行行为学评分。
1.2.4 脑梗死体积测定 大鼠再灌注24 h后,采用TTC染色法测定脑梗死体积。各层面梗死面积(S)=(健侧正常面积-患侧正常面积)/健侧正常面积×100%;梗死体积=1/2(S1+S2)+1/2(S2+S3)+…+1/2(Sn-1+Sn);结果以百分数表示。
1.2.5 血脑屏障通透性评估 大鼠再灌注22 h后尾静脉注射2%伊文思蓝(Evans blue,EB)(4 mL/kg),循环2 h后取脑,常规配制已知浓度梯度EB溶液,测定620 nm处OD值,制定标准曲线,通过线性回归方程计算各样品EB含量。
1.2.6 脑水肿测定 再灌注48 h后,断头取脑,采用干湿重法测定脑含水量(110℃恒温烤箱内烘烤48 h至恒重);脑组织含水量/%=(湿重-干重)/湿重×100%。
1.2.7 免疫荧光染色评估BBB紧密连接蛋白变化 再灌注72 h后取脑,冰冻切片(前囟至前囟后3.0 mm),片厚10µm;ZO-1和occludin一抗稀释比例为1:200,claudin-5为1:100;二抗稀释比例均为1:200。荧光显微镜观察,采集缺血半暗带处图像,假手术组采集与MCAO缺血半暗带相对应区域;所有图像采集参数保持一致。
1.2.8 BBB紧密连接蛋白半定量 再灌注72 h后取脑取缺血边缘区组织,western blot法测定ZO-1、occludin、claudin-5蛋白含量。蛋白终浓度为5µg/µl;SDS-凝胶电泳,每孔蛋白上样量约40µg;转膜条件:220 mA恒流,转膜时间ZO-1及occludin为90 min,claudin-5及β-actin为60 min。室温封闭2 h后孵育抗体,一抗稀释比例:claudin-5(1:200)、ZO-1(1:200)、β-actin(1: 1000)、occludin(1:200);二抗稀释比例均为1:1000。加ECL化学发光液后用ChemiDocXRS+凝胶成像系统进行连续曝光;软件分析条带灰度。
1.3 统计学处理
2 结果
2.1 TPPU改善MCAO后神经功能缺损症状
Garcia评分结果显示,模型组大鼠缺血再灌注清醒后评分显著低于假手术组,再灌注24 h评分进一步降低,48 h后评分开始上升,但仍低于假手术组(均P<0.01);TPPU组各时间点得分均高于模型组(P<0.01),见图1。

图1 TPPU对MCAO神经功能重塑的影响
2.2 TPPU减小MCAO大鼠脑梗死体积
TTC染色结果显示,TPPU组大鼠大脑半球和皮质脑梗死体积小于模型组(P<0.05),2组纹状体梗死体积差异无统计学意义(P>0.05),见表1。
表1 TPPU对大鼠脑梗死体积的影响(±s)
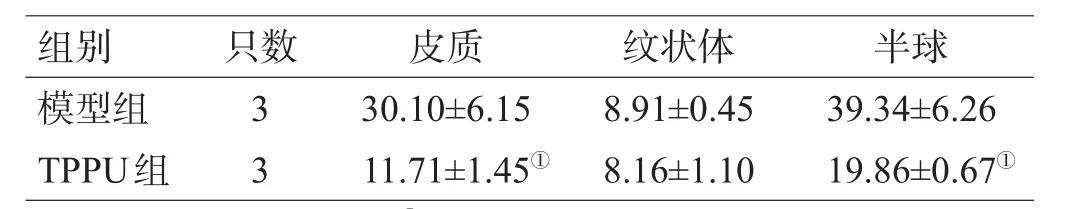
表1 TPPU对大鼠脑梗死体积的影响(±s)
注:与模型组比较,①P<0.05
组别 只数 皮质 纹状体 半球模型组TPPU组33 30.10±6.15 11.71±1.45①8.91±0.45 8.16±1.10 39.34±6.26 19.86±0.67①
2.3 TPPU改善大鼠脑梗死后继发脑水肿
缺血再灌注后,模型组大鼠梗死侧脑组织含水量明显高于假手术组(P<0.05),TPPU组脑组织含水量明显低于模型组(P<0.05);假手术组左右半球及各组健侧脑组织含水量差异无统计学意义(P>0.05),见表2。
2.4 TPPU减小BBB通透性
缺血再灌注后,模型组大鼠患侧脑组织EB渗漏明显多于假手术组(P<0.05),TPPU组EB渗漏明显少于模型组(P<0.05);假手术组左右半球及各组健侧EB含量差异无统计学意义(P>0.05),见表2。
2.5 TPPU保护BBB结构完整
模型组大鼠BBB紧密连接蛋白ZO-1、occludin及claudin-5表达明显低于假手术组(P<0.01),TPPU组上述蛋白表达量高于模型组(P<0.05),见图2、3,表3。
表2 各组脑组织EB渗漏量及脑含水量(±s)

表2 各组脑组织EB渗漏量及脑含水量(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组别假手术组模型组TPPU组只数333 EB含量/(μg/100mg)左脑0.54±0.04 4.73±0.18①1.20±0.32②右脑0.49±0.05 0.62±0.04 0.53±0.05组别假手术组模型组TPPU组脑含水量/%左脑77.93±0.49 82.76±0.26①80.40±0.58②右脑77.62±0.39 78.38±0.46 77.74±0.25

图2 血脑屏障紧密连接蛋白的表达(免疫荧光,×40)

图3 血脑屏障紧密连接蛋白的表达(western blot)
表3 血脑屏障紧密连接蛋白的表达(±s)
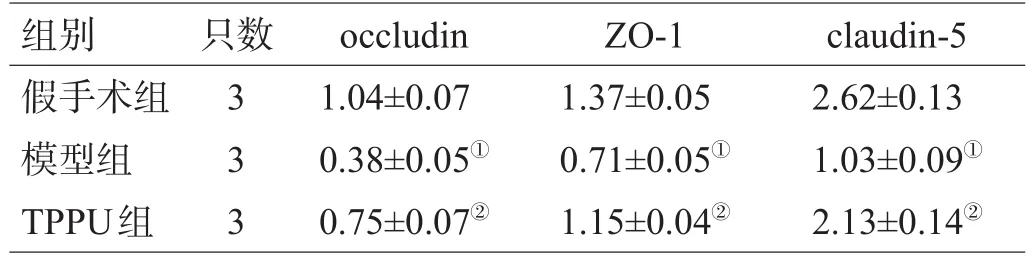
表3 血脑屏障紧密连接蛋白的表达(±s)
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
组别假手术组模型组TPPU组只数333 occludin 1.04±0.07 0.38±0.05①0.75±0.07②ZO-1 1.37±0.05 0.71±0.05①1.15±0.04②claudin-5 2.62±0.13 1.03±0.09①2.13±0.14②
3 讨论
急性脑梗死缺血半暗带带处存在大量存活的神经元细胞,在短时间内恢复血液供应,该处神经元可存活下来并恢复功能[8]。EETs具有扩管、抗炎、血管再生等作用,可能成为脑缺血治疗潜在靶点。脑缺血后EETs在神经血管单元多种细胞中发挥作用[9],但EETs对缺血后BBB是否具有保护作用尚无研究报道。本实验通过抑制EETs的水解酶活性间接提高缺血脑组织中EETs含量,探索其对卒中后BBB的作用。
体内EETs来自花生四烯酸(arachidonic acid,AA)的代谢。缺血、缺氧时磷脂酶A2激活,使AA从膜磷脂中游离出来[10]。游离的AA是多种二十碳活性物质的重要前体,可经CYP450表氧化酶途径代谢为EETs、HETEs等。根据烯键位置不同,EETs存在4种同分异构体,即5,6-EET、8,9-EET、11,12-EET和14,15-EET。EETs在体内极不稳定,其烯键极易被sEH加水水解为二醇而降低活性。外源性加入EETs和(或)应用sEH抑制剂常用于EETs相关研究。sEH抑制剂能通过常规方式给药,保证实验条件一致,常用于动物实验。
sEH抑制剂是一类脲衍生物,通常其羰基上1位氨基结合非极性基团,3位氨基结合极性基团,电荷分布类似于EETs,能够与EETs竞争sEH催化位点,抑制sEH对EETs的降解。近来,通过引入构象限制结构如哌嗪环,研究者合成了稳定性较好的sEH抑制剂,如APAU、TPPU等。TPPU水溶性好、稳定性强,能够通过口服给药或静脉给药。TPPU作为底物类似物与EETs竞争sEH结合位点,抑制sEH活性,减少EETs的降解,间接提高组织EETs含量[11],发挥EETs生理效应。研究表明,TPPU能降低血管紧张素II依赖性高血压小鼠的血压值,减轻非甾体抗炎药双氯芬酸钠诱导的小鼠肠溃疡,抑制CCL4诱导的小鼠肝纤维化、博莱霉素诱导的小鼠肺纤维化,减轻小鼠急性胰腺炎炎症反应,减轻小鼠心梗后心肌纤维化及心肌重构。TPPU对脑缺血所起作用尚无报道。
本实验结果表明,TPPU扩张MCAO大鼠脑血管,对恢复缺血半暗带脑血流和恢复神经功能具有显著效果;TPPU减少MCAO脑梗死体积,其中对减少皮质区梗死体积显著,而纹状体梗死体积无统计学差异,可能与纹状体缺乏侧枝循环的代偿作用有关;TPPU对脑梗死血脑屏障完整性具有保护作用,减少内皮细胞通透性,减轻血管性脑水肿,与EETs扩张血管、抗炎、抑制凋亡、促进血管增殖等作用一致。TPPU除了通过提高内源性EETs含量发挥脑保护作用外是否存在其他机制尚需进一步研究。
综上所述,本研究首次证明,可溶性环氧化物水解酶抑制剂TPPU有助于保护MCAO大鼠血脑屏障完整性,减轻脑水肿,减小脑梗死体积,减轻神经功能缺损症状,发挥脑缺血神经保护作用。
[1]Obermeier B,Daneman R,Ransohoff RM.Development,maintenance and disruption of the blood-brain barrier[J].Nat Med,2013,19:1584-1596.
[2]Powell WS,Rokach J.Biosynthesis,biological effects,and receptors of hydroxyeicos-atetraenoic acids(HETEs)and oxoeicosatetraenoic acids (oxo-ETEs)derived from ara-chidonic acid[J].Biochim Biophys Acta, 2015,1851:340-355.
[3]Brash AR.Arachidonic acid as a bioactive molecule[J].J Clin Invest, 2001,107:1339-1345.
[4]Chen W,Zheng G,Yang S,et al.CYP2J2 and EETs Protect against Oxidative Stress and Apoptosis in Vivo and in Vitro Following Lung Ischemia/ Reperfusion[J].Cell Physiol Biochem,2014,33:1663-1680.
[5]Iliff JJ,Jia J,Nelson J,et al.Epoxyeicosanoid signaling in CNS function and disease[J].Prostaglandins Other Lipid Mediat,2010,91:68-84.
[6]Abdu E,Bruun DA,Yang D,et al.Epoxyeicosatrienoic acids enhance axonal growth in primary sensory and cortical neuronal cell cultures[J].J Neurochem,2011,117:632-642.
[7]Zhang W,Davis CM,Edin ML,et al.Role of endothelial soluble epoxide hydrolase in cerebrovascular function and ischemic injury[J].PLoS One,2013,8:e61244.
[8]Heiss WD.The ischemic penumbra:how does tissue injury evolve[J]? Ann N YAcad Sci,2012,1268:26-34.
[9]Liu Y,Wan Y,Fang Y,et al.Epoxyeicosanoid Signaling Provides Multi-target Protec-tive Effects on Neurovascular Unit in Rats After Focal Ischemia[J].J Mol Neurosci,2016,58:254-265.
[10]Chalimoniuk M.Secretory phospholipase A2 and its role in oxidative stress and infla-mmation[J].Postepy biochemii,2012,58:204-208.
[11]Askari AA,Thomson S,Edin ML,et al.Basal and inducible anti-inflammatory epox-ygenase activity in endothelial cells[J].Biochem Biophys Res Commun,2014,446:633-637.
(本文编辑:唐颖馨)
The Protective Effects of Soluble Epoxidehydrolase Inhibitor TPPU on Blood Brain Barrier fol-lowing Cerebral Ischemia in Rats
HU Xiao-jing1,ZHANG Gui-bin1,XIE Min-jie2.
1.Department of neurology,Xiangyang No.1 People’s Hospital,Hubei University of Medicine,Hubei 441000,China;2.Department of neurology,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective:To investigate the effect of soluble epoxidehydrolase inhibitor(sEHi)TPPU on blood brain barrier(BBB)function in rats after focal ischemia.Methods:Rat focal cerebral ischemia model was established by transient middle cerebral artery occlusion(MCAO)via intraluminal suture.Forty-five male SD rats were randomly divided into three groups:the sham group,MCAO group and TPPU group(n=15 respectively). Neurologic deficits and behavioral function recovery were assessed by Garcia neurological severity score.The degree of cerebral edema was evaluated by dry/wet weight method.The infarct volume was evaluated by TTC staining.BBB permeability was determined by detecting the leakage of Evens Blue(EB)dye in the brain tissue. Immunofluorescent staining and western blotting were used to observe the content changes of tight junction proteins of BBB.Results:Compared with those in the MCAO group,the treatment of TPPU helped to improve the neurological deficits,decrease the infarct volume of cerebral cortex,reduce the vasogenic brain edema,decrease the leakage of EB in brain tissue and alleviate the loss of tight junction proteins in BBB(P<0.05).Conclusion: TPPU plays an active role in protecting the BBB integrity,mitigating cerebral edema,decreasing infarct volume and ameliorating the neurological deficit in rats after MCAO.
TPPU;blood-brain barrier;tight junction protein;cerebral ischemia
R741;R741.02;R743
ADOI10.16780/j.cnki.sjssgncj.2017.04.002
1.湖北医药学院附属襄阳医院神经内科湖北 襄阳 441000
2.华中科技大学同济医学院附属同济医院神经内科武汉 430030
国家自然科学基金(No.81371312)
2017-05-17
张贵斌zgb1969@126.com
