冻存颗粒脂肪组织移植成活率的实验研究
2017-08-11
(菏泽医学专科学校科,山东菏泽274000)
冻存颗粒脂肪组织移植成活率的实验研究
程爱娟,刘春霞
(菏泽医学专科学校科,山东菏泽274000)
目的探讨以二甲基亚砜和海藻糖作为低温保护剂在低温储存后的颗粒脂肪组织的活性和自体脂肪移植两周、四周后的成活率。方法将实验动物分组,获取脂肪并处理,分别通过葡萄糖转移检测法测定脂肪细胞活性。低温保护剂组加入等体积的二甲基亚砜和海藻糖,放置于-80℃深低温冰箱中冻存,两周后取出,复温后测定细胞活性,并进行移植设为冻存脂肪移植组。生理盐水组加入等体积的生理盐水,冻存复温、测定活性,并同步进行新鲜脂肪移植,设为新鲜脂肪移植组。并于自体移植两周、4周后获取移植物,比较移植物的体积和成活率。应用SPSS17.0软件,所获数据采用方差分析和t检验。结果冻存前两组比较,P>0.05;冻存两周后两组比较,P<0.0005。两组不同时期脂肪移植物体积比较,P>0.05;移植后两周比较,P<0.0005;移植后4周,P>0.05。结论-80℃条件下应用低温保护剂储存的脂肪,移植后较好地保持了体积和活性,适用于临床短期内重复移植需求。
颗粒脂肪;低温保存;自体移植;成活率
用自体脂肪移植修复组织缺损,为软组织填充物的选择开辟新的方向,至今已有百余年历史[1]。由于脂肪组织这一填充材料获取容易、质地柔软、供源充足,并具有良好组织相容性,创伤小,充盈外形好,且不会增加患者额外的花费。因此,这一技术现在已被整复外科和美容外科广泛应用[2]。但目前该技术仍存在移植脂肪细胞成活率低、坏死与吸收、感染等问题,移植时常需要少量、多次、反复注射。为了做到“一次吸脂、多次使用”,我们采用SD大鼠自体脂肪移植动物模型,观察低温保护剂二甲基亚砜和海藻糖在低温条件下对颗粒脂肪组织的保护作用及移植后成活情况的影响。现报道如下。
1 材料与方法
1.1 材料雌性成年健康SD大鼠40只,体重210~305 g(菏泽医学专科学校实验动物中心);正规胰岛素(400 IU/10 ml,江苏万邦生化医药股份有限公司)、二甲基亚砜(DMSO,纯度≥99.9%,Amresco公司)、海藻糖(北京中杉金桥生物技术有限公司)、DMEM(低糖,含1000 mg/L葡萄糖,HyClone公司)、超低温冰箱(MDF-382F,日本Sanyo公司)、三用恒温水浴箱(DK-600 S型,上海医用恒温设备厂)、罗氏全自动生化分析仪(日本Sanyo公司)。
1.2 方法
1.2.1 分组SD大鼠40只,随机分为生理盐水组和低温保护剂组。生理盐水组同步进行新鲜脂肪移植。低温保护剂组颗粒脂肪复苏后进行冻存脂肪移植。
1.2.2 颗粒脂肪细胞的获取腹腔注射水合氯醛麻醉低温保护剂组SD大鼠后固定、脱毛,常规消毒铺巾。选取腹部正中线偏左侧0.3 cm、耻骨联合上方1.2 cm处做一纵向皮肤全层切口,长约2 cm,获取脂肪组织。严格无菌操作,按照临床中获取移植微粒皮方法,用眼科剪修剪为大小均一的脂肪颗粒,约0.1 cm×0.1 cm×0.1 cm。倒入20 ml注射器中,生理盐水反复冲洗,约4~5次。静置30 min后,每只大鼠获取2.5 ml纯净颗粒脂肪,然后分成2份,其中0.5 ml用于新鲜颗粒脂肪活性测定,2 ml加入等体积的低温保护剂(15%DMSO、0.035 g/ml海藻糖)。
1.2.3 颗粒脂肪细胞的冻存、复苏冻存管消毒、封口、标记,于0℃环境中降温15 min,置入-80℃(超低温冰箱)冻存。两周后取出,立即置入37℃恒温水浴槽中解冻,快速晃动,待完全溶解,肉眼观察外观变化,及时去除防冻剂,用生理盐水反复洗涤4~5次,减少对脂肪细胞的继续毒害作用。其中0.5 ml用于活性测定,1.0 ml用于移植,设为冻存脂肪移植组。
1.2.4 活性测定葡萄糖转移实验[3]:低温保护剂组每组取5份0.5 ml的冻存管。将洗涤后的脂肪颗粒静置20 min,去除底层的生理盐水,电子天平称质量。每个标本取0.3 ml置于无菌培养皿中,每个培养皿中加0.9 ml含低糖无血清Dulbeceo改良Eagle培养基(DMEM),8 μl正规胰岛素。同时制备5份只含胰岛素和DMEM、不含颗粒脂肪的空白标本。充分混匀,培养皿表面用酒精棉球消毒,然后放进含5% CO2、37℃恒温孵育箱中进行孵育。大约1小时后取出,全自动生化分析仪及时测定培养液中葡萄糖的浓度。
以相同方法获取并处理生理盐水组。每只大鼠获得新鲜脂肪约2.5 ml,其中1.5 ml放入含等体积生理盐水的无菌冻存管中,两周后复温进行活性测定,剩余1.0 ml用于移植,设为新鲜脂肪移植组。
1.2.5 移植于大鼠背部备皮,常规消毒铺巾,在中线中部作皮肤纵行切口,钝性分离,形成一个圆形皮下腔隙,将两组处理后的脂肪颗粒1 ml填入上述腔隙,缝合并进行编号。
1.2.6 取材及体积分析每组分别随机抽取10只大鼠于术后两周、四周处死取材。先在移植部位找到移植物,环绕移植物周围0.3 cm切开皮肤肌肉,取出脂肪移植物,分离修去周围组织及外周包膜以充分暴露纯脂肪移植体,放入精密测量器微刻度试管中测量。
1.3 统计学处理应用SPSS17.0软件分析,所获数据采用方差分析和t检验。
2 结果
2.1 肉眼观察-80℃条件下储存两周的颗粒脂肪复苏后与新鲜脂肪颗粒相比,表面略暗,缺少光泽,但未见脂滴液化、破碎的纤维组织细胞。
移植后两周,新鲜脂肪组织和冻存脂肪组织移植物内及周围组织均可观察到明显的炎症反应,部分脂肪包块内甚至可见坏死的组织和脓肿,后者严重于前者。移植物质地中等、界清。移植后四周,新鲜脂肪移植组和冻存脂肪移植组移植物无明显差别,质地均较韧,弹性较好,移植物被一层纤维组织包膜包绕,边界清,呈盘状,表面可见较多血管生长。
2.2 不同条件下葡萄糖转移量比较见表1。
2.3 不同时期两组脂肪移植物体积比较见表2。
表1 不同条件下葡萄糖转移量(mmol/L,)

表1 不同条件下葡萄糖转移量(mmol/L,)
冻存前两组比较,t=0.26348,P>0.05;冻存两周后两组比较比较,t=23.245,P<0.0005。
组别n冻存前冻存两周后生理盐水组20 1.670±0.089 0.951±0.090低温保护剂组20 1.668±0.078 1.597±0.088
表2 不同时期两组脂肪移植物体积(ml,)
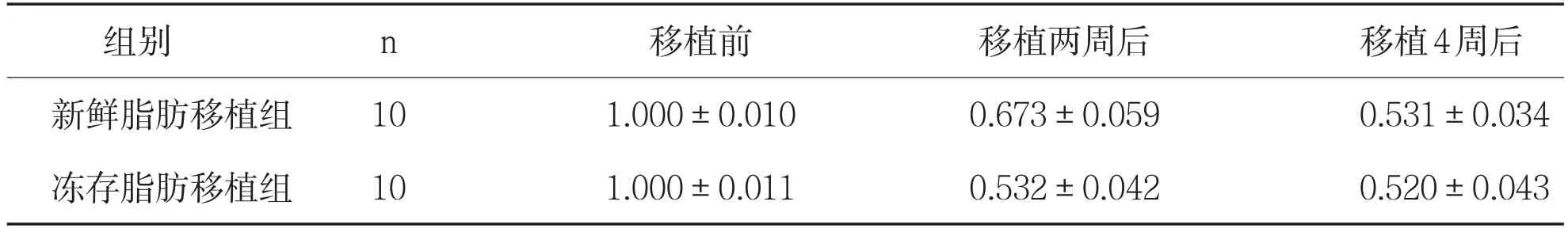
表2 不同时期两组脂肪移植物体积(ml,)
两组不同时间脂肪移植物体积变化比较,t=0,P>0.05;移植两周后比较,t=3.6812,P<0.0005;移植4周后比较,t=0.63455,P>0.05。
组别n移植前移植两周后移植4周后新鲜脂肪移植组10 1.000±0.010 0.673±0.059 0.531±0.034冻存脂肪移植组10 1.000±0.011 0.532±0.042 0.520±0.043
3 讨论
将获得的多余脂肪组织低温保存起来,以备按预定计划重复注射,避免再次抽取,需要把脂肪组织低温保存起来。冷冻法用于保存脂肪组织[4],但冻伤是低温保存的最大副反应,所以在器官、组织、细胞冷冻保存时需要加入低温保护剂。目前广泛使用的低温保护剂分为穿透性和非穿透性两大类[5]。穿透性低温保护剂如甘油、二甲基亚砜、丙二醇、甲醇、乙二醇(ethlylene glycol,EG)等。应用较多的是二甲基亚砜,DMSO为低分子中性物质,属于强大的脂溶性有机溶剂,优点是能迅速渗透到细胞膜两侧以达到维持细胞内外渗透压平衡的目的,并且能增加溶液粘性使结晶过程弱化,从而有效地减轻冷冻造成的损伤[6],缺点是常温下微毒性。非穿透性低温保护剂包括海藻糖(Trehalose)、蔗糖、葡萄糖、卵黄、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、聚乙二醇、羟乙基淀粉和脂蛋白等。海藻糖是近年来发现并开始广泛应用的一种非穿透性低温保护剂,是由两个葡萄糖分子以α,α,1,l-糖苷键构成的非还原性糖。研究发现少量的外源性海藻糖有利于提高组织的抗胁迫能力,生物体在不良环境下会调节体内合成部分海藻糖以抵抗外界的伤害。在选择低温保护剂时要充分全面考虑保护剂的种类、浓度以及其加入、清除方式对细胞活性的损伤影响[7],主要是因为冷冻保护剂对细胞既有保护作用,也存在一定的毒性。不同物种、不同器官、不同组织和细胞对低温保护剂的反应不完全相同,每种低温保护剂的具体防冻机制也不完全相同,所以在组织细胞储存前需对低温保护剂的种类、组合、浓度加以筛选,才能获得最优效果,保持最大的细胞活性。综合文献研究,本实验选择15%二甲基亚砜加0.035 g/ml海藻糖[8,9]作为低温保护剂。
-80℃深低温冰箱中采用低温保护剂保护,冻存两周的颗粒脂肪组织复苏后,葡萄糖转移量与新鲜颗粒脂肪组织相比无明显差异。提示低温保护剂组脂肪颗粒细胞移植时不仅仅只作为填充物存在,还具有脂肪细胞活性。移植两周后,取材行体积分析,新鲜脂肪移植组明显大于冻存脂肪移植组,提示冻存的部分细胞功能、形态受到影响,成活率低,坏死液化率高。移植四周后,移植物体积分析两组无明显差异。提示以二甲基亚砜和海藻糖做为低温保护剂冻存的脂肪细胞符合临床需求。并且-80℃环境中保存方便,比较适合临床应用。本研究进一步优化了脂肪组织的冷冻保存条件,使脂肪组织长期储存、反复移植成为可能。
虽然自体脂肪移植在临床中得到广泛应用[10,11],但移植的成活率只占50%左右[12]。针对这种现象,目前国内外学者进行了大量的实验研究,就如何提高移植脂肪组织存活率提出了新的观点,发现脂肪移植物中加入碱性成纤维细胞生长因子(b-FGF),可以不同程度地提高移植脂肪组织成活率[13],同时还有实验证实[14]瘦素、表皮生长因子(EGF)、血小板衍生生长因子、胰岛素样生长因子-1、神经生长因子、转化生长因子、β-阻滞剂等均可促进脂肪细胞的存活,因此,从多方面进行优化,可达到提高冻存脂肪移植效果的目的。
[1]Neuber G.Verhandlungen der deutschen gesellschaft fur chirurgie [M].Nabu press,2010:22(66):223.
[2]郭鑫,王千文,王佳琦.自体脂肪颗粒移植隆颏术[J].中国美容整形外科杂志,2016,27(2):76-78.
[3]雷华,李青峰.自体脂肪游离移植实验研究[D].上海:上海第二医科大学,2004:18-22.
[4]Fournier PF.Facial recontouring with fat grafting[J].Dermatol Clin,1990,8(3):523-537.
[5]朱兆明,柴家科,贾晓明.皮肤储存基础及应用[M].北京:人民军医出版社,2002:105-121.
[6]Si FH,Liu ZD.Cryotherapy[J].Zhonghua Liliao Zazhi(Chin J Phys Ther),1980,3(3):169-171.
[7]陈凡凡,崔磊,曹谊林,等.组织工程化皮肤低温保存的研究进展[J].组织工程与重建外科杂志,2010,6(2):108-109.
[8]Erdag G,Eroglu A,Morgan J,et al.Cryopreservation of fetal skin is improved by extracellular trehalose[J].Cryobiology,2002,44(3):218-228.
[9]蔡宏,贾晓明,吴志谷,等.海藻糖对低温保存皮肤的作用[J].中华实验外科杂志,2005,22(2):238-240.
[10]秦晓,鲁树荣,梁军,等.自体脂肪移植重塑颧部脂肪垫的临床效果[J].中华医学美学美容杂志,2016,22(2):81-83.
[11]李巍,李云峰,刘长松,等.自体脂肪颗粒移植治疗面部凹陷[J].中国美容整形外科杂志,2016,27(2):73-75.
[12]王洁晴,张晨,姜晓丽,等.自体脂肪移植隆乳术的临床效果观察[J].中国美容整形外科杂志,2015,(8):456-459.
[13]肖斌,刘毅,张绪生,等.脂肪颗粒组织在不同低温条件下冻存后活力分析及移植成活率测定[J].中华医学美学美容杂志,2007,13 (2):97-100.
[14]Yuksel E,Weinfeld AB,Cleek R,et al.Increased free fat-graft survival with the long term local delivery of insulin,insulin-like growth factor-1,and basic fibroblast growth factor by PLGA/PEG microspheres[J].Plast Reconstr Surg,2000,105(5):1712-1720.
Cryopreserved Granular Fat Tissue Transplantation Survival Rate of Experimental Research
Cheng Aijuan,Liu Chunxia
(Heze Medical College,Heze 274000,Shandong)
Objective To investigate the dimethyl sulfoxide and trehalose as protective agent at low temperature, under the condition of-80℃low temperature storage after particles of adipose tissue,in autologous fat transplantation survival rate of two weeks,four weeks later.Methods Experimental animals,get fat and handle,respectively,through the determination of glucose transfer test of fat cell activity.Low temperature protective group to add equal volume of dimethyl sulfoxide and trehalose,placed in cryopreserved-80℃ultra-low temperature freezer,take out after two weeks, measure of cell activity after thawing,and porting to frozen fat transplantation group.Physiological saline group to add equal volume of physiological saline,thawing,measure of the above methods cryopreserved activity,and simultaneous fresh fat transplantation,set to fresh fat transpla ntation group.Autologous transplantation two weeks amd four weeks later,compare the volume of the graft,analysis the survival rate.Application SPSS17.0 software,the data obtained using analysis of variance and t test.Results The two groups compare the cryopreserved,P>0.05.Cryopreserved two weeks compare the two groups,P<0.0005,fat graft volume compared two groups of different period,P>0.05.Two weeks after transplantation,P<0.0005.4 weeks after transplantation,P>0.05.Conclusion Application under the condition of-80℃low temperature protectant stored fat,after transplantation is better to keep the size and activity,is suitable for clinical repeated transplantation demand in the short term.
Particle fat;Low temperature conservation;Autotransplantation;The survival rate
R622.9
:A
:1008-4118(2017)02-0001-04
10.3969/j.issn.1008-4118.2017.02.001
2017-03-05
2015年菏泽医学专科学校科学研究课题。项目编号:H15K09。
