桑粉虱种特异性引物筛选
2017-08-11柴建萍江秀均罗雁婕白兴荣
柴建萍,江秀均,倪 婧,罗雁婕,白兴荣
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
桑粉虱种特异性引物筛选
柴建萍,江秀均,倪 婧,罗雁婕,白兴荣*
(云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101)
【目的】桑粉虱Pealiusmori(Takahashi)与其他种类粉虱形态相似,识别困难。设计、筛选桑粉虱种特异性引物,为桑粉虱检测和鉴定提供理论依据。【方法】DNAMAN软件比较与桑粉虱同源性较高的国内外具有代表性的7种粉虱线粒体COⅠ基因序列,应用Primer 5.0软件设计5对桑粉虱COⅠ基因特异性引物。将各对引物与不同种类粉虱成虫基因组DNA模板进行PCR扩增,检测目的条带,筛选桑粉虱种的特异性引物。以桑粉虱的卵和幼虫基因组DNA为模板,验证所筛选出的桑粉虱种特异性引物的灵敏性。【结果】2对桑粉虱种特异性引物sfs1-1/sfs1-2、sfs5-1/sfs5-2对桑粉虱单头成虫基因组DNA的PCR扩增产物分别为450、300 bp,而对烟粉虱B型、温室白粉虱无扩增效果。2对引物对桑粉虱DNA模板浓度最低检测值分别为0.15 pg/μl 、0.15 ng/μl。引物sfs1-1/sfs1-2灵敏性较引物sfs5-1/sfs5-2高1000倍。2对引物对桑粉虱成虫、幼虫及卵粒的线粒体COⅠ基因皆具较好扩增能力。【结论】引物sfs1-1/sfs1-2、sfs5-1/sfs5具桑粉虱种的特异性,引物sfs1-1/sfs1-2为桑粉虱检测、鉴定的首选引物。
桑粉虱;线粒体COⅠ基因;种特异性引物;筛选
【研究意义】伴随“东桑西移”,云南桑园面积扩大,桑粉虱在云南植桑区的暴发危害呈扩大趋势。桑粉虱虫体小,与其他种类粉虱形态相似,识别困难。建立快速将桑粉虱与其它种类粉虱区别开的检测技术成为桑粉虱发生机制与防控研究的迫切需求。【前人研究进展】桑粉虱Pealiusmori(Takahashi)属同翅目,粉虱科,是对中国农业生产存在较大威胁的6种重要粉虱类害虫之一[1]。桑粉虱以幼虫、成虫刺吸危害,其分泌物导致桑园煤污病流行,造成桑叶品质及产量下降。粉虱类害虫的形体微小,种内变异普遍存在,仅凭粉虱成虫的外观识别易造成种类鉴定混乱[2]。粉虱分类鉴定依据蛹壳特征而非成虫特征[3]。桑粉虱蛹体长0.70~0.80 mm,黄褐色,椭圆形;成虫体长0.70~0.80 mm,体淡黄、被有白粉[4],外形与其它种类粉虱极为相似。基于DNA序列的分子标记技术可找出不同生物类群间根本的遗传差异,弥补传统形态分类方法的不足,较快进行物种鉴定[5]。线粒体COⅠ基因被建议作为鉴定所有动物的通用工具[6-7],广泛应用于粉虱、蚜虫等多种昆虫新物种鉴定[8-9]。【本研究切入点】应用分子生物学技术,以桑粉虱线粒体COⅠ基因部分系列设计、筛选具有桑粉虱种特异性引物。【拟解关键问题】借助于线粒体COⅠ分子标记将桑粉虱与其他种类粉虱区别开,建立桑粉虱快速分子检测技术,为植桑区桑粉虱害虫识别、危害监测及种群发生机制研究提供技术支持。
1 材料与方法
1.1 试验虫源
桑粉虱于2014年6月采自云南省农业科学院蚕桑蜜蜂研究所桑园,虫态为成虫、卵、幼虫。烟粉虱样本采自桑园周边寄主植物薄荷(2012年5月),-80 ℃保存的成虫。温室粉虱2012年5月采自大棚内寄主植物黄瓜,-80 ℃保存的成虫。烟粉虱及温室粉虱经过线粒体COⅠ分子标记鉴定为烟粉虱B型及温室白粉虱[10]。
1.2 试验仪器与试剂
XW-80A涡旋仪(上海精科实业有限公司),MiniSpin小型离心机(eppendorf),S1000 PCR扩增仪(BIO-RAD),PowerPac Universal电泳系统(BIO-RAD),GelDoc TM+XR紫外凝胶成像系统(BIO-RAD)。
DNA提取液[含50 mmol/L Tris-HCl (pH 8.0)、20 mmol/L NaCl、1 mmol/L EDTA、1 % SDS],Tris-EDTA缓冲液[含10 mmol/L Tris-HCl(pH 8.0)、1 mmol/L EDTA(pH 8.0)],蛋白酶K(Merck)、Easy Taq DNA Polymerase、2.5 mmol/L dNTPs 购至Trans(北京)公司,引物由Invitrogen(上海)公司合成,其他无机试剂为国产分析纯。
1.3 供试粉虱DNA提取
粉虱DNA提取方法参照柴建萍等[10],分别提取5头桑粉虱、烟粉虱、温室白粉虱基因组DNA。收集桑粉虱5个粒卵及5头2龄幼虫,进行桑粉虱卵、幼虫基因提取。
1.4 桑粉虱特异性引物设计
根据柴建萍等[11]研究中桑粉虱Pealiusmori(登陆号 KP168713)测序结果,以及NCBI数据库中与桑粉虱具同源性及代表性的烟粉虱Bemisiatabaci(登陆号 KF059959)、温室白粉虱Trialeurodesvaporariorum(登陆号 HM185763)、螺旋粉虱Aleurodicusdispersus(登陆号 KC822648)、番荔枝褶粉虱Aleurotrachelusanonae(登陆号 HM150624)、番石榴黑棒粉虱Aleuroclavaguyavae(登陆号 JQ340179)、伯粉虱待定种MetabemisiaSP(登陆号 JQ340198)7种粉虱线粒体COⅠ基因碱基序列,应用CLUSTAL X 2.1、MEGA5软件进行序列对比分析,Primer Premer 5.0设计可供筛选的桑粉虱特异性引物5对(表1)并进行评价。
1.5 PCR最佳反应条件确定
用5对引物分别对桑粉虱DNA进行梯度PCR扩增,检测引物扩增的有效性,确定PCR扩增最佳反应条件。PCR扩增体系为25 μl,其中含10×buffer 2.5 μl,2.5 μmol/L dNTPs 1.9 μl,20 μmol/L上、下游引物各0.5 μl, 5 U/μlTaqDNA polymerase 0.2 μl,100 μg/mL DNA模板1.8 μl。反应程序:94 ℃预变性5 min;94 ℃变性20 s,50~65 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min。取5 μl 扩增产物,加1 μl载样缓冲液于1 %琼脂糖凝胶样品孔,100 V电压、电泳15 min后,用紫外凝胶成像系统检测电泳结果。
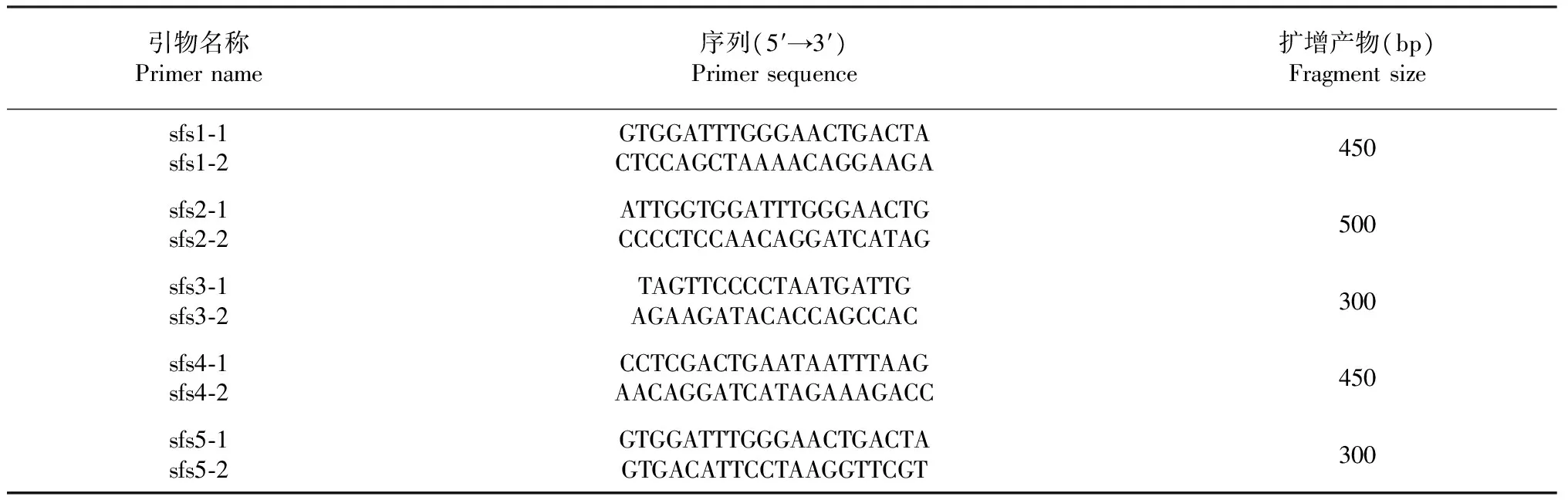
表1 供筛选的桑粉虱特异性引物
1.6 特异性引物筛选
分别以桑粉虱、烟粉虱B型、温室白粉虱各5头成虫的DNA为模板,用5对引物进行PCR扩增,检测得到目的条带有无或差异,筛选出桑粉虱种特异性引物。扩增条件同1.5。
1.7 特异引物灵敏性检测
以桑粉虱5头幼虫、5粒卵提取的基因组DNA为模板,用筛选得到的特异性引物进行PCR扩增,检测引物对不同虫态DNA扩增的有效性;将桑粉虱DNA模板浓度按100、10-1、10-2、10-3、10-4系列梯度稀释,以特异性引物进行PCR扩增,检测、比较引物灵敏性差异。PCR体系及反应条件同1.5。
2 结果与分析
2.1 PCR最佳反应条件
5对引物对桑粉虱DNA进行梯度PCR扩增后得到清晰、单一、大小分别为450、500、300、450、300 bp的目的条带,与预期产物相符(图1~2)。结合目的条带特异性及试验操作简便性,选择52 ℃为各引物PCR退火温度。结果表明,PCR反应体系及条件可作为特异性引物筛选及其灵敏性检测的最佳反应条件。
2.2 特异性引物筛选
5对引物对桑粉虱、烟粉虱B型、温室白粉虱基因组DNA进行PCR扩增,电泳检测结果表明引物sfs2-1/sfs2-2不能将桑粉虱与温室白粉虱区别开。引物sfs3-1/sfs3-2对烟粉虱B型、温室白粉虱有非特异性扩增。引物sfs4-1/sfs4-2对烟粉虱B型及温室白粉虱具一定扩增能力,不能产生与桑粉虱明显区别。鉴于以上3对引物不能简单、清淅、直观的将桑粉虱与其他两种粉虱区别开,故作舍弃。引物sfs1-1/sfs1-2、sfs5-1/sfs5-2对桑粉虱基因组DNA可分别扩增出约450、300 bp目的条带,而这两对引物对烟粉虱B型及温室白粉虱DNA未能扩增出目的条带(图3~4)。结果表明,引物sfs1-1/sfs1-2、sfs5-1/sfs5-2具桑粉虱种的特异性,可用于桑粉虱与烟粉虱B型、温室白粉虱的区别鉴定。
2.3 特异引物灵敏性检测
特异引物sfs1-1/sfs1-2、sfs5-1/sfs5-2对桑粉虱幼虫及卵DNA可分别扩增出约450、300 bp目的条带,说明两对引物对桑粉虱卵、幼虫、成虫各虫态具有良好扩增能力(图5~6)。桑粉虱DNA模板经100、10-1、10-2、10-3、10-4系列梯度稀释后分别得到1.5 ng/μl、0.15 ng/μl、15 pg/μl、1.5 pg/μl、0.15 pg/μl模板浓度,经过两对引物PCR扩增、灵敏度检测得出:sfs1-1/sfs1-2引物对4个浓度模板均可扩出450 bp目的条带,其对模板浓度的最低检测值为0.15 pg/μl;sfs5-1/sfs5-2引物对2个浓度模板可扩出300 bp目的条带,其对模板浓度的最低检测值为0.15 ng/μl。引物sfs1-1/sfs1-2的灵敏性高于引物sfs5-1/sfs5-2 近1000倍,为桑粉虱检测、鉴定的优选引物(图7~8)。
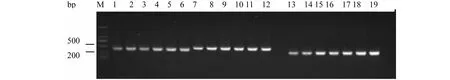
M:DNA 分子标记;1~6:引物sfs1-1/sfs1-2;7~12:引物sfs2-1/sfs2-1;13~19:引物sfs3-1/sfs3-1M: DNA marker; 1-6: Primer sfs1-1/sfs1-2; 7-12: Primer sfs2-1/sfs2-1; 13-19: Primer fs3-1/sfs3-1图1 引物sfs1-1/sfs1-2、sfs2-1/sfs2-2、sfs3-1/sfs3-2对桑粉虱DNA梯度PCR电泳图Fig.1 Electrophoretogram of primers sfs1-1/sfs1-2,sfs2-1/sfs2-2,sfs3-1/sfs3-2 gradient PCR to the DNA of Pealius mori
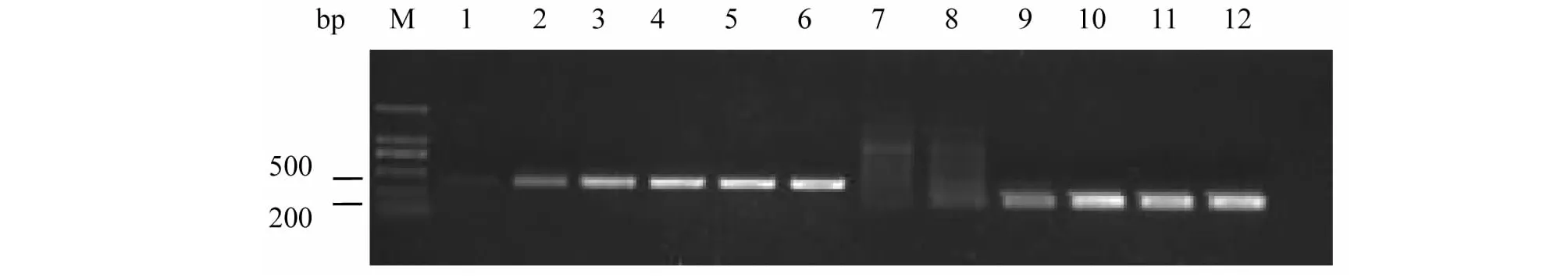
M:DNA分子标记;1~6:引物sfs4-1/sfs4-2;7~12:引物sfs5-1/sfs5-2M: DNA marker; 1-6: Primer sfs4-1/sfs4-2; 7-12: Primer sfs5-1/sfs5-2图2 引物sfs4-1/sfs4-2、sfs5-1/sfs5-2对桑粉虱DNA梯度PCR电泳图Fig.2 Electrophoretogram of primers sfs4-1/sfs4-2、sfs5-1/sfs5-2 gradient PCR to the DNA of Pealius mori
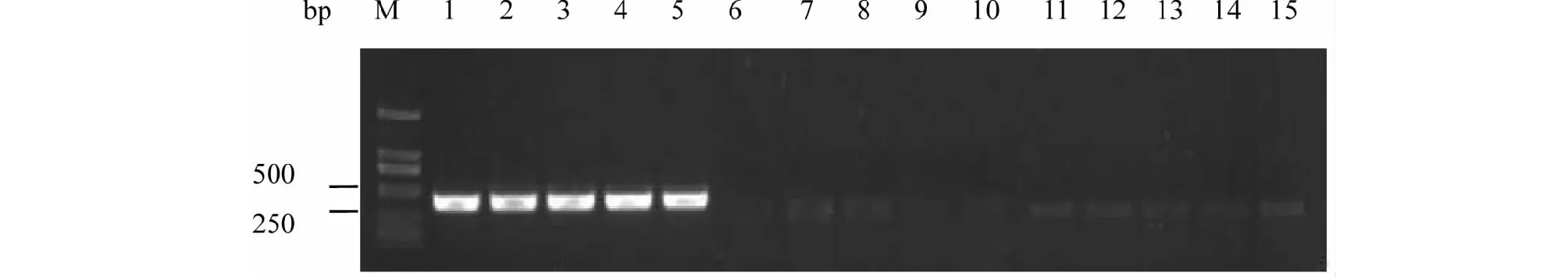
M:DNA分子标记;1~5:桑粉虱;6~10:烟粉虱;11~15:温室白粉虱M: DNA marker; 1-5: Pealius mori; 6-10: Bemisia tabaci B; 11-15: Trialeurodes vaporariorum图3 引物sfs1-1/sfs1-2特异性检测电泳图Fig.3 Electrophoretogram of primer sfs1-1/sfs1-2 specificity detection

M:DNA分子标记;1~5:桑粉虱;6~10:烟粉虱;11~15:温室白粉虱M: DNA marker; 1-5: Pealius mori; 6-10: Bemisia tabaci B; 11-15: Trialeurodes vaporariorum图4 引物sfs5-1/sfs5-2种的特异性检测电泳图Fig.4 Electrophoretogram of primer sfs5-1/sfs5-2 specificity detection
3 讨 论
对于形态特征不稳定或多变异性的昆虫,特别是近缘种的区别和疑难种的鉴定,以PCR扩增分子标记技术可解决传统形态分类难以解决的难题且不受虫态影响[11]。线粒体COⅠ基因序列已在烟粉虱生物型鉴定,烟粉虱生物型取代、变迁、分布等监测多个领域发挥重要作用[12-13]。基于线粒体COⅠ基因序列分析基础上发展起来的种特异性鉴定技术,在扩增未知模板时可根据目标片段的有无将目标种类与其它种类鉴别开,被广泛应用于粉蚧、实蝇、小蠹虫等检疫性害虫的快速鉴定[14-16]。粉虱类害虫的快速识别与鉴定是有效阻止其扩散危害及防控的重要前堤[17]。泰丽等[18]通过对烟粉虱多个隐种线粒体COⅠ序列限制性内切酶位点分析,筛选特定的内切酶,建立了利用线粒体COⅠ 的PCR-RFLP技术成功鉴定了国内9个烟粉虱隐种。姚晶等[19]选择线粒体DNACOⅠ保守区域内单核苷酸多态性为靶标,应用TaqMan等位基因技术快速鉴定烟粉虱隐种MEAM1和MED。王金娜等[20]应用RAPD技术筛选出温室白粉虱特异性片段,由此片段设计SCAR特异引物可将温室白粉虱与其他种粉虱区别开,提高了温室白粉虱检测效率。入侵性螺旋粉虱、双钩巢粉虱,应用其mtCOⅠ基因种的特异性序列,设计各自特异性引物,通过PCR扩增、检测,成功将该粉虱与其他种粉虱区别开,为口岸检疫、害虫检测及监测提供了快速分子鉴定技术支持[21-22]。
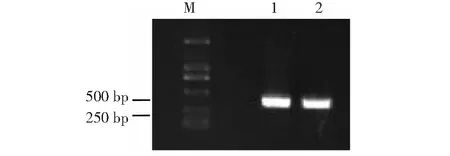
M:DNA分子标记;1:桑粉虱幼虫;2:桑粉虱卵M: NDA marker; 1: Larva of Pealius mori; 2: Egg of Pealius mori图5 引物sfs1-1/sfs1-2对桑粉虱幼虫、卵PCR扩增电泳图Fig.5 Electrophoretogram of primer sfs1-1/sfs1-2 amplification to the larva and egg of Pealius mori
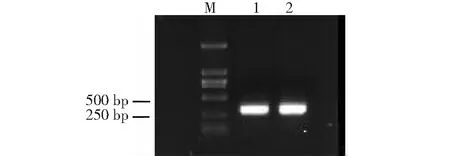
M:DNA分子标记;1:桑粉虱幼虫;2:桑粉虱卵M: NDA marker; 1: Larva of Pealius mori; 2: Egg of Pealius mori图6 引物sfs5-1/sfs5-2对桑粉虱幼虫、卵PCR扩增电泳图Fig.6 Electrophoretogram of primer sfs5-1/sfs5-2 amplification to the larva and egg of Pealius mori
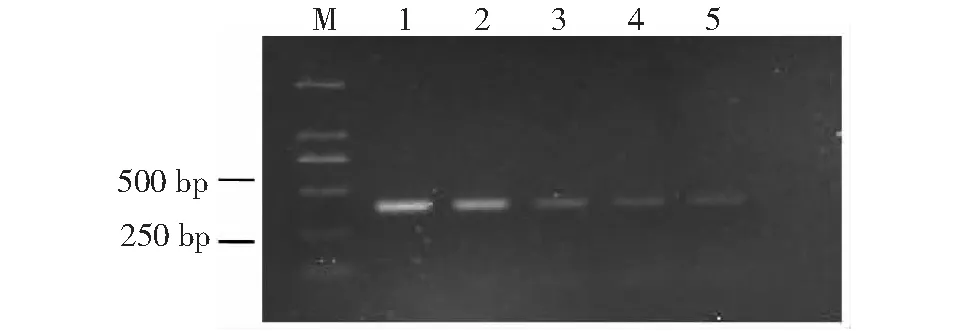
M:DNA分子标记;1~5:模板浓度分别为1.5 ng/μl,0.15 ng/μl,15 pg/μl,1.5 pg/μl,0.15 pg/μlM: NDA marker; 1-5: Template concentration 1.5 ng/μl,0.15 ng/μl,15 pg/μl,1.5 pg/μl,0.15 pg/μl图7 引物sfs1-1/sfs1-2对桑粉虱DNA灵敏性检测电泳图Fig.7 Sensitivity test electrophoretogram of prime sfs1-1/sfs1-2 to DNA of Pealius mori
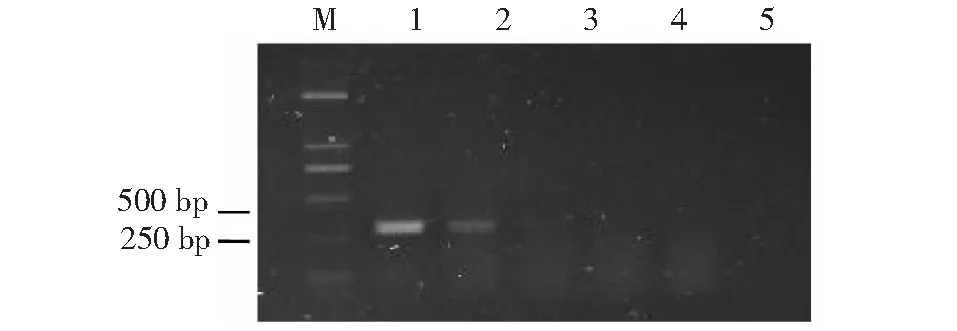
M:DNA分子标记;1~5:模板浓度分别为1.5 ng/μl,0.15 ng/μl,15 pg/μl,1.5 pg/μl,0.15 pg/μlM: NDA marker; 1-5: Template concentration 1.5 ng/μl,0.15 ng/μl,15 pg/μl,1.5 pg/μl,0.15 pg/μl图8 引物sfs5-1/sfs5-2对桑粉虱DNA灵敏性检测电泳图Fig.8 Sensitivity test electrophoretogram of prime sfs5-1/sfs5-2 to DNA of Pealius mori
桑粉虱分布于我国各植桑区,东南部、西南部省份为主要危害地区。刘曼等[23]通过系统调查得出,西南地区主要粉虱害虫为桑粉虱、烟粉虱、温室粉虱和黑刺粉虱,桑粉虱已对云南保山和四川攀枝花一带造成严重危害。宋早芹等[24]应用环境扫描电镜对山东、江苏、安徽、黑龙江4省桑树粉虱伪蛹进行超微结构观察,鉴定了桑树上有5种常见粉虱。Wang, et al[25]借助于环境扫描电镜对中国16省份87个采集地桑树粉虱伪蛹数字图像进行分析,鉴定了我国桑树上有10种7属粉虱。柴建萍等[10]应用线粒体COⅠ分子标记技术对云南蒙自桑园及周边寄主植物粉虱种群鉴定,结果表明蒙自桑园只发现桑粉虱1种粉虱害虫危害。云南植桑区分布于金沙江流域、珠江流域、滇南、滇西等产业带、海拔300~2200 m区域。针对云南省复杂多样的地理与气候环境下桑园粉虱的危害,建立科学、简便、高效的桑粉虱快速检测技术,对桑粉虱鉴定、桑粉虱种群迁移扩散监测及其防控机制研究等有重要的科学意义。
本研究通过对比桑粉虱及与其同源性较高,国内外代表性粉虱共7种粉虱线粒体COⅠ碱基序列,设计、筛选出sfs1-1/sfs1-2、sfs5-1/sfs5-1桑粉虱特异性引物2对并建立桑粉虱快速分子检测技术。sfs1-1/sfs1-2、sfs5-1/sfs5-1对桑粉虱单头成虫、幼虫、卵粒均具扩增能力,产生目的片段分别约为450、300 bp,可将桑粉虱与桑园周边多发性的烟粉虱、温室白粉虱区别开。筛选出的两对引物对桑粉虱基因组DNA模板最低检测值为0.15 pg/μl 、0.15 ng/μl,皆可用于痕量或可疑虫态的桑粉虱检测。其中,引物sfs1-1/sfs1-2灵敏性是引物sfs5-1/sfs5-1的1000倍,为桑粉虱检测、鉴定首选引物。由于受粉虱种类样本限制,本试验检测验证样本仅涉及桑粉虱及广泛分布危害的烟粉虱B型、温室白粉虱,桑粉虱种特异引物验证还需更多地域、更多种类粉虱样本进行检测证明。
4 结 论
引物sfs1-1/sfs1-2、sfs5-1/sfs5-1对桑粉虱单头成虫、幼虫、卵粒均具扩增能力,为桑粉虱种特异性引物,可用于桑粉虱检测与鉴定。由于引物sfs1-1/sfs1-2灵敏性更高,可作为桑粉虱检测、鉴定首选引物。
[1]任顺祥,邱宝利,戈 峰,等.粉虱类害虫的监测预警与可持续治理技术透视[J].应用昆虫学报,2011,48(1):7-15.
[2]孙会忠,董钧锋,宁月芹,等.四种粉虱种群超微形态特征多样性研究[J].应用昆虫学报,2011,48(1):70-76.
[3]Martin J H. An identification guide to common whitefly pest species of the world(Homopt Aleyrodidae) [J]. Tropical Pest Management, 1987,33(4): 298-322.
[4]屈达才,邱靖芸,虞崇江.广西桑粉虱为害特点及综合防控措施[J].广西农业科学,2010,41(11):1187-1190.
[5]阎凤鸣.非形态特征在粉虱分类中的运用[J].昆虫分类学报,2001,23(2):107-112.
[6]Hebert P D, Cywinska A, Ball S L, et al. Biological identifications through DNA barcodes[J]. Proceedings of the Royal Society of London Series B, 2003, 270: 313-321.
[7]Costa F O, deWaard J R, Boutillier J,et al. Biological identifications through DNA barcodes: the case of the Crustacea[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2007, 64: 272-225.
[8]Frohlich D R, Torres-Jerez I, Bedford I D, et al. A phylogeographical analysis of the Bemisia tabaci species complex based on mitochondrial DNA markers[J]. Molecular Ecology, 1999, 8(10):1683-1691.
[9]Wang J F, Jiang L Y, Qiao G X. Use of a mitochondrial COⅠsequence to identify species of the subtribe Aphidina (Hemiptera,Aphididae)[J]. Zookeys, 2011,122:1-17.
[10]柴建萍,刘增虎,罗雁婕,等.桑园及周边不同寄主植物粉虱种群鉴定[J].南方农业学报,2014,45(11):1963-1969.
[11]阎凤鸣.非形态特征在粉虱分类中的运用[J].昆虫分类学报,2001,23(2):107-112.
[12]罗 晨,姚 远,王戎疆,等.利用mtDNA COⅠ基因序列鉴定我国烟粉虱的生物型[J].昆虫学报,2002,45(6):759-763.
[13]王 欢,李 凯.上海地区烟粉虱生物型的最新鉴定[J].上海农业学报,2015,31(2):75-78.
[14]田 虎,李小凤,万方浩,等.利用种特异性COⅠ引物(SS-COⅠ)鉴别扶桑绵粉蚧[J].昆虫学报,2013,56(6):689-696.
[15]黄 振,陈韶萍,谢 婧,等.应用种特异性PCR技术快速鉴定辣椒实蝇[J].昆虫学报,2015,58(4):460-466.
[16]张总泽,陈 艳,林阳武,等.雅点六小蠹的SS-COⅠ技术鉴定[J].安徽农业科学,2014,42(9):2588-2589,2599.
[17]陈俊谕,韩冬银,张方平,等.哥德恩蚜小蜂对6种不同植物及其挥发物的选择行为[J].南方农业学报,2015,46(2):250-254.
[18]秦 丽,王 佳,邴孝利,等.利用mtCOⅠ PCR-RFLP技术鉴定中国境内九个烟粉虱隐种[J].昆虫学报,2013,56(2):186-194.
[19]姚 晶,郭晓军,王 甦,等.利用TaqMan等位基因技术鉴定烟粉虱MEAN1和MED隐种[J].昆虫学报,2013,56(1):98-103.
[20]王金娜,王相晶,张友军,等.温室白粉虱SCAR分子鉴定技术的建立及应用[J].环境昆虫学报,2012,34(3):295-301.
[21]李伟东,刘福秀,韩玉春,等.螺旋粉虱的分子检测方法[J].植物检疫,2012,26(5):9-13.
[22]张桂芬,郭建洋,王 瑞,等.双钩巢粉虱的种特异性SS-COⅠ检测技术[J].生物安全学报,2013,22(3):157-162.
[23]刘 曼,王济红,任春光,等.西南地区主要粉虱害虫的分布与危害[J].西南农业学报,2010,23(3):728-734.
[24]宋早芹,季小雨,杜予州,等.我国桑树五种常见粉虱的超微结构[J].应用昆虫学报,2011,48(1):65-69.
[25]Wang J R, Song Z Q, Du Y Z. Six new record species of whiteflies (Hemiptera: Aleyrodidae) infesting Morus alba in China[J]. Journal of Insect Science, 2014,14(274):1-5.
(责任编辑 王家银)
Screening of Species Specific Primiers forPealiusmori
CHAI Jian-ping, JIANG Xiu-jun, NI Jing, LUO Yan-jie, BAI Xing-rong*
(Sericulture and Apiculture Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Mengzi 661101, China)
【Objective】As it is difficult to identifyP.moriwith naked eye, the specific primer ofPealiusmori(Takahashi) was designed and selected to provide theortical basis for its detection and identification from similar whitefly. 【Method】The representative mitochondrialCOⅠ gene sequences of 7 species whitefly in the domestic and foreign homology withP.moriwere compared by using DNAMAN software, and five pairs of specific primers forCOⅠ gene ofP.moriwere designed by using Primer 5.0 software. PCR primers were used to amplify different kinds of whitefly adults DNA with five pairs primer, and the specific bands were selected to screen the specific primers. Using the egg and larvae DNA genome as the template, the sensitivity of the selected primers were verified.【Result】The amplification fragments of the 2 pairs specific primers sfs1-1/sfs1-2,sfs5-1/sfs5-2 to single adult genome DNA ofP.moriwere 450 bp, 300 bp, respectively. But it was no amplification effect toBemisiatabaciandTrialeurodesvaporariorum. The minimum detection value ofP.moriDNA template for the 2 pairs specific primer were 0.15 pg/μl, 0.15 ng/μl, respectively, and the sensitivity of primer sfs1-1/sfs1-2 was 1000 times higher than that of sfs5-1/sfs5-2. The two pairs of primers had a good ability to amplify theCOⅠ gene of adult, larvae and eggs ofP.mori. 【Conclusion】Primers of sfs1-1/sfs1-2 and sfs5-1/sfs5 have the species specificity forP.mori., and primer of sfs1-1/sfs1-2 is the first choice for the detection and identification ofP.mori..
Pealiusmori; MitochondrialCOⅠ; Species specific primers; Screening
1001-4829(2017)7-1570-06
10.16213/j.cnki.scjas.2017.7.018
2015-08-01
云南省现代农业蚕桑产业技术体系项目(2013KJTX 006);现代农业产业技术体系建设专项项目(CARS-22-SYZ27)
柴建萍(1970-),女,学士,副研究员,E-mail: chaijp@163.com,*为通讯作者:白兴荣,E-mail: bxrong3@163.com。
S888.739;S435.79
A
