硒酸钠对不同麦类作物谷胱甘肽过氧化物酶活性的影响
2017-08-11陈月星赵丽那阮景军程剑平
梁 勇,陈月星,赵丽那,阮景军,程剑平,赵 钢,严 俊*
(1. 成都大学药学与生物工程学院,四川 成都 610106;2.贵州大学麦类作物研究中心,贵州 贵阳 550025)
硒酸钠对不同麦类作物谷胱甘肽过氧化物酶活性的影响
梁 勇1,陈月星1,赵丽那2,阮景军2,程剑平2,赵 钢1,严 俊1*
(1. 成都大学药学与生物工程学院,四川 成都 610106;2.贵州大学麦类作物研究中心,贵州 贵阳 550025)
【目的】本文探究硒对不同麦类谷胱甘肽酶活性的影响。【方法】分别测定在高硒(施30 g/hm2硒酸钠)和低硒(不施硒)条件下,不同麦类作物分蘖期第二片叶谷胱甘肽过氧化物酶(GSH-Px)的活性,分析硒酸钠与 GSH-Px 活性两个因素间的相互作用。【结果】麦类 GSH-Px 活性在高硒环境显著高于低硒环境;不同麦类 GSH-Px 活性对硒敏感度不同。【结论】这为进一步研究麦类硒摄取的生理机制提供了重要依据。
麦类作物;谷胱甘肽过氧化物酶;硒酸钠
【研究意义】麦类作物是一个需氧代谢的有机体,在呼吸作用和光合作用中,活性氧 Reactive Oxygen Species, ROS ) 含量的升高通常是有机体内线粒体、叶绿体和过氧化物酶等的共同作用引起的。当 ROS 值在麦类作物体内积累到某一极限值时,就会破坏细胞的蛋白质和DNA、RNA 以及生物膜内的呼吸链系统,进而对植物造成不可逆的伤害,影响植物正常的生理功能[1]。谷胱甘肽过氧化物酶 (GSH-Px) 是生物机体内一种重要的抗氧化酶[2],它可以在一定程度上降低 ROS 含量,保护植物免受 ROS 的伤害,保证生物体能正常进行生命活动[3],对其研究日益受到重视。研究表明,GSH-Px是一种重要的含硒酶,硒是构成该酶活性中心的必需成分,在硒充足的情况下,GSH-Px 在所有细胞中才能有效表达[4]。因此,探究硒对麦类作物体内谷胱甘肽过氧化物酶活性的影响具有重要意义。植物可以把环境中的无机硒转变为有机硒,供人体利用[5]。通常农业生产中是通过叶面喷硒来实现机体内硒的富集,然而,硒易溶于水,叶面喷硒极易受到外界因素的影响,比如降雨,朝露等造成硒源的流失,很难使机体内硒含量保持稳定。因此,在叶面上喷施硒产生的时效性并不强,并且亚硒酸钠的作用效果比硒酸钠的作用效果差[6]。【前人研究进展】在动物体内,硒含量的高低与谷胱甘肽过氧化物酶活性有着密切的关系[7],人体血清中硒的浓度直接决定着谷胱甘肽过氧化物酶的活性[8],Sag isaka 等发现, 冷处理苹果的谷胱甘肽过氧化物酶活性升高[9],现在谷胱甘肽过氧化物酶已成功在甜橙和芦荟中分离出来[10-11],薛文涛等研究表明,小麦对硒元素的吸收及利用与谷胱甘肽过氧化物酶活性的高低有着直接联系[12]。【本研究切入点】采用将硒酸钠喷施于土壤,分别测定喷洒硒酸钠土壤与没有喷洒硒酸钠土壤的麦类作物分蘖期第二叶的谷胱甘肽过氧化物酶的活性。【拟解决的关键问题】本研究为进一步研究麦类硒富集的生理机制提供依据。
1 材料与方法
1.1 供试材料
共有73个野生和栽培燕麦、大麦、小麦基因型
和品种用于该研究。这些材料分别由意大利农业研究委员会基因组研究中心,以色列海法大学进化研究所,西北农林科技大学和贵州大学等提供。材料基本情况见表1。
1.2 土壤
分别取喷洒硒酸钠和未喷洒硒酸钠的土壤进行晒干,用玛瑙研钵精研至100目左右[13],送四川省农科院分析测试中心测定,结果见表2。
1.3 试验设计
根据Cakmak[14]的实验设计方案,采用有别于常规叶片喷洒硒酸钠的方法[15-17],将定量的硒酸钠水溶液直接喷施于直径为24.5 cm花盆的土壤中,再将土壤靶平,使硒酸钠均匀分布于中上层土壤,每盆6株植株,统一管理,定时定量滴灌。取麦类作物分蘖期第二叶为实验材料,将其置于冰盒中,保存于-70 ℃冰箱待测。

表1 麦类材料基本情况
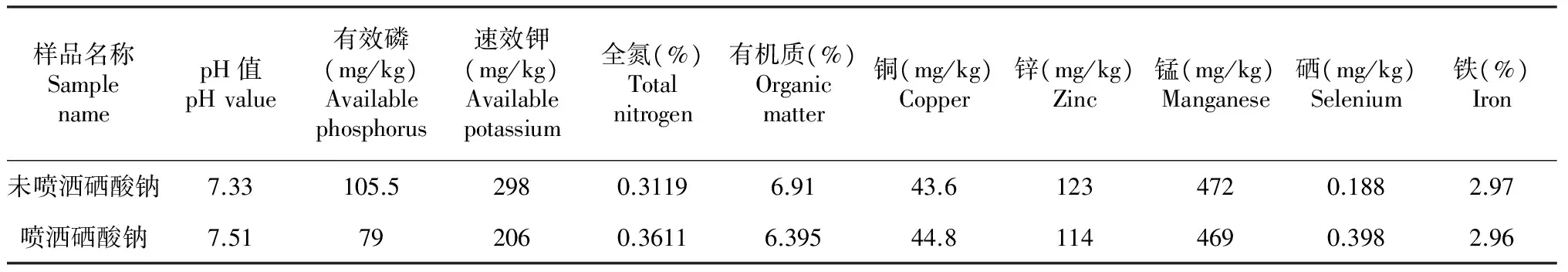
表2 土壤基本性质
1.4 测定方法
将叶片用0.2 mol/L pH 6.2的磷酸缓冲液(含1 mmol/L 乙二胺四乙酸二钠,5 %的聚乙烯吡咯烷酮溶液)提取麦类作物 GSH-Px。以偏磷酸溶液沉淀蛋白质,将二硫代对二硝基苯甲酸 (DTNB) 与 GSH 快速混合5 min后,立即在 412 nm 下测定酶管和非酶管显色反应的 OD 值来测定不同硒处理、不同麦类 GSH-Px 活性的大小。实验操作步骤参照黄爱缨和吴珍龄[18]的方法并略作改进。每个样品重复3次实验,测量结果取平均值。
1.5 数据统计分析
利用JMP6.0等软件对数据进行统计分析,用Sigmaplot 12.0软件绘制柱状图。
2 结果与分析
2.1 GSH-Px 活性差异分析
如图1所示,73个样品在低硒环境中,GSH-Px 活性范围为0.0096~0.2948 mmol/(g FW·min),平均值为0.0522,最低为BZ-008,最高是ITAO-88。通过比较发现,紫青1号、ITAO-88、BZ-030、Nah24的酶活性分别在青稞、栽培燕麦、栽培大麦和野生大麦等样品中相对较高,其余栽培大麦、小麦酶活性相差不明显(方差分析P> 0.05);然而,在高硒环境中,其活性范围为0.2347~3.7527 mmol/(g FW·min),最低是XO-39,最高是Nah23,平均值为1.4351,而且GSH-Px 活性大小在麦类作物中分布也有所不同,在小麦、青稞、野生大麦活性最高的分别是LDN、紫青1号及Nah23,并且分析发现栽培燕麦中相互无统计学差异(P> 0.05),而栽培大麦相互间有显著差异(P< 0.05);此外通过对高硒环境与低硒环境 GSH-Px 活性差值比较发现,最大差值的是Nah23,差值为3.7629,最小的是XO-39,差值为0.2077。

图1 不同麦类作物 GSH-Px 活性Fig.1 GSH-Px activity of different triticeae crops
2.2 不同硒处理 GSH-Px 酶活性的比较分析
将所有麦类材料作为一个整体,比较在不同硒环境中 GSH-Px 酶的活性。在低硒环境中的 GSH-Px 活性平均值为0.0522 μlmol/(gFW·min),在高硒环境中,麦类的 GSH-Px 活性平均值为1.4351 μmol/(gFW·min),是低硒环境平均值的27.49倍。 两环境中 GSH-Px 活性有显著差异(P< 0.05)。
将73个麦类品种按其来源及类别来看,在低硒环境中的栽培大麦、野生燕麦、青稞、小麦、野生大麦和栽培燕麦的 GSH-Px 活性平均值分别为0.0297、0.0471、0.0475、0.0503、0.0563、0.0668 μlmol/(gFW·min);在高硒环境中,其 GSH-Px 活性平均值分别为0.9130、1.0863、1.2079、1.5697、1.6551、1.8569 μmol/(gFW·min),分别是低硒环境 的39.42、36.58、32.90、25.43、23.50、16.22倍。由此可见,不同麦类 GSH-Px 酶活性对硒敏感度不同,其中栽培大麦GSH-Px受硒的影响最大,而栽培燕麦对硒的敏感度相对较小,但总的来看,在施硒后麦类作物谷胱甘肽过氧化物酶活性均有提高,表明直接喷施硒酸钠,可明显提高麦类的 GSH-Px 酶活性水平。
2.3 不同麦类 GHS-Px 酶活性的比较分析
由表3可见,在不同硒环境下 GHS-Px 的活性有显著变化,低硒环境下野生燕麦为 [(0.0297±0.0241) mmol/(g FW·min)],低于其他麦类作物该酶的活性,而在高硒环境下栽培大麦达到 [(1.8569±1.2729) mmol/(g FW·min)],表现出很高的酶活性。总的来看,野生大麦、栽培大麦、小麦、野生燕麦、栽培燕麦和青稞的 GHS-Px 酶活性在高硒时均表现出很高的酶活性,在施硒肥后增幅较大。此外在低硒环境中,各类麦类作物相互间不具有显著性差异(P>0.05);在高硒环境中,它们相互间有不同程度的差异性。不同麦类谷胱甘肽过氧化物酶活性对外源硒敏感度略有差异,其中GSH-Px 活性受外源硒含量影响最大的是栽培大麦,最小的是栽培燕麦。
3 讨 论
谷胱甘肽过氧化物酶 (GSH-Px) 作为细胞内重要的抗氧化酶,正日益受到重视,GSH-Px的生物学功能很多,例如具有清除自由基和保护细胞膜及生物大分子结构等[19]。因此,GSH-Px 活性与生物体的生理机制有重要关联。GSH-Px 的活性中心含有硒代半胱氨酸 (Se-Cys),植物对于硒元素的利用和吸收与植物体内 GSH-Px 活性的高低有着直接的联系[20]。生物体内最重要的一种含硒酶就是谷胱甘肽过氧化物酶,大量研究表明硒能够参与植物的生理代谢,适量的硒可以促进植物叶绿素的生成、增强植物的抗逆抗氧化能力[21],同时,适量浓度的硒对许多植物组织的生理功能有着重要的促进与保护作用[22],此外硒还是 GSH-Px 活性中心的必需成分[23]。因此,利用生物体内 GSH-Px 活性的大小可以反映机体的硒含量来研究 GSH-Px 活性与 Se 的关系[24]。我们之前采用严俊等[25]同样方法对来自以色列的15个群体野生二粒小麦和来自国内6个省区的小麦栽培品种进行实验,不仅在高硒和低硒环境下野生与栽培小麦的GSH-Px活性表现不同,收获的两环境的野生和栽培小麦籽粒硒含量差异也很显著[26],说明不同麦类作物不仅在摄取硒的生理机制上有差异,而且不同品种的作物对土壤硒影响的敏感度也有所不同。作物是否受到体内生理及遗传因素的制约,以及作物对硒的吸收和转化是否有严格的调控作用仍需进一步研究。

表3 不同麦类作物 GSH-Px 活性比较
4 结 论
通过检测不同硒处理对不同麦类 GSH-Px 活性的影响,发现 GSH-Px 活性在不同硒处理和不同的麦类均有所不同,其中栽培大麦的 GSH-Px 活性受外源硒含量影响最大,栽培燕麦 GSH-Px 活性则对外源硒的喷施敏感度最小,而小麦、野生大麦、青稞和野生燕麦 GSH-Px 活性对外源硒喷施的敏感性则居中。
总的来说,硒在麦类植物抗脂质过氧化作用中起着重要作用,在大田作物施肥中,适量增加微量元素硒,将有助于提高作物的抗逆能力,这为进一步研究麦类硒摄取的生理机制提供了重要依据。
[1]肖 蓉,罗慧珍,张小娟,等. 干旱和盐胁迫条件下枣树谷胱甘肽过氧化物酶基因(ZjGPX)的差异表达及功能分析[J]. 中国农业科学,2015,48(14):2806-2817.
[2]张 琛,徐 辉,解书冬,等. 粉棒束孢谷胱甘肽过氧化物酶对氧化胁迫的响应[J]. 中国生物防治学报,2012,28(3):444-447.
[3]龚宏伟,马翎健. 2类小麦雄性不育系育性敏感时期谷胱甘肽过氧化物酶活性及丙二醛含量变化[J]. 江苏农业科学,2013,41(7):60-62.
[4]张丽丽,徐碧玉,刘菊华,等. 香蕉谷胱甘肽过氧化物酶基因MaGPX的克隆和表达分析[J]. 园艺学报,2012,39(8):1471-1481.
[5 ]刘 庆,田 侠,史衍玺,等. 外源硒矿粉对玉米硒累积及矿质元素吸收的影响[J]. 植物营养与肥料学报,2016,22(2):403-09.
[6]赵会杰,刘华山,林学梧,等. 小麦胞质不育系花粉败育与活性氧代谢关系的研究[J]. 作物学报,1996,22(3):365-368.
[7]Burk R F. Biological Activity of Selenium[J]. Ann Rev.Nutr, 1983(3):53-70.
[8]Hafeman D G, Sunde R A, Hoeckstra W G. Effect of dietary selenium on erythrocyte and liver glutathione peroxidase in the rat[J]. Nutr, 1996(10):580-587.
[9]Kuroda H, Sagisaka S, Chiba K. Peroxide-scavenging systems during cold acclimation of apple callus in culture[J]. Plant Cell Physiol, 1992, 33: 743-750.
[10]Ben-Hayyim G, Faltin Z, Gepstein S, et al. Isolation and characterization of salt-associated protein in citrus[J]. Plant Sci, 1993, 88: 129-140.
[11]Sabeh F, Wright T,Norton S J. Purification and characterization of a glutathione peroxidase from the Aloe vera plant[J]. Enzyme.Prot, 1993, 47:92-98.
[12]薛文韬,严 俊,杨荣志,等. 硒酸钠对小麦谷胱甘肽过氧化物酶活性的影响[J]. 贵州农业科学,2010,38(12):89-91.
[13]丁文慈,赵由之,赵彦龙,等. 海南南山长寿区土壤微量元素含量分析[J]. 琼州学院学报,2013,20(2):15-18.
[14]Cakmak I, Yilmaz A, Kalayci M, et al. Zinc deficiency as a critical problem in wheat production in Central Anatolia[J]. Plant & Soil, 1996, 180(2):165-172.
[15]刘世亮,马 闯,介晓磊,等. 喷施亚硒酸钠对紫花苜蓿干草产量和品质的影响[J]. 草业科学,2008,25(8):73-78.
[16]王淑珍,赵喜茹,王喜枝,等. 叶面喷施亚硒酸钠对大蒜光合作用及产量品质的影响[J]. 中国农学通报,2008,24(4):294-297.
[17]吴正景,郭大龙,高 文. 不同时期喷施亚硒酸钠对豌豆芽苗生长及硒含量的影响[J]. 种子,2008,27(8):40-42.
[18]黄爱缨,吴珍龄. 水稻谷胱甘肽过氧化物酶的测定法[J]. 西南大学学报:自然科学版,1999(4):324-327.
[19]R Corrocher, M Casaril, G Bellisola, et al. Severe impairment of antioxidant system in human hepatoma[J]. Cancer, 1986, 58(8): 1658-1662.
[20]薛文韬,严 俊,杨荣志,等. 硒酸钠对小麦谷胱甘肽过氧化物酶活性的影响[J]. 贵州农业科学,2010,38(12):89-91.
[21]覃思跃,赵文龙,李 俊,等. 硒与硫单一及交互作用对小白菜生长及硒生物有效性的影响[J]. 环境科学学报,2016,36(4):1500-1507.
[22]马小灵,唐维龙,刘 芳,等. 施肥富硒对茶油主要化学特性及功能性成分的影响[J]. 粮食与油脂,2015,40(11):148-154.
[23]郭 玲. 含硒的谷胱甘肽过氧化物酶与人类健康的关系[J]. 微量元素与健康研究,2002,19(1):69-72.
[24]董卫华,吴珍龄. Na2SeO3对麦苗谷胱甘肽过氧化物酶影响的研究[J]. 西南农业大学学报,2004,26(4):474-478.
[25]严 俊,薛文韬,何 跃,等. 以色列二穗短柄草谷胱甘肽过氧化物酶活性分析[J]. 山地农业生物学报,2011,30(3):198-202.
[26]Yan Jun. Grain Mineral and Protein Concentrations of Wild Emmer Wheat (Triticumdicoccoides) and Wild Barley (Hordeumspontaneum) and Their Potential for Crop Improvement[D]. Haifa, University of Haifa, 2010.
(责任编辑 陈 虹)
Effect of Sodium Selenate on Glutathione PeroxidaseActivity of Different Triticeae Crops
LIANG Yong1,CHEN Yue-xing1,ZHAO Li-na2,RUAN Jing-jun2,CHENG Jian-ping2,ZHAO Gang1,YAN Jun1 *
(1.School of Pharmacy and Bioengineering, Chengdu University, Sichuan Chengdu 610106, China; 2.Institute of Triticeae Crops, Guizhou University, Guizhou Guiyang 550025, China)
【Objective】The present study was conducted to explore the effect of selenium (Se) on different triticeae crops glutathione enzyme activity. 【Method】Under the different condition of low Se (not applied Se) and high Se (30 g/hm2sodium selenate), the activity of the glutathione enzyme of the second leaf of triticeae crops in tillering stage was tested, respectively. The interaction between sodium selenate and glutathione enzyme (GSH-Px) activity was analyzed. 【Result】The glutathione enzyme activity of the triticeae crops in the high Se environment was significantly higher than low Se environment, and different triticeae crops glutathione enzyme activities had different sensitivity for Se. 【Conclusion】This study would provide important basis for further research of the physiological mechanism of sodium selenate intake of triticeae crops.
Triticeae crops; Glutathione peroxidase; Sodium selenate
1001-4829(2017)7-1511-05
10.16213/j.cnki.scjas.2017.7.008
2016-07-10
国家国际科技合作专项项目(2013DFA32200);成都大学大学生创新训练计划孵化培育项目(CDU-CX-2016152)
梁 勇(1993-),男,河北承德人,药学与生物工程学院生物工程专业,E-mail:2838574796@qq.com;*为通讯作者:严 俊,博士,教授,E-mail:yanjun62@qq.com。
S512
A
