脂多糖对人鼻黏膜上皮细胞人β防御素2诱导表达的影响△
2017-08-11胡秀娟刘海兵贺广湘
胡秀娟 刘海兵 贺广湘
·基础研究·
脂多糖对人鼻黏膜上皮细胞人β防御素2诱导表达的影响△
胡秀娟 刘海兵 贺广湘*
目的 观察脂多糖(LPS)诱导人鼻黏膜上皮细胞人β防御素2(hBD-2)表达的影响。方法 用LPS刺激人鼻黏膜上皮细胞,反转录聚合酶链反应(RT-PCR)检测hBD-2 mRNA的表达,免疫细胞化学检测hBD-2蛋白的表达。结果 LPS刺激2 h后人鼻黏膜上皮细胞可见hBD-2 mRNA的表达,并呈剂量和时间依赖性;刺激4 h后人鼻黏膜上皮细胞胞质中可见hBD-2蛋白的表达。结论 一定剂量的LPS可诱导人鼻黏膜上皮细胞hBD-2的表达,这种表达具有一定的剂量和时间依赖性。(中国眼耳鼻喉科杂志,2017,17:245-248)
人鼻黏膜上皮细胞;人β防御素2;脂多糖
鼻-鼻窦炎是常见的难治性疾病,发病率高达16%,极大影响了人们的健康和生活质量[1]。目前其治疗效果欠佳,复发率高。而人β防御素2(human β defensin 2, hBD-2)广泛表达于包括鼻黏膜在内的各种黏膜细胞和上皮组织,不仅具有广谱抗微生物活性,迄今未发现对其有明显抗性的噬菌体,而且在先天性免疫和获得性免疫中发挥重要作用[2]。因此作为内源性“超级抗生素”的hBD-2有可能成为一种新型的鼻-鼻窦炎治疗药物,既能解决细菌耐药问题,又能发挥免疫防御功能,在治疗鼻-鼻窦炎中具有广泛的应用前景,可能给鼻-鼻窦炎的治疗带来新的革命,值得进一步深入研究。本研究在前期研究的基础上,进一步深入研究脂多糖(lipopolysaccharide, LPS)对鼻黏膜上皮细胞hBD-2的诱导表达作用,以期从分子生物学水平明确鼻黏膜上皮细胞中hBD-2诱导表达的规律和机制,为深入研究鼻-鼻窦炎的有效防治提供理论依据和线索。
1 材料与方法
1.1 主要试剂及材料 DMEM:Ham F12以1∶1配比,0.25%胶原酶、Hank液(Hyclone公司),Keratinocyte-SFM(GIBCO公司),胎牛血清(四季清公司),I型胶原酶和LPS购自Sigma公司,BD-2(C-17)(SC-10854,美国SANTA公司),Total RNA 试剂盒Ⅱ(R6934-01,OMEGA公司),Rever Tra Ace qPCR RT试剂盒(TOYOBO公司),2×Taq Master Mix、DNA Marker(TIANGEN公司),hBD-2上下游引物(255 bp)、GAPDH上下游引物(452 bp)均由上海生工公司合成。
1.2 原代鼻黏膜上皮细胞的分离和培养 标本来自湘雅三医院耳鼻咽喉头颈外科同期做鼻中隔矫正术、鼻腔血管电凝术患者。经患者同意,在行鼻内镜手术时取其下鼻甲黏膜。所有患者无全身及鼻腔局部炎症、无变态反应性疾病,取材前近2个月无全身及局部应用糖皮质激素及其他抑制细胞生长药物史,无鼻手术、外伤史。在无菌条件下,生理盐水浸洗,去除粘附的鼻甲、坏死组织及黏液、血液,放入4 ℃的保存液中转运到细胞培养室。4 h内于无菌超净台上,用含10 mg/L氟康唑和100 mg/L庆大霉素的生理盐水反复冲洗下鼻甲黏膜3~5遍后,将下鼻甲黏膜剪成1 mm ×1 mm×1 mm大小的组织块。参照王振霖等[3]的方法并略作改动,以组织块30~50倍体积的0.1% 胶原酶37 ℃消化30 min,加入等量0.25%的胰蛋白酶消化5 min,加入适量含15%血清的DMEM/F12培养基终止消化。静置后组织块沉于无菌玻璃皿底时,吸去上清液,以1 mL无菌注射器挑起组织块,均匀种植于25 cm×25 cm瓶底,翻转培养瓶,在对侧加入5 mL含15%血清的DMEM/F12培养基,37 ℃、5%CO2、95% O2培养箱中培养24 h后翻转培养瓶。48 h 后更换Keratinocyte-SFM(K-SFM)培养基继续培养,每4 d换液。传代后种板,72 h后进行细胞角蛋白鉴定。
1.3 LPS刺激鼻黏膜上皮细胞 待第10天左右细胞呈对数生长时进行消化传代,以1∶3的比例种板。待细胞基本融合,生长状态良好时分别予以LPS 0、1、10 μg/mL的浓度进行刺激,并取LPS 10 μg/mL的浓度分别刺激鼻黏膜上皮细胞0、2、4、6、24 h,收集不同浓度刺激后的细胞总RNA及不同时相点的细胞总RNA,以LPS 10 μg/mL的浓度刺激鼻黏膜上皮细胞4 h后检测胞质蛋白。
1.4 反转录聚合酶链反应 采用Trizol法抽提总RNA,行完整性检测。根据反转录试剂盒说明配置反应体系:5×RT缓冲液4 μL、RT Enzyme Mix 1 μL、Primer Mix 1 μL、RNA 3 μg(通过所测浓度依次计算需加入反应体系的各样本RNA体积),最后加入Nuclease-free Water使总体积达20 μL。在37 ℃反转录成cDNA,参照试剂盒说明书加样至20 μL体系,反应条件为95 ℃预变性1 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共33个循环,72 ℃延伸10 min,4 ℃保存。阳性对照GAPDH,产物长度为452 bp,上游:5′-ACC ACA GTC CAT GCC ATC AC-3′,下游:5′-TCC ACC ACC CTG TTG CTG TA-3′;hBD-2引物上游: 5′-CCA GCC ATC AGC CAT GAC GGT-3′,下游:5′-GGA GCC CTT TCT GAA TCC GCA-3′,产物长度为255 bp。
1.5 免疫细胞化学检测 磷酸盐缓冲液(phosphate buffer saline, PBS)漂洗细胞后用4%多聚甲醛固定,3%H2O2室温孵育去除内源性过氧化物酶,0.2%的Triton X-100室温处理30 min增加细胞膜通透性,封闭液封闭,一抗(山羊抗hBD-2)孵育过夜,二抗孵育2 h。二氨基联苯胺(DAB)显色,苏木素复染,树胶封片。本组实验中LPS 0 μg/mL为对照组。
1.6 结果判定标准 各测量组的电泳图片用凝胶成像系统照相后进行吸光度值测定,将目的基因的吸光度值与GAPDH的吸光度值进行比较,得出相对值。相对值越高,说明目的基因转录水平越高。hBD-2在黏膜上皮细胞胞质中呈现棕黄色或棕黄色颗粒为阳性,与苏木素复染后细胞核蓝染不重叠,定位区分明确。
2 结果
2.1 LPS刺激鼻黏膜上皮细胞对hBD-2 mRNA表达的作用 不同浓度的LPS(0、1、10 μg/mL)刺激鼻黏膜上皮细胞4 h后,hBD-2 mRNA表达呈剂量依赖性升高,经电泳后在凝胶上呈现的亮度随着刺激浓度的增加而增加(图1)。将hBD-2mRNA与GAPDH的吸光度比值[LPS为0、1、10 μg/mL时分别为(0.35±0.035)(0.51±0.009)(0.62±0.002)]进行比较,可见两两比较差异有统计学意义(P<0.05)。
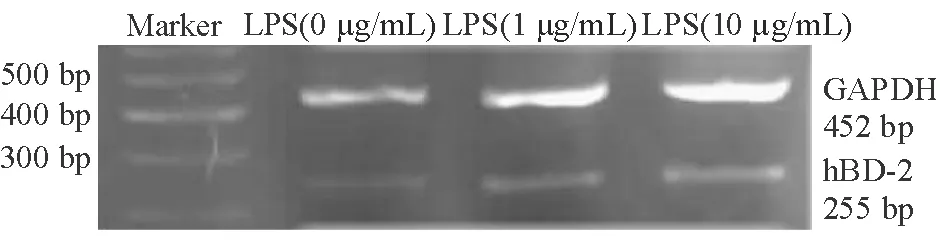
图1. LPS刺激鼻黏膜上皮细胞对hBD-2mRNA表达的作用
2.2 一定浓度LPS不同时间点刺激上皮细胞对hBD-2 mRNA表达的作用 用一定浓度的LPS(10 μg/mL)刺激鼻黏膜上皮细胞,在0、2、4、6、24 h时检测hBD-2mRNA的表达。从电泳后的凝胶上呈现的亮度变化可见看出,2 h时可见鼻黏膜上皮细胞中hBD-2 mRNA表达,4 h表达最明显,6 h有所下降,24 h后降低明显(图2)。将hBD-2 mRNA与GAPDH的吸光度比值[0、2、4、6、24 h后分别为(0.44±0.029)(0.56±0.029)(0.60±0.028)(0.52±0.029)(0.50±0.027)]进行比较,可见两两比较差异有统计学意义(P<0.05)。

图2. hBD-2mRNA表达与LPS刺激的时效关系
2.3 免疫细胞化学检测hBD-2的表达 正常情况下,未受刺激的对照组鼻黏膜上皮细胞胞质呈半透明状,基本未检测到hBD-2蛋白的表达;用一定浓度的LPS(10 μg/mL)刺激4 h,免疫细胞化学法证实鼻黏膜上皮细胞有hBD-2蛋白表达,主要分布在胞质中,呈棕色颗粒(图3)。
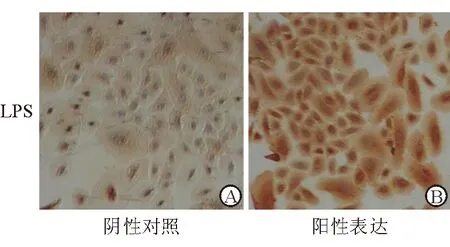
图3. 鼻黏膜上皮细胞免疫细胞化学染色(SP法×100倍) A.未受刺激的对照组鼻黏膜上皮细胞胞质呈半透明状;B.受刺激的鼻黏膜上皮细胞胞质黄染
3 讨论
hBD-2是人体内发现的富含半胱氨酸的内源性抗微生物活性肽,具有抵御病原微生物入侵的生物活性,参与了许多疾病的病理生理过程。与hBD-1的固有表达不同,hBD-2在某些组织如气道上皮中呈微量的固有表达,但主要表现为受到炎症刺激后的诱导表达。可诱导hBD-2表达的因素包括大肠埃希菌、铜绿假单胞菌、肺炎链球菌、肺炎杆菌、金黄色葡萄球菌、鲁斯假丝酵母(念珠菌)、白假丝酵母、人类免疫缺陷病毒(HIV-1)等微生物;一些细胞因子如白细胞介素α(interleukin α,IL-α)、IL-β、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-γ、L-异亮氨酸和LPS等物质也可诱导hBD-2的表达。不同的微生物成分可诱导不同防御素分子的表达,以对抗不同微生物感染,而不同刺激因素对hBD-2的诱导存在着明显的不同[4-7]。近年来对hBD-2的诱导研究以及诱导表达机制的研究也越来越多。
鼻部炎症性疾病多与革兰阳性球菌、革兰阴性杆菌以及真菌感染等有关。LPS是含糖和脂的化合物,糖多于脂,是革兰阴性细菌外膜的主要成分,可作用于体内的巨噬细胞等,使之产生IL-1、IL-6和TNF-α等细胞因子[8]。因此,用LPS刺激鼻黏膜上皮细胞从而诱导hBD-2的表达具有一定的代表性。
目前关于鼻部hBD-2表达的研究也不少,但系统应用革兰阴性菌毒性物质诱导hBD-2的表达尚罕见报道。因此本实验系统应用革兰阴性菌毒性物质LPS刺激培养的鼻黏膜上皮细胞,观察hBD-2的表达,发现LPS能诱导鼻黏膜上皮细胞中hBD-2的表达,且在一定剂量范围内呈现剂量依赖性,这与文献[9]报道LPS诱导人气道上皮细胞hBD-2的表达规律一致。另外,一定浓度LPS(10 μg/mL)刺激鼻黏膜上皮细胞时,发现刺激2 h时hBD-2的表达增加,4 h时表达增加明显,6 h时较4 h有所减少,24 h时开始降低,说明当病原微生物侵袭上呼吸道时,hBD-2的表达、分泌可能是上呼吸道最初的防御反应,参与早期的抗菌过程。
hBD-2诱导表达的机制和信号传导通路目前并不完全清楚。有研究[10-12]发现,首先各种刺激因素被靶细胞上的病原识别受体识别,如Toll样受体、CD14等,然后通过某种信号通路传导这种刺激并诱导hBD-2表达和上调。Scharf等[12]研究发现,嗜肺军团杆菌刺激人肺上皮细胞诱导hBD-2表达是通过TLR2和TLR5介导的,同时p38MAPK、JNK、核因子κB(nuclear factor κB,NF-κB)和AP-1信号通路都参与了调控。赵俊丽等[13]发现LPS可能通过TLR4/NF-κB信号传导通路诱导肾小管上皮细胞表达hBD-2。有学者[14]在体外白假丝酵母刺激食管细胞株诱导hBD-2和hBD-3表达实验中发现,两者调控的信号传导通路是不同的,其中hBD-2表达调控的信号传导通路是NF-κB和AP-1信号传导通路协同作用,而hBD-3是独立依赖EGFR/MAPK/AP-1信号传导通路调控。Yoon等[15]发现脆弱类杆菌肠毒素刺激小肠上皮细胞诱导hBD-2的表达时需要通过丝裂原激活蛋白激酶/IκB激酶/NF-κB信号传导通路。以上研究表明,不同防御素表达调控的信号传导通路是不同的[14],并且hBD-2的诱导表达也可能是通过多种信号通路实现的。外来刺激信号通过激活NF-κB可能是上皮细胞hBD-2基因激活的机制之一。然而亦可能还有其他激活通路,如p38MAPK、JNK、NF-κB和AP-1途径。李同丽等[16]的实验证实LPS刺激鼻黏膜上皮细胞致炎在 30 min 内和浓度在1 mg/L内是以时间和浓度“正依赖”方式导致p38MAPK的活性增强。
本实验不足之处在于没有用更多的刺激浓度刺激鼻黏膜上皮细胞,但目前诱导表达规律的揭示,为下一步通过信号通路基因芯片对鼻黏膜上皮细胞诱导hBD-2表达的调控信号通路进行检测奠定了基础。
[ 1 ] Suh JD, Cohen NA, Palmer JN. Biofilms in chronic rhinosinusitis[J]. Curr Opin Otolaryngol Head Neck Surg,2010,18(1):27-31.
[ 2 ] 周海,卫丽,马萍,等.人防御素2的研究进展[J]. 重庆医学,2014,43(11):1386-1387.
[ 3 ] 王振霖,张秋航,李源,等.人鼻黏膜上皮细胞2种原代体外培养方案的比较研究[J]. 临床耳鼻咽喉头颈外科杂志,2008,22(17):776-779.
[ 4 ] Schneider JJ,Unholzer A,Schaller M,et al. Human defensins[J]. J Mol Med, 2005, 83(8):587-95.
[ 5 ] Pazgier M, Hoover DM, Yang D,et al. Human β-defensins[J]. Cell Mol Life Sci CMLS,2006,63(11):1294-1313.
[ 6 ] Auvynet C,Rosenstein Y.Multifunctional host defense peptides:antimicrobial peptides,the small yet big players in innate and adaptive immunity[J].FEBS J, 2009,276(22):6497-6508.
[ 7 ] Kruse T,Kristensen HH.Using antimicrobial host defense peptides as anti-infective and immunomodulatoyr agents[J].Expert Rev Anti Infect Ther,2008,6(6):887-895.
[ 8 ] 全国科学技术名词审定委员会.脂多糖 [DB/OL]. http://baike.baidu.com/view/1149753.htm.
[ 9 ] 廖伟.人气道上皮细胞抗菌肽hBD-2诱导表达的信号途径及影响[D]. 重庆:第三军医大学,2006.
[10] Redfern RL,Reins RY,McDermott AM.Toll-like receptor activation modulates antimicrobial peptide expression by ocular surface cells[J].Exp Eye Res,2011,92(3):209-220.
[11] Romano CC, Mazzola N,Paolillo R,et al.Toll-like receptor 4(TLR4)mediates human beta-defensin-2(HBD-2)induction in response to Chlamydia pneumonia in mononuclear cell[J].FEMS Immunol Med Microbiol,2009,57(2):116-124.
[12] Scharf S,Hippenstiel S,Flieger A,et al.Induction of human β-defensin-2 in pulmonary epithelial cells by Legionella pneumophila:involvement of TLR2 and TLR5,p38MAPK,JNK,NF-κB and AP-1[J]. AJP Lung Cell Mol Physiol,2010,298(5):L687-95.
[13] 赵俊丽,王俭勤,王晶宇. LPS 通过 TLR4 信号通路诱导人肾小管上皮细胞株(HK-2)表达 hBD-2[J].免疫学杂志,2013,29(3):222-225.
[14] Steubesand N,Kiehne K,Brunke G,et al. The expression of the β-defensins hBD-2 and hBD-3 is differentially regulated by NF-κB and MAPK/AP-1 pathways in an in vitro model of Candida esophagitis[J]. BMC Immunol, 2009, 10(1):36.
[15] Yoon YM,Lee JY,Yoo D,et al.Bacteroides fragilis enterotoxin induces human beta-defensin-2 expression in intestinal epithelial cells via a mitogen-activated protein kinase/I kappaB kinase/NF-kappaB-dependent pathway[J].Infect Immun,2010,78(5):2024-2033.
[16] 李同丽,李源,张革化. 细菌脂多糖诱导离体鼻黏膜上皮细胞致炎后 p38MAPK 的活性变化及意义[J]. 临床耳鼻咽喉头颈外科杂志,2005,19(13):607-610.
(本文编辑 杨美琴)
Roles of lipopolysaccharide in the expression of human β defensin 2 in human nasal mucosa epithelial cells
HU Xiu-juan, LIU Hai-bing, HE Guang-xiang*.
Department of Otolaryngology Head and Neck Surgery, the Affiliated Hospital of Chengdu University, Chengdu 610081, China
HE Guang-xiang, Email: hgx2000@163.com
Objective To explore the role of lipopolysaccharide (LPS) in the expression of human β defensin 2(hBD-2) in human nasal mucosa epithelial cells. Methods After the human nasal mucosa epithelial cells were stimulated with LPS, the expression of hBD-2 mRNA was detected by reverse transcription polymerase chain reaction (RT-PCR) and the expression of hBD-2 protein was detected by immunocytochemistry. Results The hBD-2 mRNA could be detected 2 hours after LPS stimulation and expressed in a dose- and time-dependent manner. The hBD-2 protein could be detected in cytoplasm 4 hours after LPS stimulation. Conclusions A certain dose of LPS could induce the expression of hBD-2 in human nasal mucosa epithelial cells in a dose- and time-dependent manner. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:245-248)
Human nasal mucosa epithelial cells; Human β defensin 2; Lipopolysaccharide
湖南省自然科学基金项目(14JJ2038);湖南省长沙市科技项目(K1203050-31)
成都大学附属医院耳鼻咽喉头颈外科 成都 610081;*中南大学湘雅三医院耳鼻咽喉头颈外科 长沙 410013
贺广湘(Email: hgx2000@163.com)
10.14166/j.issn.1671-2420.2017.04.005
2016-11-17)
