一株普通鵟源H9N2亚型禽流感病毒的分离鉴定
2017-08-10曾志燎茹开卓温暖玲茹正忠
曾志燎,茹开卓,温暖玲,茹正忠*
(1.深圳市野生动物救护中心,广东深圳 440300;2.深圳市真和丽生态环境建设有限公司,广东深圳 440300)
一株普通鵟源H9N2亚型禽流感病毒的分离鉴定
曾志燎1,茹开卓1,温暖玲2,茹正忠1*
(1.深圳市野生动物救护中心,广东深圳 440300;2.深圳市真和丽生态环境建设有限公司,广东深圳 440300)
从深圳野生鸟类救护基地的1只普通鵟的泄殖腔拭子中分离到1株禽流感病毒,将该禽流感病毒进行鸡胚接种和HA、HI试验鉴定、HA基因扩增及测序分析,并进行致病性试验。结果表明,该分离株为H9N2亚型禽流感病毒, 按照国际流感病毒系统命名原则将该病毒株暂命名为A/Wild bird /Guangdong/ SZ-YN05/2015(H9N2)。进化分析显示,该毒株属于4.2.1分支,与SS/94株同源性较低,与A/Chicken/Shandong/GM-TH/2014(H9N2)的遗传距离最近。同时以血凝价HA 8 log2 病毒尿囊液稀释200倍静脉注射接种感染4周SPF鸡,感染3 d后从心、肝、肺、肾、气管、咽及肛分别检测到病毒,感染7 d后从心、肝、肺、肾、气管均未分离到病毒,咽部病毒分离率2/6,肛部病毒分离率3/6。
H9N2亚型禽流感病毒;分离鉴定;HA基因
禽流感(Avian influenza,AI)是由禽流感病毒(Avian influenza virus,AIV)引起的一种烈性传染病。禽流感病毒是分节段的单股负链RNA病毒,宿主范围较广[1],据报道,主要有鸡、火鸡、鸭、鹌鹑、鹧鸪及鹅等家禽[2],天鹅、鸵鸟、燕鸥及海鸠等野禽,甚至还包括了人、老鼠及猪、马等哺乳动物[3],从而给社会公共安全带来了一定的威胁。20世纪初,包括我国在内,泰国、巴基斯坦、澳大利亚、日本及伊拉克等国相继从死亡野生鸟类中分离到了H7N1、H5N1及H9N2等亚型AIV[4]。截止2016年初,摩洛哥于2016年1月中旬首次暴发了H9N2亚型禽流感[5],而我国的上海、山东及安徽等近几年也相聚分离到了几株H9N2亚型禽流感病毒[6-7],而H9N2亚型禽流感能够跨地域出现,与野生鸟类的迁徙不无关系。据研究表明,我国的华东和华南等养禽业比较发达的地区为H9N2亚型禽流感病毒的主要分布区[8],而深圳属于华南地区,同时也是候鸟留鸟等的迁徙途径之地,野生鸟类作为病原的携带者,是病毒跨地域扩散的潜在宿主。因此,务必引起一定程度的重视[9]。
本研究是将2015年从深圳野生鸟类救护基地的1只普通鵟的拭子中分离到的1株禽流感病毒进行鉴定与生物信息学分析及致病性试验,为野生禽类的禽流感流行情况和防控提供一定的数据。
1 材料与方法
1.1 材料
1.1.1 样本和SPF鸡 样本来源于2015年广东省深圳市野生鸟类救护基地的1只普通鵟的拭子样本,置于病毒运输保存液中低温保存;9日龄~11日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.1.2 主要试剂 H9标准抗原购自中国农业科学院哈尔滨兽医研究所;抗新城疫病毒、抗H5和H9亚型禽流感病毒等标准阳性血清购自中国农业科学院哈尔滨兽医研究所;病毒核酸提取试剂盒、cDNA反转录酶、ExTaqDNA 聚合酶、质粒pMD 18-T simple vector 、大肠埃希菌DH5α、DNA Marker DL 2 000,宝生物工程(大连)有限公司产品;胶回收纯化试剂盒,OMEGA公司产品。
1.2 方法
1.2.1 病毒的分离与HA亚型的鉴定 无菌处理采集的泄殖腔拭子,按照0.1 mL/胚接种9日龄~11日龄SPF鸡胚尿囊腔,37℃孵化,每天照蛋2次,连续观察6 d,弃去24 h污染死胚,将死亡或濒死鸡胚置4℃ 4 h以上,剖检,观察胚胎病变,收获1 d~4 d内活的或死亡的鸡胚尿囊液,测其血凝效价,根据Reed-Muench法计算EID50。
将有血凝活性的鸡胚尿囊液分别与抗新城疫病毒、抗H5及H9亚型禽流感病毒的标准阳性血清进行血凝抑制(HI)试验,具体操作程序按照OIE的国际标准方法进行[9],将鉴定过的病毒分装,置-70℃保存备用。
1.2.2 病毒特异性片段的PCR 扩增及序列测定
1.2.2.1 引物设计 参考GenBank中发表的禽流感病毒基因序列(登录号: KC986294、AY790313),用 Primer 5 .0软件设计1对HA 基因引物,预期扩增的片段长度为1 696 bp,由上海生工生物工程技术服务有限公司合成,引物序列如下:
HA-F:TCAAGATGGAAGTAGTATCACT
HA-R:TTTGCCAATTATATACAAATGTTG
1.2.2.2 病毒核酸的提取与扩增 根据病毒核酸提取试剂盒说明书提取收集的鸡胚尿囊腔病毒液的总RNA,用反转录试剂盒将RNA反转录成cDNA,以cDNA为模板按以下程序进行PCR扩增:95℃ 5 min,然后进入循环:94℃ 30 s,55℃ 30 s,72℃ 1 min~3 min, 35个循环;72℃ 10 min。将5 μL PCR产物于10 g/L的琼脂糖凝胶上样孔中,130 V电泳30 min进行检测。用胶回收试剂盒回收PCR产物,用于克隆。
1.2.2.3 HA序列的测定与分析 将胶回收产物连接至pMD 18-T simple vector,进行克隆,并将克隆产物送至深圳华大基因有限公司测序。将所获取的序列用DNA Star 7.0进行拼接与分析,获得HA全基因序列。从Influenza Virus Sequence Database中选取51株H9N2亚型AIV株HA基因;再从近年本中心从国内19省鉴定的100株鸡源的H9N2亚型AIV基因序列和29个WS参考序列;用MEGA4.0基因分析软件绘制1980年-2015年中国H9N2禽流感病毒HA基因分子进化树。
1.2.3 分离株对SPF鸡的致病性试验 以106EID50或10 log2尿囊液10倍稀释,静脉注射接种 3
周龄SPF鸡(10只),接种后3 d~7 d咽肛拭子采集,检测排毒情况;接种后3 d和7 d各取3只鸡进行剖检,取气管、肺、肝、脾、肾各1 g,用含双抗的PBS碾磨匀浆1 mL,接种9日龄鸡胚,48 h收取尿囊液测HA效价;并于接种后3、7、14、21、28 d各采血1 mL,分离血清,测抗体效价。
2 结果
2.1 病毒的分离与HA亚型的鉴定
拭子经过处理后接种9 d~11 d SPF鸡胚,收集到的鸡胚尿囊液能够凝集1%的鸡红细胞,血凝价为10 log2,根据Reed-Muench法计算EID50为106。用抗新城疫病毒、H5和H9亚型禽流感病毒的标准阳性血清进行血凝抑制(HI)试验,抗新城疫病毒和抗H5亚型禽流感病毒标准阳性血清对该病毒血凝不产生抑制作用,而抗H9亚型禽流感病毒标准阳性血清能够产生抑制作用,血凝抑制效价达到8 log2,从而表明这份尿囊液含有H9亚型禽流感病毒。
2.2 病毒特异性片段的PCR 扩增及序列测定
病毒特异性片段经过PCR扩增得到了目的片段,通过克隆及测序所获得的HA序列长度为1 696 bp,包含有完整的开放阅读框,与预期相符。将测序获得的HA基因序列经DNA Star 7.0 软件包中的Seqman 软件校对正确无误后,登录NCBI进行Blast 分析,分析鉴定为H9N2亚型禽流感病毒,命名为A/Wild bird/Guangdong/SZ-YN05/2015(H9N2)。与GenBank中的毒株A/Chicken/Shandong/GM-TH/2014(H9N2)的遗传距离最近,同源性为97.5%。
2.3 分离株对SPF鸡的致病性试验
以血凝价HA为 8log2 病毒尿囊液稀释200倍静脉注射接种感染4周龄SPF鸡,感染后3 d,心、肝、肺、肾、气管、咽及肛分别检测到病毒,感染后7 d,心、肝、肺、肾及气管未分离到病毒,咽部病毒分离率2/6,肛部病毒分离率3/6,如表1所示。
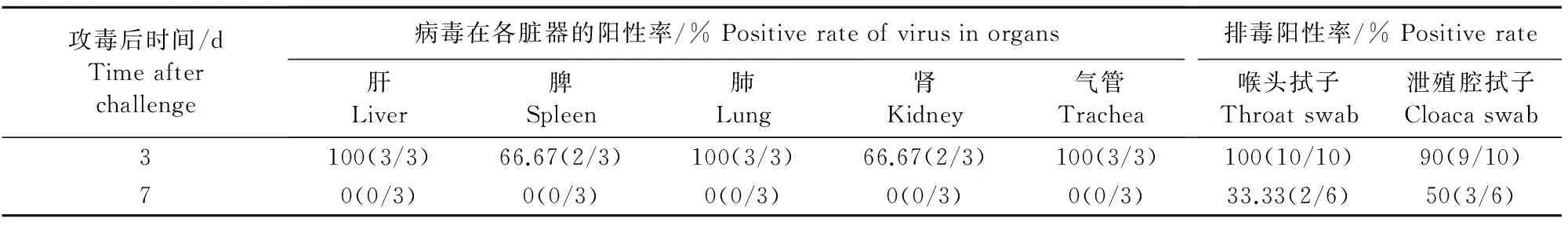
表1 A/Wild bird/Guangdong/SZ-YN05/2015(H9N2)感染 SPF鸡病毒分布情况
3 讨论
2015年从深圳野生鸟类救护基地的一只普通鵟的泄殖腔拭子中分离到的H9N2亚型禽流感病毒,按照国际流感病毒系统命名原则将该病毒株暂命名为A/Wild bird /Guangdong/ SZ-YN05/2015(H9N2),为国内外首次从普通鵟中分离到的禽流感病毒。禽流感是由A型流感病毒引起的可感染禽类和人类等具有宿主广泛性的一类高度接触性传染病。世界上第1株H9N2亚型禽流感病毒Ty/Wisconsin/1/66于1966年由Homme分离得到,在我国的第1株H9N2亚型禽流感病毒被陈伯伦所分离[10],时隔半个世纪,虽然H9N2目前还没有对养殖业造成明显的损失,只是潜在的降低生产能力等,但是,禽流感病毒的HA亚型基因与NA亚型基因的复杂性,决定了禽流感高变异的性质,低致病性会向高致病性突变,且宿主范围也越来越广,从1999 年第1次分离到了人源H9N2 亚型禽流感病毒后,人源H9N2 亚型禽流感的报道逐渐增多,可见H9N2亚型禽流感传播的广泛性。据报道,某些宿主存在高致病性和低致病性禽流感混合感染的情况,在此条件下,很难否定高致病性禽流感与低致病性禽流感的基因会因抗原漂移发生重组变异甚至产生新的病毒[11],增加禽流感的防控难度。
野生鸟类携带禽流感病毒现象十分普遍,在鸡、鸭、鹅、斑鸠、麻雀、百灵、八哥及天鹅等许多鸟类身上都检测出AIV抗体阳性[12]。经研究揭示,迁徙候鸟在禽流感病毒全球性传播中扮演着“载体”和“传播器”的重要角色[13]。野禽尤其是水禽是流感病毒的巨大储库,迄今已在88种鸟类中分离到病毒。候鸟可以在迁徙过程中通过直接接触或水媒介将自身携带的病毒传播给家禽[14]。而在一些地方,存在人类捕捉候鸟的情况,从而使禽流感病毒得以感染人类。虽然从野生鸟类,包括野鸭身上分离出的禽流感病毒基本上都是低致病性病毒,但是,AIV具有高度的诱导突变能力,能迅速改变其类型和毒力,最终成为具有高致病性的类型。因此,家禽暴发禽流感与野鸟是密切相关的。为了控制野生鸟类向家禽传播禽流感,进而预测和有效防治禽流感的暴发,对野鸟的带毒状况进行监测和分析是十分必要的。野鸟群体庞大,种类繁多,候鸟来去路径复杂,存在传播扩散禽流感病毒的较高风险,对该区域野生鸟类及周边区域家禽建立长期科学的禽流感流行病学监测调查,及时客观的评价周边区域感染及防控状态,对禽流感疫情的预警和制定科学的防控措施有着重要意义。
[1] Tollis M,Di Trani L.Recent developments in avian influenza research: epidemiology and immunoprophylaxis[J].Vet J,2002,164(3): 202-215.
[2] 张 彬.鸭H9N2亚型禽流感病毒在鹧鸪和鸡体内复制能力的比较[D].广西南宁:广西医科大学,2016.
[3] Liu Q,Liu Y,Yang J,et al.Two genetically similar H9N2 influenza A viruses show different pathogenicity in mice[J].Front Microbiol,2016(7):1737.
[4] Arzey G.The role of wild aquatic birds in the epidemiology of avian influenza in Australia[J].Aust Vet J,2004,82(6): 377-378.
[5] Khan S U,Anderson B D,Heil G L,et al.A Systematic review and meta-analysis of the seroprevalence of influenza A(H9N2) infection among humans[J].J Infect Dis,2015,212(4): 562-569.
[6] El H M,Fellahi S,Nassik S,et al.First outbreaks and phylogenetic analyses of avian influenza H9N2 viruses isolated from poultry flocks in Morocco[J].Virol J,2016,13(1): 140.
[7] Shi Q,Wang Q,Ju L,et al.Biological characteristics of H9N2 avian influenza viruses from healthy chickens in Shanghai,China[J].Med Sci Monit,2016,22: 4844-4853.
[8] 张 静,陈立根,张 宇,等.1997~2015年我国不同地区H9N2亚型禽流感病毒流行情况研究[J].中国家禽,2016(20): 20-27.
[9] Sun Y,Liu J.H9N2 influenza virus in China: a cause of concern[J].Protein Cell,2015,6(1): 18-25.
[10] 陈伯伦,张泽纪,陈伟斌.禽流感研究Ⅰ.鸡A型禽流感病毒的分离与血清学初步鉴定[J].中国兽医杂志,1994(10): 3-5.
[11] 周虹妤,裴 磊,毛爱民,等.H9N2病毒研究进展[J].中国畜牧兽医文摘,2016(6): 152.
[12] 胡晓苗,戴 银,沈学怀,等.2012年—2015年安徽部分地区发病家禽H9N2亚型禽流感流行情况分析[J].动物医学进展,2016,37(3): 127-130.
[13] Yan Y,Gu J Y,Yuan Z C,et al.Genetic characterization of H9N2 avian influenza virus in plateau pikas in the Qinghai Lake region of China[J].Arch Virol,2017,162(4):1025-1029.
[14] Normile D.Avian influenza.Are wild birds to blame?[J].Science,2005,310(5747): 426-428.
Isolation and Identification of H9N2 Subtype Avian Influenza Virus fromButeobuteo
ZENG Zhi-liao1, RU Kai-zhuo1, WEN Nuan-ling2, RU Zheng-zhong1
(1.ShenzhenWildlifeRescueCentre,Shenzhen,Guangdong, 440300,China; 2.ShenzhenZhenheliEcologicalEnvironmentConstructionCo.,Ltd.,Shenzhen,Guangdong, 440300,China)
An avian influenza virus was isolated from the cloacal swab of aButeobuteoin Shenzhen Wild Bird Rescue Center. The avian influenza virus was identified by inoculating chicken embryo and hemagglutination(HA), hemagglutination inhibition(HI), HA gene amplification and sequencing, as well as pathogenicity test. The results showed that the isolate was H9N2 subtype avian influenza virus, and named A/Wild bird/Guangdong/SZ-YN05/2015 (H9N2), according to the international influenza virus system naming rules. The phylogenetic analysis showed that the strain belonged to 4.2.1 and had the same homology with SS/94 strain, and the genetic distance from A/Chicken/Shandong/GM-TH/2014 (H9N2) was the closest. At the same time, 4 week SPF chickens were infected with the virus by intravenous injection with 8 log2 HA titer diluted 200 times. After 3 days of infection, the virus was detected from the heart, liver, lung, kidney, trachea, pharynx and anus swabs respectively.But after 7 days, the virus was not isolated from heart, liver, lung, kidney, trachea, while pharyngeal virus isolation rate was 2/6, anal virus isolation rate was 3/6.
H9N2 subtype Avian influenza virus; isolation and identification; HA gene
2016-12-01
深圳市城管局科研项目(201421)
曾志燎(1985-),男,广东河源人,兽医师,兽医硕士,主要从事野生动物救护和野生动物疫源疫病监测工作。*通讯作者
S852.659.5;S865.34
B
1007-5038(2017)07-0112-04
