普氏蹄蝠胃肠道细菌的分离与鉴定
2017-08-10苑志敏王艳梅郑刘梦李俊楼胡丽莉牛红星
苑志敏,王艳梅,郑刘梦,吴 杰,李俊楼,胡丽莉,牛红星
(河南师范大学生命科学学院,河南新乡 453007)
普氏蹄蝠胃肠道细菌的分离与鉴定
苑志敏,王艳梅,郑刘梦,吴 杰,李俊楼,胡丽莉,牛红星*
(河南师范大学生命科学学院,河南新乡 453007)
国内外关于蝙蝠消化道细菌的研究极少,为研究普氏蹄蝠(Hipposiderospratti)胃肠道细菌的种类及数量,对普氏蹄蝠胃肠道内的细菌进行分离,采用形态观察、生理生化试验、16 S rRNA基因序列及序列同源性分析等方法,鉴定细菌的种类。结果表明,普氏蹄蝠胃肠道中存在的菌群隶属于肠杆菌属(Enterobacter)、克雷伯菌属(Klebsiella)、摩根菌属(Morganella)、哈夫尼菌属(Hafinia)、Gibbsibela、Lysinibacillus、乳球菌属(Lactococcus)、柠檬酸杆菌属(Citrobacter)、Raoultella、普罗威登斯菌属(Providencia)及肠球菌属(Enterococcus)共11个属。其中革兰阴性菌占据了绝对优势,普氏蹄蝠胃内可培养的细菌数量大约为3.8×108CFU/mL~7.2×108CFU/mL,肠道可培养的细菌数量约8.6×108CFU/mL~1.3×1010CFU/mL。普氏蹄蝠胃肠道中的细菌大多为人类致病菌或条件致病菌。其结果为普氏蹄蝠胃肠道细菌的深入研究奠定了基础,并为人与蝙蝠共患疾病的预防提供基础资料。
普氏蹄蝠;胃肠道细菌;16 S rRNA基因;致病菌
蝙蝠是生态系统的主要组成部分,对维持生态系统的平衡起着至关重要的作用,它们不仅在传播种子、花粉及害虫控制等方面有重要作用,也是多种人畜共患病病原体的携带者[1]。蝙蝠物种丰富,分布广泛,与人类关系密切,目前已从蝙蝠体内发现130多种病毒,大多是重大人兽共患病的病原[2],如严重急性呼吸道综合征冠状病毒(Severe acute respiratory syndrome virus,SARSV)、中东呼吸综合征冠状病毒(Middle East respiratory syndromes virus,MERS V)、埃博拉病毒(Ebola virus,EV)、狂犬病病毒(Rabies virus,RABV)、尼帕病毒(Nipah virus,NIV)及亨德拉病毒(Hendra virus,HEV)等,但迄今为止,从蝙蝠体内分离出的人类致病菌很少,仅有沙门菌属(Salmonella)、肠杆菌属(Escherichia)、弯曲菌属(Campylobacter)等几种常见菌属。随着传染性疾病的不断增加,人们日益关注蝙蝠与人类健康的关系,关于蝙蝠作为细菌宿主的研究也越来越多[3]。动物胃肠道内存在大量的微生物,而细菌是动物胃肠道中最主要的微生物[4],可见,蝙蝠的胃肠道是研究蝙蝠体内细菌种类的最佳部位。目前国内外关于蝙蝠胃肠道菌群的研究较少[5-7],而这样的研究对于人类健康是很有必要的。
普氏蹄蝠(Hipposiderospratti)又名黄大蹄蝠,隶属于翼手目小蝙蝠亚目蹄蝠科 (Hipposideridae)蹄蝠属(Hipposideros),为洞栖型蝙蝠,分布于中国南部及越南北部[8]。普氏蹄蝠体型较大,需要较多的食物满足自身的需求,能飞到几公里外的地方觅食,在飞行过程中,它们也会排便[9],这些粪便中含有致病菌,若这些粪便排入溪流中,会对人类健康造成威胁。此外,由于旅游开发等原因,许多有普氏蹄蝠栖息的洞穴已经或正在被开发成旅游景点[10],这使得人与蝙蝠的接触机会增多,也会增加蝙蝠体内致病菌向人类传播的可能性。本研究通过对普氏蹄蝠胃肠道细菌分离、生理生化试验、16 S rRNA基因序列的测定及同源性分析,初步鉴定出普氏蹄蝠胃肠道细菌的数量和种类,以期为人与蝙蝠共患疾病的预防提供基础资料。
1 材料与方法
1.1 材料
2015年9月,于河南省南阳市南召县乔端镇仙人洞(N33°34′,E112°06′),通过洞内架设雾网捕捉蝙蝠,采集到5只蝙蝠,物种鉴定依据《中国兽类野外手册》[8],经鉴定为普氏蹄蝠(H.pratti)。将5只蝙蝠带回实验室,饥饿处理24 h备用。将经过饥饿处理的5只普氏蹄蝠用过量氯仿麻醉处死,用700 mL/L的酒精浸泡进行体表消毒,无菌水漂洗后,在无菌条件下取出胃和肠(包括小肠和大肠)内容物,分别放入无菌的5 mL离心管,将每只蝙蝠胃和肠的内容物分别混合均匀备用,编号为PW(胃内容物)和PC(肠道内容物)。
1.2 方法
1.2.1 胃肠道细菌的计数、分离、纯化及保存
1.2.1.1 计数 无菌条件下,用无菌生理盐水对上述10管胃肠道内容物进行10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-810倍梯度稀释,取不同稀释梯度的内容物稀释液200 μL均匀涂布于已灭菌的LB固体培养基中,每个梯度设3个平行和1个空白对照。将已涂布好的平板放于37℃培养箱和厌氧培养箱中,恒温培养12 h,计数。
1.2.1.2 分离 将上步中经过梯度稀释的胃肠道内容物均匀涂布于SS琼脂培养基、LBS培养基和厌氧琼脂培养基、MRS琼脂培养基和LB培养基中,每种培养基设3个平行和1个空白对照,将已涂布的平板放于恒温培养箱中37℃恒温培养12 h~24 h。
1.2.1.3 纯化与保存 仔细观察平板上菌落形态,挑取表征各异的菌落在相对应的平板上划线分离、纯化、培养。挑选具有代表性的细菌进行显微照相。将纯化后的单菌落接种在LB液体培养基中,放入摇床37℃恒温振荡培养12 h,得到细菌悬液。一部分细菌悬液用300 mL/L甘油与菌液1∶1混合,保存于-80℃冰箱;一部分保存于4℃冰箱,备用。
1.2.2 生化试验 选取具有代表性的18株分离菌的纯培养液按常规方法接种于葡萄糖、蔗糖、乳糖、甘露醇、果糖及麦芽糖等13种糖发酵培养基上及VP、MR、吲哚等8种生理生化培养基上进行生化试验,在指定时间内观察结果。
1.2.3 DNA提取和16 S rRNA基因的PCR扩增 以提取的纯度较高的基因组DNA为模板,应用细菌通用引物27-F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492-R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增条件:94℃ 5 min;94℃ 60 s,57℃ 45 s,72℃ 90 s,35个循环;72℃ 10 min。对PCR扩增产物进行电泳检测,将检测合格的样品送往公司,进行基因测序。在NCBI数据库中进行BLAST同源性分析,运用DNA Star、BioEdit进行多重序列比较,采用MEGA5.0邻近相接法 (Neighbor-Joining methods)构建系统发育树(bootstrap为1 000)。
2 结果
2.1 普氏蹄蝠胃肠道内分离菌菌落的培养特性和活菌数量
普氏蹄蝠不同个体胃肠道中分离的细菌在不同种培养基中的生长表现各异, 在MRS琼脂平板上形成表面光滑、湿润、边缘整齐,中间隆起乳白色不透明的圆形菌落;LB琼脂平板上形成表面光滑、湿润、边缘整齐,中间隆起的乳白色不透明的或浅黄色圆形菌落;厌氧琼脂平板上形成表面光滑、边缘整齐,中间隆起乳白色圆形菌落;SS琼脂平板和LBS 琼脂平板上未见菌落生长。估算了试验所用的5只普氏蹄蝠样本胃肠道内活菌数量,普氏蹄蝠胃内可培养的细菌数量大约为3.8×108CFU/mL~7.2×108CFU/mL,肠道细菌数量约为8.6×108CFU/mL~1.3×1010CFU/mL(表1)。

表1 普氏蹄蝠胃肠道菌落数量统计
2.2 普氏蹄蝠胃肠道纯化菌株的镜检结果
普氏蹄蝠胃中分离出8株细菌,均为需氧或兼性厌氧菌,编号PWX1~PWX8。PWX1~PWX6均为革兰阴性菌,杆状;PWX7为革兰阳性菌,杆状;PWX8为革兰阳性菌,球形或卵圆形,细菌外形特征见图1。
普氏蹄蝠肠道中分离出10株细菌,均为需氧或兼性厌氧菌,编号PCX1~PCX10。PCX1~PCX8均为革兰阴性菌,杆状;PCX9为革兰阳性菌,杆状;PCX10为革兰阳性菌,球形或卵圆形,细菌外形特征见图2。
2.3 普氏蹄蝠胃肠道分离菌的生化鉴定
选取具有代表性的18株分离菌的纯培养液进行各种糖发酵试验、VP试验、MR试验、吲哚试验等各项生化试验,结果见表2和表3。
由表2可知,分离菌中PWX1和PWX2,利用糖的特性和各种生化特征相似,表明它们可能属于同一菌属。由表3可知,PCX1、PCX2和PCX3,PCX4和PCX8利用糖的特性和各种生化特征相似,分别表明它们可能属于同一菌属。其他分离菌利用糖和生化特征上存在较大差异,可能属于不同的菌属。

a-h.PWX1-PWX8

a-j. PCX1-PCX10

项目ItemPWX1PWX2PWX3PWX4PWX5PWX6PWX7PWX8葡萄糖Glucose++++++±+蔗糖Sucrose+++-++-+乳糖Lactose+++-++-+甘露醇Mannose++±-++-±果糖Fructose++±±+±-+麦芽糖Maltose+++-++-+山梨醇Sorbitol++--++-+阿拉伯糖Arabinose+++-±±-±棉籽糖Raffinose±±--±±-±木糖Xylose++±-±±-+鼠李糖Rhamnose+++-±±-±卫矛醇Dulcit++±-±±±±肌醇Inositol-+±-±±±+VP试验VPtest+++--+--MR试验MRtest---++--+硫化氢Hydrogensulfide---------接触酶Catalase++++-++-吲哚试验Indole----+----硝酸盐还原Deoxidizenitrate++++++++-柠檬酸盐Citrate+++-++++脲酶Urease--++-++-
注:“+”表示阳性反应;“-”表示阴性反应;“±”表示弱阳性反应。
Note: "+"means positive reaction ; "-"means negative reaction; "±"means weak positive reaction.

表3 肠道分离菌的糖发酵和生化试验结果
注:“+”表示阳性反应;“-”表示阴性反应;“±”表示弱阳性反应。
Note:“+”means positive reaction;“-”means negative reaction;“±”means weak positive reaction.
2.4 分离细菌16 S rRNA基因的PCR扩增
提取菌株的基因组DNA,经PCR扩增其16 S rDNA序列,10 g/L琼脂糖凝胶电泳显示,扩增序列条带大小约1 500 bp,与目的片段大小一致,结果见图3和图4。
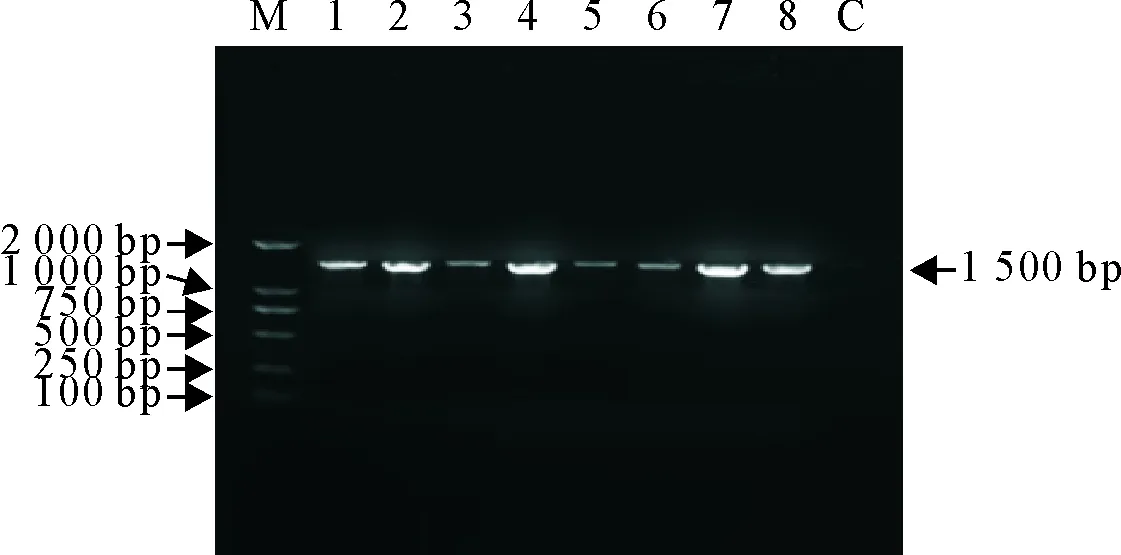
M.DNA标准DL 2 000;1~8.PWX1~PWX8;C.阴性对照
M.DNA Marker DL 2 000;1-8.PWX1-PWX8;C.Negative control
图3 胃内分离菌16 S rRNA基因扩增结果
Fig.3 PCR amplified products of 16 S rRNA genes of bacteria in the stomach
2.5 分离细菌16 S rRNA基因序列分析
把胃内分离菌株PWX1~PWX8和肠道分离菌株PCX1~PCX10的16 S rRNA基因序列在NCBI数据库中BLAST同源性检索,并分别构建系统发育树(图5和图6)。结果显示,分离菌PWX1和PWX2 分为一簇,与肠杆菌属(Enterobacter)的同源性为98%,PWX3~PWX8分别与克雷伯菌属(Klebsiella)、摩根氏菌属(Morganella)、哈夫尼菌属(Hafinia)、Gibbsiella、Lysinibacillus、乳球菌属(Lactococcus)聚在一起,同源性都在97%~100%之间。其中PWX1和PWX2同属(肠杆菌属)序列之间显示了较高的一致性,可能来源于相距较近的类群;PWX4(摩根氏菌属)和PWX5(哈夫尼菌属)不同属序列之间也显示了较高的一致性,可能也来源于相距较近的类群。

M.DNA标准DL 2 000;1~10.PCX1~PCX10;C.阴性对照
M.DNA Marker DL 2 000;1-10.PCX1-PCX10;C.Negative control
图4 肠道分离菌16 S rRNA基因扩增结果
Fig.4 PCR amplified products of 16 S rRNA genes of bacteria in the intestine
分离菌PCX1、PCX2及PCX3亲缘关系较近,与肠杆菌属(Enterobacter)同源性高达98%;PCX4和PCX8与柠檬酸杆菌属(Citrobacter)的同源性高达99%;PCX5、PCX6、PCX7、PCX9、PCX10分别与Raoultella、摩根菌属(Morganella)、普罗威登斯菌属(Providencia)、Lysinibacillus、肠球菌属(Enterococcus)聚在一起,同源性都在98%以上。其中PCX1、PCX2及PCX3这3株同属(肠杆菌属)序列之间显示了较高的一致性,可能来源于相距较近的类群;PCX6(摩根菌属)和PCX7(普罗威登斯菌属)不同属序列之间也显示了较高的一致性,可能也来源于相距较近的类群;PCX4和PCX8同为柠檬酸杆菌属,并没有分为一支,同源性较小,可能是来源于相距较远的类群。

图5 基于胃内分离菌16 S rRNA基因序列构建的系统进化树
3 讨论
我国蝙蝠物种丰富,多达155种[11]。其中普氏蹄蝠是典型的洞穴居住者,其居住的洞穴多被开发为旅游景点,这增加了人与普氏蹄蝠接触的机会,旅游者有被传染疾病的可能,此外,洞穴中常有溪流流出,这些水中必然有蝙蝠的排泄物,而这或许成为部分居民的直接饮用水,给他们的健康造成直接威胁。因此,研究蝙蝠胃肠中细菌及致病菌的种类是非常必要的。
已有的研究表明,采用单一方法很难鉴定胃肠道细菌的具体菌属[7],本试验中,普氏蹄蝠胃肠道分离菌的糖发酵和生化试验结果与《伯杰氏系统细菌学手册》[12]对照后,发现存在较大差异,不能准确鉴定出分离菌的具体菌属。现代细菌学倾向于细菌的基因型结合表型特征进行分类,基于细菌16 S rRNA序列进行分类的标准是:99%~100%全序列同源性的细菌可判定为同一种,97%~100%全序列同源性的定义为同一个属[13]。迄今,国内外关于蝙蝠胃肠道菌群的研究极少[5-7]。本研究应用生化试验和16 S rRNA基因序列分析相结合的方法,首次报道了普氏蹄蝠胃肠道细菌种类及数量,结果更加准确可靠。

图6 基于肠道分离菌16 S rRNA基因序列构建的系统进化树
从普氏蹄蝠胃肠道中共分离出18株细菌,属于11个属,革兰阴性菌占有绝对优势。肠杆菌属、摩根菌属及Lysinibacillus在胃肠道中均有分布,而克雷伯菌属、哈夫尼菌属、Gibbsiella、乳球菌属仅分布在胃中,柠檬酸杆菌属、Raoultella、普罗威登斯菌属及肠球菌属只分布在肠道中,普氏蹄蝠胃肠道菌群的组成不同可能与胃肠道环境的差异有关,也可能与胃肠道功能差异有关。普氏蹄蝠胃内可培养的细菌数量约3.8×108CFU/mL~7.2×108CFU/mL,肠道细菌数量约8.6×108CFU/mL~1.3×1010CFU/mL,这可能是由于胃内菌群丰富度和多样性低于肠道菌群造成的。
普氏蹄蝠胃肠道中分离出的细菌,一些为可引起人类患病的致病菌或条件致病菌,如肠杆菌属细菌为条件致病菌,常引起包括皮肤软组织、泌尿道、呼吸道感染及败血症等在内的细菌感染性疾病[14]。克雷伯氏菌属细菌可引起咯血、胸痛、呼吸困难等症状。柠檬酸杆菌属细菌可引起菌血症、尿路感染、性腹膜炎、胆囊炎等[15];肠球菌属是条件致病菌,可引起尿路感染、化脓性腹部感染、腹泻发烧等多种疾病[16]。大多数这些致病菌对蝙蝠本身是无害的(属于蝙蝠体内的正常菌群),除非蝙蝠的免疫系统受损或之前受过外伤,才会导致蝙蝠患病[17]。
本研究以河南省南阳市南召县乔端镇仙人洞的普氏蹄蝠为对象,对普氏蹄蝠所携带胃肠道细菌进行分离鉴定,结果表明,普氏蹄蝠胃肠道细菌种群具有多样性,且存在人类致病菌和条件致病菌,这为研究野生动物是否携带致病菌提供了参考。同时也为旅游环境的保护,提出了警示和建议,为合理开发旅游提供了一定的参考。
[1] Calisher C H,Childs J E,Field H E,et al.Bats:important reservoir hosts of emerging viruses[J].Clin Microbiol Rev,2006,19(3):531-545.
[2] 张海林.我国蝙蝠携带新发现病毒的研究进展[J].中国媒介生物学及控制杂志,2015,26(3):223-227.
[3] Kamani J,Baneth G,Mitchell M,et al.Bartonellaspecies in bats (Chiroptera) and bat flies (Nycteribiidae) from Nigeria,West Africa[J].Vector Borne Zoonotic Dis,2015,14(9):625-632.
[4] Walker M M,Talley N J.Review article:bacteria and pathogenesis of disease in the upper gastrointestinal tract-beyond the era ofHelicobacterpylori[J].Aliment Pharmacol Ther,2014,39(8):767-779.
[5] Anand A A,Sripathi K.Digestion of cellulose and xylan by symbiotic bacteria in the intestine of the Indian flying fox (Pteropusgiganteus)[J].Comp Biochem Physiol A,2004,139(1):65-69.
[6] Mühldorfer K,Wibbelt G,Haensel J,et al.Yersiniaspecies isolated from bats,Germany[J].Emerg Infect Dis,2010,16(3):578-580.
[7] Daniel D S,Ng Y K,Chua E L,et al.Isolation and identification of gastrointestinal microbiota from the short-nosed fruit batCynopterusbrachyotisbrachyotis[J].Microbio Res,2013,168(8):485-496.
[8] Smith A T,解 焱.中国兽类野外手册[M].陈廷熹,译.湖南长沙:湖南教育出版社,2009.
[9] Hornok S,Estók P,Kováts D.Screening of bat faeces for arthropod-borne apicomplexan protozoa:BabesiacanisandBesnoitiabesnoiti-like sequences from Chiroptera[J].Parasit Vectors,2015,8(441):1052-1057.
[10] Bu Y Z,Wang Y M,Zhang C,et al.Geographical distribution,roost selection,and conservation state of cave-dwelling bats in China[J].Mammalia,2015,79(4):409-417.
[11] 刘志霄,张佑祥,张礼标.中国翼手目动物区系分类与分布研究进展、趋势与前景[J].动物学研究,2013,34(6):687-693.
[12] 布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1984.
[13] Drancourt M,Bollet C,Carlioz R,et al.16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates [J].J Clin Microbiol,2000,38(10):3623-3630.
[14] 黄 敏,吴毅歆,何鹏飞.人和动物条件致病菌环境菌株侵染植物的研究进展[J].微生物学报,2016,56(2):188-197.
[15] 魏寒松,马春红,李立旻,等.基层医院柠檬酸杆菌属细菌的临床分布与耐药分析[J].中国卫生检验杂志,2016,26(17):2564-2566.
[16] 杨 青,俞云松,林 洁 ,等.2005—2014 年 CHINET 肠球菌属细菌耐药性监测[J].中国感染与化疗杂志 ,2016,16(2):146-152.
[17] Mühldorfer K,Speck S,Kurth A,et al.Diseases and causes of death in European bats:dynamics in disease susceptibility and infection rates[J].PLoS One,2011,6(12):811-822.
Isolation and Identification of Gastrointestinal Bacteria fromHipposiderospratti
YUAN Zhi-min,WANG Yan-mei,ZHENG Liu-meng,WU Jie, LI Jun-lou,HU Li-li,NIU Hong-xing
(CollegeofLifeScience,HenanNormalUniversity,Xinxiang,Henan,453007,China)
Studies on the bacteria composition of gut microbiota in bats are scarce.In order to study the bacteria variety and count of gastrointestinal tract inHipposiderospratti, the bacteria of gastrointestinal tract were isolated fromH.pratti.Based on morphologic observation,physiological and biochemical properties,homology and phylogenetic analysis of 16 S rRNA gene sequence,eleven isolates were identified as the generaEnterobacter,Klebsiella,Morganella,Hafinia,Gibbsibela,Lysinibacillus,Lactococcus,Citrobacter,Raoultella,Providencia,Enterococcus.The most bacteria were the Gram-negative bacteria and the estimation of variable bacteria ranged from 3.8×108CFU/mL-7.2×108CFU/mL of the stomach fluid and 8.6×108CFU/mL-1.3×1010CFU/mL of the intestinal fluid,respectively.Most isolates fromH.prattihave been reported as pathogens or opportunistic pathogens to humans.This study would lay a foundation for further studies on bacteria of gastrointestinal tract fromH.prattiand for preventing transmission of diseases from the bats to humans.
Hipposiderospratti; gastrointestinal bacteria; 16 S rRNA gene; pathogen
2016-12-13
国家自然科学基金项目(30970331,31172056);河南省科技攻关项目(082102360004)
苑志敏(1991-),女,河南周口人,硕士研究生,主要从事动物微生物分类研究。*通讯作者
Q959.833
B
1007-5038(2017)07-0105-07
兽医临床
