阿维菌素对胶质母细胞瘤U251细胞增殖、凋亡的影响及其机制探讨
2017-08-09罗丹罗亮杨志军黄佛宝王燕燕
罗丹,罗亮,杨志军,黄佛宝,王燕燕
(1南方医科大学,广州510000;2陆军总医院附属八一脑科医院)
·基础研究·
阿维菌素对胶质母细胞瘤U251细胞增殖、凋亡的影响及其机制探讨
罗丹1,罗亮2,杨志军1,黄佛宝1,王燕燕2
(1南方医科大学,广州510000;2陆军总医院附属八一脑科医院)
目的 观察阿维菌素(AVMs)对胶质母细胞瘤U251细胞增殖、凋亡的影响,并探讨其相关机制。方法 传代培养U251细胞,将细胞分为药物实验组和阴性对照组,药物实验组给予不同浓度的AVMs处理,阴性对照组不加AVMs。取药物实验组细胞,分别给予2、4、6、8、10、12 μmol/L的AVMs,采用MTT法测算给药24、48、72 h后U251细胞的增殖抑制率。取药物实验组细胞,分别给予4、8 μmol/L的AVMs培养72 h后,测算各组细胞凋亡率,检测各组细胞线粒体膜电位及细胞中的Caspase-3、Bcl-2、Bax蛋白。结果 2、4、6、8、10、12 μmol/L的AVMs作用于U251细胞后,细胞增殖抑制率逐渐升高,AVMs作用24、48、72 h后U251细胞增殖抑制率也逐渐升高;AVMs对U251细胞的增殖抑制作用呈时间、剂量依赖性(P均<0.01)。AVMs作用72 h时对U251细胞增殖的IC50为5.220 μmol/L。阴性对照组与药物实验组4、8 μmol/L亚组的细胞凋亡率分别为5.2%±0.16%、31.5%±0.43%、52.4%±0.72%,细胞线粒体膜电位分别为92.4±2.52、85.2±1.32、45.3±0.75,三组细胞凋亡率和线粒体膜电位相比,P均<0.01。阴性对照组和药物实验组4 μmol/L亚组、8 μmol/L亚组细胞中Caspase-3、Bax蛋白相对表达量依次升高,Bcl-2蛋白相对表达量依次降低(P均<0.01)。结论 AVMs可抑制U251细胞增殖并促进其凋亡,作用机制可能与降低细胞线粒体膜电位、调节凋亡相关蛋白表达有关。
阿维菌素;胶质瘤;脑胶质母细胞瘤;U251细胞;细胞增殖;细胞凋亡;线粒体膜电位
化疗是脑胶质母细胞瘤重要的治疗手段,但由于肿瘤细胞有耐药性,往往导致化疗效果不理想。FDA批准的一线胶质母细胞瘤化疗药物仅有替莫唑胺,疗效不甚理想,筛选和研发新型药物意义重大。阿维菌素(AVMs)是由阿维链霉菌产生的一类大环内酯类抗生素。越来越多的研究发现AVMs具有抗肿瘤作用[1],但其抗肿瘤相关机制目前还不明确。本研究观察了AVMs对胶质母细胞瘤U251细胞增殖和凋亡的影响,并探讨相关机制,现报告如下。
1 材料与方法
1.1 实验细胞与主要实验材料 U251细胞用含10%胎牛血清的高糖DMEM培养基培养,在37 ℃、5% CO2、饱和湿度条件下生长传代,根据细胞生长状态每周传代2~3次。用新鲜完全培养基重悬为单细胞。按照细胞量1∶3左右传代培养或根据实验需要技术铺板。将细胞分为药物实验组和阴性对照组,药物试验组给予不同浓度AVMs处理,阴性对照组不加入AVMs。AVMs,DMEM,0.25%胰蛋白酶,胎牛血清,MTT,Annexin V-FITC/PI细胞凋亡检测试剂盒,线粒体膜电位检测试剂盒,SYBR Premix Ex Taq,SDS-PAGE凝胶配置试剂盒,Goat anti-Rabbit HRP-IgG(H+L) Antibody,Rabbit anti-Bcl-2 Antibody,Rabbit anti-bax Antibody,Rabbit anti-Caspase3 Antibody,微量移液器。
1.2 AVMs对U251细胞增殖的影响观察 收集对数生长期的U251细胞,调整细胞悬液浓度为(3.0~5.0)×104/mL,将细胞均匀接种于96孔培养板中,每孔加入150 μL,边缘孔用无菌PBS填充。细胞在温箱孵育12 h后,药物实验组分别加入含2、4、6、8、10、12 μmol/L AVMs的培养基,每个浓度设3个平行孔;同时设只添加培养基的空白对照组。在在5% CO2、37 ℃温箱中分别孵育24、48、72 h,倒置显微镜下观察。每孔加入预先稀释的 0.5 mg/mL的MTT 20 μL,继续避光培养4 h。终止培养,取出96孔板,吸去培养液,每孔加入二甲基亚砜150 μL,置摇床上低速振荡15 min,待结晶物溶解后,在酶标仪上检测各孔的光密度值(OD值)。以(药物实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%计算不同浓度AVMs作用后细胞增殖抑制率。
1.3 AVMs对U251细胞凋亡的影响观察 取指数生长期的U251细胞,调整密度为(4~5)×105/孔接种于6孔板内,置于37 ℃、5% CO2培养箱中孵育过夜。药物实验组分别加入4、8 μmol/L的AVMs,将药物实验组和阴性对照组细胞继续培养72 h。用不含EDTA的胰酶消化收集细胞,预冷PBS洗涤2次。加入Binding Buffer 500 μL悬浮细胞。加入Annexin V-FITC 5 μL混匀后,加入PI 5 μL混匀,室温、避光条件下反应15~30 min。用流式细胞仪检测凋亡细胞,计算细胞凋亡率。
1.4 AVMs作用后U251细胞线粒体膜电位检测 取指数生长期的U251细胞,调整密度为(4~5)×105/孔接种于6孔板内,置于37 ℃、5% CO2培养箱中孵育过夜。药物实验组分别加入含4、8 μmol/L AVMs的培养液,药物实验组和阴性对照组细胞继续培养72 h。用不含EDTA的胰酶消化收集细胞,预冷PBS洗涤2次。取(1.0~6.0)×105个细胞,重悬于0.5 mL的细胞培养液中,细胞培养液中可含血清和酚红。加入JC-1染色工作液0.5 mL,颠倒数次混匀,37 ℃孵育20 min,孵育期间配制适量的JC-1染色缓冲液,并放置于冰浴。37 ℃孵育结束后,500 g离心3 min,沉淀细胞,弃上清。加入JC-1染色缓冲液1 mL重悬细胞,500 g、4 ℃下离心3 min,沉淀细胞,弃上清;重复此步骤1次。再用适量JC-1染色缓冲液重悬后,置于冰上,流式细胞仪检测线粒体膜电位。
1.5 AVMs作用后U251细胞中Caspase3、Bcl-2、Bax蛋白表达观察 取对数期的U251细胞,接种于细胞培养皿上,置于细胞培养箱在37 ℃、5%CO2、饱和湿度条件下培养24 h,药物实验组分别加入4、8 μmol/L AVMs。药物实验组和阴性对照组细胞继续培养72 h后提取蛋白,采用Western blotting法检测U251细胞中的Caspase3、Bcl-2、Bax蛋白。
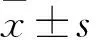
2 结果
2.1 AVMs对U251细胞增殖的影响 2、4、6、8、10、12 μmol/L的AVMs作用于U251细胞后,细胞增殖抑制率逐渐升高,AVMs作用24、48、72 h后U251细胞增殖抑制率也逐渐升高。AVMs对U251细胞的增殖抑制作用呈时间、剂量依赖性(P均<0.01)。详见表1。AVMs作用72 h时对U251细胞增殖的IC50为5.220 μmol/L。
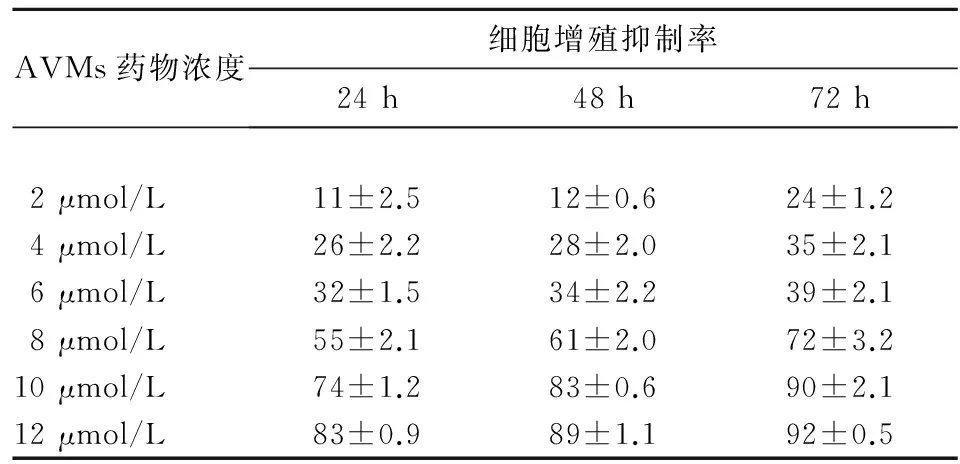
表1 不同浓度AVMs处理后各时点U251细胞增殖抑制率(%)
2.2 AVMs对U251细胞凋亡的影响 阴性对照组与药物实验组4、8 μmol/L亚组的细胞凋亡率分别为5.2%±0.16%、31.5%±0.43%、52.4%±0.72%,三组相比,P均<0.01。AVMs作用后U251细胞凋亡率增加。
2.3 AVMs作用后U251细胞线粒体膜电位变化 阴性对照组与药物实验组4、8 μmol/L亚组细胞线粒体膜电位分别为2.4±2.52、85.2±1.32、45.3±0.75,三组相比,P均<0.01。AVMs能够降低U251细胞的线粒体膜电位。
2.4 AVMs作用后U251细胞中Caspase-3、Bcl-2、Bax蛋白表达变化 阴性对照组和药物实验组4 μmol/L亚组、8 μmol/L亚组细胞中Caspase-3、Bax蛋白相对表达量依次升高,Bcl-2蛋白相对表达量依次降低(P均<0.01)。详见表2。

表2 AVMs作用后U251细胞中Caspase-3、Bcl-2、Bax蛋白表达变化
3 讨论
目前越来越多的研究表明AVMs具有抗肿瘤作用。本课题组在前期预实验中发现AVMs对胶质瘤的增殖有明显抑制作用,且对肿瘤细胞具有诱导凋亡的作用,但其作用机制尚未明确。本研究以胶质瘤U251细胞为实验对象,给予不同浓度的AVMs进行处理,发现AVMs可明显抑制U251细胞増殖,且呈浓度和时间依赖性。我们采用Annexin V-FITC/PI双染色法检测U251细胞凋亡情况,发现两个给药实验组较阴性对照组凋亡率均增加,且随着药物浓度增高,细胞凋亡率也增加,这一结果同AVMs对U251细胞的增殖抑制作用是一致的,证明AVMs可抑制U251细胞增殖并促进其凋亡。
细胞凋亡是细胞一种正常性、生理性、主动性的细胞“自杀行为”,是机体的一种自我调节机制。这种调节机制的异常参与多种疾病的发生发展,如恶性肿瘤。目前发现的凋亡途径主要有5种,即死亡受体凋亡途径、线粒体凋亡途径、B粒酶介导的细胞凋亡途径和内质网应激途径[2]。通常情况下,细胞凋亡过程受机体内严格调控,以维持整个机体的稳定性。但当细胞凋亡调控失衡时,可引起细胞过度增殖,导致相关疾病如胃肠道肿瘤、子宫内膜异位症(EMs)等[3,4]。线粒体凋亡途径起到了非常关键的作用,越来越多的证据表明,线粒体是细胞凋亡的“中枢”,是凋亡的执行者。我们用JC-1法检测线粒体膜电位,以JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的标志。我们用不同浓度的AVMs作用于U251细胞,发现阴性对照组和药物实验组的4、8 μmol/L亚组细胞线粒体膜电位依次降低,各组较对照组红、绿荧光强度比均增加,且高浓度组更为明显,提示随着AVMs浓度增加,凋亡细胞数也随之增加,AVMs可诱导U251细胞早期凋亡,这可能与AVMs降低U251细胞线粒体跨膜电位作用有关。
研究[5]表明,Bcl-2蛋白和Bax蛋白对细胞凋亡的调控起着重要作用。Bcl-2是一种抑制细胞凋亡的蛋白,而Bax是一种促进细胞凋亡的蛋白,两者作用相互制约。研究发现,当凋亡发生时,Bax蛋白能从胞质转移到线粒体并与线粒体膜相结合,可以使细胞色素C释放[6],并促进线粒体促凋亡因子释放[7,8],从而引发细胞凋亡。而位于线粒体膜上的Bcl-2蛋白能够通过与Bax竞争结合,使Bax蛋白形成异源二聚体,抑制其功能,从而抑制细胞凋亡;同时Bcl-2蛋白还可抑制Caspase家族蛋白的活化和抑制谷胱甘肽(GSH)外泄,降低胞内氧化还原电位,从而抑制细胞凋亡[9]。Caspase-3蛋白是引发细胞凋亡的关键蛋白,是细胞凋亡的最终执行者,在细胞凋亡调控中处于中心地位[10]。研究表明Bax蛋白可促进Caspase-3表达和活化,而活化的Caspase-3也可以反过来促进Bax蛋白的表达,同时抑制Bcl-2蛋白的表达;活化的Caspase-3还可引发线粒体细胞色素C释放,而细胞色素C反过来又激活Caspase-3,从而形成凋亡信号的正反馈[11~14]。我们检测了各组细胞中的凋亡相关蛋白Caspase-3、Bcl-2、Bax,发现阴性对照组和药物实验组4 μmol/L亚组、8 μmol/L亚组细胞中Caspase-3、Bax蛋白相对表达量依次升高,Bcl-2蛋白相对表达量依次降低,说明AVMs可能上调U251细胞中Caspase-3、Bax蛋白的表达水平,同时降低Bcl-2蛋白的表达水平。
综上所述,AVMs可抑制U251细胞增殖并促进其凋亡,作用机制可能与降低细胞线粒体膜电位、调节凋亡相关蛋白表达有关。上述研究结果为以后AVMs的临床应用提供了理论依据。但目前对于AVMs是否能够透过血脑屏障及达到有效浓度后是否会引起明显的不良反应,还需进一步研究。
[1] Korystov YN. Avermectins inhibit multidrug resistance of tumor cells[J]. Eur J Pharmacol, 2004,493(1-3):57-64.
[2] Liu D, Darville M, Eizirik CL. Double-stranded Ribonucleic Acid (RNA) induces beta-Cell fas messenger RNA expression and increases cytokine-induced beta-cell apoptosis[J]. Endocrinology, 2001,142(6):2593-2599.
[3] Ramakrishnan V, Painuly U, Kimlinger T, et al. Inhibitor of apoptosis proteins as therapeutic targets in multiple myeloma[J]. Leukemia, 2014,28(7):1519-1528.
[4] Fulda S, Vucic D. Targeting IAP proteins for therapeutic intervention in cancer[J]. Nat Rev Drug Discov, 2012,11(2):109-124.
[5] Reed CJ. Apoptosis and cancer: strategies for integrating programmed cell death[J]. Semin Hematol, 2000,37(4 Suppl 7):9-16.
[6] Heimlich G, Mckinnon AD, Bernardo K, et al. Bax-induced cytochrome c release from mitochondria depends on alpha-helices-5 and -6[J]. Biochem J, 2004,378(Pt 1):247-255.
[7] Orrenius S. Mitochondrial regulation of apoptotic cell death[J]. Toxicol Lett, 2004,149(1-3):19-23.
[8] Iverson SL, Orrenius S. The cardiolipin-cytochrome c interaction and the mitochondrial regulation of apoptosis[J]. Arch Biochem Biophys, 2004,423(1):37-46.
[9] Ferrari D, Stepczynska A, Los M, et al. Differential regulation and ATP requirement for caspase-8 and caspase-3 activation during CD95- and anticancer drug-induced apoptosis[J]. J Exp Med, 1998,188(5):979-984.
[10] Park HJ, Kim MJ, Ha E, et al. Apoptotic effect of hesperidin through caspase3 activation in human colon cancer cells, SNU-C4[J]. Phytomedicine, 2008,15(1-2):147-151.
[11] Fan TJ, Han LH, Cong RS, et al. Caspase family proteases and apoptosis[J]. Acta Biochim Biophys Sin (Shanghai), 2005,37(11):719-727.
[12] Wolf BB, Green DR. Suicidal tendencies: apoptotic cell death by caspase family proteinases[J]. J Biol Chem, 1999,274(29):20049-20052.
[13] Thornberry NA. The caspase family of cysteine proteases[J]. Br Med Bull, 1997,53(3):478-490.
[14] Miller DK. The role of the Caspase family of cysteine proteases in apoptosis[J]. Semin Immunol, 1997,9(1):35-49.
国家自然科学基金资助项目(81271316)。
杨志军(E-mail: zhijunyangfmmu@163.com)
10.3969/j.issn.1002-266X.2017.27.008
R739.41
A
1002-266X(2017)27-0031-03
2017-01-03)
