牡丹花中三种活性成分的快速分离方法
2017-08-09闫慧娇王志伟王岱杰安春燕耿岩玲山东省中药质量控制重点实验室山东省分析测试中心山东济南5004山东理工大学生命科学学院山东省生物信息工程技术中心山东淄博55000
闫慧娇,王志伟,王岱杰,安春燕,耿岩玲,王 晓,*(.山东省中药质量控制重点实验室,山东省分析测试中心,山东济南 5004; .山东理工大学生命科学学院,山东省生物信息工程技术中心,山东淄博 55000)
牡丹花中三种活性成分的快速分离方法
闫慧娇1,王志伟1,王岱杰1,安春燕2,耿岩玲1,王 晓1,*
(1.山东省中药质量控制重点实验室,山东省分析测试中心,山东济南 250014; 2.山东理工大学生命科学学院,山东省生物信息工程技术中心,山东淄博 255000)
建立应用高速逆流色谱快速分离牡丹花中黄酮及酚酸类活性成分方法。实验采用70%乙醇浸提牡丹花瓣,浸提物减压浓缩后经D101大孔树脂乙醇洗脱富集后,采用乙酸乙酯∶甲醇∶正丁醇∶水=5∶1∶0.5∶4两相系统进行高速逆流色谱分离,化合物结构通过1H NMR、13C NMR、MS确定。从牡丹花中一次性分离出三种化学成分,分别为野漆树苷(Ⅰ)、没食子酸(Ⅱ)、芹菜素-7-O-β-D葡萄糖苷(Ⅲ),化合物纯度经高效液相色谱检测均达到95%以上。实验建立的方法是快速分离富集纯化牡丹花中三种黄酮、酚酸类活性成分的有效方法。
牡丹花,黄酮,酚酸,分离,高速逆流色谱
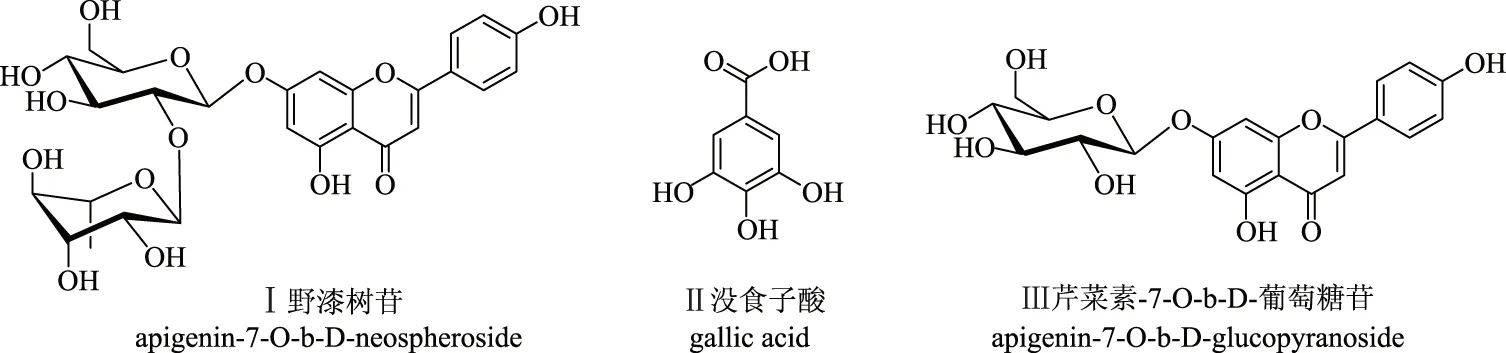
图1 化合物的结构式Fig.1 Chemical structures of the compounds
牡丹(PaeoniasuffruticosaAndr.)是芍药属植物,为多年生落叶灌木。我国传统名贵观赏植物,其中以洛阳、菏泽牡丹最富盛名[1]。牡丹花在我国有悠久的药用和食用历史,《四川中药志》载:牡丹花性平、苦、淡,具有调经活血的功能[2]。而明《遵生八菚》上曾记有“牡丹新落花瓣亦可煎食”,清《养小录》记载:“牡丹花瓣,汤淖可,蜜浸可。肉汁烩亦可”。牡丹花中活性成分种类多,含量丰富。研究表明牡丹花瓣中含有丰富的黄酮多酚类物质[3-4]、维生素(维生素B1、维生素B2和类胡萝卜素等)和矿物质(Ca、K、P、Mg、Se等)、蛋白质和氨基酸种类齐全[5-6],富含不饱和脂肪酸,是一种较好的天然营养保健资源。丹凤牡丹花更是2015年列入新资源食品名录。在崇尚回归自然的理念下,牡丹花作为普通绿色食品或保健食品前景都十分广阔。野漆树苷、没食子酸、芹菜素-7-O-β-D葡萄糖苷是牡丹花中主要化学成分,也是公认具有广泛生物活性的化合物,对牡丹花产品的质量控制和精深加工具有重要意义。
高速逆流色谱(High-Speed Counter-Current Chromatography,HSCCC),是一种连续特殊的流体动力学平衡基础上的液-液分配色谱技术,不使用固态色谱填料,制备成本相对较低且容易实现较大的制备量。与传统的分离纯化方法相比具有样品前处理简单、重复性好、避免填料对样品的吸附等特点[7-8],在黄酮、酚酸、生物碱等类型化合物的分离中优点明显。耿岩玲等采用超临界CO2萃取丹皮后高速逆流色谱分离纯化得到纯度大于99%的丹皮酚[9],罗娅君等采用高速逆流色谱利用氯仿-甲醇-水体系分离与鉴定了5个牡荆化学成分[10],徐双双等采用硅胶柱色谱结合高速逆流色谱法分离得到荷花中3个黄酮类化合物[11]。牡丹花中活性成分复杂且含量较低,直接采用HSCCC分离纯化所得化合物的产量和纯度低,而传统的柱色谱法耗时长、分离损失大。王晓等采用聚酰胺对牡丹花中的黄酮类成分富集分段后,采用高速逆流色谱分离得到4个黄酮单体化合物[12]。为了对牡丹花的成分有进一步的分析和利用,选择了对化合物类型适用范围更广的大孔树脂柱色谱进行前处理,结合高速逆流色谱,可以一次性得到酚酸和黄酮(野漆树苷、芹菜素-7-O-β-D葡萄糖苷和没食子酸,图1)两种类型牡丹花主要活性成分。
1 材料与方法
1.1 材料与仪器
牡丹花 采自山东菏泽,牡丹花瓣60 ℃鼓风干燥至恒重;D101大孔树脂 沧州宝恩化工有限公司;乙醇(分析纯) 德州恒业化工有限公司;石油醚、乙酸乙酯、正丁醇、甲醇(分析纯) 天津市化学试剂厂;甲醇、乙腈(色谱纯) 山东禹王试剂有限公司;甲酸(色谱纯) 德国Riedel 公司。
KQ3200型超声波清洗器 昆山市超声仪器有限公司;BUCH旋转蒸发仪 瑞士BUCH公司;同田HSCCC仪器系统 中国上海同田生化技术有限公司;AUW220D型电子分析天平 日本Shimadzu公司;Agilent 1120型高效液相色谱仪(配有DAD检测器,自动进样器) 美国Agilent 公司;Varian-400型核磁共振仪 美国Varian公司。
1.2 实验方法
1.2.1 牡丹花提取物的制备及预处理 干燥牡丹花瓣于70%乙醇60 ℃温浸两次(料液比8∶1 mL·g-1),每次4 h,减压浓缩,粗浸膏经D101大孔树脂精制(上样量10∶1),依次以纯水、10%、60%、90%乙醇梯度洗脱(每个洗脱剂用量为3倍柱体积),收集10%和60%部分,减压浓缩干燥,得牡丹花提取物。
1.2.2 高效逆流色谱溶剂体系的选择 用HPLC测定样品中目标成分在不同溶剂体系中的分配系数(KD),KD值的测定过程如下:取适量样品置于10 mL试管中,加入预先分配平衡的两相溶剂系统的上相和下相各2 mL剧烈振荡使其充分溶解和混合,静置分层后,取等体积的上相和下相,分别通过HPLC进行检测,KD值按下式计算:KD=A1/A2(A1目标化合物在上相中的峰面积;A2目标化合物在下相中的峰面积)。
1.2.3 HSCCC溶剂体系及样品溶液的制备 取乙酸乙酯、甲醇、正丁醇、水四种溶液按5∶1∶0.5∶4的比例配制成2 L溶液,在分液漏斗充分振荡静置分层。将上相和下相分别放在两个容器中,超声脱气备用。
取牡丹花提取物100 mg,溶于乙酸乙酯∶甲醇∶正丁醇∶水=5∶1∶0.5∶4溶剂体系上下相各10 mL。
1.2.4 HSCCC分离过程 将固定相(上相)注入螺旋管,流速是20 mL/min,流动相(下相)注入螺旋管流速是2 mL/min,注入流动相时调节主机顺时针旋转,转速为850 r/min左右。待螺旋管中的上相和下相达到流体动力学平衡后。打开紫外检测器,调节吸收波长是254 nm。同时将20 mL样品全部注入高速逆流色谱仪。根据紫外吸收色谱图手动收集各色谱峰组分。
1.2.5 高效液相色谱检测 将手动收集组分进行高效液相检测。合并高纯度组分,蒸干,得组分Ⅰ~Ⅲ。并对组分Ⅰ~Ⅲ进行纯度检测。检测条件:Agilent 1120 型高效液相色谱仪,色谱柱:YMC ODS C18(5 μm,4.6 mm×250 mm),柱温:25 ℃。流动相A:甲醇;流动相B:0.1%(v/v)甲酸水溶液;线性梯度洗脱程序:0~20 min,25% A~100% A;流速:1.0 mL/min;进样量:10 μL;检测波长:254 nm。
1.2.6 化合物的鉴定 HSCCC 分离得到的各化合物结构经过电喷雾离子质谱(ESI-MS)、核磁共振氢谱(1H-NMR)和核磁共振碳谱(13C-NMR)鉴定。质谱分析条件:正离子模式,样品通过流动注射泵进样,体积流量0.2 mL/min,干燥气温度350 ℃;干燥器流量9.0 L/min;雾化气压强24.1 Pa;毛细管电压4 kV;质量扫描范围m/z 50~1200,实验前质量数经过校正。核磁共振过程中溶剂为二甲基亚砜(DMSO),四甲基硅烷(TMS)作为内标物质。

表1 目标化合物在不同的溶剂体系中的分配系数(KD)Table 1 Partition coefficients(KD)of the 3 compounds in several solvent systems
2 结果与分析
2.1 HSCCC溶剂体系的选择与优化

图3 HPLC色谱图Fig.3 HPLC chromatograms 注:a:牡丹花提取物,b:野漆树苷(Ⅰ),c:没食子酸(Ⅱ),d:芹菜素-7-O-β-D葡萄糖苷(Ⅲ)。
在高速逆流色谱中,所选溶剂体系为互不相溶的两相液体且上下相体积比约为1,分层时间小于30 s。溶剂体系合适与否由目标化合物在两相溶剂中的分配系数(KD)来衡量,HSCCC最适合的KD值范围为0.5~2.0[7]。本实验中,对比正己烷∶乙酸乙酯∶甲醇∶水体系、乙酸乙酯∶甲醇∶水体系、乙酸乙酯∶甲醇∶正丁醇∶水体系,测定了目标化合物在不同溶剂体系中的KD值。如表1可以看出,乙酸乙酯∶甲醇∶水=5∶1.5∶4和乙酸乙酯∶甲醇∶正丁醇∶水=5∶1∶0.5∶4溶剂系统较为接近理想KD值,但从实际的分离效果来看,采用乙酸乙酯∶甲醇∶正丁醇∶水=5∶1∶0.5∶4两相溶剂体系时,分离效果较好。
2.2 HSCCC分离
采用乙酸乙酯∶甲醇∶正丁醇∶水=5∶1∶0.5∶4体系,按照1.2.4节所述实验方法对1.2.3节制备的样品进行HSCCC分离,固定相保留值为26.1%。根据HSCCC 谱图手动分段收集,分离结果见图2。通过HPLC检测,阴影部分为纯度较高的馏分,分别将其合并为组分Ⅰ~Ⅲ,减压浓缩干燥后称其质量分别为6.9、8.1、17.2 mg。

图2 HSCCC制备分离牡丹花提取物分离色谱图Fig.2 HSCCC chromatogram of the crude extract from Paeonia suffruticosa Andr.注:Ⅰ野漆树苷,Ⅱ没食子酸, Ⅲ芹菜素-7-O-β-D葡萄糖苷。
2.3 HPLC纯度测定
采用1.2.5项下方法,检测结果如图3所示。图3显示牡丹花粗提物以及分离得到三个化合物的高效液相色谱图和相应紫外吸收谱图。采用峰面积归一化法,测定野漆树苷(Ⅰ),没食子酸(Ⅱ)和芹菜素-7-O-β-D葡萄糖苷(Ⅲ)纯度分别为95.4%、97.0%、96.3%。
2.4 结构解析
化合物Ⅰ:淡黄色粉末(甲醇)。ESI-MS m/z:579[M+H]+.1H NMR(DMSO,400 MHz):δH12.94(1H,s,OH),7.96(2H,d,J=7.6 Hz,H-2′,6′),6.97(2H,d,J=7.6 Hz,H-3′,5′),6.91(1H,s,H-3),6.82(1H,s,H-8),6.39(1H,s,H-6),5.26(1H,d,J=6.0 Hz,H-1″),5.16(1H,brs,H-1‴),3.21-3.75(9H,m,H-2″-6″,H-2‴-5‴),1.22(3H,s,H-6‴);13C NMR(DMSO,100 MHz):δC182.5(C-4),164.8(C-2),163.1(C-7),162.1(C-4′),161.6(C-5),157.5(C-9),129.1(C-2′,6′),121.4(C-1′),116.6(C-3′,5′),105.9(C-10),103.7(C-3),100.9(C-1″),99.9(C-6),98.5(C-1‴),95.1(C-8),77.8(C-2″),77.7(C-3″),76.8(C-5″),72.3(C-4‴),71.1(C-3‴),71.0(C-2‴),70.2(C-4″),68.9(C-5‴),61.1(C-6″),18.7(C-6‴)。1H NMR 给出δH6.91(1H,s),6.82(1H,s)和6.39(1H,s)为黄酮A环上3位,8位,6位上的氢信号。δH7.96(2H,d,J=7.6 Hz,H-2′,6′)和 6.97(2H,d,J=7.6 Hz,H-3′,5′)为黄酮B环氢信号。δH1.22(3H,s)为鼠李糖上甲基氢信号。13C NMR给出δC100.9、98.5为两个糖的端基碳信号,δC18.7处为鼠李糖甲基碳信号。以上数据与文献[13]报道对照基本一致,故鉴定化合物为野漆树苷。
化合物Ⅱ:白色粉末(甲醇),ESI-MS m/z:171[M+H]+.1H NMR(DMSO,400 MHz):δH9.33(3H,brs,OH),6.94(2H,s,H-2,6);13C NMR(DMSO,100 MHz):δC168.2(C-7),145.9(C-3,5),138.5(C-4),121.3(C-1),109.3(C-2,6)。1H NMR给出δH6.94(2H,s)为苯环上对称的邻位氢信号。13C NMR给出6个苯环C信号和一个羧酸羰基δC168.2信号。以上数据与文献[14]报道对照基本一致,故鉴定化合物为没食子酸。
化合物Ⅲ:淡黄色粉末(甲醇)。ESI-MS m/z:433[M+H]+.1H NMR(DMSO,400 MHz):δH12.99(1H,s,OH),10.43(1H,s,OH),7.98(2H,d,J=8.0 Hz,H-2′,6′),6.96(2H,d,J=8.0 Hz,H-3′,5′),6.90(1H,s,H-3),6.85(1H,s,H-8),6.46(1H,s,H-6),5.09(1H,d,J=6.8 Hz,H-1″),4.64(1H,brs,OH),3.11-3.90(6H,m,H-2″-6″);13C NMR(DMSO,100 MHz):δC182.6(C-4),164.8(C-7),163.5(C-2),161.9(C-5),161.7(C-9),157.5(C-4′),129.3(C-2′,6′),121.7(C-1′),116.7(C-3′,5′),106.1(C-3),103.8(C-10),100.6(C-1″),100.2(C-6),95.5(C-8),77.9(C-5″′),77.1(C-3″),73.8(C-2″),70.2(C-4″),61.3(C-6″)。1H NMR给出δH6.90(1H,s),6.85(1H,s),6.46(1H,s)为黄酮A环上3位,8位,6位上的氢信号。δH7.98(2H,d,J=8.0 Hz,H-2′,6′),6.96(2H,d,J=8.0 Hz,H-3′,5′)为黄酮B环氢信号。13C NMR给出δC100.4为葡萄糖的端基碳信号。以上数据与文献[15]报道对照基本一致,故鉴定化合物为芹菜素-7-O-β-D-葡萄糖苷。
3 结论
牡丹花富含黄酮及多酚类化合物,化学成分复杂,采用传统的柱色谱分离纯化耗时长,得率低。本实验采用70%乙醇浸提牡丹花瓣,浸提物减压浓缩后经大孔树脂富集,富集得到了牡丹花中的活性组分,减少杂质对后续分离的干扰。然后采用高速逆流色谱乙酸乙酯∶甲醇∶正丁醇∶水=5∶1∶0.5∶4两相系统分离,化合物结构通过1H NMR、13C NMR、MS确定。从牡丹花中一次性分离出野漆树苷、芹菜素-7-O-β-D葡萄糖苷、没食子酸,化合物纯度经高效液相色谱检测均达到95%以上。该方法工作量小、快速、重复性好,且能同时得到黄酮和酚酸两类活性物质,具有较好的实用价值,为进一步开发利用牡丹花资源提供了一定的参考。
[1]赵兰勇. 中国牡丹栽培与鉴赏[M]. 北京:金盾出版社,2004:200-280.
[2]江苏新医学院. 中药大辞典上册[M]. 上海:上海科学技术出版社,1985:1130.
[3]闫慧娇,赵伟,耿岩玲,等. 牡丹花化学成分研究[J]. 天然产物研究与开发,2015,27(12):2056-2059.
[4]赵伟,耿岩玲,崔莉,等. 牡丹花黄酮类化学成分研究[J]. 中国现代中药,2016,18(3):303-306.
[5]史国安,郭香凤,包满珠. 不同类型牡丹花的营养成分及体外抗氧化活性分析[J]. 农业机械学报,2006,37(8):111-114.
[6]徐小博,贾文庆,刘会超. 牡丹品种间花瓣营养成分差异[J]. 浙江农林大学学报,2012,29(5):729-733.
[7]张天佑,王晓. 高速逆流色谱[M].北京:化学工业出版社,2011:1-58.
[8]曹雪丽. 高速逆流色谱分离技术及应用[M]. 北京:化学工业出版社,2005:188-189.
[9]耿岩玲,刘建华,王岱杰,等.超临界CO2萃取-高速逆流色谱分离纯化丹皮中丹皮酚[J]. 山东科学,2009,22(6):13-16.
[10]罗娅君,边清泉,张琦,等. 高速逆流色谱分离与鉴定牡荆化学成分[J]. 分析测试学报,2011,30(9):1044-1049.
[11]徐双双,孙瑜,井凤,等.硅胶柱色谱结合高速逆流色谱法分离纯化荷花中黄酮类化合物[J]. 色谱,2011,29(12):1244-1248.
[12]Wang X,Cheng CG,Sun QL,et al. Isolation and purification of four flavonoid constituents from the flowers ofPaeoniasuffruticosaby high-speed counter-current chromatography[J]. J Chromatogr A,2005,1075(1-2):127-131.
[13]章光文,周国平,谢二磊,等. 山香圆叶中黄酮类成分研究[J]. 中国中药杂志,2009,34(12):1603-1604.
[14]Sadtler R Lab. Sadtler Standard NMR Spectra[J]. Philadelphia:SadtlerRLabInc,1971:10229.
[15]Kubo M,Sasaki H,Endo T,et al. The constituents of Schizonepeta tenuifolia Briq. II Structure of a new monoterpene glucoside,schizonepetoside C[J]. Chem Pharm Bull,1986,34(8):3097-3101.
Rapid isolation of three bioactive components from the flowers ofPaeoniasuffruticosaAndr.
YAN Hui-jiao1,WANG Zhi-wei1,WANG Dai-jie1,AN Chun-yan2,GENG Yan-ling1,WANG Xiao1,*
(1.Shandong Analysis and Test Center,Shandong Key Laboratory Breeding Base of TCM Quality Control Technology,Ji’nan 250014,China; 2.Shandong Provincial Research Center for Bioinformatic Engineering and Technique,School of Life Sciences,Shandong University of Technology,Zibo 255000,China)
The present article is to develop new methods for isolation and purification of bioactive components from the flowers ofPaeoniasuffruticosaAndr. by the combination of macroporous resin column chromatography and high-speed counter-current chromatography. The 70% ethanol extracts of peony flowers was separated by macroporous resin column chromatography and the objective fraction was obtained.Then the fraction was separated by HSCCC with ethyl acetate∶methanol∶butyl alcohol∶water=5∶1∶0.5∶4 two-phase system. The purities of the obtained compounds were determined by HPLC and their chemical structures were identified by1H NMR,13C NMR,MS. Three single compounds,apigenin-7-O-β-D-neospheroside,gallic acid and apigenin-7-O-β-D-glucopyranoside were successfully obtained from Peony flowers and their purities were all over 95%. The developed method was effective in the isolation of flavonoids and phenolic acid from flowers ofPaeoniasuffruticosaAndr..
flowers ofPaeoniasuffruticosaAndr.;flavonoid;phenolic acid;isolation;high-speed counter-current chromatography
2016-12-12
闫慧娇(1984-),女,博士,助理研究员,主要从事中药学、天然产物化学方面的研究,E-mail:yanhuijiao01@163.com。
*通讯作者:王晓(1971-),男,博士,研究员,研究方向:天然产物化学及中药资源,E-mail:wangx@sdas.org。
国家青年科学基金(21506119);山东省科学院青年基金项目(青基合字2015第002号)。
TS201.2
B
1002-0306(2017)14-0188-04
10.13386/j.issn1002-0306.2017.14.037
