响应面法优化拟威尔嗜杀酵母Cyberlindneramrakii WM1代谢产嗜杀因子的发酵条件
2017-08-09谭春明杨少玲杨贤庆中国水产科学研究院南海水产研究所农业部水产品加工重点实验室国家水产品加工技术研发中心广东广州50300中国海洋大学食品科学与工程学院山东青岛266003
谭春明,杨少玲,杨贤庆,于 刚,*(.中国水产科学研究院南海水产研究所, 农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 50300; 2.中国海洋大学食品科学与工程学院,山东青岛 266003)
响应面法优化拟威尔嗜杀酵母CyberlindneramrakiiWM1代谢产嗜杀因子的发酵条件
谭春明1,2,杨少玲1,杨贤庆1,于 刚1,*
(1.中国水产科学研究院南海水产研究所, 农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300; 2.中国海洋大学食品科学与工程学院,山东青岛 266003)
以保藏于本实验室的海洋酵母菌种资源库的酵母菌株CyberlindneramrakiiWM1为研究对象,以人类条件致病菌白色假丝酵母CanidiaalbicansYTS-03为嗜杀毒素抑菌活性测试指示菌,以抑菌圈直径为考察指标,对拟威尔嗜杀酵母WM1代谢产嗜杀因子的发酵条件进行优化。首先以接种量、发酵液pH、发酵温度和时间为自变量,确定其四个因素对嗜杀活性的抑菌效果影响显著,再对这四个因素进行响应面实验优化。获得WM1生长代谢产嗜杀因子的最佳发酵条件为:接种量8%,发酵液pH4.0,发酵温度21 ℃,发酵时间2.5 d。优化后的WM1酵母发酵液的抑菌圈的直径达到21.00 mm,比优化前(16.5 mm)提高27.3%;菌液浓度也达2.58×108CFU/mL,比优化前(1.9×108CFU/mL)提高了35.8%。同时,最优发酵条件下获得的实验结果与模型预测值相吻合,说明建立的回归模型是切实可行的。
响应面,嗜杀酵母,嗜杀因子,发酵条件
嗜杀因子是嗜杀酵母在生长代谢过程中产生的,能够抑制或杀死某些特定的微生物,而这种嗜杀因子对酵母本身却没有嗜杀作用。近年来,嗜杀酵母作为工业生产菌株而被广泛使用,已被应用于发酵、食品、农业、养殖、医药等领域[1]。嗜杀酵母在发酵生产中可以净化发酵体系和环境,提高发酵产品的质量,提高生物稳定性;在食品工业,可抑制野生酵母的污染[2];在养殖业,一些海洋嗜杀酵母可以控制某些海洋酵母菌引起的海洋动物疾病[3];同时,嗜杀酵母分泌的嗜杀因子可作为抑制某些病原酵母及类酵母的抗真菌药制剂[4]。
实验发现,嗜杀酵母CyberlindneramrakiiWM1对白色假丝酵母具有较好的杀灭作用。白色假丝酵母菌为条件致病菌,正常情况与机体处于共生状态,不引起疾病,但因某些因素破坏而失衡时,便在局部大量生长繁殖,引起皮肤、黏膜甚至全身性的内源性感染。目前的防治手段并不能达到安全、高效与便捷,如果能利用这种嗜杀因子作为抗真菌药制剂来治疗白色念珠菌引发的疾病,将会带来巨大的社会效益和经济效益,这种嗜杀作用值得进一步研究。本文以WM1酵母菌株为研究对象,通过单因素实验和响应面法优化发酵条件,获得该菌代谢产生高活性嗜杀因子的最优发酵参数,为该菌株后期研究及在工业上大量生产嗜杀毒素提供一定的实践基础和理论依据。
1 材料与方法
1.1 材料与仪器
嗜杀酵母菌株CyberlindneramrakiiWM1 来自于本实验室保藏的海洋酵母菌种资源库;人类条件致病菌CanidiaalbicansYTS-03 由山东省烟台市烟台山医院妇科提供,分离自阴道内分泌物样品;美蓝 Sigma公司;实验所用试剂 均为分析纯;YPD培养基 按文献进行配制[5]。
SHP-250型生化培养箱 上海博迅实业有限公司;福玛QYC-211型摇床 上海知楚仪器有限公司;德国Eppendorf PCR仪(Mastercycler gradient) 上海恒久医疗器械有限公司;UV752型紫外分光光度计 上海精密科学仪器有限公司;PHS-3C型pH计 上海仪电科学仪器有限公司。
1.2 实验方法
1.2.1 种子液培养 用接种针挑取WM1酵母单菌落接种于装有50 mL种子培养基的250 mL三角瓶中,28 ℃,140 r/min,振荡培养24 h。
1.2.2 发酵条件的确定及优化
1.2.2.1 接种量 配好的产嗜杀因子培养基,调节初始pH4.5,取50 mL于500 mL三角瓶中,灭菌后分别按2%、4%、6%、8%、10%和12%的接种量将培养好的种子液接入,置于28 ℃、140 r/min摇床发酵,培养2 d,测定酵母所产嗜杀因子的嗜杀活性。
1.2.2.2 发酵液pH 500 mL三角瓶按10%体积装液,用0.05 mol/L柠檬酸-磷酸氢二钠缓冲溶液分别调节培养基pH为3.5、4.0、4.5、5.0、5.5、6.0、6.5,灭菌后按8%的接种量接入,置于140 r/min摇床发酵,温度28 ℃,培养2 d,测定酵母所产嗜杀因子的嗜杀活性。
1.2.2.3 培养温度 配好的产嗜杀因子培养基,调节pH4.5,取50 mL于500 mL三角瓶中,灭菌后按8%的接种量接入,置于温度分别为16、20、24、28、32和36 ℃的摇床发酵,转速为140 r/min,培养2 d,测定酵母所产嗜杀因子的嗜杀活性。
1.2.2.4 发酵时间 配好的产嗜杀因子培养基,调节pH4.5,取50 mL于500 mL三角瓶中,灭菌后按8%的接种量接入,置于140 r/min摇床发酵,温度24 ℃,分别培养12、18、24、30、36、42、48、54、60、66和72 h,测定酵母所产嗜杀因子的嗜杀活性。
1.2.2.5 响应面优化 根据单因素实验结果,选择接种量(A)、发酵液pH(B)、培养温度(C)及发酵时间(D)四个因素为自变量,利用Design-Expert(V 8.0.5)软件,通过Box-Behnken模型进行中心组合实验设计,以酵母所产嗜杀因子的嗜杀活性为响应值设计响应面实验[6-9]。实验结果取三次的平均值,实验因素水平见表1。

表1 响应面实验因素水平表Table 1 Factors and levels table of Box-Behnken experiment
1.2.3 菌液浓度的测定 采用比浊法,根据菌悬液的浓度在一定范围内与光密度成正比,可以用分光光度计测600 nm波长处的OD值,用OD值作为待测菌株菌液浓度指标,其菌液浓度由标准曲线获得[10]。取一标准样液稀释不同浓度,测定其OD值并采用平板计数法获取相对应浓度的细胞数量,以菌液浓度为横坐标(X),不同浓度发酵液OD600 nm值为纵坐标(Y)绘制标准曲线,标准曲线的方程为Y=0.6677X+0.0202,R2=0.9998。不同发酵水平的菌液浓度便可通过测定OD600 nm的形式由标准曲线得到。
1.2.4 嗜杀活性的测定 将病原酵母敏感菌株YTS-03接种于装有50 mL YPD 液体培养基的250 mL三角瓶中,28 ℃振荡培养24 h,取2.0 mL的菌体5000×g离心5 min,弃上清,用无菌水洗涤3次,最后用无菌水悬浮菌体,根据OD600与细胞数量的对应关系,将敏感菌株YTS-03 的细胞量调节至107~108cells/mL。使用前摇匀菌悬液,用灭菌的棉签沾上并涂布于嗜杀活性检测培养基平板上,静置5 min左右,让菌液完全被平板吸收,然后将灭好菌的牛津杯(Oxford-cups,6.0 mm×10.0 mm)放置于平板中央,取250.0 μL的待测样品加入到牛津杯中。将平板移至28 ℃的烘箱中培养1~2 d,用尺子量取抑菌圈的直径并记录[5]。
1.3 数据处理
实验中每个处理重复三次,采用Design-Expert(V 8.0.5)软件进行数据的显著性和回归分析,运用Office 2007软件进行作图。
2 结果与分析
2.1 单因素实验
2.1.1 接种量对酵母菌株发酵水平的影响 从图1可知,微生物的生长和嗜杀因子产生表现的趋势并不完全一致,随着接种量的增加,酵母生长逐渐加强,而所产嗜杀因子的嗜杀活性开始增强并在接种量为8%时达到最高值,之后随着接种量的增加嗜杀活性反而下降。从有利于产嗜杀因子来说,WM1的生长代谢需要适宜的接种量,过低和过高所产嗜杀因子活性都较低,不利于酵母的发酵应用。这主要是因为接种量过低时在有限的发酵时间下菌液浓度较低,所产嗜杀因子量少;而接种量过高时,因培养基的营养有限,供菌株生长后没有足够的营养来产嗜杀因子,导致所产嗜杀因子量少。因此以后的实验都在接种量为8%的条件下进行。

图1 接种量对WM1生长状况及嗜杀能力的影响Fig.1 Effect of inoculum concentration on growth status and killing ability of WM1
2.1.2 发酵液pH对酵母菌株发酵水平的影响 从图2可知,WM1适宜偏酸环境生长,最适生长pH为5.0,发酵液嗜杀能力在pH4.5最大值接近20 mm。在相同pH条件下,微生物生长与嗜杀能力的趋势表现出一定的一致性及差异性。随着pH升高,微生物生长及嗜杀能力均是先加强,分别在pH达到5.0和4.5时达到最大值,之后两者都开始减弱。然而,从有利于产生嗜杀因子角度考虑,WM1适宜的生长代谢环境为pH4.5下进行。适宜酸性环境也是酵母生长的共性[11-12],在偏酸性条件下,有利于嗜杀因子的产生,对酵母WM1的发酵应用也是有利的。所以,选定适宜的发酵pH为4.5。
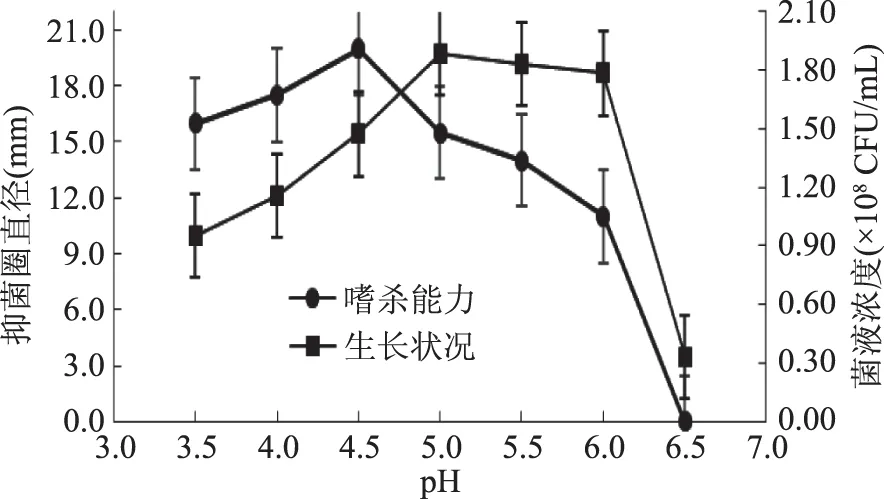
图2 发酵液pH对WM1生长状况及嗜杀能力的影响Fig.2 Effect of fermentation liquid pH on growth status and killing ability of WM1
2.2.3 温度对酵母菌株发酵水平的影响 从图3可以看出,嗜杀酵母WM1最适生长温度为28 ℃,但发酵温度在24 ℃时嗜杀能力最佳,此时发酵液菌圈直径达20 mm,兼顾生物的生长及较好的嗜杀能力,后续实验选择24 ℃作为适宜发酵温度。酵母WM1受温度的影响较大,不同温度下培养,其生长和嗜杀能力都表现出由低到高再到低的变化趋势,而且嗜杀能力随温度变化幅度表现得较为突出,从16~24 ℃嗜杀能力增强,从24~36 ℃又开始急速下降,这与蛋白对温度敏感是相一致的。

图3 发酵温度对WM1生长状况及嗜杀能力的影响Fig.3 Effect of fermentation temperature on growth status and killing ability of WM1
2.1.4 发酵时间对酵母菌株发酵水平的影响 从图4可知,随着发酵时间的延长,WM1的生长及发酵液活性均不断增加,当发酵到第2 d时,酵母菌株的生长开始减弱,进入衰亡期;而发酵液的嗜杀活性依然增加,并在发酵时间为66 h时嗜杀活性出现最高值;此后,随着发酵时间的继续延长,发酵液活性保持了稳定值。从有利于嗜杀因子的产生及结合实际情况,确定该WM1酵母最佳发酵时间可以选择为3 d。

图4 发酵时间对WM1生长状况及嗜杀能力的影响Fig.4 Effect of fermentation time on growth status and killing ability of WM1
2.2 响应面分析
2.2.1 模型的建立及分析 以接种量、发酵液pH、培养温度及发酵时间为实验四因素,抑菌圈直径为评价指标,按照二次项回归方程进行实验。BBD的完整设计矩阵和变量对响应变量的交互作用见表2。

表2 响应面实验设计及结果Table 2 Design and results of Box-Behnken experiment
由表2可知,应用Design-Expert(V 8.0.5)软件进行多元回归拟合[13-14],可得接种量(A)、发酵液pH(B)、发酵温度(C)、发酵时间(D)与抑菌圈直径(Y)的关系,如下公式所示:
Y=5.22917+6.37500A-7.16667B+1.51042C-0.75000D-0.37500AB-0.031250AC+0.50000AD+0.62500BC+3.00000BD+0.18750CD-0.33854A2-1.91667B2-0.10026C2-3.91667D2
对回归方程进行方差分析,分析结果见表3,该回归模型p值为0.0002<0.01,而失拟项的p值为0.0821>0.05,说明模型回归极其显著,失拟检验不显著,该实验数据与模型拟合良好,而且未知因素对实验结果的干扰很小,模型适合。此外,通过F检验可以看出,pH和发酵时间的一次项极其显著、发酵温度的一次项显著,接种量不显著;发酵液pH和发酵温度的交互项显著,接种量、发酵时间、发酵温度的二次项对抑菌圈直径的影响都是显著的,其中接种量和发酵温度的二次项均处于极其显著;该实验模型对嗜杀因子的嗜杀活性提供了很好的优化分析与预测。

表3 Box-Behnken实验结果的方差分析Table 3 Analysis of variance(ANOVA)of Box-Behnken experiment results
注:*:p<0.05,差异显著;**:p<0.01,差异极显著。
2.2.2 响应面分析 由表3可知,交互项BC、A2、C2、D2对Y均有显著影响(p<0.05),而A2、C2对Y有极显著影响(p<0.01),其交互作用的曲面图如图5~图10所示。它反映了接种量、pH、发酵时间和发酵温度这四个因素交互作用对响应值的影响。通过方程二次项的系数是负的和曲面图抛物线的开口是向下的,可知有一个最大值点,并且B、C、D三个因素及BC、A2、C2、D2的交互作用对抑菌圈直径的影响显著。从图5~图10可知,抑菌圈直径开始随着各因素值的增加而增加并到达最高点,之后开始下降,均有先增大后减小的趋势,这些图再一次的反映了B、C、D三个因素是影响抑制区直径的重要因素。
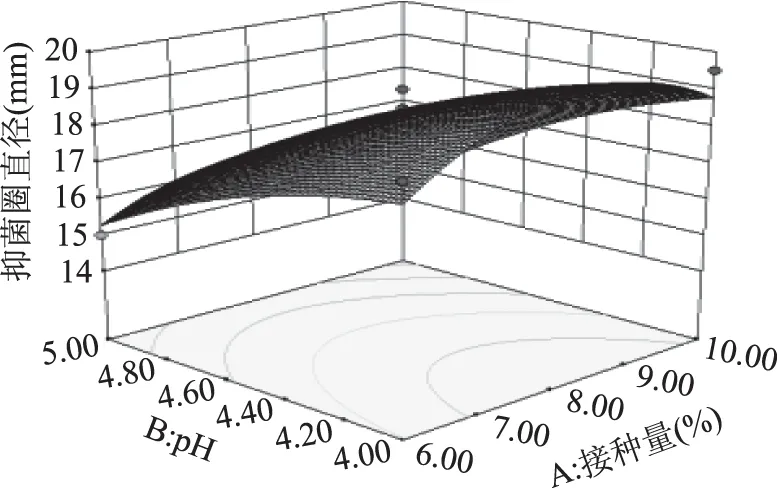
图5 接种量和pH对菌株产嗜杀毒素影响的响应面立体分析图Fig.5 The 3D surface map of inoculum concentration and pH value effect on killer toxin produced by yeast strains

图6 接种量和发酵温度对菌株产嗜杀毒素影响的响应面立体分析图Fig.6 The 3D surface map of inoculum concentration and fermentation temperature effect on killer toxin produced by yeast strains

图7 接种量和发酵时间对菌株产嗜杀毒素影响的响应面立体分析图Fig.7 The 3D surface map of inoculum concentration and fermentation time effect on killer toxin produced by yeast strains

图7 接种量和发酵时间对菌株产嗜杀毒素影响的响应面立体分析图Fig.7 The 3D surface map of inoculum concentration and fermentation time effect on killer toxin produced by yeast strains

图8 pH和发酵温度对菌株产嗜杀毒素影响的响应面立体分析图Fig.8 The 3D surface map of pH value and fermentation temperature effect on killer toxin produced by yeast strains

图9 pH和发酵时间对菌株产嗜杀毒素影响的响应面立体分析图Fig.9 The 3D surface map of pH value and fermentation time effect on killer toxin produced by yeast strains

图10 发酵温度和时间对菌株产嗜杀毒素影响的响应面立体分析图Fig.10 The 3D surface map of fermentation timeand fermentation temperature effecton killer toxin produced by yeast strains
利用Design Expert软件,进行分析计算,可得产嗜杀毒素的最佳培养条件为:接种量8%、pH4.0、发酵温度21 ℃、培养时间2.5 d,在此条件下嗜杀毒素的抑菌圈直径达21.48 mm,活菌数为2.58×108CFU/mL。
2.2.3 发酵优化条件的验证 采用最优条件进行实验,测得酵母发酵液抑菌圈直径为21.00 mm,与模型预测结果21.48 mm接近,说明此模型预测结果能较好地反映实际情况,结果见表4。

表4 最优条件下实验值和预测值的对比Table 4 Comparison between experimental and predicted responses at the optimum condition
验证值和预测值之间的误差为2.23%<5%,是显著的,说明该模型可被用于优化,并且优化是成功有效的。
3 结论
利用Box-Behnken模型对拟威尔酵母WM1产嗜杀因子的发酵条件进行优化,以获得嗜杀酵母所产嗜杀因子活性最高的发酵条件,方差分析表明模型拟合度良好。最优的发酵条件为:接种量8%,发酵液pH4.0,发酵时间2.5 d,发酵温度21 ℃,摇床转数140 r/min。通过发酵条件优化,嗜杀因子活性相比优化前得到显著提高,其发酵液的嗜杀能力达最大值21.00 mm,比优化前的(16.5 mm)提高27.3%;活菌数也达2.58×108CFU/mL,比优化前(1.9×108CFU/mL)提高了35.8%。可见,通过对接种量、发酵液pH、发酵温度和发酵时间的响应面优化是成功有效的,这为高效发酵获取高活性的嗜杀因子提供了技术指导,为后续大规模发酵及进一步的研究提供基础。
[1]王祥红,贾仁洁,李静,等. 嗜杀酵母的生物学功能及其应用[J]. 生物技术通报,2013(4):33-38.
[2]Schmitt MJ,Breinig F. The viral killer system in yeast:from molecular biology to application[J]. FEMS Microbiol,2002,26(3):257-276.
[3]Chi ZM,Liu GL,Zhao SF,et al. Marine yeasts as biocontrol agents and producers of bio-products[J]. Appl Microbiol Biotechnol,2010,86(5):1227-1241.
[4]Magliani W,Conti S,Travassos LR,et al. From yeast killer toxins to antibiobodies and beyond[J]. FEMS Microbiol Lett,2008,288(1):1-8.
[5]彭莹. 土星拟威尔酵母WC91-2菌株嗜杀因子和β-1,3-葡聚糖酶的研究[D]. 青岛:中国海洋大学,2010.
[6]Wang XH,Chi ZM,Yue LX,et al. A marine killer yeast against the pathogenic yeast strain in crab(Portunustrituberculatus)and an optimization of the toxin production[J]. Microbiol Res,2007a,162(1):77-85.
[7]Zhang TR,Yu CQ. Optimization of mortierella isabellina culture conditions in fermentation of arachidonic acid by response surface methodology[J]. Acad Period Farm Products Processing,2012(2):27-38.
[8]Su T,Bao B,Yan T,et al. Response surface methodology to optimize marine microbe culture for producing fungi fibrinolytic compound[J]. Chin J Biotech,2013,29(6):857-861.
[9]刘国荣,张郡莹,王成涛,等. 响应面法优化双歧杆菌B04代谢产细菌素的发酵条件[J]. 食品科学,2013,34(3):147-152.
[10]胡小媛,滕达,张勇,等. 防腹泻布拉酵母培养条件的响应面法优化[J]. 生物技术通报,2013(6):194-199.
[11]蔺立杰,赵媛,王建中,等. 核桃酱油制曲条件的优化[J]. 食品与发酵工业,2012,38(5):96-100.
[12]纪凤娣,鲁蟒,张建,等. 商用酱油曲精中微生物分布研究[J]. 中国酿造,2010,29(6):80-82.
[13]申乃坤,王青艳,陆雁,等. 响应面法优化耐高温酵母生产高浓度乙醇[J]. 生物工程学报,2010,26(1):42-47.
[14]左爱连,张伟国. 利用Design-Expert软件优化丝氨酸羟甲基转移酶产酶培养基[J]. 生物技术,2008,18(3):45-49.
Optimization of fermentation conditions for killer toxin production fromCyberlindneramrakiiWM1 by response surface methodology
TAN Chun-ming1,2,YANG Shao-ling1,YANG Xian-qing1,YU Gang1,*
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences, National Research and Development Center for Aquatic Product Processing,Key Laboratory of Aquatic Product Processing,Ministry of Agriculture,Guangzhou 510300,China; 2. Ocean University of China,College of Food Science and Engineering,Qingdao 266003,China)
The fermentation conditions for killer toxin production fromCyberlindneramrakiiWM1 preserved in the laboratory of marine yeast resource pool were optimized. The diameter of inhibition zone(mm)was used as evaluation index and quantified againstCanidiaalbicansYTS-03. Firstly,chose inoculum concentration,pH value,fermentation temperature and time as independent variables,based on these single factor tests,response surface methodology with the four variables was employed to optimize the fermentation conditions for killer toxin production. The optimum fermentation conditions ofCyberlindneramrakiiWM1 production for the growth and metabolism of killer toxin were inoculation of 8%,pH of 4.0,fermentation temperature of 21 ℃,fermentation time of 2.5 days. Under these optimal conditions,the WM1 killer yeast fermentation broth reached its maximum capacity of 21.00 mm,than before optimization(16.5 mm)to improve 27.3%. The number of viable cells also reached 2.58×108CFU/mL,compared with the previous optimization(1.9×108CFU/mL)improved 35.8%. At the same time,the experimental results obtained under the optimal fermentation conditions were in agreement with the predicted values,indicated the established regression model was feasible.
response surface;killer yeast;killer toxin;fermentation conditions
2016-11-28
谭春明(1991-),男,硕士研究生,研究方向:食品加工与功能食品,E-mail:cmtan_ouc@163.com。
*通讯作者:于刚(1972-),男,博士,研究员,研究方向:水产品加工及高值化利用,E-mail:gyu0928@163.com。
广东省海洋渔业科技与产业发展专项(A201501C13)。
TS201.3
A
1002-0306(2017)14-0126-06
10.13386/j.issn1002-0306.2017.14.025
