高效液相色谱-串联质谱法同时测定枸杞中31种农药残留
2017-08-09汤丽华马桂娟马雪梅宁夏回族自治区食品检测中心宁夏银川750001
汤丽华,马桂娟,朱 捷,马雪梅(宁夏回族自治区食品检测中心,宁夏银川 750001)
高效液相色谱-串联质谱法同时测定枸杞中31种农药残留
汤丽华,马桂娟,朱 捷,马雪梅
(宁夏回族自治区食品检测中心,宁夏银川 750001)
建立了高效液相色谱-串联质谱法(HPLC-MS/MS)同时测定枸杞中31种农药残留的方法。枸杞经乙腈提取,Cleant TPH固相萃取柱净化,以C18色谱柱分离待测物,在电喷雾正离子化模式下,采用多反应监测(MRM)检测。结果表明,31种农药在1~200 μg/L的范围内线性关系良好,相关系数均大于0.995,方法检出限为0.65~7.1 μg/kg,样品添加回收实验的平均回收率为69.7%~112.1%,相对标准偏差为5.67%~14.27%(n=6)。该方法简单准确,适用于枸杞中31种农药残留的同时检测。
高效液相色谱-串联质谱法,枸杞,农药残留
枸杞为茄科类灌木,是一种药食同源的珍贵中药材,其丰富的营养价值受到人们的青睐。近年来,随着枸杞种植面积扩张迅速,种植年限的增加,枸杞病虫危害日趋严重[1]。枸杞生产过程中农药施用不合理,造成枸杞产品农药残留问题日益凸显,导致其食用性和安全性均受到影响。
目前,测定枸杞农药残留的方法有气相色谱(GC)法[2]、液相色谱(HPLC)法[3]、气相色谱-质谱(GC-MS)法[4]、液相色谱-串联质谱(LC-MS/MS)法[5]等分析技术。常用测定枸杞农药残留的方法中以气相色谱-质谱(GC-MS)法应用较多,但对于一些新型农药的检测此方法难以满足要求,基质效应干扰大,而液相色谱-串联质谱(LC-MS/MS)法因其具有更好的分析性能和更宽的适用范围,抑制基质干扰效果显著,能够提高检测器的灵敏度和选择性,在农药残留检测中得到了广泛的应用[6]。本实验通过对目前市场中枸杞常用农药的品种调查,确定采用液相色谱-串联质谱法结合固相萃取技术,建立LC-MS/MS法同时测定枸杞中31种农药残留,该方法准确可靠,回收率稳定,能满足日常枸杞农药残留的检测要求。
1 材料与方法
1.1 材料与仪器
枸杞 宁夏地区市售;农药标准品:吡蚜酮(Pymetrozine)、多菌灵(Carbendazim)、吡虫啉(Imidacloprid)、啶虫脒(Acetamiprid)、敌敌畏(Dichilorvos)、甲基硫菌灵(Thiophanate-methyl)、克百威(Carbofuran)、甲霜灵(Metalaxyl)、杀扑磷(Methidathion)、咪酰胺(Prochloraz)、乙霉威(Diethofencarb)、螺虫乙酯(Spirotetramat)、嘧菌酯(Azoxystrobin)、三唑酮(Triadimefon)、乙基多杀菌素(Spinetoram)、戊唑醇(Tebuconazol)、氟硅唑(Flusilazole)、马拉硫磷(Malathion)、三唑磷(Triazophos)、丙环唑(Propiconazole)、鱼藤酮(Rotenone)、印楝素(Nimbin)、醚菌酯(Kresoxim-methyl)、四螨嗪(Clofentezine)、甲拌磷(Phorate)、辛硫磷(Phoxim)、丙溴磷(Profenofos)、噻螨酮(Hexythiazox)、唑螨酯(Fenpyroximate)、炔螨特(Propargite)、哒螨灵(Pyridaben) 德国Dr.Ehrenstorfer公司,纯度均大于98%;甲醇、乙腈 色谱纯,赛默飞世尔科技有限公司;甲苯 色谱纯,天津市科密欧化学试剂有限公司;甲酸 色谱纯,德国SIGMA公司;氯化钠 优级纯,国药集团化学试剂有限公司;所有用水 均为超纯水;0.22 μm有机相滤膜 上海安谱实验科技股份有限公司。
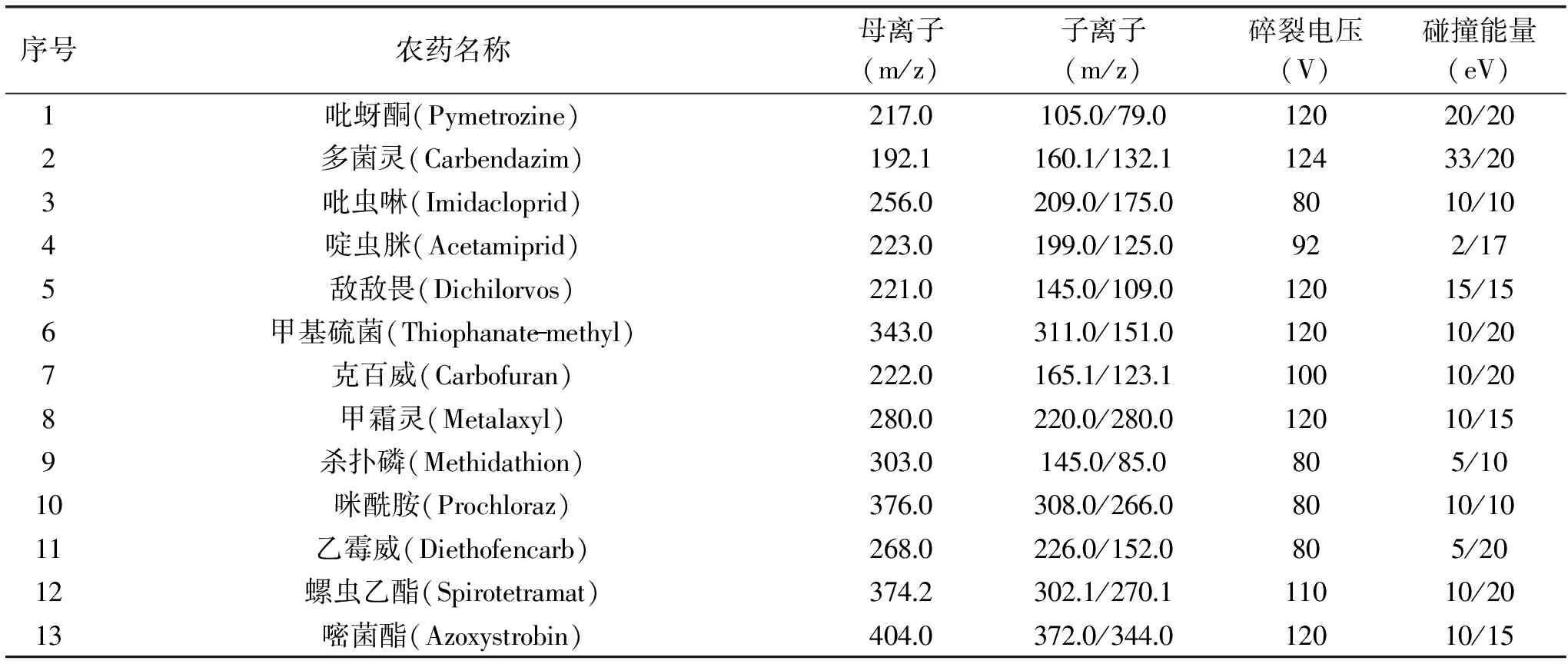
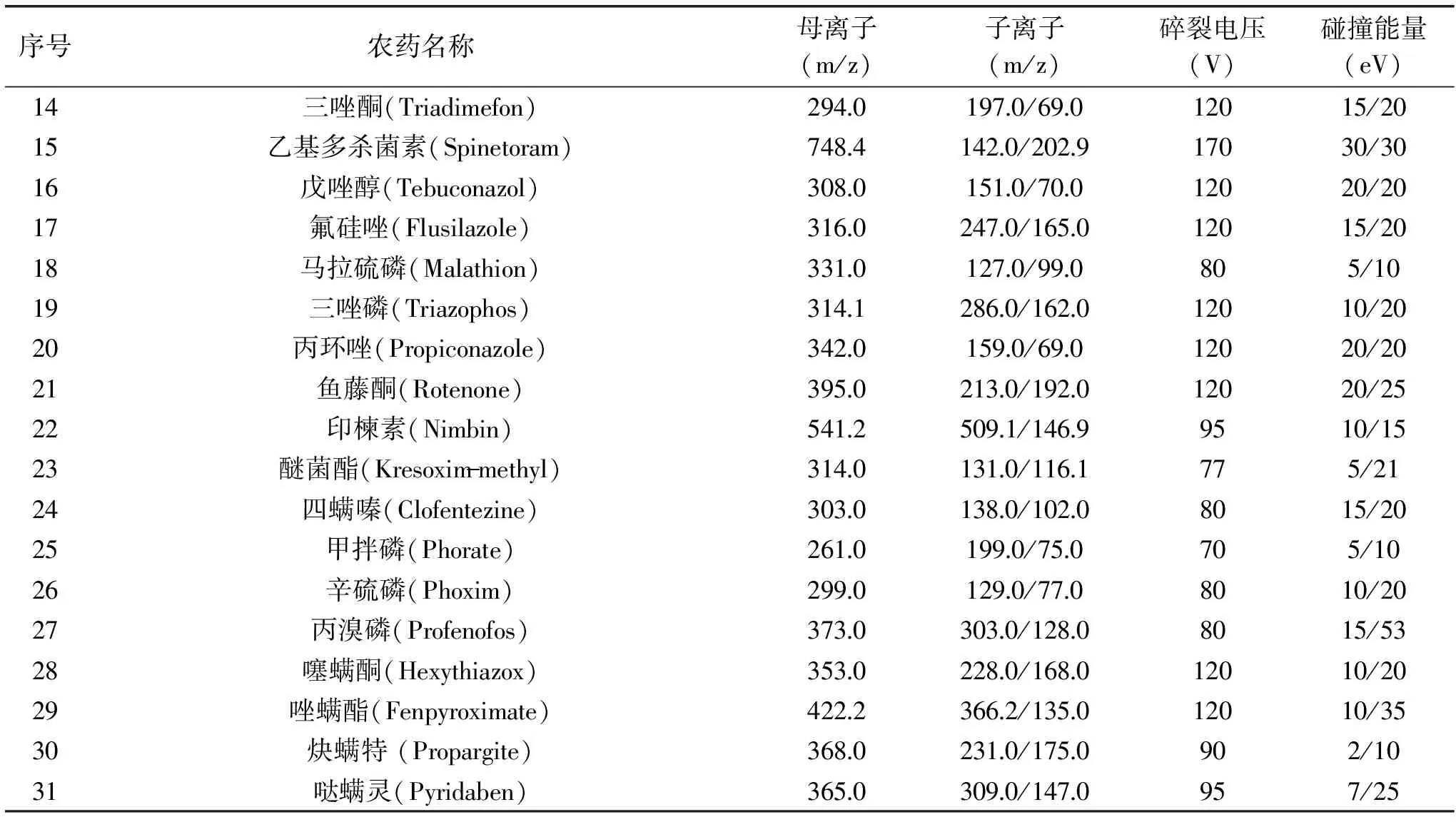
表2 31种农药的质谱分析参数Table 2 MS/MS parameters of the 31 pesticide residues
Aglient6460三重四级杆质谱 配Aglient 1260高效液相色谱仪,Aglient Jet Stream电喷雾离子源(AJS ESI),美国安捷伦公司;IKA T25数显型分散机 德国IKA公司;BUCHI V-850旋转蒸发仪 瑞士步琦实验室公司;BS224电子天平 赛多利斯科学仪器公司;HGC-24方形干式加热氮吹仪 北京恒奥德仪器仪表有限公司;3-15高速离心机 德国Sigma公司;固相萃取柱Cleant TPH-SPE(2000 mg/12 mL) 博纳艾杰尔科技公司;Carb/NH2-SPE(500 mg/6 mL) 美国美国安捷伦公司。
1.2 标准溶液的配制
准确称取适量标准品,分别用乙腈配制成1.0 mg/mL的标准储备液,根据实验需要用乙腈稀释成不同浓度的标准工作溶液,储存在-4 ℃冰箱中备用。
1.3 样品前处理
称取5.0 g(精确至0.01 g)枸杞于100 mL塑料离心管中,加入10.0 mL水放置过夜后加15 mL乙腈,10000 r/min匀浆提取1.0 min。再加入2 g氯化钠,匀浆提取1.0 min。将匀浆后的样品在冰水浴中静置5 min,于4000 r/min下离心5.0 min,取10 mL上清液于100 mL鸡心瓶中。再向离心管中加入15 mL乙腈,重复提取一次,取10 mL上清液,合并两次提取液共20 mL,于40 ℃旋转蒸发至1.0 mL左右,待净化。
Cleanert TPH柱经10 mL乙腈+甲苯(3+1)活化后,加入上述浓缩液,用鸡心瓶接收洗脱液,分两次加2.0 mL乙腈+甲苯(3+1)洗涤旋蒸瓶并接收洗脱液。将盛有洗脱液的鸡心瓶于40 ℃旋转蒸发至1.0 mL左右,氮吹仪吹干,用乙腈定容至2.0 mL,旋涡混匀,0.22 μm滤膜过滤,上机待测[7]。
1.4 仪器条件
1.4.1 色谱条件 安捷伦ZORBAX Eclipse Plus C18(2.1 mm×100 mm,3.5 μm)色谱柱;流动相:A相0.1%甲酸水,B相乙腈,流动相梯度洗脱程序见表1;流速:0.3 mL/min;进样量:5 μL;柱温:40 ℃;运行时间:25 min;后运行时间:10 min。
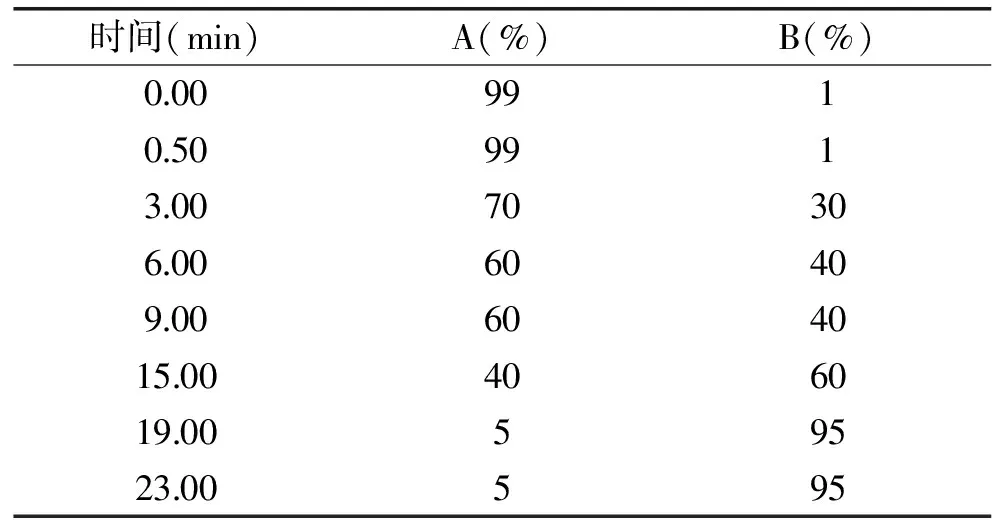
表1 流动相梯度洗脱程序Table 1 Mobile phase composition forlinear gradient elution
续表
1.4.2 质谱条件 离子源:AJS ESI源;扫描方式:正模式;检测方式:MRM(多反应监测);雾化气压力:45 psi;喷嘴电压:500 V;干燥气温度与流速:325 ℃,5 L/min;鞘气温度与流速:375 ℃,11 L/min;毛细管电压:4000 V。枸杞中31种农药的定量和定性离子、碰撞能量和碎裂电压等参数见表2。
2 结果与分析
2.1 质谱条件优化
分别对31种浓度为1.0 μg/mL的目标化合物进行单针进样,优化其质谱条件。当目标化合物进入一级质谱后,可产生稳定的[M+H]离子[8]。确定母离子后,在SIM模式下优化各目标化合物的碎裂电压。母离子进入二级质谱,产生不同的离子碎片。在子离子扫描模式下,优化碰撞能量,得到相应的离子碎片。31种农药的二级离子质谱图见图1,MRM色谱图见图2。
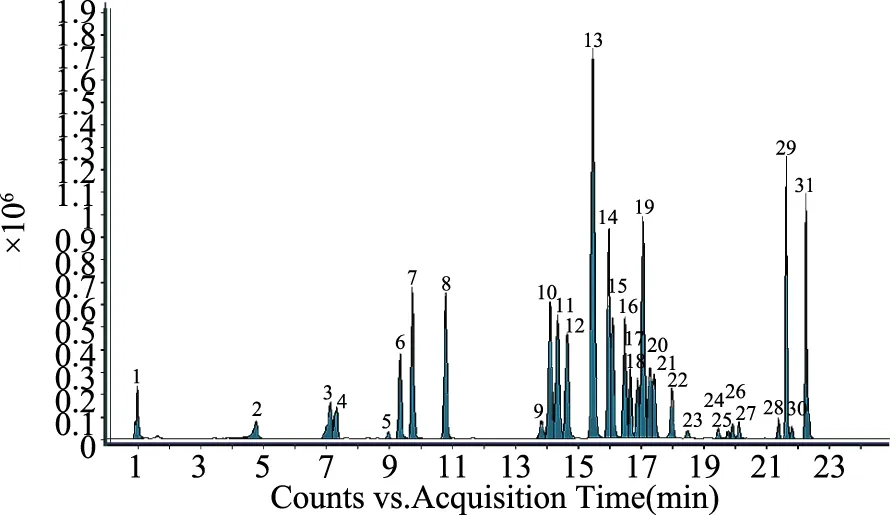
图2 31种农药的MRM色谱图Fig.2 MRM chromatograms of the 31 pesticide residues
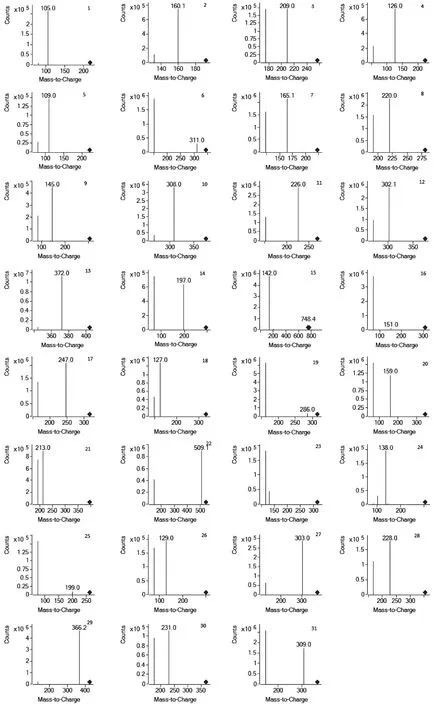
图1 31种农药的二级离子质谱图Fig.1 MS/MS spectra of the 31 pesticide residues注:1.吡蚜酮;2.多菌灵;3.吡虫啉;4.啶虫脒;5.敌敌畏;6.甲基硫菌灵;7.克百威;8.甲霜灵;9.杀扑磷;10.咪酰胺;11.乙霉威;12.螺虫乙酯;13.嘧菌酯;14.三唑酮;15.乙基多杀菌素;16.戊唑醇;17.氟硅唑;18.马拉硫磷;19.三唑磷;20.丙环唑;21.鱼藤酮;22.印楝素;23.醚菌酯;24.四螨嗪;25.甲拌磷;26.辛硫磷;27.丙溴磷;28.噻螨酮;29.唑螨酯;30.炔螨特;31哒螨灵。图2同。
2.2 前处理条件优化
2.2.1 样品提取方式的优化 由于市售的枸杞含水量偏低,乙腈对其渗透力较差,不能充分地将枸杞样本中的待测农药完全提取出来。根据现有的文献方法比较发现,直接在枸杞中加水用乙腈提取,待测组分提取不完全,回收率偏低。而采用枸杞复水放置过夜的方式,可使枸杞中部分糖分溶解,用乙腈提取,匀浆后提取效率更高,各待测组分回收率均有提高。
2.2.2 固相萃取柱的选择 固相萃取(SPE)能有效分离待测物与干扰组分,减少样品预处理的过程,富集待测组分,提高分析灵敏度[9]。目前常用的有Carbon-NH2柱、Cleanert TPH柱,Carbon-NH2能很好地吸附色素及其他杂质[10],而Cleanert TPH能去除中草药中的色素、酸性干扰杂质、糖分及脂溶性杂质。结果表明,Carbon-NH2去除色素的效果较好,但对样品中的目标物有吸附性;而Cleanert TPH能有效的分离目标化合物与杂质,去除杂质的同时不会吸附目标农药,目标化合物回收率高。
2.2.3 标准曲线、线性范围及检出限 为降低基质中的干扰物质影响目标化合物的离子化,使目标化合物产生基质效应。将上述配制好的31种农药标准储备液用乙腈稀释成1.0 mg/L混合标准溶液,用空白枸杞基质提取液将混合标准溶液稀释成1、5、10、20、50、100、200 μg/L系列质量浓度的混合标准溶液分别进行测定。以质量浓度为横坐标,定量离子峰面积为纵坐标,绘制标准曲线。31种农药的线性回归方程、相关系数、线性范围及检出限(信噪比S/N≥3)见表3。结果表明,31种农药在基质中的线性范围良好,相关系数均大于0.995,方法检出限为0.65~7.1 μg/kg,检出限达到我国枸杞农药残留限量标准GB/T 23201-2008中的要求。
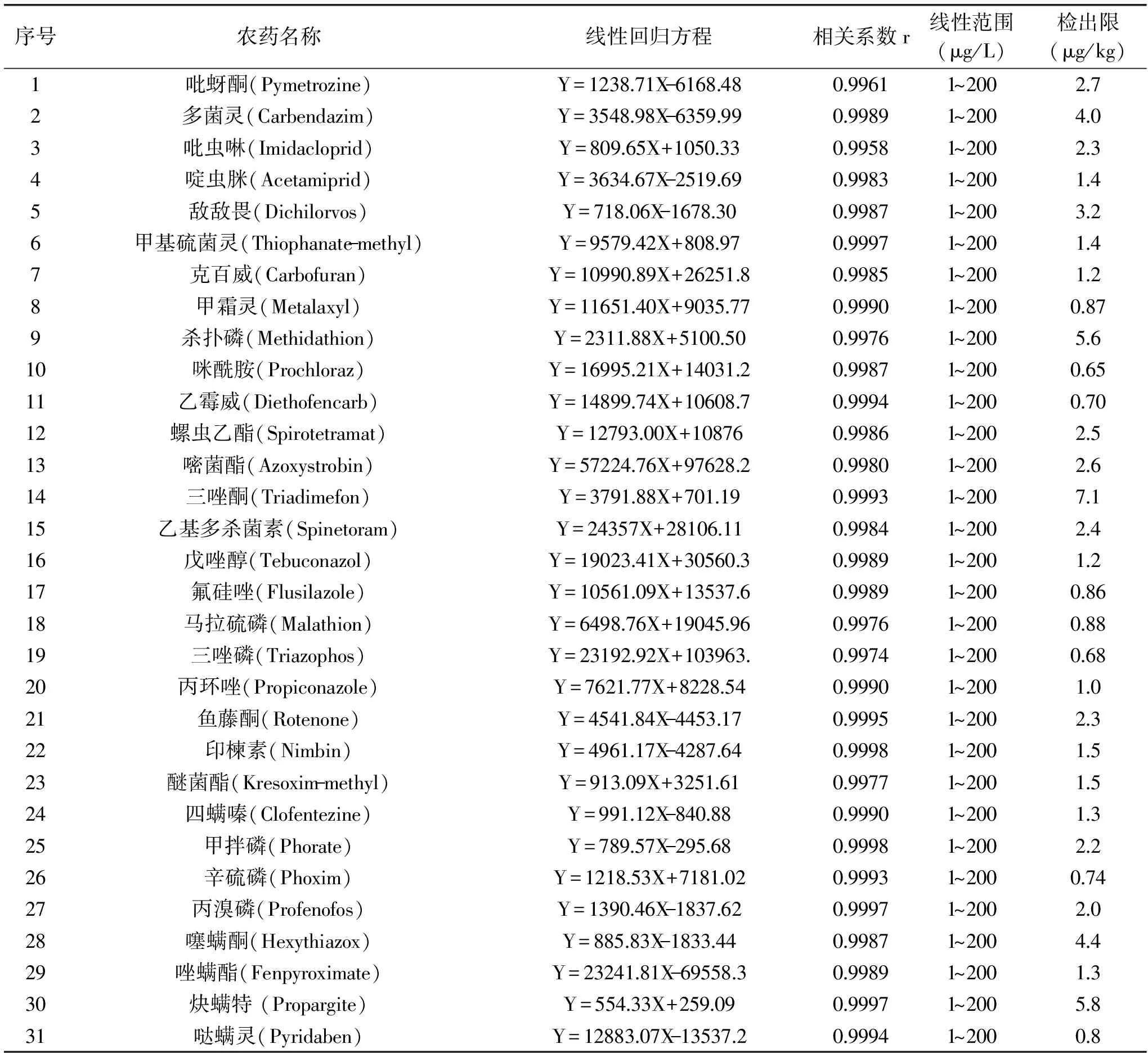
表3 31种农药的线性回归方程、相关系数、线性范围及检出限Table 3 Linear equation,coefficient correlation,linear range,LODs of the 31 pesticide residues
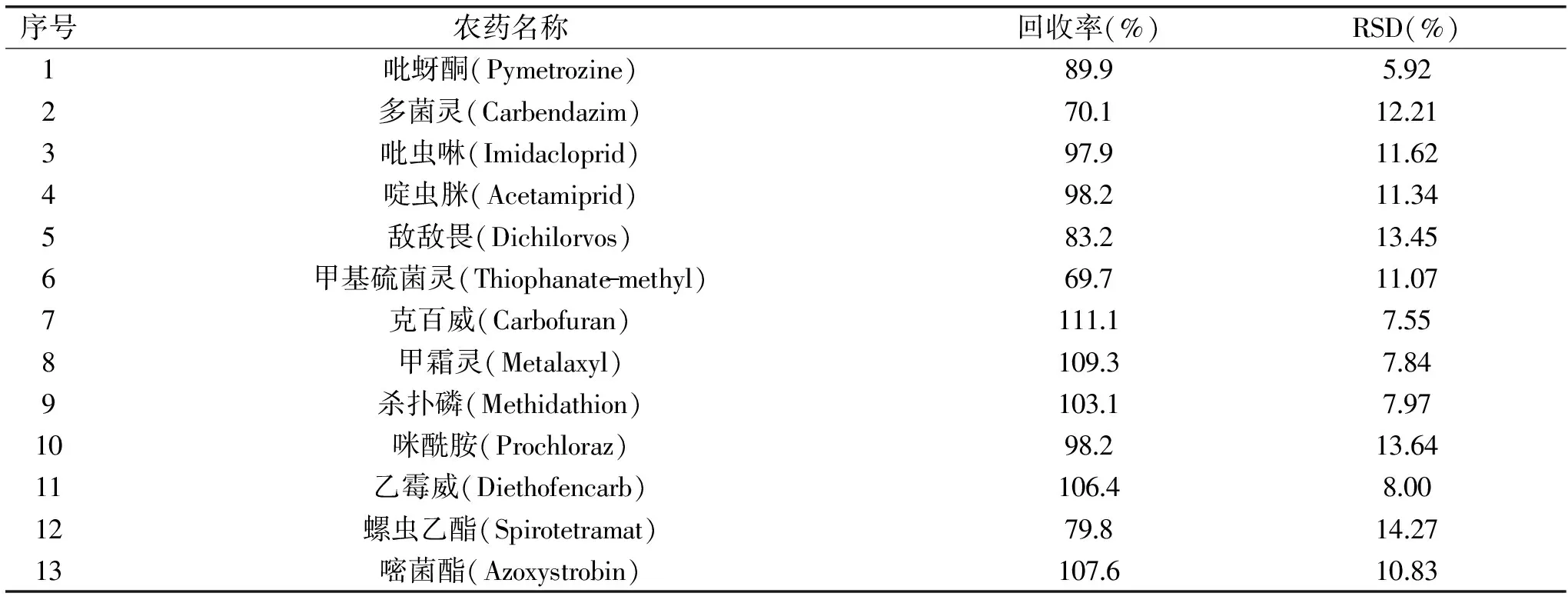
表4 31种农药的添加回收率和相对标准偏差(RSD)(n=6)Table 4 Spiked recoveries and relative standard deviations(RSD)of the 31 pesticide residues(n=6)
2.3 回收率和精密度
通过在枸杞空白基质样品中添加回收实验,考察方法的准确度和精密度(n=6),添加回收率实验结果见表4。结果表明,当添加水平浓度为20 μg/L时,31种农药的平均加标回收率为69.7%~112.1%,RSD在5.67%~14.27%之间,方法的准确度和精密度均符合农药残留分析要求,方法重现性良好。
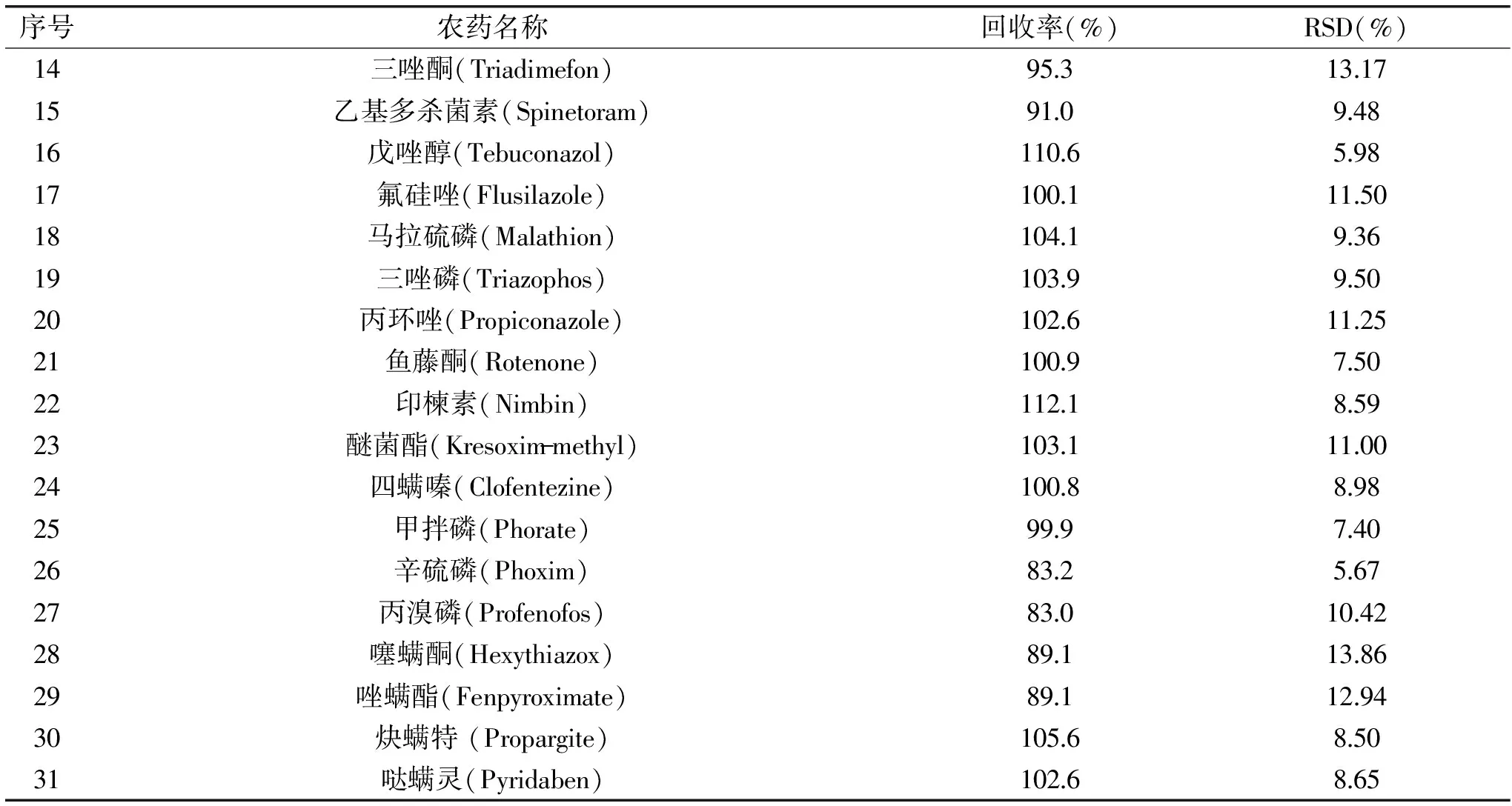
续表
3 结论
本文建立了高效液相色谱-串联质谱法结合固相萃取技术,测定枸杞中31种农药残留的分析方法。该方法前处理操作简单,净化效果好,灵敏度高,能够满足枸杞中31种农药残留的定性和定量分析。
[1]徐常青,刘赛,徐荣,等.我国枸杞主产区生产现状调研及建议[J].中国中药杂志,2014,39(11):1979-1984.
[2]陈京闽,索芳,王生英.枸杞中对硫磷残留量痕量测定的溶剂微萃取方法的研究[J].中国卫生检验杂志,2014,24(13):1874-1878.
[3]罗娟,谢云.高效液相色谱法检测枸杞子中吡虫啉残留量[J].湖北中医药大学学报,2011,13(1):34-36.
[4]林祥群,卢春霞,罗小玲,等.气相色谱-质谱法测定枸杞中28种农药残留[J].江苏农科科学,2016,44(1):285-289.
[5]张艳,王晓菁.液相色谱-串联质谱法测定枸杞中氨基甲酸酯类农药残留量[J].河南农业科学,2011,40(2):107-110.
[6]陈丽娜,宋凤瑞,刘志强.液相色谱-质谱联用技术在中药农药残留分析中的应用进展[J].质谱学报,2010,31(6):342-353.
[7]梁月香,王晓菁,姜瑞,等.固相萃取-液相色谱串联质谱测定枸杞中有机磷农药残留[J].山东林业科技,2011(6):1-4.
[8]黄何何,张缙,徐敦明,等.QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J].色谱,2014,32(7):707-716.
[9]黄嵩.气质联用和液质联用在农残检测中的应用[J].轻工科技,2012(9):120-121.
[10]林童,魏玉海,凤晓博,等.超高效液相色谱-串联质谱法测定枸杞中常见的 5种农药残留[J].现代农药,2015,14(2):37-39.
Determination of 31 pesticide residues in Chinese wolfcherry by high performance liquid chromatography-tandem mass spectrometry
TANG Li-hua,MA Gui-juan,ZHU Jie,MA Xue-mei
(Ningxia Hui Autonomous Region Food Testing Center,Yinchuan,750001,China)
A method for the simultaneous determination of 31 pesticide residues in Chinese wolfcherry by high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS)was developed. The samples were extracted with acetonitrile,cleaned up by Cleant TPH solid phase extraction column. The resulting samples were separated on a C18column,and detected by multiple reactions monitoring(MRM)under the condition of positive mode. The results showed that the linear calibration curves were obtained in the entire range(1~200 μg/L)for all the above pesticides,with the correlation coefficients higher than 0.995,the detection limit was 0.65~7.1 μg/kg. For all the samples,the average spiked recoveries ranged 69.7% from 112.1%,and the relative standard deviations(n=6)were in the range of 5.67%~14.27%.The method was easy and accurate,and can meet the requirement for the determination of the 31 pesticide residues in Chinese wolfcherry.
high performance liquid chromatography-tandem mass spectrometry;Chinese wolfcherry;pesticide residues
2016-11-23
汤丽华(1986-),女,硕士研究生,工程师,研究方向:食品分析,E-mail:tanglihua532@163.com。
TS255.7
A
1002-0306(2017)14-0026-06
10.13386/j.issn1002-0306.2017.14.006
