大孔树脂纯化茶皂素及其产品性质研究
2017-08-08杨瑞金张文斌
顾 姣 杨瑞金 谢 斌 张文斌 赵 伟 华 霄
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
大孔树脂纯化茶皂素及其产品性质研究
顾 姣1,2杨瑞金1,2谢 斌1,2张文斌1,2赵 伟1,2华 霄1,2
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
研究了利用大孔吸附树脂纯化茶皂素的方法和纯化前后茶皂素性质的变化。通过8种不同极性的大孔树脂对茶皂素的吸附和解吸规律的研究,发现XR910X对茶皂素的纯化效果最好。动力学研究表明,XR910X对茶皂素的吸附符合Freundlich模型。XR910X对茶皂素纯化的最佳工艺条件为上样:样品pH 6.0,流速1.71 BV/h,体积1 BV;洗脱部分杂质:0.05 g/100 mL NaOH溶液,流速1.71 BV/h,体积 2 BV;解吸:90%乙醇溶液,流速1.71 BV/h,体积2 BV。在上述优化的条件下,茶皂素的回收率为70.34%,产品纯度为94.26%。对比纯化前后茶皂素的相关性质,发现纯化后的茶皂素在表面活性、抗氧化活性及抑菌性能方面均比纯化前的有明显提高。
茶皂素;大孔树脂;纯化;动力学;性质
油茶树是世界四大木本油料作物之一,作为油茶的原产国,中国也是世界上最大的油茶生产基地,拥有几千年的油茶种植历史,预计到2020年油茶种植面积将达4.67×106hm2[1]。因油茶籽脂肪含量较高,主要被用于茶油的生产,然而油茶籽除了含有丰富的油脂外,还含有丰富的茶皂素、茶多糖及黄酮等多种天然活性成分。其中茶皂素的含量高达15%~20%,且茶皂素属于天然的非离子型表面活性剂[2],不但具有良好的表面活性[3],同时还有抑菌[4-5]、抗渗消炎[6-7]、防止动脉硬化[8]、抑制酒精吸收、保护肠胃[9]等生理活性,因此具有非常高的开发和利用价值。
目前市场上的茶皂素含杂质较多,普遍纯度不高,影响了茶皂素深加工利用,因此需要进一步纯化,以提高产品性能。树脂因其具有选择性好、绿色环保、可再生等优点,已经成为天然活性物质纯化的常用手段[10]。但目前应用于茶皂素纯化的树脂的回收率较低或是产品纯度较低,并缺乏纯化后相关性质的表征。本试验旨在寻找一种新型大孔树脂纯化茶籽中茶皂素,以获得更高的茶皂素得率和纯度,并对纯化前后茶皂素的相关性质进行测定,为茶皂素的推广应用提供理论支持。
1 材料与方法
1.1 材料与仪器
粗茶皂素:纯度约为60%,本实验室自制;
茶皂素标品:98%,国药集团化学试剂有限公司;
ABTS试剂:Sigma中国试剂公司;
大肠杆菌(Escherichiacoli,10899)、枯草芽孢杆菌(Bacillussubtilis,10732)和酿酒酵母(Saccharomycescerevisiae,ATCC9763):工业微生物菌种保藏中心;
黑曲霉(Aspergillusniger):由本实验室筛选;
乙醇、浓硫酸、香草醛、氢氧化钠:AR级,国药集团化学试剂有限公司;
胰蛋白胨、酵母提取物、琼脂:BR级,国药集团化学试剂有限公司;
马铃薯:市购;
NKA-2型树脂(极性):陕西蓝深特种树脂有限公司;
HPD850型树脂(中等极性)、D101型树脂(非极性):郑州勤实科技有限公司;
XR901X、XR919C、XR910X、XR919X型树脂:上海逊尔化工科技有限公司;
AB-8型树脂(弱极性):陕西蓝深特种树脂有限公司;
分光光度计:UV-1100型,上海美谱达仪器公司;
摇床:QYC-2102型,上海新苗医疗器械公司;
全自动表面张力仪:DCAT21型,德国德菲公司;
循环水式真空泵:SHZ-D型,巩义市予华仪器公司;
恒流泵:HL-2B型,上海沪西分析仪器厂有限公司;
恒温培养箱:LRH-70型,上海一恒科学仪器有限公司;
蒸汽灭菌锅:LDZX-50KBS型,上海申安器械厂。
1.2 试验方法
1.2.1 粗茶皂素的制备 实验室前期研究[11]采用乙醇水提法提取茶籽中油茶籽油,该生产过程会产生大量富含茶皂素的水相,将水相过超滤膜初步分离后进行喷雾干燥,制得粗茶皂素。
1.2.2 大孔吸附树脂的筛选
(1) 静态吸附与解吸:大孔树脂经预处理后取2 g于锥形瓶中,加50 mL的粗茶皂素溶液,在30 ℃,120 r/min的恒温恒湿摇床中吸附24 h(至饱和),抽滤后,测定滤液中茶皂素浓度,计算静态吸附过程中茶皂素的吸附率和吸附量。
向上述吸附饱和的树脂中,加入体积分数为90%的乙醇溶液50 mL,在转速120 r/min,温度30 ℃的恒温恒湿摇床中解吸24 h,抽滤后,测定滤液中的茶皂素浓度,计算茶皂素的解吸率和解吸量[12]。
(2) 静态吸附动力学曲线的测定:各取XR910X、AB-8和D101型树脂2 g于锥形瓶中,加50 mL粗茶皂素溶液,于30 ℃,120 r/min的恒温恒湿摇床中吸附至平衡,每隔一定的时间测定上清液中茶皂素的浓度。绘制树脂吸附茶皂素的静态吸附动力学曲线。
1.2.3 吸附等温线的测定 取2 g XR910X型树脂于锥形瓶中,加入50 mL不同浓度的粗茶皂素溶液,在120 r/min,不同温度(20,25,30 ℃)的摇床中吸附24 h(至平衡),抽滤后,测定滤液中茶皂素的浓度,计算平衡吸附浓度Ce和平衡吸附量qe,并绘制平衡吸附等温线。
1.2.4 解析液乙醇浓度的选择 称2 g左右吸附至饱和的XR910X型树脂,分别加入50 mL不同浓度的乙醇溶液(水,10%,30%,50%,70%,90%,无水乙醇)解吸茶皂素。解吸温度30 ℃,转速120 r/min,反应24 h(至解吸完全),测定滤液中茶皂素的浓度,对比不同浓度的乙醇对茶皂素的解吸率和解析量,选择最佳的乙醇浓度。
1.2.5 XR910X型树脂的动态吸附及流速的选择 取35 mL预处理后的XR910X型树脂,湿法装柱,玻璃层析柱规格为1.0 cm×35 cm。先用5 BV体积的去离子水冲洗柱子,然后以不同的流速(0.86,1.71,3.43 BV/h)上样,每5 mL为一管收集流出液,绘制茶皂素的动态吸附曲线,并选择最佳的上样流速。
在上述吸附至平衡的柱子中,用不同流速(0.86,1.71,3.43 BV/h)的90%乙醇进行茶皂素的洗脱,每5 mL收集洗脱液,测定茶皂素的浓度,根据洗脱曲线,选择合适的洗脱速率。
1.2.6 茶皂素溶液pH对大孔树脂吸附效果的影响 将100 mL不同pH(5,6,7,8,9)的粗茶皂素溶液以1.71 BV/h的流速上样,分管收集流出液,测定其茶皂素浓度,绘制XR910X型树脂对不同pH 的粗茶皂素溶液的动态吸附曲线。
1.2.7 不同浓度氢氧化钠溶液对杂质的去除效果 分别用2 BV不同浓度的氢氧化钠溶液(0.000,0.050,0.075,0.100,0.150 g/100 mL),对吸附至平衡的树脂柱进行杂质的洗脱,根据洗脱效果选择最佳的氢氧化钠溶液浓度。
1.2.8 茶皂素的测定 采用香草醛—浓硫酸比色法[13]。纯化后茶皂素得率和纯度按式(1)、(2)计算:

(1)

(2)
式中:
R——茶皂素回收率,%;
P——茶皂素纯度,%;
V解——乙醇解析液体积,mL;
C解——解吸液茶皂素浓度,mg/mL;
V原——粗茶皂素溶液体积,mL;
C原——粗茶皂素溶液中茶皂素浓度,mg/mL;
M茶皂素——纯化后产品中茶皂素质量,mg;
M产品——纯化后茶皂素产品质量,mg。
1.2.9 树脂纯化后茶皂素的性质
(1) 表面张力:用去离子水将树脂纯化前后的茶皂素配置成浓度分别为0.000,0.005,0.010,0.025,0.050,0.075,0.100,0.250,0.500 g/100 mL的溶液,在全自动表面张力仪上测定其表面张力,观察纯化前后茶皂素的表面性能的变化。
(2) 抗氧化性:ABTS+·清除率通常用来表示样品的总抗氧化能力[14]。配制7 mmol/L ABTS的储备液,室温下避光放置12~16 h后使用。测定时,用PBS(10 mmol/L,pH=7.4)溶液稀释,使其在734 nm处的吸光值为0.50±0.02。取3 mL ABTS+·稀释液加入30 μL纯化前后不同浓度的茶皂素溶液,震荡30 s,室温静置6 min后,测A734 nm。ABTS+·清除率按式(3)计算:
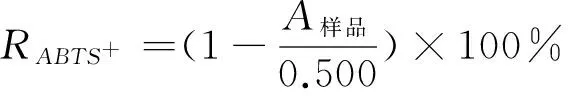
(3)
式中:
RABTS+——ABTS+清除率,%;
A样品——样品测定的吸光值。
(3) 抑菌性:本试验菌种为细菌(大肠杆菌、枯草芽孢杆菌)和真菌(酵母菌、黑曲霉);分别挑3~4环活化后生长旺盛的菌株于各自的液体培养基中(细菌为LB 液体培养基,真菌为PDA 培养基),配置成菌悬液,在摇床中培养6 h(细菌37 ℃,真菌28 ℃)至菌悬液浑浊,取100 μL,用涂布法制作4种菌种的含菌平板。
在上述含菌平板中等距离地放入3个灭菌后的牛津杯,分别将30 μL不同浓度的茶皂素溶液平稳地注射到牛津杯中,以等量的溶剂做空白对照,每个做5组平行。将接种好的平板,移动到菌种最佳生长温度的恒温恒湿培养箱中,培养2~3 d,测量每种菌的抑菌圈直径,3次测定取平均值[15]。
1.2.10 树脂纯化茶皂素的相关计算 树脂吸附率、解析率、吸附量及解吸量分别按式(4)~(7)计算[16]:

(4)
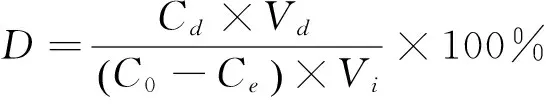
(5)

(6)

(7)
式中:
A——树脂吸附率,%;
D——树脂解析率,%;
qe——树脂吸附量,mg/g·干树脂;
qd——树脂解吸量,mg/g·干树脂;
C0——所用溶液中茶皂素浓度,mg/L;
Ce——吸附平衡后溶液中茶皂素浓度,mg/L;
Cd——解吸平衡后解析液中茶皂素浓度,mg/L;
Vd——解析液体积,mL;
Vi——茶皂素透过液体积,mL;
m——所用树脂质量,g。
1.2.11 数据处理 所有试验做3或3次以上平行,试验数据通过SPSS Statistics 18.0 进行显著性分析。
2 结果与讨论
2.1 树脂的选择
图1、2为不同的树脂对粗茶皂素溶液进行静态吸附和解吸的结果。其中D101型、AB-8型和XR910X型3种树脂在吸附和解吸2个方面都优于其他类型的树脂。D101型和XR910X型是非极性树脂,不同于弱极性树脂AB-8型,由于茶皂素是一种弱极性的化合物,根据相似相吸的原理,弱极性或非极性的树脂对茶皂素的纯化效果较好。近年来,有关AB-8型和D101型用于纯化茶皂素的研究报道比较多[17-18],但本研究中吸附效果最好的XR910X型用于茶皂素纯化的研究未见报道。XR910X型对茶皂素的吸附量高达281.21 mg/g·干树脂,远高于AB-8型(229.53 mg/g·干树脂)和D101型(211.85 mg/g·干树脂)。表1对比了3种大孔树脂的主要参数,发现XR910X型树脂的比表面积远大于另外2种树脂,而树脂的比表面积越大,越有利于增加树脂的吸附量[19]。
2.2 静态吸附动力学曲线
图3为XR910X型、D101型、AB-8型3种树脂的静态吸附动力学曲线,在0~3 h时,3种树脂的吸附速度都非常快,其中XR910X型树脂在3 h时逐渐达到吸附平衡,3~10 h时的吸附量变化不大,而D101型树脂在4 h左右达到平衡,AB-8型树脂在7 h左右才达到平衡。XR910X型树脂对茶皂素的平衡吸附量可达231.31 mg/g·干树脂,明显优于AB-8型(209.55 mg/g·干树脂)和D101型(192.04 mg/g·干树脂),因此选择XR910X型树脂进行后续研究。
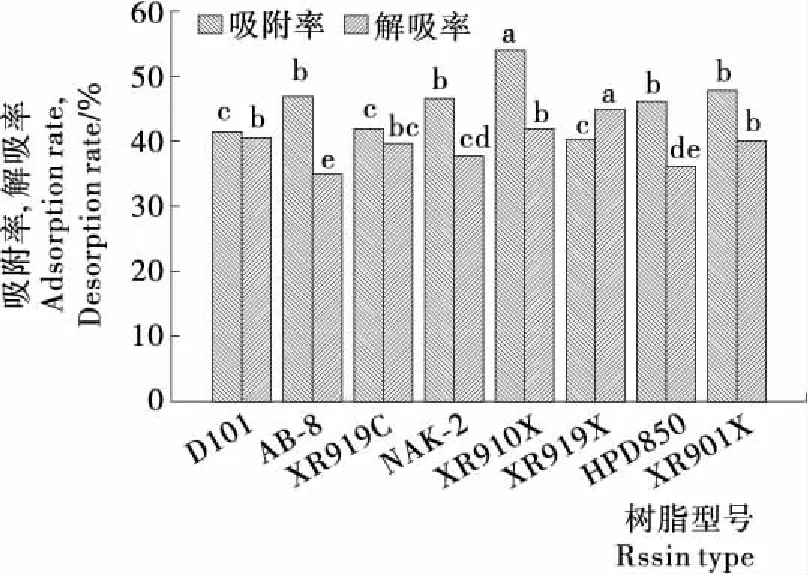
不同字母表示差异显著(P<0.05)

不同字母表示差异显著(P<0.05)
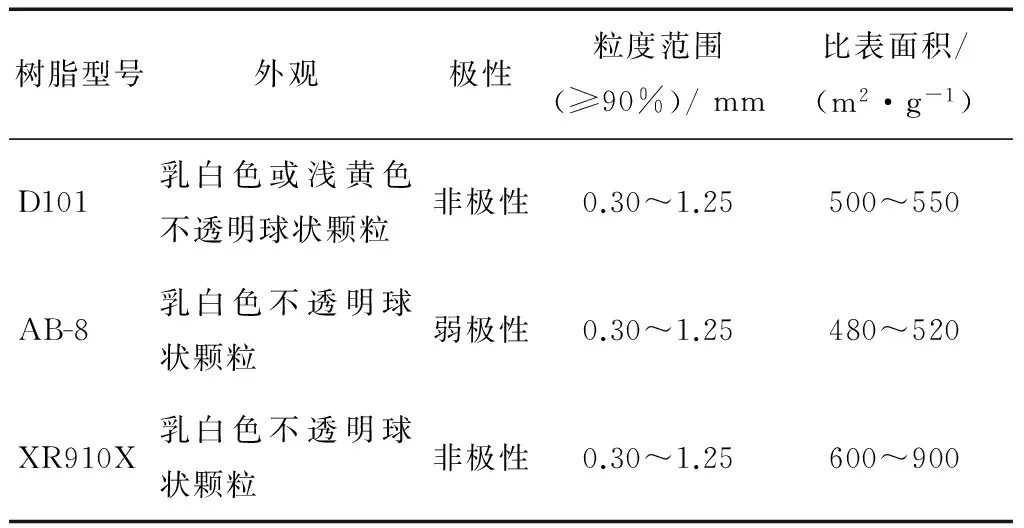
树脂型号外观极性粒度范围(≥90%)/mm比表面积/(m2·g-1)D101乳白色或浅黄色不透明球状颗粒非极性0.30~1.25500~550AB-8乳白色不透明球状颗粒弱极性0.30~1.25480~520XR910X乳白色不透明球状颗粒非极性0.30~1.25600~900
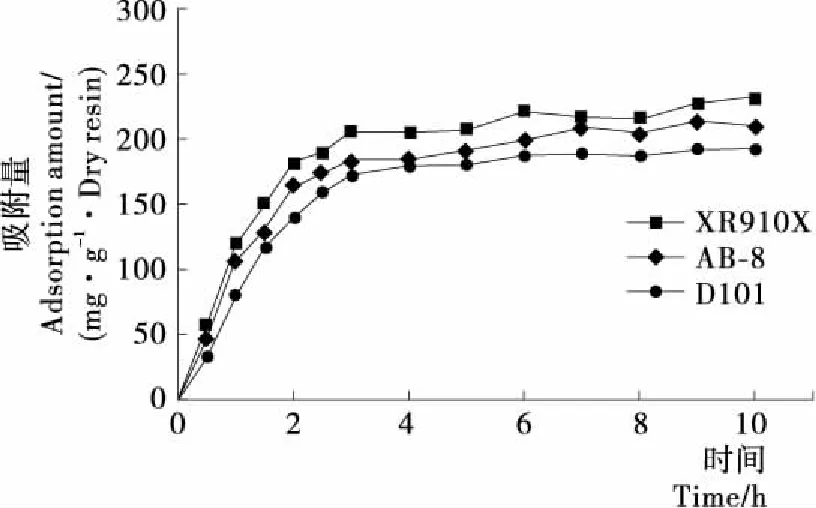
图3 静态吸附动力学曲线
2.3 吸附等温线的测定
进一步研究XR910X型树脂对茶皂素的吸附过程,采用Langmuir模型和Freundlich 模型来拟合其固-液吸附平衡过程[20]。如图4、5所示,总体上Freundlich模型的相关性略高于Langmuir模型,在Freundlich模型中1/n<0.5,表示吸附很容易发生,说明XR910X型树脂适用于茶皂素的纯化。
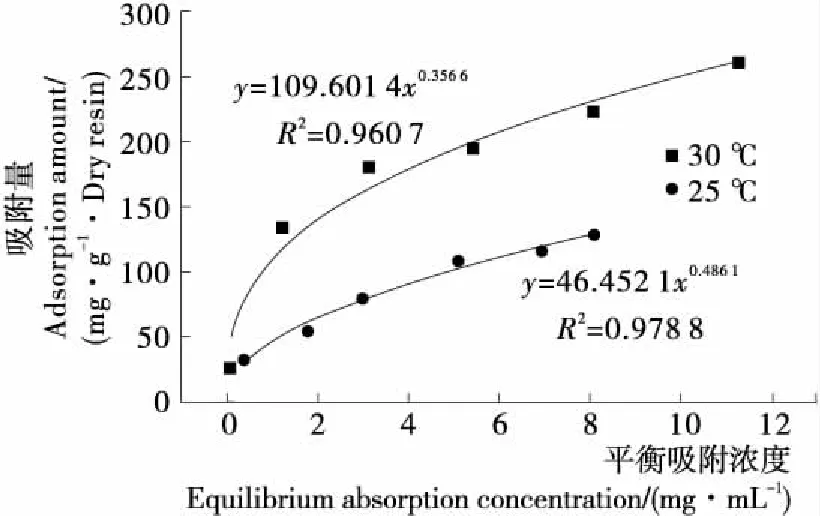
图4 XR910X型树脂吸附的Freundlich模型

图5 XR910X型树脂吸附的Langmuir模型
Freundlich拟合模型说明,XR910X型树脂对茶皂素的吸附并不是简单的单分子层的吸附,而是较为复杂的,多分子层的、多位点的吸附。图4中,茶皂素平衡吸附浓度和平衡吸附量会随茶皂素初始上样浓度的增加而增加,当上样浓度较低时,茶皂素的扩散能力弱,未能与树脂充分接触,造成平衡吸附量低;当茶皂素的浓度增加时,扩散能力增加,树脂与茶皂素分子充分接触并相互作用,因此平衡吸附量较大;但是上样浓度继续增加,树脂的作用位点处于“供不应求”状态,此时平衡吸附量逐渐趋向稳定。因此选择合适的初始茶皂素浓度至关重要[21]。
当茶皂素浓度一致时,30 ℃条件下的平衡吸附量会略大于25 ℃时的,表明茶皂素在树脂上的吸附是一个吸热过程。
2.4 解析液乙醇浓度的选择
由图6可知,选择乙醇作为茶皂素的洗脱剂时,低浓度的乙醇对茶皂素的解吸率不到20%,增加乙醇浓度,洗脱液的极性降低,更有利于从非极性的树脂中将茶皂素洗脱下来,因此随着乙醇浓度的增加,茶皂素的解吸率也迅速增加,当乙醇浓度达到90%时,茶皂素的解吸率最高,达99.04%,而使用无水乙醇进行解吸时,解吸效果显著下降(P<0.05),这与茶皂素在无水乙醇中溶解度差有关,因此选择90%乙醇浓度进行茶皂素解吸。
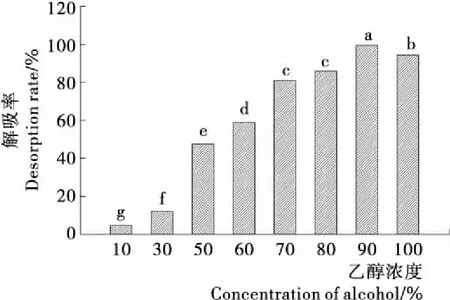
不同字母表示差异显著(P<0.05)
2.5 XR910X型树脂动态吸附流速的选择
图7为XR910X型树脂在0.86,1.71,3.43 BV/h的上样流速下对茶皂素的动态泄露曲线。当流出液中的茶皂素浓度达到原液浓度的10%时,视为动态泄漏点,动态泄漏点出现得越晚,说明树脂对茶皂素的吸附效果越好[22]。图7中,当上样流速3.43 BV/h时,茶皂素与树脂之间未能充分接触,树脂未能充分吸附茶皂素,很早就出现动态泄漏点。但是上样流速太慢又会使得耗时增加,1.71,0.86 BV/h流速下的吸附效果相差不大,考虑到时间成本,选择1.71 BV/h的上样流速进行树脂的吸附。
当XR910X型树脂吸附至平衡后,选择体积分数为90%的乙醇进行茶皂素的解吸,图8为不同洗脱流速下的解吸曲线,当流速为1.71 BV/h时,茶皂素在解吸过程中流出时间较集中,流出的茶皂素的性质一致性高,解吸曲线的峰型较窄,是进行解吸的理想选择。当速度过慢时,乙醇可以与茶皂素充分接触并解吸,但是解吸峰的宽度较大,解吸时间过长;当流速过快时,乙醇与茶皂素的接触时间变短,解吸不完全。因此选择1.71 BV/h的洗脱流速,用90%的乙醇对茶皂素进行洗脱,洗脱体积为2 BV。
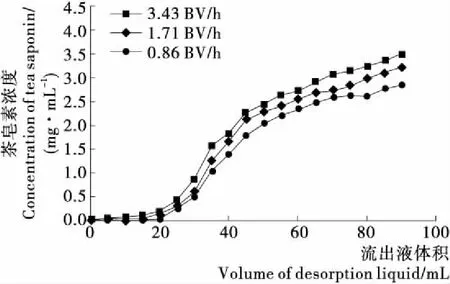
图7 不同上样流速的动态吸附泄露曲线
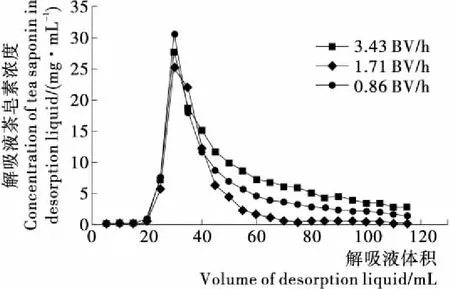
图8 不同解吸速率的解吸曲线
2.6 上样溶液的pH对树脂纯化效果的影响
pH不但会影响茶皂素的存在状态,也会改变杂质分子,如蛋白质和黄酮等物质的分子结构和极性[23]。图9为不同pH茶皂素溶液的动态吸附曲线,当茶皂素溶液pH为6.0时,茶皂素与树脂之间的亲和度较高,树脂对茶皂素的吸附效果好,泄漏点出现得较晚,吸附量最大为379.25 mg。 因此最佳上样溶液的pH为6.0。
2.7 氢氧化钠浓度对解吸过程中除杂的影响
粗茶皂素的主要杂质有蛋白质、多酚类化合物及一些色素等物质,其中多酚类物质及一些醇溶性色素会随着茶皂素一起被乙醇洗脱下来,降低精制茶皂素的纯度,因此在乙醇洗脱之前增加碱洗工序,以一些蛋白质、多酚类化合物及色素除去[18]。图10表明,0.050 g/100 mL的NaOH溶液除杂效果良好,对蛋白质和总酚的去除率达69.77%和72.98%,茶皂素的损失仅为5.18%,随着NaOH溶液浓度的增加,杂质的去除效果并没有明显的变化(P>0.05),反而茶皂素的损失逐渐增加,因此选择0.050 g/100 mL NaOH溶液对杂质进行洗脱除杂。
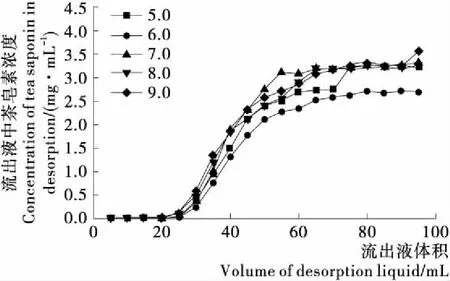
图9 不同pH值的上样溶液的的动态吸附曲线
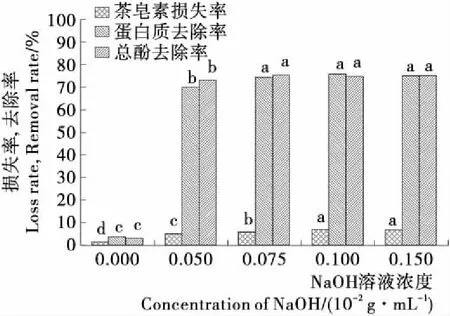
不同字母表示差异显著(P<0.05)
经上述优化得到利用XR910X型树脂纯化粗茶皂素的优化工艺条件为:上样体积1 BV,上样流速1.71 BV/h;用0.050 g/100 mL 的氢氧化钠溶液进行洗脱除杂,碱洗体积2 BV;用90%的乙醇解吸茶皂素,解吸流速1.71 BV/h,解吸体积2 BV。在此条件下茶皂素的回收率为70.34%,产品纯度可达94.26%,比程文娟等[24]研究的茶皂素回收率更高。
2.8 纯化前后茶皂素性质的变化
2.8.1 表面张力 茶皂素因为其结构中含有亲油和亲水2种基团[25],成为一种天然的非离子型表面活性剂,具有良好表面活性,能显著地降低水的表面张力。图11为利用XR910X型树脂纯化前后得到的茶皂素的表面张力随茶皂素浓度变化的曲线。纯化后的茶皂素溶液降低水溶液表面张力的能力明显大于未纯化的,并且随着茶皂素浓度的增加,溶液的表面张力逐渐降低,当茶皂素浓度的对数达到-0.125(即茶皂素的浓度为0.75 mg/mL)时,水溶液的表面张力为34.19 mN/m,此后表面张力基本维持此水平上。而纯化前的茶皂素溶液最低的表面张力为37 mN/m左右。证明纯化后的茶皂素具有良好的表面活性。
2.8.2 抗氧化能力 对ABTS+·的清除率在一定程度上代表着该物质的总抗氧化能力。树脂纯化茶皂素前后的抗氧化能力的对比见图12,结果表明,茶皂素具有一定的抗氧化能力,并且随着茶皂素浓度的增加,抗氧化能力增强。纯化后的茶皂素的抗氧化能力总体上强于纯化前的,在低浓度时,纯化前后茶皂素在抗氧化能力上的差距比较大;随着浓度的增加,纯化前后其抗氧化能力的差异在不断的减少。最终纯化后的茶皂素在4 mg/mL时,抗氧化能力达到较稳定的状态,对ABTS+·的清除率达到88.80%。而纯化前的茶皂素在8 mg/mL时,对ABTS+·的清除率稳定在65.5%左右。
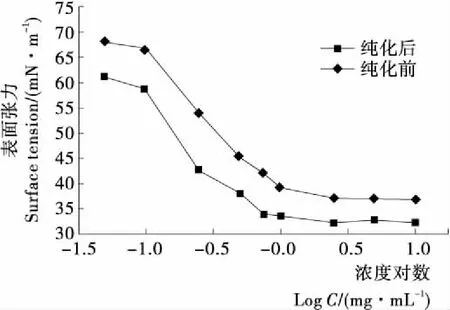
图11 树脂纯化前后茶皂素的表面张力

图12 茶皂素的抗氧化活性
2.8.3 茶皂素的抑菌活性 由表2可知,纯化前后茶皂素对不同微生物的抑菌敏感性不同,总体上纯化后的茶皂素抑菌性能较纯化前明显提高。大肠杆菌对茶皂素不敏感,只有纯化后的高浓度茶皂素样品才会对大肠杆菌起到抑制效果;纯化后的茶皂素对枯草芽孢杆菌的抑制作用比较明显,在低浓度时就有一定的抑菌性,但是未纯化的样品,在高浓度下仍没有抑菌性;相反,纯化前后茶皂素对酵母菌的抑制效果都很好,差别不明显;而对黑曲霉,茶皂素在纯化前后对它都没有抑制效果。因此,纯化后的茶皂素抑菌效果有明显的提高,但是对不同菌种的抑菌效果有细微的差别。
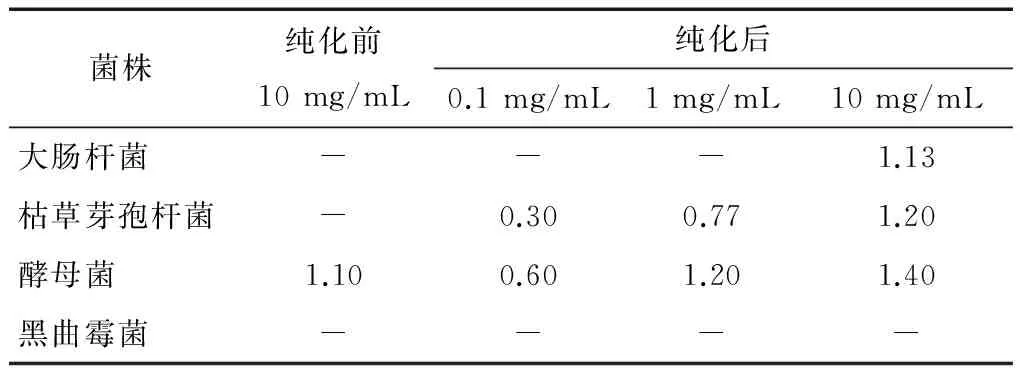
表2 不同浓度的茶皂素对不同菌种的抑菌圈直径
3 结论
研究了XR910X型树脂吸附茶皂素的动力学模型及吸附曲线,优化了树脂纯化过程中的上样溶液的pH、流速及体积;解吸液的乙醇浓度、解吸速率;以及利用稀碱溶液来洗脱杂质时氢氧化钠的浓度等参数。在最佳纯化条件下茶皂素的回收率为70.34%,纯度可达94.26%。纯化后的茶皂素在表面活性、抗氧化活性和抑菌活性等方面有了明显的提高,预示着茶皂素在洗涤、化工等领域有着巨大的潜在应用前景。
[1] 中国产业调研网. 2015-2020年中国油茶行业现状调研分析与发展趋势预测报告[R/OL]. 2017版. [2017-06-11]. http://www.cir.cn/R_ShiPinYinLiao/85/YouChaHangYeXianZhuang YanJ-iu. html.
[2] 王曙跃. 一种性能优良的天然表面活性剂—茶皂素[J]. 日用化学工业, 1987(2): 32-34.
[3] XIA Chun-hua, ZHU Quan-fen, TIAN Jie-hua et al. Surface Activity of Tea Saponin and the Related Functional Properties[J]. Journal of Tea Science, 1990, 10(1): 1-10.
[4] CHEN Jiao-jiao, ZHANG Shao-shan, YANG Xiao-ping. Control of brown rot on nectarines by tea polyphenol combined with tea saponin[J]. Crop Protection, 2013(45): 29-35.
[5] ZHANG Xin-fu, YANG Shao-lan, HAN Ying-ying, et al. Qualitative and quantitative analysis of triterpene saponins from tea seed popace (Camelliaoleiferaabel) and their activities against bacteria and fungi[J]. Molecules, 2014, 19(6): 7 568-7 580.
[6] SUR P, CHAUDHURI T, VEDASIROMONI J R, et al. Antiinflammatory and antioxidant property of saponins of tea [Camellia sinensis (L) O. Kuntze] root extract[J]. Phytotherapy Research, 2001, 15(2): 174-176.
[7] CHATTOPADHYAY P, BESRA S E, GOMES A, et al. Anti-inflammatory activity of tea (Camellia sinensis) root extract[J]. Life sciences, 2004, 74(15): 1 839-1 849.
[8] MATSUI Y, KOBAYASHI K, MASUDA H, et al. Quantita-tive analysis of saponins in a tea-leaf extract and their antihypercholesterolemic activity[J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(7): 1 513-1 519.
[9] GHOSH P, BESRA S E, TRIPATHI G, et al. Cytotoxic and apoptogenic effect of tea (Camellia sinensis var. assamica) root extract (TRE) and two of its steroidal saponins TS1 and TS2 on human leukemic cell lines K562 and U937 and on cells of CML and ALL patients[J]. Leukemia Research, 2006, 30(4): 459-468.
[10] 徐先祥, 夏伦祝, 高家荣. 大孔吸附树脂在皂苷分离纯化中的应用[J]. 中国中医药信息杂志, 2003, 10(1): 79-80.
[11] 李强. 乙醇辅助水剂法提取油茶籽油[D]. 无锡: 江南大学, 2012: 8-30.
[12] 游瑞云, 黄雅卿, 郑珊瑜, 等. 大孔树脂纯化茶皂素的工艺研究[J]. 应用化工, 2016(1): 64-66, 70.
[13] 刘红梅, 周新跃, 周建平, 等. 油茶皂素定量分析的研究[J]. 生命科学仪器, 2008, 6(10): 13-16.
[14] 王延芳. 油茶皂素及其水解产物的分离及降血脂抗氧化活性研究[D]. 广州: 华南理工大学, 2012: 57-58.
[15] 赵丽. 油茶枯中抑菌物质的提取及其抑菌活性研究[D]. 广州: 仲恺农业工程学院, 2015: 25-27.
[16] 苏鹤, 杨瑞金, 赵伟, 等. 紫薯花色苷的超滤和树脂联用纯化工艺[J]. 食品工业科技, 2016(10): 268-272.
[17] 孙国金, 叶春林, 余勤. D101型大孔树脂纯化茶皂素的研究[J]. 食品科技, 2011, 36(3): 206-208.
[18] 孟维, 李湘洲, 吴志平, 等. AB-8型大孔吸附树脂分离纯化茶皂素工艺[J]. 食品科技, 2013(9): 213-217.
[19] 娄嵩, 刘永峰, 白清清, 等. 大孔吸附树脂的吸附机理[J]. 化学进展, 2012(8): 1 427-1 436.
[20] 欧阳玉祝, 张辞海, 魏燕. 大孔树脂对倍花单宁酸的吸附特性及其动力学模型[J]. 食品科学, 2013(11): 122-125.
[21] 孙君辉, 孟秀芬. 大孔树脂的应用及其提取纯化中药有效成分的影响因素[J]. 山东商业职业技术学院学报, 2008(6): 94-96.
[22] 米聪. 紫薯中花色苷的提取纯化及稳定性研究[D]. 厦门: 集美大学, 2014: 36-37.
[23] 彭青, 李晓刚, 刘亚明. 大孔吸附树脂研究进展[J]. 实用中医药杂志, 2013(5): 409-412.
[24] 程文娟, 谢海荣, 秦永, 等. 膜分离与大孔树脂联用技术纯化茶皂素[J]. 食品与机械, 2015, 31(4): 172-177.
[25] 王兰. 茶籽粕中茶皂素的提取及性质表征[D]. 西安: 陕西科技大学, 2012: 3-5.
Purification of tea saponin with macroporous resin and properties of the product
GU Jiao1,2YANG Rui-jin1,2XIE Bin1,2ZHANG Wen-bin1,2ZHAO Wei1,2HUA Xiao1,2
(1. School of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122, China;2. State Key Laboratory of Food Science &Technology, Jiangnan University, Wuxi, Jiangsu 214122, China)
Purification of tea saponin with macroporous resin and the changes of properties of the product were investigated. With comparisons of eight kinds of macroporous resin with different polarity to the crude tea saponin through static adsorption and dynamic adsorption, XR910X resin was selected to refine the tea saponin. Moreover, it was found that the tea saponin adsorption by XR910X would be matched by Freundlich Model. The optimal purification conditions were as following: the loading sample was crude tea saponin solution with pH 6.0, and the loading volume 1 BV, loading velocity 1.71 BV/h. Then 0.05 g/100 mL NaOH solution was used to remove impurity with 1.71 BV/h velocity and 2 BV volume. At last, 90% ethanol of 2 BV volume was used as eluent to desorb the tea saponin with the ethanol flow rate 1.71 BV/h. Under that condition, the recovery rate of tea saponin was 70.34% and the purity was 94.26%. In addition, the properties of tea saponin after purification in face activity and antioxidant capacity as well as antibacterial activities were much higher than those before purification.
Tea saponin; macroporous resin; purification; dynamical model; properties
国家863计划重点项目课题(编号:2013AA102103)
顾姣,女,江南大学在读硕士研究生。
杨瑞金(1964—),男,江南大学教授,博士。 E-mail:yrj@jiangnan.edu.cn
2017—04—06
10.13652/j.issn.1003-5788.2017.06.031
