考前押题卷(二)
2017-08-08河南特级教师
河南 陈 飞(特级教师)
考前押题卷(二)
河南 陈 飞(特级教师)
第Ⅰ卷(选择题 共42分)
一、选择题:本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.(原创题)化学与生活、社会密切相关。下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅
8.(改编题)NA表示阿伏加德罗常数,下列叙述正确的是( )
A.电解法精炼铜(粗铜含铁、锌、银、金杂质),阴极析出1mol Cu,阳极失去的电子数小于2 NA
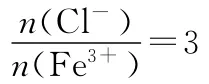
C.64g SO2与足量的O2在一定条件下反应生成的SO3分子数为NA
D.在标准状况下,2.24LNH3通入足量的水中形成氨水,NH+4数小于0.1 NA
9.(原创题)下列关于有机化合物的叙述正确的是( )
A.有机物CH2CHCH2CH2CH3和氢气加成后的产物的二氯取代物有8种
C.乙烯使溴水褪色与苯与溴水混合振荡后水层变为无色原理相同
D.CH2Cl2是纯净物说明甲烷是正四面体形结构而不是平面正方形结构
A.9种B.10种
C.11种D.12种
11.(改编题)下图是锂-空气电池放电和充电时的工作示意图。下列说法正确的是( )
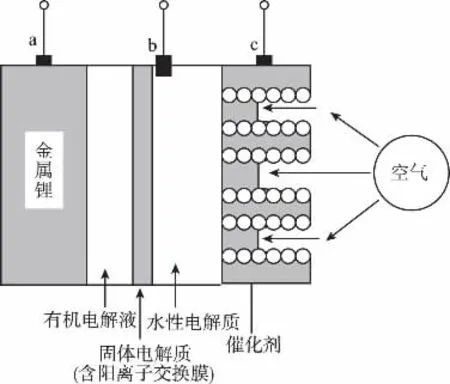
A.该电池放电时,图中电极a是正极,c为负极
B.该电池放电时,水性电解质pH不变
C.当给该锂-空气电池充电时,c极应接电源的负极
12.(改编题)下列实验操作、现象、解释和结论正确的是( )
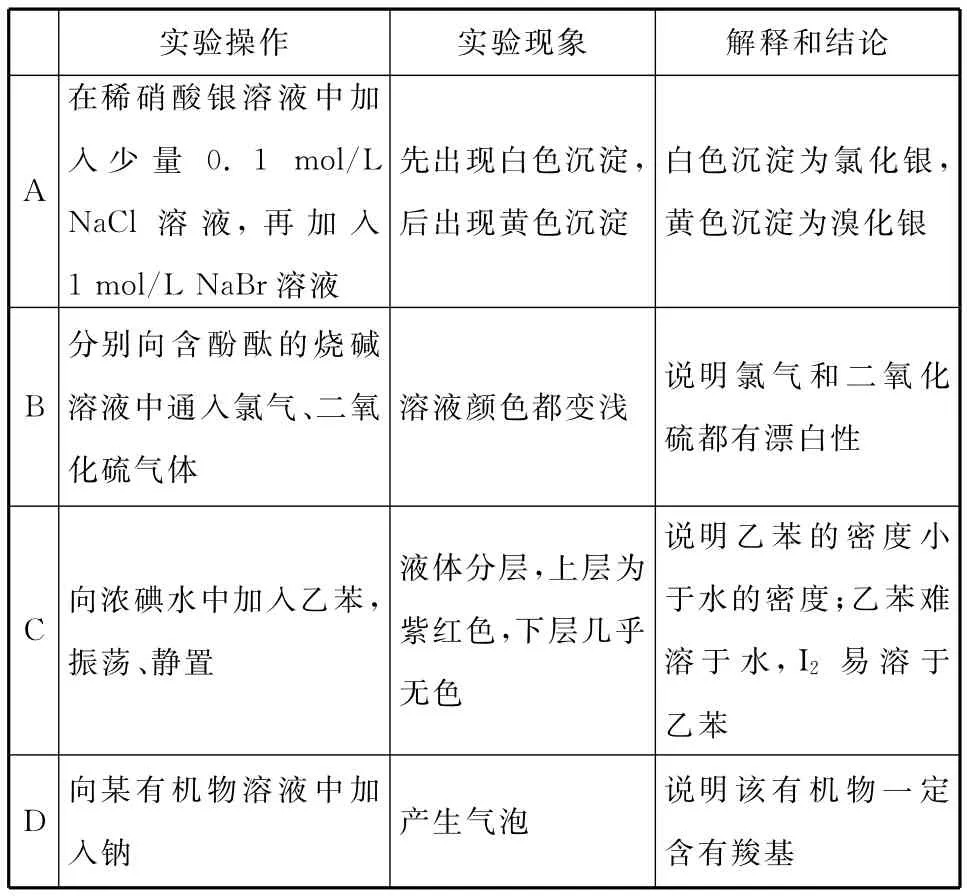
实验操作实验现象解释和结论白色沉淀为氯化银,A在稀硝酸银溶液中加入少量0.1mol/L NaCl溶液,再加入1mol/L NaBr溶液先出现白色沉淀,后出现黄色沉淀黄色沉淀为溴化银说明氯气和二氧化B分别向含酚酞的烧碱溶液中通入氯气、二氧化硫气体溶液颜色都变浅硫都有漂白性C向浓碘水中加入乙苯,振荡、静置液体分层,上层为紫红色,下层几乎无色说明乙苯的密度小于水的密度;乙苯难溶于水,I2易溶于乙苯说明该有机物一定D向某有机物溶液中加入钠产生气泡含有羧基
13.(改编题)短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构相同。p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质。这些物质间的转化关系如图所示。下列说法不正确的是( )
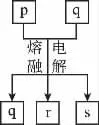
A.离子半径:W>X>Y>Z
B.p可以和强碱溶液发生离子反应
C.p和q均属于供价化合物
D.X离子和Z离子均能促进水的电离
第Ⅱ卷(非选择题 共58分)
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每个试题考生都必须作答。第35、36题为选考题,考生根据要求作答。
(一)必考题(包括3小题,共43分)
26.(改编题)(14分)氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
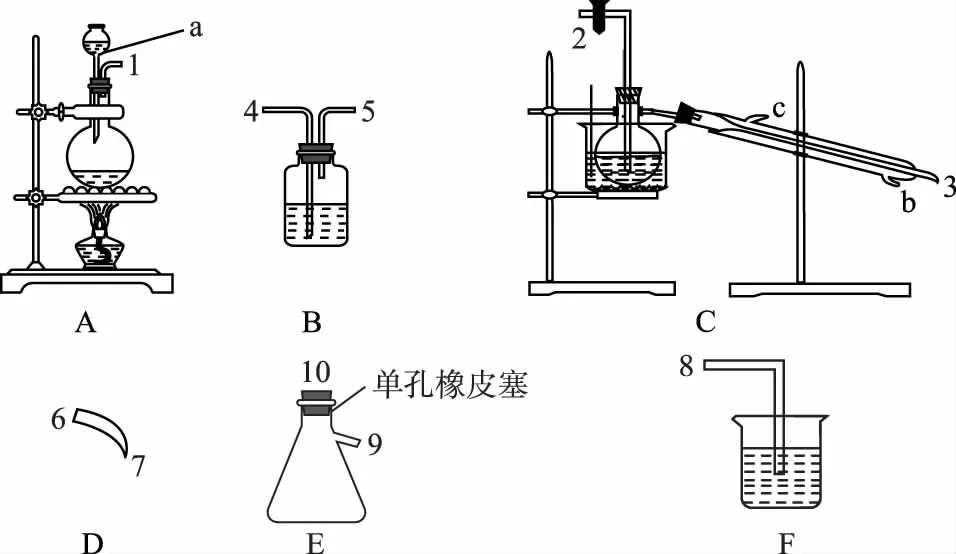
回答下列问题:
(1)氯气用于自来水的杀菌消毒,其原理是__________。
(2)根据实验目的,按气流方向用图中数字表示接口连接的顺序为1→4、5→________。
(3)仪器a的名称是________;A装置中发生反应的化学方程式为___________________________________________。
(4)B中的试剂为________;F中反应的离子方程式为_____________________。
(5)C装置中发生反应的化学方程式为_____________________,当C装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为________,冷凝管的冷却水的进口是________(填“b”或“c”)。
(6)当E装置的锥形瓶内有黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色;若取该液体滴入热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,写出该油状液体与热水反应的化学方程式:_________________________________。
27.(14分)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下图:
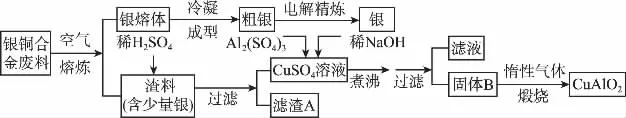
(1)电解精练银时,阴极反应式为_________________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为___________。
(2)固体混合物B的组成为________;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为________________________。
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为_________________。这个反应中会有白烟产生,该白烟为_________________________________。
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为________mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液________L。
28.(改编题)(15分)甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制备的相关信息如下表:
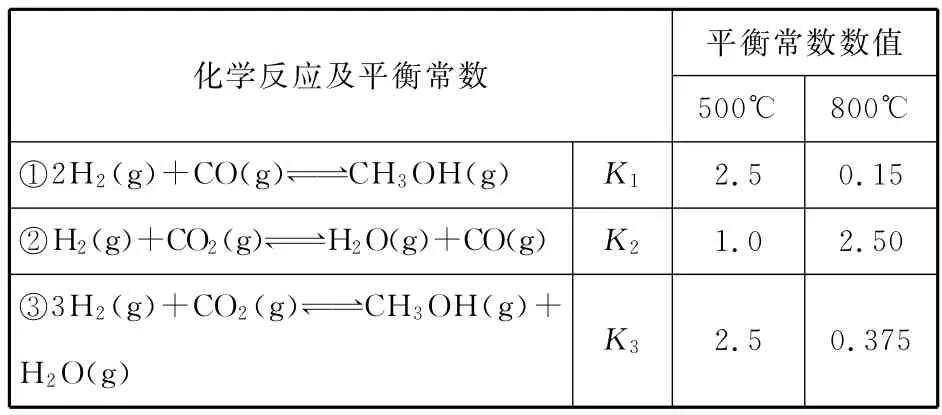
__平衡常数数值化学反应及平衡常数_____________________________________________500℃800℃①2H2(g)+CO(g)CH3OH(g)K1______2.5 0.15_②H2(g)+CO2(g)H2O(g)+CO(g)K2______1.0 2.50_③3H2(g)+CO2(g)CH3OH(g)+H2O(g)K32.5 0.375
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据上表信息推导出K1、K2与K3之间的关系,K3=________(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,此时v正_______________(填“>”“<”或“=”)v逆。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速率v(H2)=________;若某温度下反应①中H2的平衡转化率(α)与体系总压强(p)的关系如图二所示,则平衡状态由A变到B时,平衡常数KA_______________(填“>”“<”或“=”)KB。
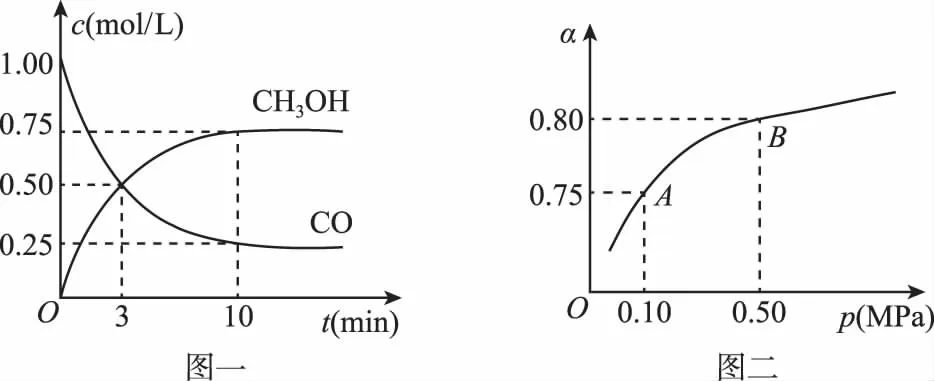
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是________。(用相应字母表示)
A.容器中总压强不变
B.混合气体的平均摩尔质量不变
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将amol/L醋酸溶液与b mol/L NaOH溶液等体积混合。若溶液显中性,则a________(填“>”“<”或“=”)b。若c(Na+)<c(CH3COO-),则溶液显_________(填“酸”“碱”或“中”)性。
(二)选考题(15分。请考生从给出的两道小题中任选一题作答。如果多做,则按所做的第一小题计分)
35.[化学—选修3:物质结构与性质](15分)
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为________,该元素的名称是________;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是______________,该化合物的空间构型为________;短周期元素形成的化合物中与XZ3互为等电子体的是________。
(3)请写出X的两种含氧酸的化学式:______________、______________,其中酸性较强的是________。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为___________________。
36.[化学—选修5:有机化学基础](改编题)(15分)
制备液晶材料时经常用到有机物I,有机物I可以用E和H在一定条件下合成:
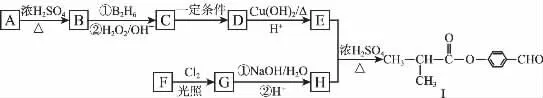
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基
请根据以下信息完成下列问题:
(1)B的结构简式为_________________;D中含的官能团名称是________________。
(2)A→B的反应类型为__________________;G→H的反应类型为_________________。
(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为_____________________。
(4)E与H反应生成I的化学方程式为_____________。
(5)K的相对分子质量比I小28。K的结构中能同时满足如下条件:①K和I具有相同的官能团;②苯环上只有两个取代基;③分子中不含甲基。则K共有________种同分异构体(不考虑立体异构)。试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式:_____________。
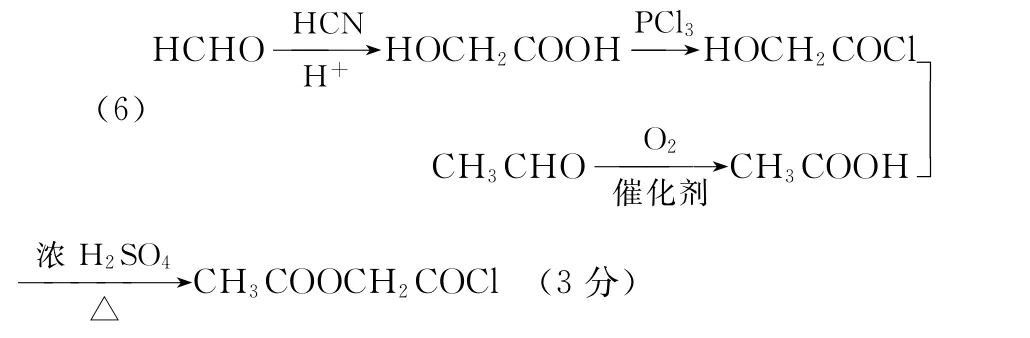
写出以甲醛和乙醛为原料合成CH3COOCH2COCl的路线流程图(无机试剂任选)。
________________________________________________。
参考答案及解题提示
7.D 【解析】A项,聚乙烯已经不存在双键,不能加成,错误;B项,煤的气化和液化过程中包含比较复杂的化学变化,错误;C项,铁在潮湿的空气中放置,主要发生电化学腐蚀而生锈,错误;D项,光纤的主要成分为高纯度二氧化硅,正确。
10.B 【解析】依题意,M的同分异构体不包括本身,且含有羟基、羧基和六元环,环上同一个碳原子上不连接两个取代基。环上有三个取代基为甲基、羟基和羧基。先写两个取代基的同分异构体(邻、间、对三种),然后再用羧基取代环上一个氢原子,分别得到2种、4种、4种同分异构体,符合条件的同分异构体有10种。
11.D 【解析】根据题意,A选项,图中a电极为锂,活泼金属,易失电子,故a为负极,错误;B选项,电池工作时c为正极发生反应为,水性电解液pH变大,错误;当给图中的锂-空气电池充电时,电池两极发生的反应与放电时相反,为电解原理,a为阴极接电源负极,b为阳极应接充电电源的正极,电极反应式为4OH--↑,因此C选项错误,D选项正确。
12.C 【解析】溴化银呈浅黄色,不是黄色,A项错误;二氧化硫与碱反应使溶液碱性减弱,说明二氧化硫是酸性氧化物,具有酸性氧化物的性质,不能说明其具有漂白性;氯气溶于水生成的次氯酸具有漂白性,使溶液褪色,氯气没有漂白性,B项错误;乙苯类似于苯能作碘水的萃取剂,由实验现象可知,乙苯的密度小于水的密度,乙苯难溶于水,碘溶于乙苯,C项正确;有机物中的羟基、羧基以及水都能与钠反应产生气泡,不能确定是否一定有羧基,D项错误。
13.C 【解析】p为氧化铝,q为Na3[AlF6],W为氧元素,X为氟元素,Y为钠元素,Z为铝元素,r为氧气,s为铝。离子半径:W>X>Y>Z,A项正确;氧化铝可以和强碱发生离子反应,B项正确;氧化铝和Na3[AlF6]均属于离子化合物,熔融状态可以导电,C项错误;F-离子和Al3+离子均能促进水的电离,D项正确。
26.(1)氯气与水反应生成次氯酸,次氯酸有杀菌消毒作用 (1分)
(2)→2、3→6、7→10、9→8 (1分)
(5)3Cl2+(2分) 71~95℃ (1分) b (1分)

【解析】(1)略。(2)先制备纯净的氯气(不必干燥),然后Cl2与NH4Cl溶液在低温下反应生成NCl3,NCl3蒸气冷凝后的液体通过牛角管接收到E装置中,尾气需用NaOH溶液进行吸收,故接口连接的顺序为1→4、5→2、3→6、7→10、9→8。(3)略。(4)B中的试剂为饱和食盐水,用于吸收氯气中的氯化氢;F中为氢氧化钠溶液,用于吸收氯气,反应的离子方程式为(5)氯气在C装置的蒸馏烧瓶中与NH4Cl溶液反应生成NCl3,化学方程式为+4HCl。由于NCl3的沸点为71℃,其在95℃时会发生爆炸,故水浴加热的温度应在71~95℃之间。冷凝管的冷却水应从下口进入,填b。(6)NCl3在热水中会发生水解,得到的产物能使红色石蕊试纸变蓝,说明产物中有NH3,最后试纸又褪色,说明产物之一具有漂白性,该产物为HClO,从而可写出NCl3与热水反应的化学方程式:3HClO+NH3。
27.(1)Ag++2HNO3+NO↑ (2分)
(2)CuO[或Cu(OH)2]和Al(OH)3(2分) OH―+
(4)30 (2分) 15 (2分)

28.(1)吸热 (1分)
(2)K1·K2(2分) > (2分)
(3)0.15mol·L-1·min-1(2分) = (2分)
(4)D (2分)
(5)> (2分) 酸 (2分)
【解析】(1)略。(2)据上表反应方程式可知K1=c(CH3OH)/[c2(H2)×c(CO)],K2=c(H2O)×c(CO)/[c(H2)×c(CO2)],K3=c(CH3OH)×c(H2O)/[c3(H2)×c(CO2)],所以K3=K1·K2;500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,把各物质的浓度带入平衡常数表达式进行计算,计算结果小于500℃时的平衡常数值2.5,所以反应向正反应方向进行,v(正)>v(逆)。(3)根据图一所示,v(H2)=2v(CO)=2×(1.00-0.25)mol/L÷10min=0.15mol·L-1·min-1;温度不变,平衡常数不发生改变,所以KA=KB。(4)一定温度下,在体积固定的密闭容器中发生反应②,反应过程中压强始终不发生变化,所以如果容器中总压强不变不一定达到平衡状态;反应过程中混合气体的平均摩尔质量始终不变,所以混合气体的平均摩尔质量不变,不一定达到平衡;反应过程中混合气体的密度始终不变,所以混合气体的密度不变,不一定达到平衡;反应过程中CO2(g)和CO(g)的浓度不断发生变化,可以判断反应已经达到平衡状态,选D。(5)室温下,将amol/L醋酸溶液与b mol/L NaOH溶液等体积混合,若a=b,则溶液显碱性,若溶液显中性,则必有a>b。若c(Na+)<c(CH3COO-),根据电荷守恒关系式c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有c(H+)>c(OH-),溶液显酸性。
(2)sp3(2分) 三角锥形 (2分) NH3和PH3(2分)
(3)H3AsO3、H3AsO4(2分) H3AsO4(2分)
【解析】X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3,可以推出X为砷,Y为氧,Z元素既可以形成正一价离子也可形成负一价离子,可知Z为氢。
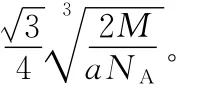
(2)消去反应 (1分) 水解反应(或取代反应) (1分)
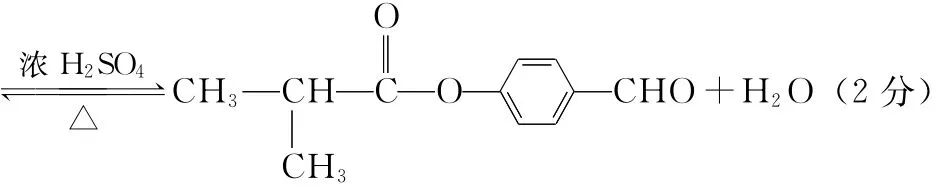
【解析】A为丁醇且核磁共振氢谱有2种不同化学环境的氢,所以A为(CH3)3COH,在浓硫酸作用下发生消去反应生成的B为(CH3)2C CH2,结合信息②可知C为(CH3)2CHCH2OH,D为(CH3)2CHCHO,E为(CH3)2CHCOOH。(1)略。(2)略。(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为。(4)E与H反应生成I的方程式为(5)K的相对分子质量比I小28,所以K比I少2个碳原子,4个氢原子,其结构中能同时满足如下条件:I中有酯基和醛基,分子中不含甲基且苯环上只有两个取代基,所以两个取代基可以是HCOOCH2—和—CHO或者是HCOO—和—CH2CHO,分别有邻位、对位和间位3种,所以K共有6种同分异构体。消耗NaOH最多的有机物结构简式为(邻、间、对位均可)。(6)略。
(作者单位:河南省卢氏县第一高级中学)
