膜反应器中乙苯脱氢制苯乙烯热力学分析
2019-12-13权文鹏周大发黎小辉黄风林
张 超,权文鹏,黄 庆,谢 勇,周大发,黎小辉,黄风林
(西安石油大学化学化工学院,陕西西安 710065)
1 引言
苯乙烯(SM)作为高分子聚合物的重要单体,是一种重要的基本有机化工原料,用途十分广泛,可用于生产聚苯乙烯(PS)、丙烯腈-丁二烯-苯乙烯(ABS)树脂、苯乙烯-丙烯腈(SAN)树脂、丁苯橡胶和丁苯胶乳(SBR/SBR 胶乳)等。它是仅次于PE,PVC,EO 的第四大乙烯衍生产品[1,2]。目前,世界范围内苯乙烯的生产方法主要包括:乙苯脱氢法,乙苯共氧化法,选择氧化脱氢法等工艺技术,其中,乙苯脱氢法是目前国内外生产苯乙烯的主要方法,世界上约有90 %的苯乙烯通过该方法生产[3]。目前工业上主要采用绝热固定床催化反应器进行乙苯脱氢制苯乙烯,但乙苯转化率较低,且后续的分离、提纯处理成本较高[3]。近年来,由于膜反应器具有良好的热稳定性、机械稳定性并可提高反应转化率等优点,受到了广泛关注,已在实验室中利用膜反应器进行了大量的加氢、脱氢、分解和氧化反应实验,有些小规模的膜反应器已实现了工业化应用[4]。
乙苯在一定的温度、压力和催化剂存在条件下发生脱氢反应生成苯乙烯并副产氢气,主反应方程式[5,6]:

该反应是一个分子数增加的可逆吸热反应,为克服乙苯脱氢反应的热力学限制,近年来研究人员设计了多种膜反应过程。人们对膜反应器的关注点在于具有H2选择透过性的膜上,它将H2从反应区不断地移除到隔离区域内,实现了反应-分离的同时进行,可打破热力学平衡限制,进而大幅度提高反应物转化率,并可降低反应苛刻度,提高催化剂选择性,延长催化剂使用寿命[3]。在隔离区域内,H2或被吹扫出来,或进一步参与反应生成其他产品。在所设计的膜反应过程中,Abo-Ghander 等提出的模型特别令人感兴趣,该过程将乙苯的脱氢与硝基苯的氢化相耦合[7]。
数值模拟计算结果显示,在膜反应器中,通过增加反应压力,能够克服动力学限制,乙苯转化率能增加90 %以上且苯乙烯选择性未有明显降低[8]。Becker 等研究了氧化铝膜反应器中的乙烯脱氢反应,实验结果表明,膜反应器中乙苯的转化率比固定床反应器中高10 %~15 %[9]。显然,膜反应器性能受膜的渗透性及反应动力学等因素控制。
在高温条件下,三种膜材料被推荐使用:致密金属膜(pd 或pd-合金),多孔膜(氧化铝、钛、锆或vycor 玻璃),复合膜(金属/氧化铝、金属/vycor 玻璃、金属/不锈钢)[8]。虽然由于成本较高,但致密钯膜因其特有的氢渗透特性已受到广泛关注。钯合金膜只允许H2渗透,H2分离选择性接近100 %[10]。H2分子首先呈原子态吸附在钯膜表面,并进一步离子化成质子和电子,而后扩散移出反应侧,即H2以H+的形式透过[11,12]。
为了研究H2移出反应体系对乙苯平衡转化率的影响,从热力学角度,对不同温度条件下膜反应器中乙苯脱氢反应体系进行了计算,分析H2移出程度不同时乙苯平衡转化率的变化情况。
2 反应体系的热力学分析
2.1 吉布斯自由能变的计算
由于乙苯脱氢反应体系具有高温、低压的特点,故在进行热力学计算时,该体系可按理想气体处理。乙苯和苯乙烯的沸点分别为136.2 ℃、146 ℃,因此,反应过程中,二者均会发生相变。现根据热力学知识,设计热力学途径(见图1),并说明具体计算过程[13,14]:
根据上述热力学途径,可知热力学性质间的关系:

故有:
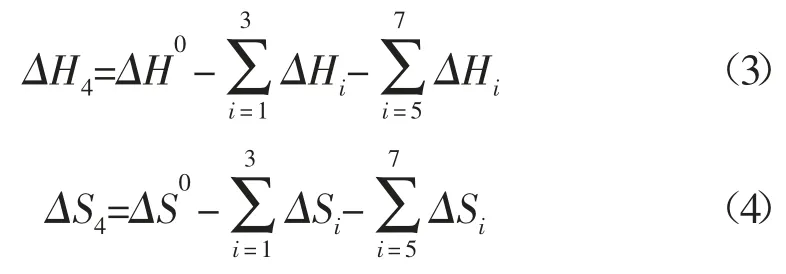
式中:

式(19)中,i 分别为C8H10,C8H8及H2。
计算所需的热力学数据取自相关文献[14,15],完成上述计算后,乙苯脱氢生成苯乙烯反应的吉布斯自由能变ΔG 可由下式计算得到:

2.2 平衡常数与平衡转化率的计算
反应达到平衡状态时平衡常数的热力学定义式为:

式(21)变形得到平衡常数K 的计算式:

膜反应器中,H2经过选择透过膜后进入隔离室,通过控制吹扫气流量调节氢气移出比率,计算不同条件下的乙苯平衡转化率,计算过程如下:
设初始进料为一定比例(1:ns)的乙苯与水蒸气,乙苯的物质的量为1 mol,水蒸气的物质的量为nsmol,平衡时乙苯转化率为x,H2的移出率为α:

由上述物料衡算式,可以得到平衡常数K 的表达式:

联立式(22)(23),即可解出平衡转化率x。
在等压条件下,反应的平衡常数K 只与温度有关,即K=f(T)。当T 一定,则K 不变。因此,无论H2移出与否,或移出率多大,都不影响K 值大小。但是,当H2移出后,乙苯的平衡转化率x 会发生变化。由于平衡向生成苯乙烯的方向移动,故乙苯的平衡转化率x会提高。当采用传统固定床反应器时,H2无法移出,此时α=0;采用膜反应器时,H2会不断移出,即此时α≠0。
3 计算结果与分析
3.1 吉布斯自由能变
在100 kPa、乙苯与水蒸气的初始进料比为1:10的条件下,乙苯脱氢生成苯乙烯这一反应的焓变及吉布斯自由能变计算结果(见表1)。
由表1 可见,该反应在550 K~1 000 K 温度范围内的焓变均大于零,且数值均在120 kJ/mol 以上,即乙苯脱氢生成苯乙烯为强吸热可逆反应。因此,当温度升高时,对反应向生成苯乙烯方向的进行是有利的。此外,由表1 还可知,随温度升高,反应的ΔG 不断减小,当温度升至T=973 K,此时,ΔG=0,说明反应达到平衡状态;在550 K~973 K 的温度范围内,ΔG 均大于0,说明反应向逆方向进行;在973 K~1 000 K 的温度范围内,ΔG<0,说明反应向生成苯乙烯的正方向进行。

表1 反应(R-1)的热力学分析结果Tab.1 The thermodynamic analysis results for R-1

表2 不同温度条件下平衡常数的数值Tab.2 The value of equilibrium constant under different temperature
3.2 平衡常数与平衡转化率
乙苯脱氢生成苯乙烯的反应在不同温度条件下的平衡常数K 的计算结果(见表2)。
在平衡常数计算的基础上,进一步计算可得不同温度条件下,膜反应器中H2移出率α=0~99.99 %范围内乙苯的平衡转化率计算结果(见图2)。
由图2 可知,由于乙苯脱氢反应为强吸热反应,因此,在所考察的温度范围内,随着温度的升高,平衡向生成苯乙烯的方向移动,导致乙苯的平衡转化率增大,无论是否有H2移出,亦或H2移出比率有多大。进一步细致观察可知,当H2移出率一定时,在较高温度区间内,随着温度的升高,乙苯平衡转化率的增加幅度逐渐变小,这是因为升温至极高温度条件时,受温度“补偿”作用的影响,各条件下的乙苯平衡转化率的差距缩小,及至近乎消失。
在温度相同时,乙苯的平衡转化率随着H2移出率的增加而增大,并且增加幅度逐渐提高。当所生成的H2几乎全部被移出时(移出率达99.99 %),该可逆反应已相当大程度地向生成苯乙烯的方向发生移动,近乎于不可逆反应,从而导致乙苯的平衡转化率接近100 %。在H2移出率为99.99 %的条件下,反应温度的提升会促使乙苯转化率持续增大,在650 K 时,该可逆反应已具有不可逆反应的特点,乙苯的平衡转化率接近100 %。因此,由以上分析可知,提升温度的措施配合反应体系中生成产物H2的不断移出,可打破该反应平衡的热力学限制,实现所谓的“超平衡”,使得乙苯平衡转化率大幅提升。为清晰地看出温度及H2移出率发生变化时乙苯平衡转化率变化的细节信息,乙苯平衡转化率增加的百分比(见图3)。
由图3 可知,在同一温度条件下,无H2移出的固定床反应器中乙苯的平衡转化率均低于与可实现H2移出的膜反应器中乙苯的平衡转化率。并且,随着膜反应器中H2移出率α 的增加,反应平衡向生成苯乙烯的方向移动的幅度增大,导致乙苯平衡转化率提高的百分点数也增大。在温度为750 K 的条件下,膜反应器中α=40 %时乙苯的平衡转化率仅比α=0(固定床反应器)时乙苯的平衡转化率增加了6.94 %,当α=80 %时乙苯的平衡转化率比α=0 时增加24.5 %,因此,即α 增加40 %时,乙苯的平衡转化率仅提高17.56 %;进一步增大H2移出率,当α=90 %时乙苯的平衡转化率比α=0 时增加36.23 %,即α 仅增加10 %,乙苯的平衡转化率提高了11.73 %;由此可见,当α 越高时,反应向生成苯乙烯的方向移动幅度越大,乙苯平衡转化率提高的幅度也就越大。

图2 不同温度条件下H2移出率对乙苯平衡转化率的影响Fig.2 Ethylbenzene equilibrium conversion along with the removal rate of hydrogen under different temperature

图3 不同H2移出率时乙苯平衡转化率相对于无H2移出时平衡转化率增加的百分点数Fig.3 The increasing percent point value of equilibrium conversion of ethylbenzene under different removal rate of hydrogen relative to the condition when α equals

表3 不同H2移出率时乙苯平衡转化率增加的百分点数Tab.3 The increasing percent point value of equilibrium conversion of ethylbenzene under different removal rate of hydrogen
进一步从图3 中还可知,膜反应器中α=80 %与α=0(固定床反应器)时相比,乙苯的平衡转化率随温度升高的增加幅度先逐步增大,升至800 K 时增加幅度达到峰值,此后,继续升高温度,乙苯平衡转化率的增加幅度又逐步减小。
此外,随α 的增大,乙苯平衡转化率增加的最大增幅对应的温度逐渐降低,其中几组计算数据(见表3)。
由表3 中的数据可知,当α 分别为80 %、90 %时,乙苯平衡转化率增加的最大百分点对应温度分别为800 K、750 K;进一步增加H2移出率,当α=99.99 %时,乙苯平衡转化率增加的最大百分点对应温度降至650 K,即α 从90%增加为99.99%的过程中,仅9.99%的H2移出增加量,却换取了100 K 的温度降低。因此,H2移出率与温度之间是相辅相成的,在实际过程中,H2移出率的增加有利于操作温度的降低,即反应苛刻度的减小。
4 结论
(1)从热力学观点分析,利用膜反应器实现乙苯脱氢制苯乙烯这一过程中乙苯转化率的提升是可行的,且比传统固定床反应器有较大优势。
(2)与无H2移出的固定床反应器相比,膜反应器中,增加H2移出率,可增加反应平衡向生成苯乙烯方向移动的幅度,从而增加乙苯平衡转化率提升的幅度。当99.99 %的H2被移出反应体系时,可逆反应将近乎转化为不可逆反应,此时乙苯接近于完全转化。
(3)与无H2移出的固定床反应器相比,膜反应器中,随着反应温度的升高,乙苯平衡转化率的提升幅度先持续增大,并达到峰值,而后逐步减小。
(4)与无H2移出的固定床反应器相比,膜反应器中,乙苯平衡转化率增加幅度最大时对应的温度降低,即膜反应器可使乙苯脱氢制苯乙烯在相对较低的温度下进行,从而降低反应的苛刻度。
符号说明:
ΔG-反应的吉布斯自由能变,kJ/mol;ΔH-反应的焓变,kJ/mol;ΔH0-反应的标准焓变,kJ/mol;ΔS-反应的熵变,J/(mol·K);ΔS0-反应的标准熵变,J/(mol·K);Cp-恒压摩尔热容,J/(mol·K);T-温度,K;R-摩尔气体常数,8.314 J/(mol·K);K-反应的平衡常数;Pi-气体组分i 的气相分压,kPa;P-反应系统总压,kPa;Pθ-标准压力,100 kPa;n0-初始组成,mol;ne-平衡组成,mol;i-组分;vi-组分i 的化学计量系数;ni-组分i 的量,mol。
