高考化学选择题常考类型误区警示
2017-08-08湖北文丽娟杨恩健
湖北 文丽娟 杨恩健
高考化学选择题常考类型误区警示
湖北 文丽娟 杨恩健
高考化学选择题覆盖面大、便于阅卷、有一定的选拔功能,理科综合中化学科选择题所占分值比重较大(全国卷中每小题6分),考生即使面对十分熟悉的化学选择题,也不可掉以轻心,否则会“大意失荆州”。鉴于这种情况,本文将高考化学中常考类型选择题的解题误区及方法与技巧进行归纳总结,对于提高解题速度和准确度,都是大有裨益的。
一、关于阿伏加德罗常数
阿伏加德罗常数是历年高考化学试题中的热点之一,题目涉及的知识面广、灵活性强、主要考查学生对概念的内涵的理解及把握,并综合考查学生的计算能力、审题能力,学生思维的严密性和深刻性。
【例1】(2016全国Ⅰ,8)设NA为阿伏加德罗常数值。下列有关叙述正确的是 ( )
A.14g乙烯和丙烯混合气体中的氢原子数为2NA
B.1molN2与4molH2反应生成的NH3分子数为2NA
C.1mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
【答案】A

【误区警示】要正确解答本类题目,首先要认真审题。审题是“审”而不是“看”,审题的过程中要注意分析题目中概念的层次,要特别注意试题中一些关键性的字、词,要边阅读边思索。其次要留心“陷阱”,对常见的一些陷阱要千万警惕。考生要在认真审题的基础上利用自己掌握的概念仔细分析、比较、做出正确解答。只要注意下列一些细微的知识点,就可以做到战无不胜。
1.注意物质所处的外界条件及状态。
2.注意物质组成方面:①用到摩尔质量时,注意特别物质的摩尔质量;②掌握微粒数的计算并注意某些物质在分子中的原子个数;③注意一些物质中的化学键的数目。
3.注意关注一些特殊的和较复杂的反应:①可逆反应,不可能进行到底,实际生成物比理论值小,转移电子数等也相应地比理论值小;②某些物质或者几种物质的混合物可能发生反应;③铜与浓硫酸的反应,实验室制氯气的反应等,随着反应的进行浓溶液会变稀,参加反应的实际量比理论计算值要小一些;④注意较复杂的化学反应中,转移电子数目的计算。
4.注意考查电解质溶液中微粒数目或浓度时要注意弱电解质的电离,盐类的水解。
二、有机化合物基础知识
有机选择题由于具有信息量大、概念性强、知识覆盖面广、考查角度和层次多。取材新颖,灵活考查,可以从多角度全方位的考查有机基础知识及基本能力,注重生产、生活、医药、新科技等方面的内容,注重学生的迁移能力的考查。
【例2】(2016江苏,11)化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )

A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1mol化合物X最多能与2mol NaOH反应
【答案】C
【解析】A项,根据图示知两个苯环均连在同一个饱和碳原子上,两个苯环不一定共面,错误;B项,X中含有羧基,能与饱和碳酸钠溶液反应,错误;C项,在酸性条件下水解,水解产物只有一种,正确;D项,X的水解过程中,2个羧基和1个酚羟基都能与NaOH反应,故1mol化合物X最多能与3mol NaOH反应,错误。答案选C。
【误区警示】
1.注意有机物的结构与性质,这需要根据各官能团的特性推测其可能发生的反应,注意与羟基连接的是否是苯环,酚羟基与醇羟基性质差异很大,酚羟基在空气中容易被氧化,等等。
2.注意有机反应类型的考查,主要看官能团的性质以及官能团所处的环境:醇、卤代烃的消去反应要求与官能团相连的C的邻C(β碳)上要有H,苯环上的卤素原子(—X)、酚羟基不可以发生消去反应;与羟基相连的C上无氢不可以被催化氧化;与苯环直接相连的烃基的C上没有H的不可以被酸性高锰酸钾氧化为羧基;加氢去氧是还原反应、加氧去氢是氧化反应。
3.同分异构体的考查中突破误区:①对有机物的名称理解有误,复习中注重常见有机物命名的复习;②对于同分异构体书写方法和思维的无序导致重写和漏写,常常可以按等效氢法、定一移二法、排列组合法等。
4.NaOH 等消耗量的计算:1mol的—COOH、—X、—OH(酚羟基)分别能消耗1mol的NaOH,若—X与苯环直接相连水解消耗1mol NaOH,生成酚又要消耗1mol;同样苯环与—OOC—R连接(酸酚酯)水解成羧酸和酚共消耗2mol NaOH,若苯环与—COO—R连接水解成苯甲酸和醇则只能消耗1mol NaOH。
三、化学实验基础知识
化学实验基础知识的考查:正确使用化学实验仪器、规范操作化学实验、化学实验方案的评价等。
【例3】(2016全国Ⅰ,10)下列实验操作能达到实验目的的是 ( )
A.用长颈漏斗分离出乙酸与乙醇反应的产物
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
【答案】C
【解析】A项,应用分液漏斗分离出乙酸与乙醇反应的产物乙酸乙酯,错误;B项,NO的密度与空气接近,且能与氧气反应成NO2,所以应该用排水法收集,错误;C项,铁离子水解,使溶液显酸性,因此配制氯化铁溶液时,为了抑制盐的水解,应该将氯化铁溶液溶解在较浓的盐酸中,然后再加水稀释到相应的浓度,正确;D项,将Cl2与HCl混合气体通过饱和食盐水只能除去氯气中的HCl,但不能除去其中的水蒸气,故不能得到纯净的Cl2,错误。
【误区警示】
1.实验类试题一定要明确实验目的,然后联想这一实验需要用的仪器和基本操作及实验中需要注意的事项。复习备考中仅仅将书本上的内容熟记是不够的,必须建立合理的知识框架,关键注重理解。
2.化学实验选择题对实验的基础知识考查越来越细,这就要求我们在复习备考中关注细节尤其是特殊之处的复习,在答题过程中关注图中的“细节”,容量瓶的规格等,“细节决定成败”。
四、原子结构与元素性质、元素周期表、物质推断等
这类题型主要考查原子的组成与结构、原子核外电子排布的关系,元素周期表的结构,元素及其主要性质的周期性变化规律,元素推断,元素原子结构、位置、性质之间的关系。
【例4】(2016全国Ⅲ,12)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是 ( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
【答案】B
【解析】X的原子半径是短周期主族元素原子中最大的,为钠元素,Z、X形成的化合物为中性,说明为氯化钠,则Y为硫元素,W为氧元素。A项,Na+和O2-电子层结构相同,核电荷数越大,半径越小,故Na+半径小于O2-半径,故错误;B项,O和Na形成的化合物为氧化钠或过氧化钠,其水溶液都为氢氧化钠,显碱性,故正确;C项,水和硫化氢比较,水稳定性强,故错误;D项,最高价氧化物对应的水化物中高氯酸是最强酸,故错误。
商鞅是法家思想的伟大实践者,在唯实力论的战国时代,清醒地意识到国家要想自保,必须不断壮大,而当时的秦国在七雄中最为羸弱,内部国力凋敝,外部征战不力,在夹缝中艰难求生,这说明当时秦国的治国政策已经无法满足国家发展的需要。在《商君书·更法》中,商鞅明确指出,“圣人苟可以强国,不法其故;苟可以利民,不循其礼”[2],随着时代的变化,社会的发展,不要再因循守旧,要进行变革,建立新的政治制度。这种政治观落实到执政政策上,便是法家政策的推行。
【误区警示】
解答此类题型要注意以下几点:①元素的非金属性与对应氢化物的稳定性、最高价含氧酸酸性具有一致性,如元素的非金属性越强,氢化物的稳定性越强,最高价含氧酸的酸性也越强;②一般来说,非金属单质的氧化性越强,对应阴离子的还原性则越弱。
解答半径大小要注意以下两点:①电子层数越多,原子半径越大;电子层数相同时,原子序数越小,其原子半径越大。②具有相同的电子层结构的离子,原子序数越小,其离子半径越大。
甚至做元素及物质推断题的时候不能将思维限制在无机物的范畴,如2016年全国Ⅰ卷第13题,其中化合物p即是有机化合物CH4。
五、水溶液中的离子平衡
水溶液中的离子平衡问题常常结合各种新颖的知识情境,以能力立意,题型全面,全面考查相关知识,难度较高,占高考分值比重大,一直是高考的热点之一。
【例5】(2016全国Ⅲ,13)下列有关电解质溶液的说法正确的是 ( )



【答案】D
【误区警示】
1.水解平衡与电离平衡,注意不要把盐类水解和弱电解质的电离平衡混淆,盐溶液酸、碱性的相对强弱通常可以用“越弱越水解”来判断。
2.解答离子浓度大小的比较问题时,要注意以下两点:①三个基本守恒关系,即电荷守恒关系、原子守恒关系和质子守恒关系;②三条基本原则,即电离程度较小原则(弱电解质的电离程度较小,产生的离子浓度也较小),水解程度较小原则(含一种弱酸根离子或弱碱阳离子的盐溶液水解程度一般较小)和以电离为主的原则(等浓度的HA与Na A溶液等体积混合时,因HA的电离程度及A-的水解程度均较小,溶液呈酸性,以电离为主)。
3.解答有关混合后溶液中离子浓度的大小比较问题时,首先应判断是否有化学反应发生;若不发生化学反应,再考虑加入的物质电离出来的离子对溶液中存在的离子的浓度的影响;最后才看加入的物质是否水解及水解产生的离子对溶液中离子浓度的影响。
4.解答有关中和滴定的问题时注意:①依据酸碱恰好完全反应生成的盐的性质选择指示剂;②正确区分酸碱恰好完全反应与溶液呈中性,恰好完全反应时,溶液不一定呈中性。
5.Ksp的误区:①只与难溶电解质的性质和温度有关,离子浓度的改变可以使沉淀溶解平衡发生移动,但不能改变Ksp。②误认为Ksp大的难溶电解质只能向Ksp小的转化,实际上当两种电解质Ksp相差不是很大时,通过调节某种离子浓度,可实现电解质由Ksp小的向Ksp大的转化。
六、电化学
根据原电池和电解池工作原理,充分利用氧化还原反应的实质,分清正负极和阴阳极,正确书写半极方程式,分清放电顺序,离子交换膜,高考对隔膜问题考查由定性走向定量,把握电化学解题误区,电化学的题目可轻松得分。
【例6】(2016全国Ⅰ,11)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
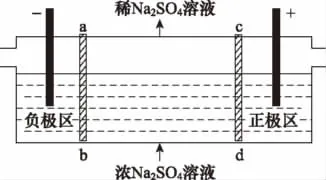
下列叙述正确的是 ( )
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
【答案】B
【解析】A项,电解池中阴离子向阳极区移动,因此通电后中间隔室的离子向正极迁移;正极区OH-放电,所以正极区溶液pH减小,错误;B项,阳极区OH-放电,产生硫酸,阴极区H+放电,产生氢氧化钠,因此该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品,正确;C项,负极区H+得到电子,使溶液中c(OH-)增大,所以负极区溶液pH升高,错误;D项,当电路中通过1mol电子的电量时,会有0.25mol的O2生成,错误。
【误区警示】
解答有关原电池的问题时,需要掌握原电池的工作原理,并从以下易混点对两极做出对比分析:电极名称、反应类型、电子流向、电流流向、电极变化、电解质溶液中离子移动方向、盐桥中离子移动方向等。
1.忽视了某些离子不能大量共存,错误地判断放电离子;忽视了活泼金属做阳极,应该活泼金属先放电。
2.不明白储氢合金电池储氢原理。储氢合金的储氢原理是H2镶嵌到了金属原子之间,而不是和金属发生了反应,所以得到的氢化物实际为混合物。
3.看清隔膜类型。隔膜分阳离子交换膜、阴离子交换膜、质子交换膜等。左室、右室什么离子减少或增多,变化的离子的物质的量确定等。
(作者单位:湖北省襄阳市一中,湖北省襄阳市四中)
