学科内综合题解题方法与策略
2017-08-08北京李宏华
北京 李宏华
学科内综合题解题方法与策略
北京 李宏华
学科内综合题常出现在理综化学试题中,由于高考《考试大纲》中所涉及的知识点很多,高考命题要求覆盖《考试大纲》中的大多数知识点,而一套试卷的题量是有限的,为了解决题量小与需要考查的知识点多的矛盾,命题者设置了这种学科内的综合题。
一、学科内综合题的类型
根据学科内的综合题背景材料和各小题的关联线索,可把学科内综合题分为四类:第一类,以元素化合物为中心与理论、实验的综合;第二类,以化学理论为中心的综合;第三类,以化工流程为背景的结合实验的综合;第四类,以化学实验为中心的综合。不论哪种类型的综合,各小题之间都有一条线贯穿,给人以“形散而神不散”的感觉。
二、学科内综合题的解题方法与策略
该类试题涉及的知识面广,单个知识点的难度并不大,但由于是多个知识点连在一起,客观上增加了难度。解题时要采取逐个分析、各个击破的方法,认真分析每个小题所考查的知识点,迅速转变思路,防止在每一个知识点、一个思路上走到底。
题型一:以元素化合物为中心,与理论、实验综合考查
元素化合物知识点多,在备考过程中要注意类似知识的归纳整合,建立知识点之间的联系,这种联系既是命题的着眼点,又是解题的关键,忽视这些联系会导致错误的判断。以元素化合物为中心的综合题,往往以某一种元素为素材,涉及化学实验和化学反应原理等知识,除了吃透各知识间的交融结合点外,答非所问是考生解答此类试题经常出现的错误。
【例1】(2016新课标Ⅰ,节选)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、(橙红色)、(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是______。
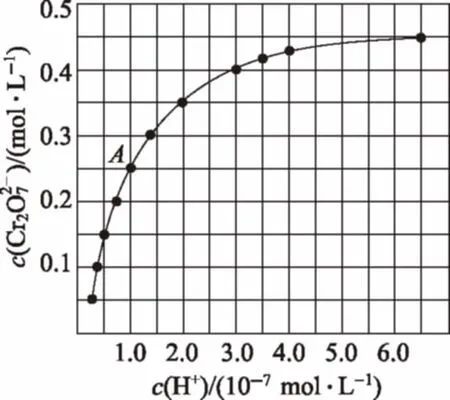
①用离子方程式表示Na2CrO4溶液中的转化反应________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_____mol·L-1,此时溶液中等于_____mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
【解析】(1)由Cr3+与Al3+的化学性质相似可知,Cr(OH)3是两性氢氧化物,能溶解在强碱NaOH溶液中。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,首先发生反应产生Cr(OH)3灰蓝色固体,当碱过量时,可观察到沉淀消失。故观察到的现象是开始有灰蓝色固体生成,随后沉淀消失。(2)①随着H+浓度的增大转化为的离子反应式为H2O。②溶液酸性增大,平衡H2O正向进行的平衡转化率增大;A点的浓度为0.25mol/L,根据Cr元素守恒可知的浓度为0.5mol/L;H+浓度为1×10-7mol/L;此时该转化反应的平衡常数为1014;③升高温度,溶液中的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的ΔH<0;(3)当溶液中Cl-完全沉淀时,即c(Cl-)=10-5,根据Ksp(AgCl)=2.0×10-10,此时c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×10-10÷(1.0×10-5)=2.0×10-5mol·L-1;此时溶液中(2.0×10-5)2=5×10-3mol·L-1。
【答案】(1)蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液(3)2.0×10-55×10-3
【名师点评】化学平衡原理适用于任何化学平衡。如果改变影响平衡的一个条件,化学平衡会向能够减弱这种改变的方向移动。会应用沉淀溶解平衡常数计算溶液中离子浓度大小,并根据平衡移动原理分析物质的平衡转化率的变化及移动方向,并根据电子守恒、电荷守恒、原子守恒书写离子反应方程式,是一个综合性试题。
题型二:以化学理论为中心,与实验探究综合考查
高考要求考生要有分析综合能力,而体现分析综合能力水平高低就是看考生是否具有把一个复杂问题分解为若干个较简单的问题,并找出它们之间的联系的能力,即考生要善于大题化小题,把综合性问题分解为简单化学问题。
【例2】(2016北京)用零价铁(Fe)去除水体中的硝酸盐已成为环境修复研究的热点之一。
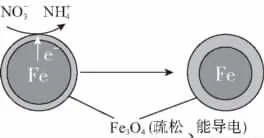
①作负极的物质是________。
②正极的电极反应式是___________________________。
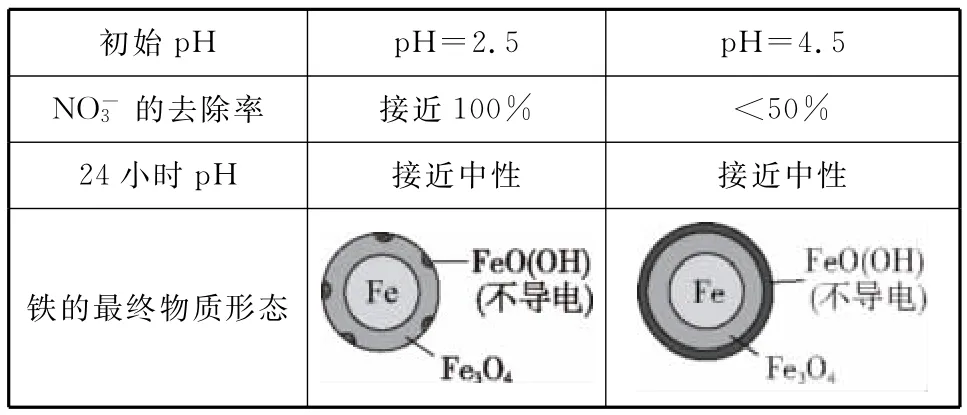
______初始pH pH=2.5 pH=4.5________NO-3的去除率_______接近100%<5 0%___________2 4小时pH 接近中性 接近中性铁的最终物质形态
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_____。
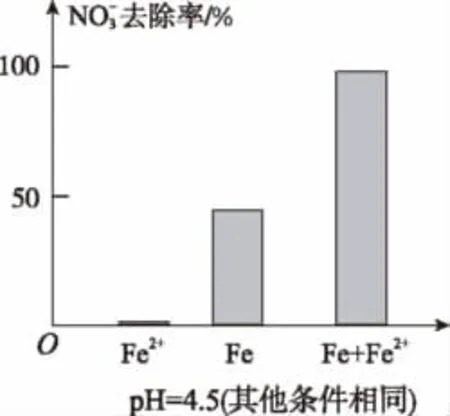
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高去除率的原因:________。

____初始pH pH=2.5 pH=4.5____NO-3的去除率约10%约3%________1小时pH接近中性 接近中性____
【解析】用零价铁去除水体中的硝酸盐,实验过程中涉及多种化学原理分析,如(1)(2)为电化学原理分析,(3)(4)以实验探究为依托,考查化学反应速率和化学平衡的影响因素。
【名师点评】该题一改化学原理综合应用的拼题,改成“借实验考原理”的方式来考查学生应用化学反应基本理论、化学反应速率平衡、电化学等理论联系实际,解题时我们只要抓住主要矛盾,便可简化解题思路。我们只需要从影响速率平衡的主要因素(此题主要是浓度)考虑问题即可。此问极易诱导学生从复杂角度分析问题,不容易得到正确答案。
题型三:以化工流程为背景的结合实验的综合
“变废为宝”是中学化学环保命题的主流课题,无机化工流程图题是2017年高考命题的新方向,通过化工流程图考查中学化学的基本原理和实验操作,对处理新信息的能力进行有效考查。解答这类题关键是读懂图示,分析物质的进入与流出方向,以及每一步发生什么反应,物质组成是什么,根据组成采取混合物分离、提纯的方法。
【例3】(2016新课标Ⅲ)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分如下表所示:

____物质 V2O5 V2O4___K2S O4__SiO2___Fe2O3A l2O3质量分数/%2.2~2.9 2.8~3.1 2 2~2 8 6 0~6 5 1~2 <1_
以下是一种废钒催化剂回收工艺路线:
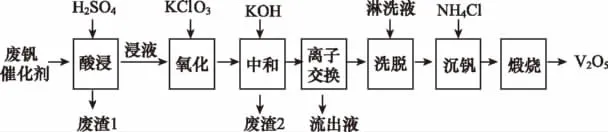
回答下列问题:
(1)“酸浸”时V2O5转化为,反应的离子方程式为________________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
(2)“氧化”中欲使3mol的VO2+变为,则需要氧化剂KClO3至少为________mol。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式:_____________________________。
【解析】(1)“酸浸”时V2O5转化为,V元素化合价不变,说明不是氧化还原反应,根据原子守恒可知反应的离子方程式为;二氧化硅与硫酸不反应,则“废渣1”的主要成分是二氧化硅。(2)“氧化”中欲使3mol的VO2+变为,V元素化合价从+4价升高到+5价,而氧化剂KClO3中氯元素化合价从+5价降低到-1价,则根据电子得失相等可知需要氯酸钾的物质的量为少3mol÷6=0.5mol。(3)“中和”作用之一是使钒以形式存在于溶液中,同时生成氢氧化铁、氢氧化铝沉淀,则“废渣2”中含有Fe(OH)3、Al(OH)3。(4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。(5)由于前面加入了氯酸钾和氢氧化钾,则“流出液”中阳离子最多的是钾离子。(6)根据原子守恒可知偏钒酸铵(NH4VO3)“煅烧”生成七氧化二钒、氨气和水,发生反应的化学方程式为H2O+2NH3↑。
【名师点评】本题是工艺流程问题,充分体现了“源于教材又不拘泥于教材”的指导思想,在一定程度上考查了学生的知识的灵活运用能力和分析问题解决问题的能力。书写离子反应方程式,首先找出反应物和生成物,然后判断此反应是否属于氧化还原反应,最后根据原子守恒、反应前后电荷守恒配平其他;工艺流程中充分把握题目所给数据。
题型四:以化学实验为中心的综合考查
【例4】(2016全国Ⅱ)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁属,其目的是__________________________________________________。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______________________________________________________。
(4)丙组同学取10mL 0.1mol/LKI溶液,加入6mL 0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
① 第一支试管中加入1mL CCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为______________________;一段时间后,溶液中有气泡出现,并放热。随后有红褐色沉淀生成。产生气泡的原因是_____________________;生成沉淀的原因是_____________________(用平衡移动原理解释)。
【解析】(1)亚铁离子具有还原性,能被空气中的氧气氧化,所以在配制的FeCl2溶液中加入少量铁属的目的是防止Fe2+被氧化。(2)Cl2可将Fe2+氧化成铁离子,自身得电子生成氯离子,反应的离子方程式为2Fe3++2Cl-。(3)防止空气中的氧气将Fe2+氧化,产生干扰,所以煤油的作用是隔绝空气。(4)根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,一定含有亚铁离子;则实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显血红色,实验①和③说明,在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为可逆反应。(5)H2O2溶液中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为,铁离子的溶液呈棕黄色;一段时间后,溶液中有气泡出现,并放热。随后有红褐色沉淀生成,产生气泡的原因是H2O2分解反应放热,促进Fe3+的水解平衡正向移动。
【答案】(1)防止Fe2+被氧化2Fe3++2Cl-(3)隔绝空气(排除氧气对实验的影响)(4)Fe2+Fe3+可逆反应2Fe3++2H2OFe3+催化H2O2分解产生O2H2O2分解反应放热,促进Fe3+的水解平衡正向移动
【名师点评】本题以常见的铁离子和亚铁离子的性质、H2O2的性质为基础,考查探究实验方案的设计与评价,学生读题不会感到陌生,有利于考查学生的基础知识,涉及铁离子和亚铁离子的性质、离子的检验、H2O2的性质、盐类的水解等知识。
(作者单位:北京市顺义区第八中学)
