钩吻素子在人和猪、大鼠、猴、犬肝微粒体的酶促动力学及CYP450酶亚型分析
2017-08-07魏文增黄慧玲叶丽香俞昌喜
魏文增,黄慧玲,叶丽香, 林 菁,, 俞昌喜
钩吻素子在人和猪、大鼠、猴、犬肝微粒体的酶促动力学及CYP450酶亚型分析
魏文增1,2,黄慧玲1,叶丽香3, 林 菁1,3, 俞昌喜1
目的 研究和比较钩吻素子(KM)在人与各种实验动物肝微粒体体外代谢的酶促动力学及选择性CYP450酶抑制剂对其代谢的影响。 方法 采用优化的反应体系和UPLC检测方法,测定系列浓度的KM与各种属肝微粒体孵育的降解曲线,以底物消除法计算酶动力学参数;共孵育方法考察选择性CYP450酶抑制剂对KM在各种属肝微粒体代谢的影响。 结果 在人肝微粒体,KM的米氏常数(Km)、最大反应速率(Vmax)、半哀期(T1/2)、固有清除率(CLint)分别为(0.135±0.067)mmol/L、(1.89±0.19)μmol·min-1·g-1pro、(712±23)min和(15.7±5.2)mL·min-1·g-1pro。与人相比,犬、猪的Km值较大,大鼠及猴的CLint较高,4种实验动物的Vmax值均较大、T1/2均较短。酮康唑在各种属均可显著抑制KM代谢,在人、猪、犬IC50<1 μmol/L,在大鼠、猴IC50为1~10 μmol/L,可见CYP3A为主要代谢酶。噻氯匹定、奎尼丁和磺胺苯吡唑仅对大鼠,噻氯匹定仅对猴和犬的KM代谢为弱抑制(抑制率20.43%~44.31%),说明在体情况下,CYP2B、CYP2D和CYP2C与KM的代谢可能无关。 结论 KM在人与猪、大鼠、犬、猴肝微粒体中的主要代谢途径相同,均由CYP3A酶催化,但酶活性和代谢动力学特征有一定差异。
钩吻; 钩吻碱; 微粒体,肝; 色谱法,高压液相; 催化作用; 酶抑制剂
钩吻素子(koumine,KM)为钩吻中含量最高的一种假吲哚型生物碱。据报道,KM具有高效低毒的镇痛、抗焦虑、抗肿瘤、抗应激等药理作用[1-2]。近年来本课题组对KM进行了深入的研究,发现其还具有较强的治疗慢性神经疼痛、类风湿性关节炎等作用,具有创制新药的潜能[3-6]。前期研究显示,KM可在肝微粒体代谢,其在不同实验动物种属肝微粒体的主要代谢产物相同,但代谢特征及次要代谢产物构成具有一定的差异[6]。为探讨和比较KM在人与各种动物代谢的差异情况,本研究采用KM的盐酸盐(分子式为C20H22N2O·HCl,图1),应用UPLC法测定其在肝微粒体孵育系统的代谢变化,并研究CYP酶特异性抑制剂对代谢的影响,判断和比较KM在人与4种实验动物肝微粒体的酶动力学特征和代谢酶亚型,为该药的进一步研发提供参考。
1 材料与方法
1.1 供试品、试剂和主要仪器 KM盐酸盐(批号201310,纯度99.0%,福建医科大学药学院提供),以PBS溶解,配制成100或5 g/L的母液,分别用于方法学验证和肝微粒体孵育试验。PBS粉末(每包2 L,pH为7.2~7.4)及NADPH粉末(北京索莱宝科技有限公司),PBS以超纯水溶解,NADPH以PBS溶解配制成10 mmol/L的溶液。酮康唑(批号531F01)、噻氯匹定(批号058K1300)、磺胺苯吡唑(批号096K1462)及奎尼丁(批号066K2509)(美国Sigma公司),分别以甲醇溶解配制成合适浓度的溶液;乙腈和甲醇为色谱纯(德国默克公司);人、小型猪、SD大鼠、恒河猴及比格犬肝微粒体(蛋白含量20 g/L)(瑞德肝脏疾病研究上海有限公司),-80 ℃保存。UPLC(Agilent 1290,美国Agilent公司);精密天平(BT 25 S,精密度0.01 mg,赛多利斯科学仪器北京有限公司);pH计(ORION 3 STAR,赛默飞世尔科技有限公司);自动氮气浓缩仪(HAC-I,天津市恒奥科技发展有限公司)。
图1 钩吻素子盐酸盐结构Fig 1 The structure of koumine hydrochloride
1.2 方法
1.2.1 分析和反应条件 KM及其代谢产物的UPLC分析、肝微粒体共孵育反应体系采用本实验室建立的条件进行[7]:安捷伦Poroshell HPH-C18液相色谱柱(2.1 mm×100 mm,2.7 μm),检测波长256 nm,建立色谱条件,方法学考察显示日内精密度及日间精密度良好,RSD分别<2.42%和<3.61%,回收率>90%。KM保留时间为4.01 min,各种属的主要代谢物相同,保留时间为1.85 min。
孵育反应体系及其优化:肝微粒体5 μL、KM 10 μL、PBS补足至终体积200 μL,于EP管置37 ℃恒温振荡箱中预孵育5 min后,再加入预孵育的NADPH溶液(1 mmol/L,20 μL)启动反应,继续孵育一定时间后取出,立即加入4倍体积的冰乙腈溶液终止反应并沉淀蛋白;温孵液采用700 μL冰乙腈萃取2次,置氮气浓缩仪挥干后,加入100 μL 25%乙腈复溶,取上清进样。反应体系优化结果:肝微粒体蛋白浓度0.5 g/L,KM浓度0.73 mmol/L,孵育时间为人和猪4 h、大鼠和犬3 h、猴2 h。
标准曲线:在灭活温孵液(将肝微粒体水浴100 ℃加热10 min灭活,蛋白浓度0.5 g/L)中加入系列浓度的KM溶液,进行样品处理和进样测定,以KM峰面积对浓度进行线性回归,实验过程所有随行标准曲线在0.012~7.31 mmol/L范围内线性关系良好。
1.2.2 KM代谢及酶动力学数据分析 根据优化反应条件,肝微粒体浓度为0.5 g/L,测定不同浓度KM在各种属肝微粒体反应体系中随孵育时间的浓度变化。KM为0.15,0.29,0.73,1.83,3.65 mmol/L,孵育时间0.25,0.5,1,1.5,2,3,4 h(末次:人和猪4 h,大鼠和犬3 h,猴2 h),每个浓度各个时间点设3复管。孵育样品处理后进行UPLC测定,根据随行标准曲线计算各时间点KM浓度,按照底物消除法[8],以每个试验浓度0时间点的底物浓度测值为100%,按方程(1)以其他时间点的底物浓度测值与该值的比值(剩余底物水平)的自然对数值对反应时间作图,计算初始线段斜率即为相应底物浓度下的消耗常数(kdep),再根据方程(2)以不同底物浓度的kdep值的倒数对底物浓度作图,进行倒数法直线回归,计算米氏常数(Km)、最大反应速率(Vmax)和半衰期(T1/2)。
[S]=[S]0·e-kdep·t
(1)
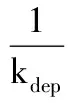
(2)
1.2.3 CYP450酶抑制试验 在KM-肝微粒体温孵体系中分别加入特异性抑制剂,酮康唑终浓度0.32,0.8,2,5,12.5,31.25 μmol/L,奎尼丁、磺胺苯吡唑和噻氯匹定终浓度8,20,50,125,312.5 μmol/L,设3复管,按优化的反应条件处理,测定KM主要代谢产物(保留时间为1.85 min)的峰面积,计算抑制率及IC50,评价不同抑制剂对各种属代谢物生成的影响。抑制率的计算公式如下,将抑制率对抑制剂浓度对数值作线性回归计算IC50。


以抑制剂对酶的抑制率判断,在抑制剂浓度为50 μmol/L时,抑制率<20%为无抑制,抑制率20%~50%和>50%分别为可能抑制和较强抑制[9],进一步测定IC50。根据CYP450酶抑制剂强度分级规则[10],IC50<1 μmol/L为强抑制;IC50>10 μmol/L为弱抑制,在临床上不太可能抑制CYP450酶活性;IC501~10 μmol/L为中等抑制作用,其抑制作用需经过体内的验证。
1.3 统计学处理 应用 Windows Excel Microcal Origin 8.5与SPSS 16.0软件进行数据分析和作图。
2 结 果
2.1 KM酶动力学参数测定 根据不同浓度KM在各种属肝微粒体反应体系的代谢随孵育时间的浓度变化曲线(图2A~E),计算相应底物浓度下的kdep,可见kdep值表现为浓度依赖关系,再以不同底物浓度的kdep值的倒数对底物浓度作图,进行倒数法直线回归,计算Km、Vmax和T1/2,结果见表1。回归方程分别为(图2F):
y=18.139 4x+2.756 2,r=0.991 4 (HLM)
y=4.328 0x+4.596 4,r=0.939 7 (PLM)
y=2.391 8x+0.435 1,r=0.997 2 (RLM)
y=4.192 4x-0.198 6,r=0.998 6(MLM)
y=0.773 3x+1.736,r=0.812 6 (DLM)
(HLM,PLM,RLM,MLM,DLM分别为人、猪、大鼠、猴、犬肝微粒体)
2.2 CYP450酶抑制剂对KM代谢的影响 31.25 μmol/L的酮康唑可显著抑制KM在人和各种属微粒体的代谢,抑制率78.31%~95.76%(图3)。不同浓度下进一步试验显示,KM为0.73 mmol/L时,酮康唑在人为强抑制(IC50<1 μmol/L),在猪、大鼠、猴、犬为中等抑制(IC50为1~10 μmol/L),低浓度KM(0.15 mmol/L)下酮康唑的抑制作用更显著(表2)。
在抑制剂浓度为50 μmol/L下,噻氯匹定、奎尼丁和磺胺苯吡唑仅见对大鼠、噻氯匹定仅对猴和犬的KM体外代谢抑制程度为20.43%~44.31%,IC50均高于10 μmol/L(图3B~D)。
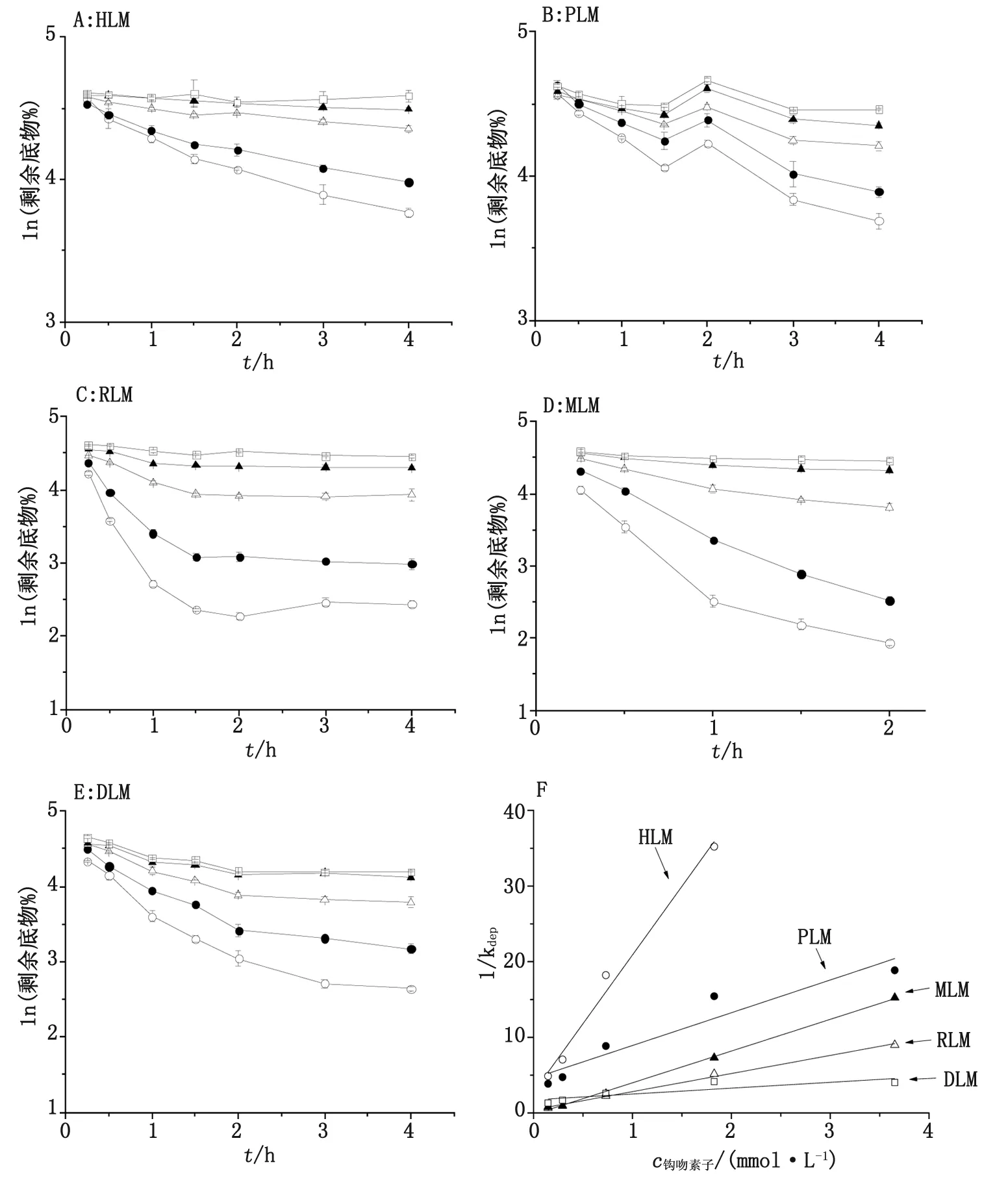
钩吻素子浓度(mmol/L,A~E):0.15 0.29 0.73 1.83 3.65. HLM,PLM,RLM,MLM,DLM:分别为人、猪、大鼠、猴、犬肝微粒体.图2 剩余底物水平-时间曲线(A~E)及倒数作图法(F)Fig 2 Percentage of remaining substrate-time curves (A~E)and reciprocal plot(F)
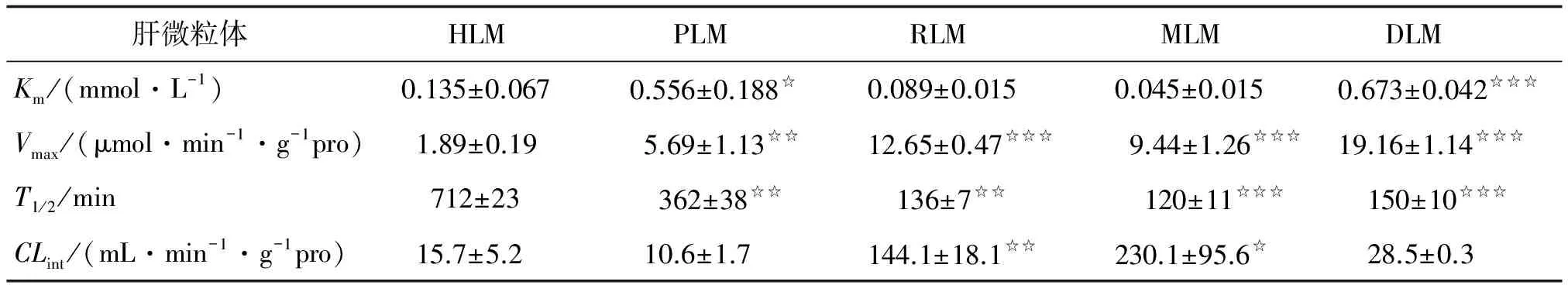
肝微粒体HLM PLM RLM MLM DLM Km/(mmol·L-1)0.135±0.0670.556±0.188☆0.089±0.0150.045±0.0150.673±0.042☆☆☆Vmax/(μmol·min-1·g-1pro)1.89±0.195.69±1.13☆☆12.65±0.47☆☆☆ 9.44±1.26☆☆☆19.16±1.14☆☆☆T1/2/min712±23 362±38☆☆ 136±7☆☆120±11☆☆☆ 150±10☆☆☆CLint/(mL·min-1·g-1pro)15.7±5.210.6±1.7144.1±18.1☆☆230.1±95.6☆ 28.5±0.3
HLM,PLM,RLM,MLM,DLM:分别为人、猪、大鼠、猴、犬肝微粒体. 与HLM比较,☆:P<0.05,☆☆:P<0.01,☆☆☆:P<0.001.
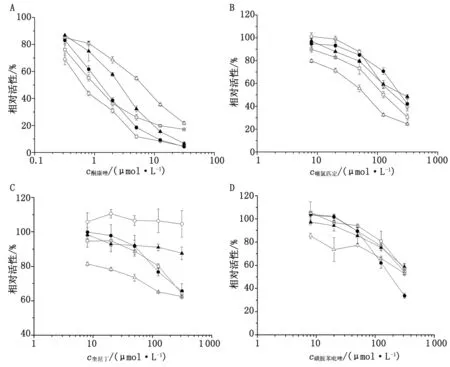
分别为人、猪、大鼠、猴、犬肝微粒体;钩吻素子浓度为0.73 mmol/L.图3 不同抑制剂对钩吻素子体外代谢的影响Fig 3 In vitro metabolic inhibition of koumine by different inhibitors

c钩吻素子/(mmol·L-1)IC50/(μmol·L-1)HLM PLM RLM MLM DLM 3.651.98±0.24▲▲1.74±0.11▲▲14.57±0.26▲5.31±0.05▲▲3.78±0.34▲▲0.730.73±0.09▲▲▲1.28±0.05▲▲5.99±0.13▲▲2.46±0.16▲▲1.25±0.05▲▲0.15 <1.0▲▲▲0.55±0.12▲▲▲3.84±0.09▲▲3.90±0.42▲▲0.76±0.06▲▲▲
HLM,PLM,RLM,MLM,DLM:分别为人、猪、大鼠、猴、犬肝微粒体. ▲:弱抑制; ▲▲:中等强度抑制; ▲▲▲:强抑制.
3 讨 论
在新药研究的初期阶段,明确药物代谢特征、途径以及参与的代谢酶等,对于临床前和临床试验的合理设计以及预测药物间的相互作用有着重要的意义。CYP450酶的测定、诱导或抑制作用研究为国际上新药筛选及代谢研究所必须进行的新药临床前研究。本研究参照我国CFDA及美国FDA的相关指导原则[11-12],对KM酶促动力学及CYP酶抑制剂的影响进行研究。
底物消除法是CYP酶促动力学研究的常用方法,通过测定药物代谢的酶动力学参数,可预测药物在体内代谢的动力学特征[7]。李彧和邢晓丹等对大鼠肝微粒体中KM的酶促反应动力学测定,其结果差异较大[13-14]。本研究比较KM在人和多种实验动物的研究结果,可见猴的Km值最小,即KM与猴的亲和力最大,与大鼠、人的亲和力居中,与猪、犬的亲和力较小;比较Vmax、T1/2和CLint值可见,KM在人、猪的代谢较慢、肝清除率较低,在猴、大鼠、犬的代谢较快、肝清除率较高。表明KM在人与不同实验动物种属肝微粒体中的酶促反应动力学特征差异较明显,在应用实验动物进行体内外代谢研究时,应考虑其与人之间的相似性和差异的存在。
在P450超家族中,CYP1、CYP2和CYP3家族约占肝P450含量的70%,介导大多数药物的代谢,其中CYP3A介导>50%药物的代谢。人类CYP3A家族以CYP3A4、3A5为最重要的药物转化酶,在动物中的主要同工酶分别是CYP3A29(小型猪)、CYP3A1(大鼠)、CYP3A8(猴)和CYP3A12(犬)[15-17]。酮康唑为CYP3A酶特异性抑制剂,本研究发现其显著抑制KM在人和各动物种属肝微粒体的代谢,具有明显的抑制剂浓度依赖性,且在不同种属中抑制强弱有一定差异,其中在人抑制作用最强,猪和犬次之,在大鼠和猴为中等程度抑制,据此推断KM的代谢可能主要通过CYP3A酶所介导的氧化、脱甲基、羟化等途径[12],与噻氯匹定、奎尼丁和磺胺苯吡唑相关的CYP2B、CYP2D和CYP2C酶可能无关。最近Hu等也指出,KM在人肝微粒体系通过CYP3A4/3A5介导脱甲基、脱甲基-脱氢、氧化代谢[18]。
本研究通过探讨和比较KM在人与常用实验动物种属肝微粒体的代谢途径和动力学特征,表明各动物种属中KM的主要代谢酶与人一致,但代谢动力学特征在人与各种动物以及动物之间存在较明显的差异,CYP450酶活性可能也存在一定的种属差异。
(致谢:感谢台湾嘉南药理大学生物科技系高毓瑩助理教授对开展本研究的建议以及对论文的斧正。)
[1] Dutt V, Thakur S, Dhar V J,etal. The genus gelsemium:an update [J].PhcogRev, 2010,4(8):185-194.
[2] 蔡 晶, 王万山,雷林生, 等.钩吻素子对小鼠抗应激作用的实验研究[J].广州中医药大学学报, 2007, 24(4):317-319.
[3] 俞昌喜,许 盈,刘 浩. 作为唯一活性成分的在制备治疗慢性疼痛药物中的应用:中国. ZL200810071467.X[P]. 2011-08-31.
[4] 俞昌喜, 许 盈, 杨 渐, 等. 钩吻素子在制备治疗类风湿性关节炎药物中的应用:中国. ZL201110174657.6[P]. 2012-08-29.
[5] Xu Y, Qiu H Q, Liu H,etal. Effects of koumine, an alkaloid of Gelsemium elegansBenth., on inflammatory and neuropathic pain models and possible mechanism with allopregnanolone[J].PharmacolBiochemBehav, 2012,101(3):504-514.
[6] Liu M, Huang H H, Yang J,etal. The active alkaloids of Gelsemium elegansBenth. are potent anxiolytics[J].Psychopharmacology(Berl), 2013,225(4):839-851.
[7] 魏文增, 叶丽香, 黄慧玲, 等. 钩吻素子在人与小型猪、SD大鼠、恒河猴、比格犬肝微粒体中的体外代谢比较[J].中南药学, 2016,14(10):1045-1049.
[8] 段俊敏, 王小莹, 郭 宾, 等. 底物消除法测定微粒体酶动力学参数的实用性分析[J]. 中国卫生检验杂志, 2011,21(7):1691-1694.
[9] Krippendorff B F, Lienau P, Reichel A,etal. Optimizing classification of drug-drug interaction potential for CYP450 iso-enzymes inhibition assays in early drug discovery[J].JBiomolScreen, 2007,12(1):92-99.
[10] Liu Y, Jiao J, Zhang C,etal. A simplified method to determine five cytochrome P450 probe drugs by HPLC in a single run[J].BiolPharmBull, 2009,32(4):717-720.
[11] 国家食品药品监督管理总局药品审评中心. 药物非临床药代动力学研究技术指导原则[S/OL]. 国家食品药品监督管理总局, [2014-05-13]. http://www.cde.org.cn/zdyz.do?method=largePage&id=191.
[12] Center for drug evaluation and research, FDA. Drug interaction studies-study design, data analysis, implications for dosing, and labeling recommendations [S/OL]. FDA, [2012-02-17].http://101.96.10.43/www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidance s/UCM292362.pdf.
[13] 李 彧, 曾荣洁, 郑雪卿, 等.大鼠肝微粒体中钩吻素子UPLC-MS/MS法测定与酶促反应动力学研究[J]. 福建中医药, 2013,44(3):50-52.
[14] 邢晓丹. 钩吻素子在大鼠肝微粒体中的酶促反应动力学研究[J].海峡药学, 2013,25(8):33-36.
[15] Donato M T, Castell J V. Strategies and molecular probes to investigate the role of cytochrome P450 in drug metabolism focus oninvitrostudies[J].ClinPharmacokinet, 2003,42(2):153-178.
[16] Martignoni M, Groothuis G M, de Kanter R. Species differences between mouse, rat, dog, monkey and human CYP-mediated drug metabolism, inhibition and induction[J].ExpertOpinDrugMetabToxicol, 2006,2(6):875-894.
[17] Xue Z K, Wei H. Comparison of pharmacokinetics between recombinant liver microsomes with CYP3A4 and CYP3A29[J].HeraldofMedicine, 2015,34(1):15-21.
[18] Hu Y X, Wang Z Y, Huang X,etal. Oxidative metabolism of koumine is mainly catalyzed by microsomal CYP3A4/3A5[J/OL].Xenobiotica,[2016-08-08]. http://www.ncbi.nlm.nih.gov/pubmed/27499416.
(编辑:何佳凤)
Metabolism Kinetics and Subtype Analysis of CYP450 of Koumine in Liver Microsomes of Human, Minipig, Rat, Monkey and Dog
WEI Wenzeng1,2, HUANG Huiling1, YE Lixiang3, LIN Jing1,3, YU Changxi1
1.College of Pharmacy, Fujian Medical University, Fujian Medical University, Fuzhou 350122, China;2.Fujian Institute of Traditional Chinese Medicine, Fuzhou 350003, China;3.Fujian Center for Safety Evaluation of New Drug, Fujian Medical University, Fuzhou 350122, China
Objective To study the enzyme kinetics and the effects of selective CYP450 enzyme inhibitors on the koumine metabolism in liver microsomes of human, pig, rat, monkey and dog. Methods Koumine in liver microsome was quantified through UPLC. Based on substrate deletion approach, various concentrations of koumine were incubated with liver microsomes under optimized condition, and residual substrate concentrations were measured at different incubating time. Enzymatic kinetic parameters were calculated by reciprocal plot. Influence of four selective inhibitors on koumine metabolism was investigated to identify the enzyme subtypes of the metabolism. ResultsKm,Vmax,T1/2andCLintof koumine in human liver microsomes were (0.135±0.067) mmol/L, (1.89±0.19)μmol·min-1·g-1pro, (712±23)min and (15.7±5.2)mL·min-1·g-1pro, respectively. The parameters in liver microsomes of the four specie animals were observed differences from human in varying degrees, such as:Kmwere higher in dog and pig;CLintwere higher in rat and monkey;Vmaxwere higher andT1/2were smaller among four specie animals. Ketoconazole significantly inhibited the koumine metabolism in liver microsomes from human, pig, dog(IC50<1 μmol/L)and rat, monkey (IC50between 1 and 10 μmol/L), indicating that CYP3A is the major enzyme of koumine metabolism in these speciesinvitro. The inhibitory ratio of ticlopidine, quinidine and sulfaphenazole to the koumine metabolism in rat, ticlopidine in monkey or dog, were 20.43%~44.31% (IC50>10 μmol/L), and no other inhibitory effects were observed by ticlopidine, quinidine and sulfaphenazole. Thus CYP2B, CYP2D and CYP2C are unlikely to participate koumine metabolisminvivo. Conclusion The major metabolic pathway of koumine is similar in the liver microsomes among five species, and CYP3A is the major metabolic enzymesinvitro. However, there are some differences among the various species in enzyme kinetic characters and enzyme activity of koumine metabolism.
Gelsemium elegans; Gelsemine; microsomes, liver; chromatography, high pressure liquid; catalysis; enzyme inhibitors
2016-10-13
福建省科技计划重点项目(2013Y0088)
1. 福建医科大学 药学院,福州 350122; 2. 福建省中医药研究院,福州 350003; 3. 福建医科大学 福建省新药安全性评价中心,福州 350122
魏文增,男,研究实习员,医学硕士
林 菁. Email: yq509@163.com
R284.1; R345; R446
A
1672-4194(2017)02-0082-06
