转化生长因子β1/Smads信号传导通路在哺乳动物卵巢发育中的调控作用及其作用机制
2017-08-07黄丽波杨在宾杨维仁姜淑贞
周 敏 冯 强 黄丽波 杨在宾 杨维仁 姜淑贞*
(1.山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,泰安271018;2.泰安市中心医院,泰安271000)
转化生长因子β1/Smads信号传导通路在哺乳动物卵巢发育中的调控作用及其作用机制
周 敏1冯 强2黄丽波1杨在宾1杨维仁1姜淑贞1*
(1.山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,泰安271018;2.泰安市中心医院,泰安271000)
不同信号转导通路间的彼此协调保证了机体的正常运行。在众多的信号通路中,转化生长因子(TGF)β1/Smads信号传导通路越来越受到学者们的关注,已经成为分子生物学和细胞生物学研究的一大热点。已有研究证实,TGF-β1/Smads信号传导通路是调控卵泡发育的重要途径。本文就TGF-β1/Smads信号传导通路与哺乳动物卵巢卵泡的发育进行综述,分别从TGF-β受体、Smads蛋白、骨形态发生蛋白(BMP)、血小板反应蛋白1(THB-S1)、S期激酶相关蛋白1(SKP1)和其他调节机制阐述TGF-β1/Smads信号传导通路在哺乳动物卵巢发育中的调控作用及其机制,旨在引起人们对TGF-β1/Smads调控卵巢发育的关注,并为卵巢发育过程中某些疾病的治疗提供一些参考。
TGF-β1/Smads;哺乳动物;卵巢;BMP;THB-S1;SKP1
雌性动物的繁殖性能是影响动物生产力的重要因素,繁殖性能的高低由多种因子协调控制。卵巢是产卵和排卵的生殖器官,若卵巢发育异常,将会导致雌性动物卵泡发育异常、卵巢功能紊乱、不孕等疾病,在雌鼠上表现为性成熟推迟、不规则排卵、排卵减少[1]。机体程序的正常运行依赖于不同信号转导通路之间的相互协调,卵泡的生长发育是由多种因子共同调控的。最新的研究发现,转化生长因子-β(transforming growth factor-β,TGF-β)超家族在调控细胞的分化增殖和周期、胚胎发育、骨骼形成、创伤修复、机体免疫和内分泌、肿瘤的形成和发展等方面起到一定的作用[2-4]。TGF-β1作为TGF-β超家族成员中活性最强、功能最多、分布最广的因子[5],在调节卵泡发育、卵母细胞和颗粒细胞之间的信号传导[6],调节细胞的生长、分化、迁移、凋亡以及细胞外基质的生成等信号转导中起着重要的作用[7]。Smads蛋白是细胞内重要的TGF-β信号转导和调节分子,可以将TGF-β信号由细胞膜直接转导入细胞核内[8]。研究发现,TGF-β信号传导通路的受体和Smads蛋白编码基因的突变与肿瘤发生有关[9]。当今探索信号传导通路无疑成为整个生命科学研究前沿领域的热点之一,然而对TGF-β信号传导通路作用分子机制的阐释才刚刚开始,许多问题亟待解决。积极探索TGF-β1/Smads经典信号通路的调控机制,无疑成为了对TGF-β超家族再认识的重中之重。
1 TGF-β1/Smads信号通路与卵巢卵泡的发育
卵巢是雌性哺乳动物的主要性腺器官,可以产生卵子用于繁衍,还能分泌雌性激素促进第二性征的发育。哺乳动物卵巢功能的正常发育是由多种因素相互协调的复杂且精密的过程,其功能起始于胚胎发育时期。卵巢发育的整个过程中,受到许多激素和细胞因子的调节作用,它们以旁分泌/自分泌的方式在细胞间进行信号传递[6]。大量研究表明,TGF-β1/Smads信号通路在颗粒细胞、卵泡生长发育过程中有着举足轻重的调控作用,通路中任何一种信号传导分子的时空表达或激活异常都会使动物机体卵巢发育异常,甚至与人类肿瘤、心血管疾病和自体免疫疾病相联系[7-8]。近年来,TGF-β超家族成员在动物繁殖中的作用被广泛研究,在动物生殖系统的整个发育过程中同样具有十分重要的作用,已有试验证明,在正常卵巢组织中有完整的TGF-β1/Smads信号通路[9]。
TGF-β1/Smads是TGF-β信号通路的一个分支,是近年来发现存在于生物体内的一条调控高等动物卵泡生长和发育的关键信号传导通路。TGF-β1/Smads信号通路是由细胞外配体、细胞表面特异受体及细胞内Smads信号传导分子共同组成的,它们之间会形成紧密联系的级联反应,最终将细胞外信号传导进入细胞核内并调控靶基因转录,引发生物学效应。当TGF-β1存在时,活化的超家族配体信号分子到细胞膜表面,识别相应的转化生长因子-βⅡ型受体(transforming growth factor-β receptor Ⅱ,TGF-βRⅡ)并与之结合,TβRⅡ自身磷酸化后直接结合或通过β聚糖间接结合转化生长因子-βⅠ型受体(transforming growth factor-β receptor Ⅰ,TGF-βRⅠ)形成二聚体复合物而具有激酶活性。磷酸化具有激酶活性的TβRⅠ可以激活胞质中的受体激活型Smads蛋白(receptor-regulated Smads,R-Smads,Smad2/3),将信号传到磷酸化的受体,并与通用型Smads(common mediator Smads,Co-Smads,Smad4)结合将TGF-β的信号由胞浆传递至胞核内作用于特定基因的启动子,与许多辅助活化因子和辅助抑制因子协同作用调节靶基因的转录,诱导下游目的基因的表达,进而引发一系列的生物学效应。TGF-β/Smads通路中抑制型Smads(inhibitory Smads,I-Smads,Smad7)通过阻断R-Smad和Co-Smad的激活以及与活化的受体或受体激活的Smads竞争性结合形成无活性复合物来负调控此信号通路[10](图1)。
2 TGF-β1/Smads信号通路的调节机制
2.1 TGF-β受体对TGF-β1/Smads信号通路的调节
TGF-β受体是一种跨膜蛋白,存在于细胞表面,目前发现的TGF-β超家族受体主要有TGF-βRⅠ、TGF-βRⅡ和转化生长因子-βⅢ型受体(transforming growth factor-β receptor Ⅲ,TGF-βRⅢ)3种亚型,均包含胞外区、跨膜区和胞内区[11]。TGF-βRⅠ在胞内区有一个高度保守的甘氨酸(glycine,Gly)及丝氨酸(serine,Ser)残基结构域,即GS结构域,在TGF-βRⅠ激酶活化中起着重要作用。但TGF-βRⅡ没有GS结构域,通过胞内侧的苏氨酸(threonine,Thr)和Ser短尾自身磷酸化与游离的TGF-β结合[12]。TGF-βRⅢ是一种蛋白聚糖,不直接参与信号传导,因此又被称为协同受体[13]。TGF-βRⅠ GS区的Ser/Thr磷酸化是介导TGF-β信号转导所必需的,决定着细胞内下游信号的特异性。目前已有研究表明,在卵巢不同发育阶段TGF-β1和TGF-βRⅠ均有表达,通过自分泌/旁分泌机制参与卵巢颗粒细胞增殖、卵母细胞成熟和类固醇生成,对维持卵巢稳态起着十分重要的作用[14]。基因敲除TGF-βRⅡ,会导致小鼠在胚胎期或新生期死亡[15]。由此可知,TGF-β受体参与了哺乳动物多种生理活动的调控。
2.2 Smads蛋白对TGF-β1/Smads信号通路的调节
Smads蛋白是细胞内重要的TGF-β信号传导和调节分子,可以将TGF-β信号由细胞膜直接传导进入细胞核内[16],其失活或突变都会导致肿瘤的发生。已有研究表明,Smad2和Smad4被确定为肿瘤抑制基因。如果没有Smad2,细胞可以逃避TGF-β调节的生长抑制发生癌变;Smad4蛋白缺失会导致DNA结合能力降低,使卵巢癌下游靶基因的表达发生改变[8]。Smads蛋白是TGF-β信号通路的关键下游信号传导分子,可将TGF-β与其受体作用的信号从胞质传到胞核,激活后的激活型/通用型Smads(receptor-regulated/common mediator Smads,R-Smad/Co-Smad)异聚体进入胞核与其他转录因子协同聚集在靶基因的启动子区,对转录产生正调节或负调节[16]。Smad2/Smad3是TGF-β1下传的第1个信号分子[17],Smad2/Smad3可以由Smad受体激活锚定蛋白(Smad anchor for receptor activation,SARA)招募到TGF-βRⅠ上磷酸化发挥正调控[18]。而Smad7可以由丝氨酸/苏氨酸激酶受体(serine-threonine kinase,STRAP)呈递与TGF-βRⅠ结合形成复合物发挥负调控。Tomic等[19]的研究表明,缺失Smad3基因的雌性小鼠卵泡发育紊乱,颗粒细胞凋亡增加,进而导致卵泡闭锁增加;同时Smad3基因的缺失还会导致小鼠缺乏正常的发情周期[20]。Stephanie等[21]研究发现,在卵巢中特异性敲除Smad4基因导致小鼠卵泡功能早衰,颗粒细胞过早黄体化,生育能力下降。由此可以推断Smads蛋白对哺乳动物卵泡发育和颗粒细胞增殖、分化方面具有重要的作用,这必将成为将来的研究热点。
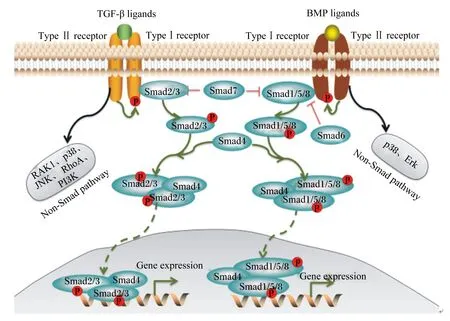
TGF-β ligands:TGF-β超家族配体 transforming growth factor-β super family ligands;BMP ligands:骨形态发生蛋白配体 bone morphogenetic protein ligands;Type Ⅱ receptor:TGF-βⅡ型受体 TGF-βRⅠⅡ;Type Ⅰ receptor:TGF-βⅠ型受体 TGF-βRⅠ;TAK1:转化生长因子β激活激酶1 transforming growth factor-β-activated kinase 1;p38:丝裂原活化蛋白激酶家族的一员 a member of mitogen-activated protein kinases (MAPKs) family;JNK:c-Jun氨基末端激酶 c-Jun nterminal kinases;RhoA:Rho蛋白家族的一个小分子蛋白 a small molecule protein of Ras homologue family;PI3K:磷脂酰肌醇-3激酶 phosphatidylinositol-3 kinase;Non-Smad pathway:不依靠Smad介导的通路;ErK:细胞外信号调节酶 extracellular signal-regulated kinase;Smad1/2/3/5/8:受体激活型Smads R-Smads;Smad7:抑制型Smad I-Smads;Smad4:通用型Smads Co-Smads;Gene expression:基因表达。
图1 TGF-β/Smads信号通路
Fig.1 TGF-β/Smads signaling pathway[10]
2.3 骨形态发生蛋白(bone morphogenetic protein,BMP)对TGF-β1/Smads信号通路的调节
BMP是从成人骨组织中提取的一种富含谷氨酸的高度保守糖蛋白,除了BMP-1均属于TGF-β家族[22],在脊椎动物、无脊椎动物的骨骼发育及器官形成中具有重要作用,并且调节多种细胞的生长和分化[23]。成熟的BMP蛋白是由二硫键连接的同型或异型二聚体,在细胞外释放,与靶细胞表面的相应受体结合而发挥作用[22]。BMP受体由短细胞外区、跨膜区和胞内区组成[22]。BMP为TGF-β信号通路中上游的转化因子。有研究表明,BMP在卵泡的生长发育、卵母细胞成熟、排卵、颗粒细胞增殖等方面有重要的作用[24],BMP在控制和调节卵巢的生理学功能和卵泡发生等方面也发挥了重要作用[25]。
2.4 血小板反应蛋白1(thrombospondin 1,THB-S1)对TGF-β1/Smads信号通路的调节
THB-S1是由血小板α颗粒分泌的基质黏合性糖蛋白,在人体组织中广泛表达[26],对伤口的愈合[27]、细胞的黏附、移行、增殖和分化起到了一定的调节作用,并且诱导血小板聚集和抑制血管生成[26]。THB-S1是通过二硫键结合3条相同肽链而构成的同源三聚体胞外基质糖蛋白[28],每条肽链可分为6个结构域,不同的结构域会与多种胞外基质和细胞表面受体结合进而发挥多种生物学功能[29]。THB-S1是TGF-β的重要活化剂,能够改变TGF-β的构象,暴露其与细胞受体结合位点进而激活TGF-β信号通路[30]。有研究发现,缺失THB-S1基因,小鼠窝产仔数会降低,生殖机能出现障碍[31]。THB-S1受多种生殖激素调控,参与颗粒细胞增殖、分化和卵泡发育的生物学过程[32-33]。
2.5 S期激酶相关蛋白1(s-phase kinase association protein 1,SKP1)对TGF-β1/Smads信号通路的调节
SKP1最早从酵母中发现的多功能蛋白,通过编码着丝粒结合蛋白参与调控细胞周期,还能进行相关物质的泛素降解[34]。SKP1作为TGF-β/Smads信号通路的下游调控因子,调控哺乳动物的卵泡发生和排卵的过程[34]。SKP1是泛素连接酶复合物SCF蛋白(skp1-cull-f-box protien,SCF)中的一个关键的骨架蛋白,并结合不同的F-box蛋白,介导不同细胞周期蛋白进行泛素化降解[35],从而推动细胞周期的正确进行[36]。通过多年研究,发现SKP1是一个多功能蛋白,在很多通路中起到关键作用。已有研究表明,SKP1是小鼠早期胚胎发育中的重要因子,其超表达能阻碍胚胎发育[37]。因此推测SKP1基因可能和猪卵泡发育、闭锁有关,进而影响猪的排卵数和繁殖能力,但是这需要一系列的研究来证实。
2.6 TGF-β1/Smads信号通路其他调节机制
机体稳态是由许多调节因子和多条通路相互作用来维持的。TGF-β1/Smads信号通路与其他信号途径存在着广泛的交流。表皮生长因子(epidermal growth factor,EGF)、脂多糖、肿瘤坏死因子(TNF)、白细胞介素-1β(IL-1β)等均可诱导Samd7产生,与TGF-β信号通路交联。TGF-β1/Smads信号传导还与酶受体介导的下游信号途径之间存在交流,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)系统对R-Smads有双重调节作用,既可以释放TGF-β1/Smads信号的生物学效应,也可以阻止R-Smad的核内聚积。此外,TGF-β信号还可与Wnt信号、P38等相互作用,这种通路间的“串话交流”纵横交错,共同构成了复杂的调节体系,不仅有效地调节了TGF-β信号通路的正常运行,还赋予TGF-β复杂多样的生物学效应[8]。
3 小 结
尽管迄今为止人们对TGF-β信号通路的研究已经有了重大进展,但还有很多重要的问题仍未解决。TGF-β1被公认为是纤维化的最强因子,但是它到底是如何诱导细胞外基质合成增加,除了现有的研究结论,还有很多功能仍需要进一步研究。Smads蛋白家族是在10年前发现的,但它在卵巢及生殖方面的作用研究相对较少。Smads蛋白如何靶向调控和干预信号通路中的各种成分以及关键环节以达到临床靶向治疗目的,以及这些Smads分子是否可以用于不孕症等问题都是未来重点关注的研究问题。
[1] 金华,丁家怡,朱庆文.颗粒细胞在未成熟卵体外培养时对未成熟卵母细胞发育的影响[J].齐齐哈尔医学院学报,2006,27(3):309-310.
[2] SHULL M M,DOETSCHMAN T.Transforming growth factor-β1 in reproduction[J].Molecular Reproduction and Development,1994,39(2):239-246.
[3] 郭永红,罗金燕.TGF-β超家族与Smad信号转导研究进展[J].医学综述,2005,11(8):685-688.
[4] DIJKE P T,GOUMANS M J,ITOH F,et al.Regulation of cell proliferation by Smad proteins[J].Journal of Cellular Physiology,2002,191(1):1-16.
[5] GRÖNROOS E,KINGSTON IJ,RAMACHANDRAN A,et al. Transforming Growth Factor β inhibits Bone Morphogenetic Protein-induced transcription through novel phosphorylated Smad1/5-Smad3 complexes[J].Molecular and Cellular Biology,2012,32(14):2904-2916.
[6] 徐梦思.TGFβ-SMAD信号通路对猪颗粒细胞和繁殖性状的作用研究[D].硕士学位论文.石河子:石河子大学,2015:1-20.
[7] 赵瑛,罗玉玉,张文成.TGF-β1/Smads信号通路与eNOS在内皮细胞稳态及动脉粥样硬化发生中的作用[J].武警后勤学院学报:医学版,2013,22(6):560-563.
[8] 张勇,秦娜,于斌.TGF-β/Smads信号转导通路的研究进展[J].广西医科大学学报,2009,26(1):155-157.
[9] 高娜,吴涛.TGF-β在卵巢癌中作用的研究进展[J].大连医科大学学报,2012,34(4):409-413.
[10] LIU S J,DE BOECK M,VAN DAM H,et al.Regulation of the TGF-β pathway by deubiquitinases in cancer[J].The International Journal of Biochemistry & Cell Biology,2016,76:135-145.
[11] BORSUTZKY S,CAZAC B B,ROES J,et al.TGF-β receptor signaling is critical for mucosal IgA responses[J].Journal of Immunology,2004,173(5):3305-3309.
[12] DE CAESTECKER M.The transforming growth factor-β superfamily of receptors[J].Cytokine and Growth Factor Reviews,2004,15(1):1-11.
[13] WANG X F,LIN H Y,NG-EATON E,et al.Expression cloning and characterization of the TGF-β type III receptor[J].Cell,1991,67(4):797-805.
[14] 程敏,闻良珍.转化生长因子β及其受体与卵泡发育[J].国外医学:妇产科学分册,2001,28(5):261-264.
[15] PANGAS S A,MATZUK M M.Genetic models for transforming growth factor β superfamily signaling in ovarian follicle development[J].Molecular and Cellular Endocrinology,2004,225(1/2):83-91.
[16] 明佳.Smads蛋白家族与TGF-β的细胞内信号转导[J].国外医学:分子生物学分册,2003,25(2):89-93.
[17] 陈峰,郑敏,陈智.Smad2和Smad3在TGF-β1信号转导中的作用[J].国际流行病学传染病学杂志,2006,33(3):187-189.
[18] 陈骏,钱云良.TGF-β/Smads通路与增生性瘢痕肌成纤维细胞分化[J].中国美容医学杂志,2007,16(7):1000-1003.
[19] TOMIC D,MILLER K P,KENNY H A,et al.Ovarian follicle development requires Smad3[J].Molecular Endocrinology,2004,18(9):2224-2240.
[20] SASSEVILLE M,RITTER L J,NGUYEN T M,et al.Growth differentiation factor 9 signaling requires ERK1/2 activity in mouse granulosa and cumulus cells[J].Journal of Cell Science,2010,123(18):3166-3176.
[21] PANGAS S A,LI X H,ROBERTSON E J,et al.Premature luteinization and cumulus cell defects in ovarian-specificSmad4 knockout mice[J].Molecular Endocrinology,2006,20(6):1406-1422.
[22] 安新玲,韩金祥,王世立.骨形态发生蛋白的研究进展[J].食品与药品,2009,11(6):69-73.
[23] 王伟.BMP/Smad信号通路对猪卵泡颗粒细胞的影响[D].博士学位论文.南京.南京农业大学,2010:1-13.
[24] 王伟,王少兵,徐银学.BMP/Smad信号通路与哺乳动物卵泡发生[J].遗传,2009,31(3):245-254.
[25] ERICKSON G F,SHIMASAKI S.The spatiotemporal expression pattern of the bone morphogenetic protein family in rat ovary cell types during the estrous cycle[J].Reproductive Biology and Endocrinology,2003,1(1):9.
[26] FENG N P,WANG Z F,ZHANG Z,et al.miR-487b promotes human umbilical vein endothelial cell proliferation,migration,invasion and tube formation through regulating THBS1[J].Neuroscience Letters,2015,591:1-7.
[27] ADAMS J C,LAWLER J.The thrombospondins[J].The International Journal of Biochemistry and Cell Biology,2004,36(6):961-968.
[28] NAGANUMA H,SATOH E,KAWATAKI T,et al.Cell density regulates thrombospondin-1 production in malignant glioma cells[J].Journal of Neuro-Oncology,2003,63(2):147-153.
[29] HUGO C,DANIEL C.Thrombospondin in renal disease[J].Nephron Experimental Nephrology,2009,111(3):e61-e66.
[30] LAWLER J.Thrombospondin-1 as an endogenous inhibitor of angiogenesis and tumor growth[J].Journal of Cellular and Molecular Medicine,2002,6(1):1-12.
[31] ZHOU Z Q,CAO W H,XIE J J,et al.Expression and prognostic significance of THBS1,Cyr61 and CTGF in esophageal squamous cell carcinoma[J].BMC Cancer,2009,9(1):291.
[32] MURPHY-ULLRICH J E,POCZATEK M.Activation of latent TGF-β by thrombospondin-1:mechanisms and physiology[J].Cytokine and Growth Factor Reviews,2000,11(1/2):59-69.
[33] LAWLER J,SUNDAY M,THIBERT V,et al.Thrombospondin-1 is required for normal murine pulmonary homeostasis and its absence causes pneumonia[J].Journal of Clinical Investigation,1998,101(5):982-992.
[34] BAI C,SEN P,HOFMANN K,et al.SKP1 connects cell cycle regulators to the ubiquitin proteolysis machinery through a novel motif,the F-box[J].Cell,1996,86(2):263-274.
[35] FELDMAN R M R,CORRELL C C,KAPLAN K B,et al.A complex of Cdc4p,Skp1p,and Cdc53p/cullin catalyzes ubiquitination of the phosphorylated CDK inhibitor Sic1p[J].Cell,1997,91(2):221-230.
[36] CONNELLY C,HIETER P.Budding yeastSKP1 encodes an evolutionarily conserved kinetochore protein required for cell cycle progression[J].Cell,1996,86(2):275-285.
[37] 王宇峰.Skp1蛋白在小鼠早期胚胎发育过程中的功能研究[D].硕士学位论文.南京:南京医科大学,2008.
*Corresponding author, associate professor, E-mail: shuzhen305@163.com
(责任编辑 武海龙)
Regulation and Mechanism of Transforming Growth Factor-β1/Smads Signaling Pathway on Development of Ovaries in Mammalian
ZHOU Min1FENG Qiang2HUANG Libo1YANG Zaibin1YANG Weiren1JIANG Shuzhen1*
(1.ShandongProvincialKeyLaboratoryofAnimalBiotechnologyandDiseaseControlandPrevention,CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai’an271018,China;2.Tai’anCentralHospital,Tai’an271000,China)
The normally operation of the program within the body is depend on the coordination among different signal transduction pathways. transforming growth factor (TGF)-β1/Smads signaling pathway among numerous pathways has
increasing attention by scholars and became a research hot point in molecular and cell biology. It has been confirmed that TGF-β1/Smads signaling pathway is the indispensible way to regulate the development of ovarian follcles. In this paper, the regulatory role and mechanism of TGF-β1/Smads signaling pathway in mammalian ovarian development were reviewed in aspect of TGF-β receptor, Smads protein, bone morphogenetic protein (BMP), thrombospondin 1 (THB-S1), S-phase kinase association protein 1 (SKP1) and other regulatory mechanism. This review is aim to draw attention to the regulation of TGF-β1/Smads in ovarian development and provide some reference for the treatment of some diseases during ovarian development.[ChineseJournalofAnimalNutrition, 2017, 29(7):2283-2288]
TGF-β1/Smads; mammalian; ovarian; BMP; THB-S1; SKP1
10.3969/j.issn.1006-267x.2017.07.010
2017-01-15
国家自然科学基金项目(31572441);山东省现代农业产业技术体系生猪创新团队建设项目(SDAIT-08-04);双一流”奖补资金资助(Funds ofShandong“Double Tops” Program)
周 敏(1993—),女,山东淄博人,硕士研究生,动物营养与饲料科学专业。E-mail: 1654233314@qq.com
*通信作者:姜淑贞,副教授,硕士生导师,E-mail: shuzhen305@163.com
S811.2
A
1006-267X(2017)07-2283-06
