高脂饲粮和高碳水化合物饲粮对大鼠脂肪代谢的影响
2017-08-07王薇薇李爱科韩四海刘建学
杨 莹 王薇薇 李爱科 韩四海 刘建学*
(1.河南科技大学食品与生物工程学院,洛阳471023;2.国家粮食局科学研究院,北京100037)
高脂饲粮和高碳水化合物饲粮对大鼠脂肪代谢的影响
杨 莹1,2王薇薇2李爱科2韩四海1刘建学1*
(1.河南科技大学食品与生物工程学院,洛阳471023;2.国家粮食局科学研究院,北京100037)
本试验旨在以相同代谢能水平为基础,研究高脂饲粮和高碳水化合物饲粮对大鼠脂肪代谢的影响。选取48只8周龄雄性SD大鼠,随机分为3组,每组8个重复,每个重复2只。3个组分别饲喂高脂饲粮(HF组)、高碳水化合物饲粮(HC组)和对照饲粮(CON组),试验期9周。结果表明:1)与CON组相比,HF组、HC组大鼠的初重、末重、日增重均无显著差异(P>0.05),日采食量极显著降低(P<0.01),饲料转化效率极显著升高(P<0.01)。2)各组大鼠的Lee’s指数、肾脏指数、胃指数、脾脏指数、肝脏指数无显著差异(P>0.05)。3)与CON组和HF组相比,HC组大鼠血清甘油三酯、总胆固醇、高密度脂蛋白胆固醇含量显著或极显著升高(P<0.05或P<0.01);与HC组和CON组相比,HF组大鼠血清葡萄糖含量极显著增加(P<0.01),血清尿素氮含量极显著降低(P<0.01)。与CON组相比,HF组和HC组大鼠肝脏甘油三酯含量极显著升高(P<0.01),HF组大鼠肝脏总胆固醇含量极显著升高(P<0.01)。4)与CON组相比,HF组和HC组大鼠肝脏磷酸烯醇式丙酮酸激酶(PEPCK) mRNA表达量极显著增加(P<0.01);与CON组和HC组相比,HF组大鼠肝脏胆固醇调节元件结合蛋白1(SREBP1)mRNA表达量极显著增加(P<0.01)。综上所述,相同代谢能水平下,HF组和HC组大鼠体重无显著增加。HC组大鼠血脂升高;HF组大鼠血清葡萄糖、肝脏总胆固醇含量升高,血清尿素氮含量下降。HF组和HC组大鼠肝脏甘油三酯含量升高,且通过肝脏PEPCK和SREBP1基因表达调控途径影响脂肪代谢。
代谢能;大鼠;脂肪;肝脏;胆固醇调节元件结合蛋白1;磷酸烯醇式丙酮酸激酶
人或动物长期摄入高脂、高碳水化合物饮食或饲粮会引发肥胖,并导致引发一系列的并发症,如心血管疾病、血脂异常及代谢综合征等[1-6],孕妇长期摄入高脂、高碳水化合物饮食对后代发育也会产生不利影响[7-9]。因此,研究高脂、高碳水化合物饮食或饲粮对人或动物健康的影响具有重要意义。Semiane等[10]研究发现,高碳水化合物饲粮导致沙鼠血脂异常和肥胖等问题。Honma等[11]研究发现,高脂饲粮引起小鼠糖脂代谢紊乱。Stein等[12]和Hall等[13]研究表明,限制能量摄入能够延长人的寿命和控制体重。以上研究均是在总能水平不一致的基础上进行的研究。可见,饮食或饲粮中脂肪和碳水化合物摄入过多对体重、糖脂代谢均会产生影响,因此控制饮食或饲粮中脂肪和碳水化合物的摄入量,对治疗机体代谢紊乱和慢性疾病等有一定的作用[14]。大鼠作为为能而食的动物[15],在保证相同能量水平下研究脂肪和碳水化合物对机体的影响尤为重要。目前很多研究忽略能量水平一致的基础,有部分研究也是在总能水平一致下研究饲粮对机体的影响,而在有效能(饲粮中的能量不能完全被动物利用,其中可被动物利用的能量称为有效能)水平一致下研究脂肪和碳水化合对机体的影响更科学。因此,本研究在实际摄入代谢能水平一致的条件下,研究高脂和高碳水化合物饲粮对大鼠脂肪代谢的影响,同时采用实时荧光定量PCR技术检测大鼠肝脏胆固醇调节元件结合蛋白1(SREBP1)和磷酸烯醇式丙酮酸激酶(PEPCK)的mRNA表达量,分析相同代谢能水平上高脂和高碳水化合物饲粮对大鼠脂肪代谢的影响,这有助于人们更清楚地认识饮食中过多的油脂和碳水化合物在消化代谢水平上对机体的影响,也对人们控制体重有积极指导意义。
1 材料与方法
1.1 试验材料
主要试剂:肝脏甘油三酯(TG)检测试剂盒和总胆固醇(TC)检测试剂盒由南京建成生物工程研究所提供;RNA提取及反转录试剂盒购自宝生物(大连)有限公司;实时荧光定量PCR试剂盒由ABI公司提供。
主要仪器:SynergyTMHT酶标仪(Biotek公司,美国);Centrifuge-5810R型高速冷冻离心机(Eppendorf公司,德国);罗氏生化分析仪(Roche公司,瑞士);全自动氧弹量热仪(Parr-6300,美国);实时荧光定量PCR仪(ABI-7500,美国);全自动凝胶成像系统(BIO-RAD公司,美国)。
1.2 试验设计
试验采用48只8周龄无特定病原体(specific pathogen free,SPF)级雄性SD大鼠,体重(319.69±2.73) g,购自北京维通利华实验动物技术有限公司。预试期7 d结束后,48只SD大鼠随机分为3组,每组8个重复,每个重复2只。3个组分别饲喂高脂饲粮(HF组)、高碳水化合物饲粮(HC组)和对照饲粮(CON组)。大鼠饲粮由南通特洛菲饲料科技有限公司提供,维生素、矿物质预混料依照AIN-93G标准饲料配方设计,试验饲粮组成及营养水平见表1。
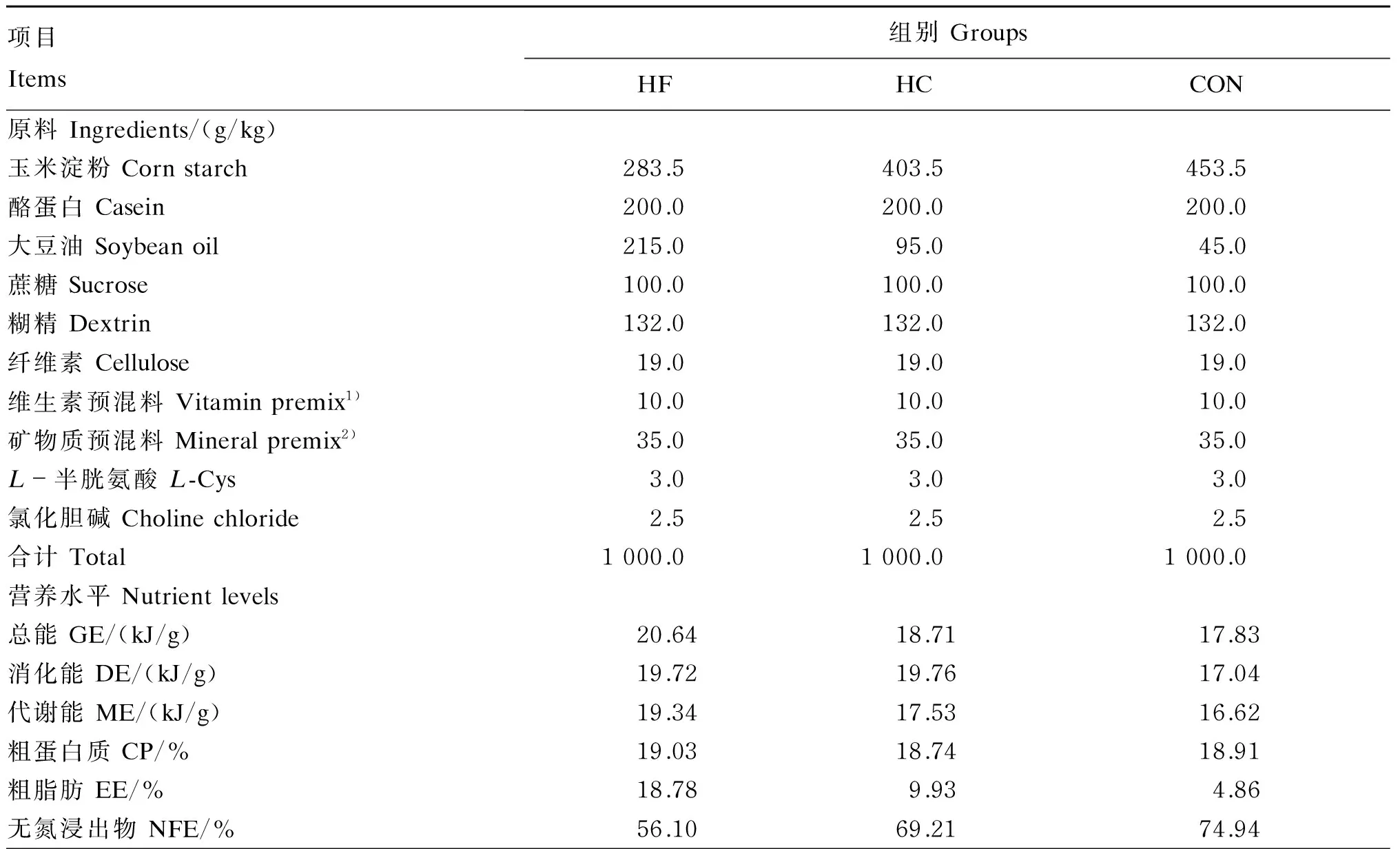
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets (air-dry basis)

续表1项目Items组别GroupsHFHCCON粗纤维CF/%2.852.601.81粗灰分Ash/%3.233.363.33
1)维生素预混料为每千克饲粮提供 The vitamin premix provided the following per kg of diets:VA 4 000 IU,VD 1 000 IU,VE 75 IU,VK 0.9 mg,VB15 mg,VB26 mg,VB330 mg,VB515 mg,VB66 mg,胆碱 choline 1 000 mg,叶酸 folic acid 2 mg,生物素 biotin 0.2 mg,VB12 0.025 mg。
2)矿物质预混料为每千克饲粮提供 The mineral premix provided the following per kg of diets:Ca 5 000 mg,P 3 000 mg,K 3 600 mg,Na 1 039 mg,Mg 513 mg,Fe 45 mg,Zn 38 mg,Mn 10 mg,Cu 6 mg,I 0.2 mg,Cr 1 mg,S 300 mg,Cl 1 631 mg。
1.3 饲养管理
大鼠饲喂于SPF级实验动物房(国家粮食局科学研究院,北京),采用独立送风笼具(individual ventilated cage,IVC)。大鼠饲养室保持温度(22±2) ℃,相对湿度50%,12 h循环日夜光照。代谢试验测定消化能和代谢能。根据代谢试验测得的代谢能,以HF组大鼠采食量为基准(采食量×表观代谢能/体重0.75),采用配对饲喂,每天同一时间饲喂保证各组大鼠代谢能(有效能)一致。试验期为9周。
1.4 试验方法
1.4.1 血清和组织样品采集
每周记录体重和采食量。试验结束时,所有大鼠禁食12 h后称重,采用二氧化碳窒息致死,心脏取血。室温静置4 h,待血清析出后,4 ℃下3 000 r/min离心10 min,分离血清,冻存于-20 ℃待测。采集血样后,测定体长(从鼻子到肛门的长度),解剖分离大鼠肾脏、胃、脾脏、肝脏和腹部脂肪。用0.90%生理盐水冲洗器官,用滤纸吸干水分,称重后计算器官指数。样品称重后迅速放液氮中冷冻,并保存于-80 ℃冰箱待测。
1.4.2 Lee’s指数和器官指数的测定
称取大鼠处死前体重,记录大鼠解剖前鼻尖到肛门的长度,按照下列公式计算Lee’s指数:
Lee’s指数=[体重(g)×103/体长(cm)]1/3。
试验结束时,测定体长和称量各组大鼠肾脏、胃、脾脏、肝脏和腹部脂肪,并按照下列公式计算器官指数:
肾脏指数(%)=100×肾脏重量/体重;
胃指数(%)=100×空胃重量/体重;
脾脏指数(%)=100×脾脏重量/体重;
肝脏指数(%)=100×肝脏重量/体重;
脂肪指数(%)=100×脂肪重量/体重。
1.4.3 能量及营养成分测定
代谢试验所用SD大鼠均为8周龄。根据饲粮分类分为3组,分别饲喂高脂饲粮、高碳水化合物饲粮和对照饲粮,每组8个重复,每个重复1只大鼠。使用大鼠专用代谢笼,饲养室保持温度(22±2) ℃,相对湿度50%,12 h循环日夜光照。试验期为7 d,前3 d适应期,后4 d正试期。每天08:00和20:00收集2次粪和尿。所用代谢笼下方设有钢丝盘,可全部收集粪便,下方有集尿瓶收集尿样。参考Kim等[16]的方法使用0.5 mol/L硫酸喷洒在收集的粪便上,以防止含氮化合物的分解和挥发,在65 ℃下干燥48 h,研磨并冷冻储存于-20 ℃冰箱。加入2 mL 0.1 mol/L盐酸溶液至尿样中,然后将其储存在4 ℃的冰箱中。
计算代谢能根据公式:
代谢能=食入饲料总能-尿能-粪能。
采用氧弹量热仪测定饲料总能、代谢试验尿能和粪能。饲料营养成分测定:粗纤维含量根据GB/T 6433—2006标准测定,使用纤维分析仪(FOSS-2010)测定;粗灰分含量根据GB/T 6438—1992标准测定,使用箱式智能电阻炉(天津中环SX2-5-12)测定;粗蛋白质含量测定根据GB/T 6432—1994标准测定,使用凯氏定氮仪(FOSS-8400)测定;粗脂肪含量测定根据GB/T 10359—2008标准测定,使用索氏抽提仪(FOSS SoxtecTM-2050)测定;水分含量按GB/T 6435—2006方法测定。
1.4.4 血清脂肪代谢指标检测
采用全自动生化分析仪检测血清中TG、TC、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、葡萄糖(GLU)和尿素氮(UN)的含量。
1.4.5 肝脏TG和TC检测
根据试剂盒提供方法,进行匀浆离心取上清,采用酶标仪测定肝脏中TG和TC含量。
1.4.6 肝脏脂肪代谢相关因子mRNA表达量
总RNA提取:采用TAKALA的RNA提取试剂盒提取肝脏总RNA,采用核酸测定仪(Eppendorf公司,德国)测定RNA浓度,1%凝胶电泳检测RNA条带是否完好,A260/A280比值介于1.8~2.0,-80 ℃保存备用。
逆转录反应:按TAKALA试剂盒说明。分别为:5×PrimeScript RT Master Mix 4 μL,总RNA 1 000 ng,加入RNase-free Water至20 μL。将各组分混匀,反应条件:37 ℃下15 min,85 ℃下5 s,反应结束cDNA保存于-20 ℃备用。
实时荧光定量PCR:参照http://www.ncbi.nlm.nih.gov提供的大鼠各基因序列,用Primer Premier 5.0软件设计磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)、胆固醇调节元件结合蛋白1(sterol regulatory element binding protein-1,SREBP1)和磷酸甘油醛脱氢酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)基因的引物,由上海生工合成,引物序列PEPCK为上游:5′-GTGATGACATTGCCTGGATG-3′,下游:5′-TTAATGGCGTTCGGATTTGT-3′;SREBP1为上游:5′-GCACAGCAACCAGAAACTCA-3′,下游:5′-TCATGCCCTCCATAGACACA-3′;GADPH为上游:5′-GGTTGTCTCCTGCGACTTCA-3′,下游:5′-TGGTCCAGGGTTTCTTACTCC-3′。
实时荧光定量PCR反应条件分别为:95 ℃预变性10 min,随后95 ℃变性15 s,60 ℃退火1 min,40个循环;最后95 ℃变性15 s,60 ℃退火1 min,95 ℃变性15 s。PCR反应体系为:cDNA 1 μL,Mix 5 μL,前引物和后引物各0.4 μL,加水至总体积10 μL。以内参基因GADPH表达量为参比,目的基因相对表达量以2-△△Ct表示。
1.5 数据统计分析
试验数据均用平均值±标准差表示,采用SAS 9.0统计软件,使用ANOVA程序进行单因子方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 高脂饲粮和高碳水化合物饲粮对大鼠体重、采食量和饲料转化效率的影响
各组大鼠在饲养过程中,生长状况良好,无死亡现象。根据代谢能一致原则每天喂养,9周试验结束。由图1可知,大鼠随着喂养时间的增长体重逐渐增加,各组之间大鼠体重均无显著差异(P>0.05)。

相同时间点,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同小写字母或无字母表示差异不显著(P>0.05)。图2同。
In the time point, with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same small letter or no letter superscripts mean no significant difference (P>0.05). The same as Fig. 2.
图1 高脂饲粮和高碳水化合物饲粮对大鼠体重的影响
Fig.1 Effects of high fat diet and high carbohydrate
diet on body weight of rats
由图2可知,第1周各组大鼠采食量无显著差异(P>0.05),第2周CON组大鼠采食量显著高于HF组(P<0.05),但与HC组相比无显著差异(P>0.05)。从第4周开始,随着喂养时间的增加,CON组采食量均极显著高于HF组和HC组(P<0.01)。

图2 高脂饲粮和高碳水化合物饲粮对 大鼠采食量的影响Fig.2 Effects of high fat diet and high carbohydrate diet on feed intake of rats
由表2可知,各组大鼠初重、末重、日增重均无显著差异(P>0.05)。CON组大鼠日采食量极显著高于HF组和HC组(P<0.01)。CON组饲料转化效率极显著低于HF组和HC组(P<0.01)。

表2 高脂饲粮和高碳水化合物饲粮对大鼠增重、采食量及饲料转化效率的影响Table 2 Effects of high fat diet and high carbohydrate diet on weight gain, feed intake and feed conversion efficiency of rats
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同小写字母或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same small letter or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 高脂饲粮和高碳水化合物饲粮对大鼠Lee’s指数、腹脂率和器官指数的影响
由表3可知,各组大鼠的Lee’s指数、肾脏指数、胃指数、脾脏指数、肝脏指数无显著差异(P>0.05)。与CON组相比,HF组腹脂率极显著增加(P<0.01),增加了42.64%。

表3 高脂饲粮和高碳水化合物饲粮对大鼠Lee’s指数、腹脂率和器官指数的影响Table 3 Effects of high fat diet and high carbohydrate diet on Lee’s index, abdomen fat percentage and organ indexes of rats %
2.3 高脂饲粮和高碳水化合物饲粮对大鼠血清生化指标的影响
由表4可知,与CON组和HF组相比,HC组大鼠血清TG含量极显著升高(P<0.01)。与HF组和CON相比,HC组大鼠血清TC含量极显著升高(P<0.01)。与HF组和CON组相比,HC组大鼠血清HDL-C含量显著升高(P<0.05)。各组之间大鼠血清LDL-C含量无显著差异(P>0.05)。与HC组和CON组相比,HF组大鼠血清GLU含
量极显著升高(P<0.01)。与HC组和CON相比,HF组大鼠血清UN含量极显著降低(P<0.01)。
2.4 高脂饲粮和高碳水化合物饲粮对大鼠肝脏脂代谢的影响
由图3和图4可知,与CON组相比,HF组和HC组大鼠肝脏TG含量极显著升高(P<0.01);与HC组和CON组相比,HF组大鼠肝脏TC含量极显著升高(P<0.01)。

表4 高脂饲粮和高碳水化合物饲粮对大鼠血清生化指标的影响Table 4 Effects of high fat diet and high carbohydrate diet on serum biochemical indexes of rats mmol/L

数据柱标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同小写字母或无字母表示差异不显著(P>0.05)。下图同。
Value columns with the different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same small letter or no letter superscripts mean no significant difference (P>0.05). The same as below.
图3 高脂饲粮和高碳水化合物饲粮对
大鼠肝脏甘油三酯含量的影响
Fig.3 Effects of high fat diet and high carbohydrate
diet on liver TG content of rats
2.5 高脂饲粮和高碳水化合物饲粮对大鼠肝脏PEPCK和SREBP1 mRNA表达量的影响
由图5和图6可知,与CON组相比,HF组和HC组大鼠肝脏PEPCKmRNA表达量极显著增加(P<0.01);与CON组和HC组相比,HF组大鼠肝脏SREBP1 mRNA表达量极显著增加(P<0.01)。
3 讨 论
本试验根据实际测得的代谢能,通过配对饲喂,保证各组大鼠每日采食有效能一致,在此基础上研究高脂饲粮和高碳水化合物饲粮对大鼠脂肪代谢的影响。根据各组大鼠每天实际采食量计算,HF组、HC组和CON组大鼠的采食量×表观代谢能/各组体重0.75分别为4.86、4.77和5.03,符合试验设计单位代谢体重下,各组大鼠摄入相同的有效能。

图4 高脂饲粮和高碳水化合物饲粮对 大鼠肝脏总胆固醇含量的影响Fig.4 Effects of high fat diet and high carbohydrate diet on liver TC content of rats
试验结果分析表明,相同有效能喂养大鼠,HF组大鼠体重有增加趋势,但与HC组、CON组大鼠相比无显著差异,而HF组、HC组大鼠日采食量极显著低于CON组。Caton等[17]报道,大鼠摄入相同能量的高脂饲粮和标准饲粮结合日常运动锻炼,发现限制高脂饲粮能量,大鼠体重显著下降。高脂饲粮导致大鼠体重增加,限制高脂饲粮能量摄入对减肥有效[18]。本试验大鼠未进行日常运动,但限制能量摄入发现大鼠体重无显著增加,这表明限制高脂饲粮和高碳水化合物饲粮能量摄入对控制体重有积极效果。虽然限制能量摄入对体重有控制作用,但会增加体脂[19-20]。本试验结果表明,HF组与HC组腹脂率分别增加了42.64%和17.26%。在有效能一致的情况下,虽然HF组和HC组肝脏指数相对CON组均有增加趋势,但无显著差异。脾脏指数、胃指数及Lee’s指数与CON组相比无显著差异,这说明保证有效能一致情况下饲喂大鼠,对大鼠器官指数影响不大。

图5 高脂饲粮和高碳水化合物饲粮对 大鼠肝脏PEPCK mRNA表达量的影响Fig.5 Effects of high fat diet and high carbohydrate diet on liver PEPCK mRNA expression of rats
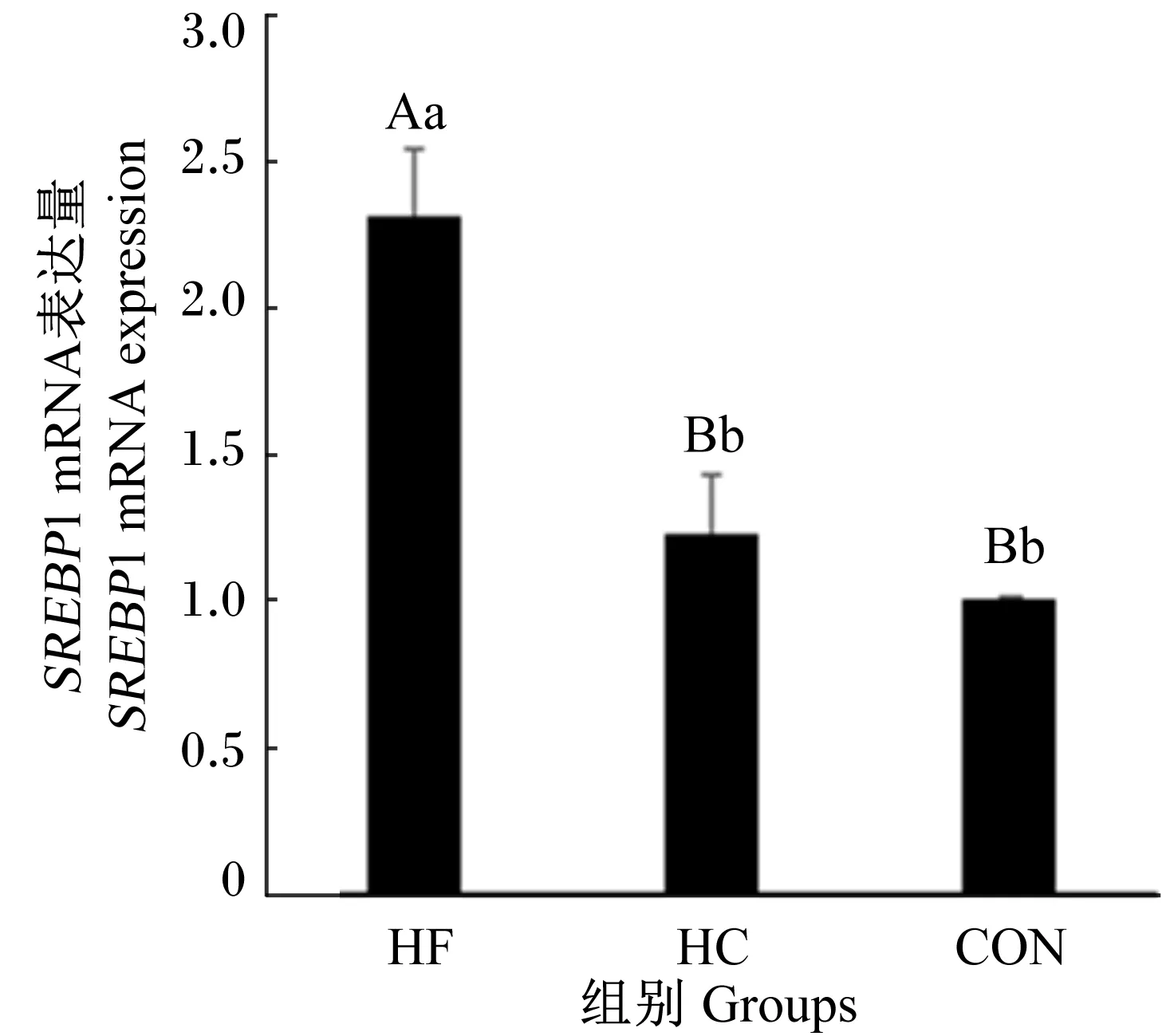
图6 高脂饲粮和高碳水化合物饲粮对 大鼠肝脏SREBP1 mRNA表达量的影响Fig.6 Effects of high fat diet and high carbohydrate diet on liver SREBP1 mRNA expression of rats
肥胖与血糖、血脂异常关系密切,这往往与摄入高脂、高碳水化合物饮食过多有关[21]。与CON组和HF组相比,HC组大鼠血清TG、TC和HDL-C含量显著或极显著升高,相比对照组分别升高了64.49%、26.18%和14.78%。这说明有效能一致限饲喂养下,高碳水化合物会导致大鼠血清TG、TC
和HDL-C含量升高。HF组、HC组和CON组大鼠血清LDL-C含量无显著差异。高脂饲粮易导致高血糖症状[22]以及血清UN含量下降[23]。相比HC组和CON组,HF组大鼠血清GLU含量极显著增加,相比CON组升高了59.28%,出现高血糖症状。HF组大鼠血清UN含量极显著低于HC组和CON组,相比CON组下降了25.09%。肝脏是脂肪代谢的重要场所,高脂高碳水化合物饲粮容易导致肝脏脂肪水平升高[24]。肝脏TC和TG含量分析显示,HF组和HC组大鼠肝脏TG、TC含量相比CON组分别升高了52.94%、35.29%和83.92%、25.76%。总之,限饲喂养下达到有效能一致,高脂和高碳水化合物饲粮会导致大鼠肝脏TG和TC含量升高。高碳水化合物饲粮会导致大鼠血清TG、TC和HDL-C含量升高,而高脂饲粮导致大鼠血清GLU含量升高。
肝脏是脂肪代谢的重要场所,脂肪代谢过程蛋白酶、转录因子等参与其中并协同一系列信号途径共同调控脂肪代谢。肝脏TG合成与GLU代谢密切相关。其中甘油由糖酵解中间产物转化而成,脂肪酸由糖氧化分解生成的乙酰辅酶A(CoA)合成。PEPCK是调节GLU生成和脂肪酸代谢通路的关键信号。肝脏PEPCKmRNA表达量增加可能导致TG合成和脂肪增加[25]。SREBP1通过信号途径进行反馈调节,SREBP1在调节脂肪酸合成中起关键作用,介导肝脏脂肪生成[26-27]。高脂饲粮和高碳水化合物饲粮会上调SREBP1进而刺激肝脏脂肪合成[28]。Flavia等[29]利用高脂饲粮、高糖饲粮、高脂高糖饲粮研究发现,小鼠饲喂不同饲粮,相比高糖饲粮组,高脂饲粮组和高脂高糖饲粮组小鼠肝脏SREBP-1含量分别升高了59%和74%。本试验研究发现,有效能一致条件下喂养,高脂和高碳水化合物饲粮导致大鼠肝脏PEPCKmRNA表达量增加。相比于CON组,HF组和HC组大鼠肝脏PEPCKmRNA表达量分别增加了160%和77%。高脂和高碳水化合物饲粮导致大鼠肝脏SREBP1 mRNA表达量增加。相比于CON组,HF组和HC组大鼠肝脏SREBP1 mRNA表达量分别增加了131%和23%。这与Fernandes-Lima等[29]研究结果一致,可能原因是高碳水化合物饲粮不会对SREBP-1 mRNA表达量产生影响。
4 结 论
① 在相同代谢能水平下,高脂饲粮和高碳水化合物饲粮对大鼠体重无显著影响。
② 高脂饲粮能提高大鼠血清GLU含量,高碳水化合物饲粮能提高大鼠血清TG、TC、HDL-C含量。
③ 高脂饲粮和高碳水化合物饲粮会上调肝脏脂肪代谢相关基因SREBP1和PEPCK的表达,从而增加肝脏脂肪积累。
[1] LA FLEUR S E,LUIJENDIJK M C M,VAN DER ZWAAL E M,et al.The snacking rat as model of human obesity:effects of a free-choice high-fat high-sugar diet on meal patterns[J].International Journal of Obesity,2014,38(5):643-649.
[2] SONG X L,KESTIN M,SCHWARZ Y,et al.A low-fat high-carbohydrate diet reduces plasma total adiponectin concentrations compared to a moderate-fat diet with no impact on biomarkers of systemic inflammation in a randomized controlled feeding study[J].European Journal of Nutrition,2015:55(1):237-246.
[3] SCHAEFER E J,RD J A G M,DANSINGER M L.The effects of low-fat,high-carbohydrate diets on plasma lipoproteins,weight loss,and heart disease risk reduction[J].Current Atherosclerosis Reports,2005,7(6):421-427.
[4] POUDYAL H,KUMAR S A,IYER A,et al.Responses to oleic,linoleic and α-linolenic acids in high-carbohydrate,high-fat diet-induced metabolic syndrome in rats[J].The Journal of Nutritional Biochemistry,2013,24(7):1381-1392.
[5] POUDYAL H,PANCHAL S K,WARD L C,et al.Effects of ALA,EPA and DHA in high-carbohydrate,high-fat diet-induced metabolic syndrome in rats[J].The Journal of Nutritional Biochemistry,2013,24(6):1041-1052.
[6] PANCHAL S K,WARD L,BROWN L.Ellagic acid attenuates high-carbohydrate,high-fat diet-induced metabolic syndrome in rats[J].European Journal of Nutrition,2013,52(2):559-568.
[7] KRUEGER R,DERNO M,GOERS S,et al.Higher body fatness in intrauterine growth retarded juvenile pigs is associated with lower fat and higher carbohydrate oxidation during ad libitum and restricted feeding[J].European Journal of Nutrition,2014,53(2):583-597.
[8] GUBERMAN C,JELLYMAN J K,HAN G,et al.Maternal high-fat diet programs rat offspring hypertension and activates the adipose renin-angiotensin system[J].American Journal of Obstetrics and Gynecology,2013,209(3): 262.e1-262.e8.
[10] SEMIANE N,FOUFELLE F,FERRÉ P,et al.High carbohydrate diet induces nonalcoholic steato-hepatitis (NASH) in a desert gerbil[J].Comptes Rendus Biologies,2016,340(1):26-36.
[11] HONMA K,HIKOSAKA M,MOCHIZUKI K,et al.Loss of circadian rhythm of circulating insulin concentration induced by high-fat diet intake is associated with disrupted rhythmic expression of circadian clock genes in the liver[J].Metabolism,2016,65(4):482-491.
[12] STEIN P K,SOARE A,MEYER T E,et al.Caloric restriction may reverse age-related autonomic decline in humans[J].Aging Cell,2012,11(4):644-650.
[13] HALL K,BEMIS T,BRYCHTA R,et al.Calorie for calorie,dietary fat restriction results in more body fat loss than carbohydrate restriction in people with obesity[J].Cell Metabolism,2015,22(3):427-436.
[14] BREHM B J,SEELEY R J,DANIELS S R,et al.A randomized trial comparing a very low carbohydrate diet and a calorie-restricted low fat diet on body weight and cardiovascular risk factors in healthy women[J].The Journal of Clinical Endocrinology & Metabolism,2003,88(4):1617-1623.
[15] National Research Council (US) Subcommittee On Laboratory Animal Nutrition.Nutrient Requirements of laboratory animals[M].4th rev ed.Washington,D.C.:National Academies Press,1995.
[16] KIM E,CHOI J,KIM H.Mabolizable energy differences between values calculated using energy conversion factors and actual values determined by metabolic study of Korean starch foods[J].Journal of Food Science,2014,79(4):H713-H718.
[17] CATON S J,BIELOHUBY M,BAI Y L,et al.Low-carbohydrate high-fat diets in combination with daily exercise in rats:effects on body weight regulation,body composition and exercise capacity[J].Physiology & Behavior,2012,106(2):185-192.
[18] SHEN C L,ZHU W B,GAO W M,et al.Energy-restricted diet benefits body composition but degrades bone integrity in middle-aged obese female rats[J].Nutrition Research,2013,33(8):668-676.
[19] MCNEEL R L,MERSMANN H J.Low-and high-carbohydrate diets:body composition differences in rats[J].Obesity Research,2005,13(10):1651-1660.
[20] CATON S J,YINGLONG B,BURGET L,et al.Low-carbohydrate high-fat diets:regulation of energy balance and body weight regain in rats[J].Obesity,2009,17(2):283-289.
[21] WANG Y,WANG P Y,QIN L Q,et al.The development of diabetes mellitus in Wistar rats kept on a high-fat/low-carbohydrate diet for long periods[J].Endocrine,2003,22(2):85-92.
[22] IBRAHIM E H,EL-AZIZ M F M A,AHMED A F,et al.Is the effect of high fat diet on lipid and carbohydrate metabolism related to inflammation[J].Mediterranean Journal of Nutrition and Metabolism,2011,4(3):203-209.
[23] HUANG D W,CHANG W C,WU J S B,et al.Gallic acid ameliorates hyperglycemia and improves hepatic carbohydrate metabolism in rats fed a high-fructose diet[J].Nutrition Research,2015,36(2):150-160.
[24] DE OLIVEIRA M C,MENEZES-GARCIA Z,ARIFA R D D N,et al.Platelet-activating factor modulates fat storage in the liver induced by a high refined carbohydrate-containing diet[J].The Journal of Nutritional Biochemistry,2015,26(9):978-985.
[25] ZHOU D,WANG H,CUI H M,et al.Early-life exposure to high-fat diet may predispose rats to gender-specific hepatic fat accumulation by programmingPepckexpression[J].The Journal of Nutritional Biochemistry,2014,26(5):433-440.
[26] NAOWABOOT J,WANNASIRI S,PANNANGPETCH P.Morin attenuates hepatic insulin resistance in high-fat diet-induced obese mice[J].Journal of Physiology and Biochemistry,2016,72(2):269-280.
[27] POSTIC C,GIRARD J.Contribution of de novo fatty acid synthesis to hepatic steatosis and insulin resistance:lessons from genetically engineered mice[J].Journal of Clinical Investigation,2008,118(3):829-838.
[28] 任路平.高果糖、高脂饮食致小鼠脂肪肝机制的探讨[D].博士学位论文.石家庄:河北医科大学,2011.
[29] FERNANDES-LIMA F,MONTE T L R G,NASCIMENTO F A M,et al.Short exposure to a high-sucrose diet and the first ‘hit’ of nonalcoholic fatty liver disease in mice[J].Cells Tissues Organs,2016,201(6):464-472.
*Corresponding author, professor, E-mail: jx_liu@163.com
(责任编辑 武海龙)
Effects of High Fat Diet and High Carbohydrate Diet on Fat Metabolism of Rats
YANG Ying1,2WANG Weiwei2LI Aike2HAN Sihai1LIU Jianxue1*
(1.CollegeofFoodandBioengineering,HenanUniversityofScienceandTechnology,Luoyang471023,China;2.AcademyofStateofAdministrationofGrain,Beijing100037,China)
This experiment was conducted to investigate the effects of high fat diet and high carbohydrate diet on fat metabolism of rats under the same metabolic energy level. Forty-eight male Sprague-Dawley rats at the age of 8 weeks old were randomly divided into 3 groups with 8 replicates per group and 2 rats per replicate. Rats in the three groups were fed the high fat diet (HF group), high carbohydrate diet (HC group) and control diet (CON group), respectively. The experiment lasted for 9 weeks. The results showed as follows: 1) compared with the CON group, the body weight of rats in HF and HC groups was no significant difference (P>0.05), the daily feed intake of rats in HF and HC groups were significantly decreased (P<0.01), the feed conversion efficiency of rats in HF and HC groups were significantly increased (P<0.01). 2) There were no significant differences in Lee’s index, kidney index, stomach index, spleen index and liver index of rats among all groups (P>0.05). 3) Compared with the CON and HF groups, the contents of triglyceride, total cholesterol and high density lipoprotein cholesterol in serum of rats in HC group were significantly increased (P<0.05 orP<0.01); compared with the CON and HC groups, the serum glucose content of rats in HC group was significantly increased (P<0.01), while the serum urea nitrogen content of rats was significantly decreased (P<0.01). Compared with the CON group, the liver triglyceride content of rats in HF and HC groups was significantly increased (P<0.01), the liver total cholesterol content of rats in HF group was significantly increased (P<0.01). 4) Compared with the CON group, the liver phosphoenolpyruvate kinase (PEPCK) mRNA expression of rats in HF and HC groups was significantly increased (P<0.01); compared with the CON and HC groups, the liver sterol regulatory element binding protein 1 (SREBP1)mRNA expression of rats in HF group was significantly increased (P<0.01). In conclusion, under the same metabolic energy level, the body weight of rats in HF and HC groups is significantly increased. The blood lipid of rats in the HC group is increased, and the serum glucose and liver total cholesterol content in the HF group is increased and serum urea nitrogen content is decreased. The liver triglyceride content of rats in the HF and HC groups is increased, both through the liverPEPCKandSREBP1 gene expression regulation of fat metabolism.[ChineseJournalofAnimalNutrition, 2017, 29(7):2603-2612]
metabolism energy; rats; fat; liver; SREBP1; PEPCK
10.3969/j.issn.1006-267x.2017.07.046
2017-01-11
公益性(粮食)行业专项(201513003-8)
杨 莹(1990—),女,河南南阳人,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail: yying523@yeah.net
*通信作者:刘建学,教授,硕士生导师,E-mail: jx_liu@163.com
S816.4
A
1006-267X(2017)07-2603-10
