四川兔源金黄色葡萄球菌毒力检测及分子分型
2017-08-07向正刚张雨薇杨泽晓欧阳萍李亚军牟维豪王世震
向正刚, 耿 毅, 张雨薇, 杨泽晓, 欧阳萍, 李亚军, 牟维豪, 王世震
(四川农业大学 动物医学院, 四川 成都 611130)
四川兔源金黄色葡萄球菌毒力检测及分子分型
向正刚, 耿 毅, 张雨薇, 杨泽晓, 欧阳萍, 李亚军, 牟维豪, 王世震
(四川农业大学 动物医学院, 四川 成都 611130)
【目的】研究四川部分区域兔源金黄色葡萄球菌Staphylococcusaureus的基因型总体结构特征、遗传变异以及毒力因子的分布情况。【方法】从四川地区分离41株兔源金黄色葡萄球菌,鉴定femB基因特异性, 进行耐甲氧西林金黄色葡萄球菌(Methicillin-resistantS.aureus, MRSA)筛选,并通过PCR法检测13种常见的毒力基因,采用多位点序列分型(Multilocus sequence typing,MLST)和脉冲场凝胶电泳(Pulsed field gel electrophoresis,PFGE)确定基因型特征。【结果】41株金黄色葡萄球菌中共检测出MRSA 31株,检出率为75.61%;共检出9种毒力基因,其中nuc、hla、eta和clfA在所有菌株中均存在,而sea、sec、see、hlb和PVL的阳性检出率分别为9.7%、85.4%、80.5%、90.2%和7.3%。MLST 分型结果显示,41株金黄色葡萄球菌只存在2种序列型(ST398、ST3320)和1个克隆群CC398,其中ST398为优势序列型,所占比例为97.6%。PFGE将41株金黄色葡萄球菌分为18个基因型,但不同区域间的基因型条带差异较小。【结论】四川调查区域兔源金黄色葡萄球菌毒力因子携带率较高,其对家兔的养殖业存在较大的安全威胁; 分型分析说明四川部分区域金黄色葡萄球菌的主要流行菌株遗传变异程度小,菌株间亲缘关系较近。
金黄色葡萄球菌; 家兔; 毒力基因; 多位点序列分型; 脉冲场凝胶电泳; 基因分型
金黄色葡萄球菌Staphylococcusaureus属于葡萄球菌属,在全球范围广泛存在,是重要的人兽共患病原菌[1]。它不仅能感染人类引起化脓性关节炎、坏死性肺炎和败血症等,引起死亡[2],在养殖业上还能感染家兔[3]、鸡[4]和牛[5]等多种动物。自1961年耐甲氧西林金黄色葡萄球菌(Methicillin-resistantS.aureus, MRSA)首次被鉴定以来[6],MRSA对几乎所有β-内酰胺类抗生素高度耐药,导致该病的控制更加困难[7],而金黄色葡萄球菌致病力强弱与其产生的毒素及侵袭性酶密切相关,如肠毒素、中毒休克综合症毒素和粘附因子等[8]。这些毒力因子在金黄色葡萄球菌感染致病过程中起着重要作用。
金黄色葡萄球菌的分子分型有助于了解其流行病学特征,鉴定主要流行菌株的分子特征,对控制克隆株的传播具有重要的意义。目前常用的金黄色葡萄球菌分子分型的方法有SCCmec分型[9]、多位点序列分型(Multilocus sequence typing,MLST)[10]和脉冲场凝胶电泳(Pulsed field gel electrophoresis,PFGE)[11]等。其中,MLST分型是基于金黄色葡萄球菌的7个管家基因扩增测序[12],并在MLST网络数据库进行序列比对,该方法的试验数据便于保存,可用于大规模和长期的流行病学监控。PFGE基因分型主要是基于金黄色葡萄球菌DNA的原位酶切,可用于分析菌株之间遗传相关性[13]。本研究在检测金黄色葡萄球菌常见的13种毒力因子的基础上,结合MLST和PFGE基因分型方法鉴定41株兔源金黄色葡萄球菌的基因型特征,为金黄色葡萄球菌疾病的传播和防治提供理论依据。
1 材料与方法
1.1 菌株
41株兔源金黄色葡萄球菌分离自四川成都、乐山、德阳、自贡、眉山和南充等规模化兔场,2014—2016年采集的脓液样本由四川农业大学兽医病理学实验室保存。成都菌株编号为A01~A04,乐山菌株编号为N01~N05,德阳菌株编号为G01~G04,自贡菌株编号为D01~D15,眉山菌株编号为H01~H03,南充菌株编号为Y01~Y10。
1.2 试剂与仪器
细菌DNA抽提试剂盒购自天根生化科技(北京)有限公司;溶菌酶购自生工生物工程(上海)股份有限公司;SmaI限制性内切酶和蛋白酶K购自大连TaKaRa公司; GelDoc2000凝胶成像分析系统、Pulsed Field Certified Agarose和CHEF Mapper XA 系统均购自 Bio-Rad公司。
1.3 菌株复苏、特异性鉴定与MRSA筛选
取-80 ℃冻存菌株接种于LB固体培养基,37 ℃恒温培养24 h后观察其菌落形态,并革兰染色镜检;进一步对菌株进行PCR特异性鉴定及MRSA的筛选,MRSA筛选之后剩余的菌株则为甲氧西林敏感金黄色葡萄球菌(MethicillinsensitiveS.aureus,MSSA)。参考文献[14]中金黄色葡萄球菌特异性基因femB和β-内酰胺类药物的耐药基因mecA的引物序列,并送成都擎科梓熙生物技术有限公司进行合成,预期扩增目的片段长度分别为651和533 bp。PCR反应体系为:PCR Master Mix(2×)12.5 μL、10 μmol·L-1的上下游引物各1 μL, DNA模板2 μL,ddH2O 8.5 μL,共25 μL。循环参数为95 ℃ 5 min; 95 ℃ 30 s,47 ℃ 30 s,72 ℃ 1 min,循环30次; 72 ℃ 10 min。PCR扩增产物经15 g·L-1琼脂糖凝胶、120 V电泳15 min鉴定。
1.4 毒力因子检测
参考Jarraud等[15]和Peacock等[16]报道文献中金黄色葡萄球菌的毒力因子,选取13个常见的毒力基因进行PCR检测:肠毒素基因(sea、seb、sec、sed、see),溶血素基因(hla、hlb),中毒休克综合征毒素基因TSST-1,表皮剥脱素基因(eta、etb),黏附素基因clfA,侵袭毒素基因nuc,杀白细胞素基因PVL。具体引物序列及扩增条件参照文献[15-16]进行,引物送苏州金唯智生物科技有限公司合成。PCR扩增产物经15 g·L-1琼脂糖凝胶、120 V电泳15 min后观察结果。
1.5 多位点序列分型(MLST)
选取金黄色葡萄球菌的7个管家基因(arcC、aroE、glpF、gmk、pta、tpi、yqi)进行PCR扩增,引物序列登录金黄色葡萄球菌多位点序列分型网络数据库(http://pubmlst.org/saureus/info/primers.shtml)下载,并由成都擎科梓熙生物技术有限公司合成。PCR反应体系为:PCR Master Mix(2×)12.5 μL,10 μmol· L-1的上下游引物各1 μL,DNA模板2 μL, ddH2O 8.5 μL, 共25 μL。循环参数为95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循环30次;72 ℃ 5 min。PCR扩增产物送成都擎科梓熙生物技术有限公司测序。测序结果在http://pubmlst.org/网站进行比对,获得等位基因编号和序列号(Sequence type, ST),并通过eBURST软件进行克隆群(Clonal complex,CC)的划分与分析。
1.6 脉冲场凝胶电泳(PFGE)及聚类分析
[17]中的方法,首先用细胞悬浊液CSB(100 mmol·L-1Tris-HCl、100 mmol·L-1EDTA,pH 8.0)冲洗并收集菌体,制成细菌悬浊液;接着用10 mg·mL-1的溶菌酶、 20 mg·mL-1的蛋白酶K和1 mg·mL-1的溶葡萄球菌素酶消化细菌;并将细菌悬浊液与凝胶溶液等体积混合制成胶块。细菌基因组DNA用50 U的SmaI限制性内切酶进行酶切,在CHEF Mapper XA进行电泳,电泳程序:电泳时间为16 h,电压为6 V,电泳夹角为120°,脉冲时间为4~40 s,电泳温度14 ℃。电泳后用GoldView核酸染色剂对电泳胶进行染色,并在凝胶成像系统中成像。最后图片由Quantity One 4.6.2软件进行基因差异性分析,采用非加权组平均法对PFGE图像进行聚类,用相似性系数衡量PFGE带型的相似程度[18]。
2 结果与分析
2.1 菌株特异性鉴定及MRSA筛选
41株兔源金黄色葡萄球菌在LB固体培养基上37 ℃恒温培养24 h后,均形成表面光滑、厚、圆形隆起、湿润、边缘整齐的菌落。革兰染色镜检为球形,成对或形成像葡萄状成串的G+菌。41株分离菌femB基因特异性PCR鉴定结果显示均可扩增出长度约为651 bp的特异性条带(图1),结合形态学与PCR检测结果表明41株菌株均为金黄色葡萄球菌。同时,mecA基因扩增结果显示,41株金黄色葡萄球菌中共31耐药基因mecA阳性,确认为耐甲氧西林金黄色葡萄球菌(MRSA),检出率为75.61%。

M:DL2000 Marker:1:A01;2:G01;3:H01;4:D15;5:Y09;6:N04;7:阴性对照。
图1 部分代表菌株的femB基因PCR扩增结果
Fig.1 PCR amplication offemBgene of partial representative strains
2.2 毒力基因检测结果
对41株兔源金黄色葡萄球菌毒力基因的PCR检测结果显示(表1),此次试验共检测出nuc、sea、sec、see、hla、hlb、PVL、eta、clfA9种毒力基因,但seb、sed、TSST-1和etb基因未检测出。且结果显示,nuc、eta、clfA和hla在MSSA和MRSA菌株中的阳性检出率相同,均为100.0%。sea、sec、see、hlb和PVL在MSSA菌株的阳性检出率分别为20.0%、90.0%、80.0%、100.0%和20.0%,在MRSA菌株的阳性检出率分别为6.5%、83.9%、80.6%、87.1%和3.2%,在41株菌株的阳性检出率共计分别为9.7%、85.4%、80.5%、90.2%和7.3%。可以看出MSSA菌株保持了相当高的毒力,而MRSA菌株的毒力稍弱。绝大部分菌株(90.2%)均同时携带2种溶血素基因(hla、hlb)。其中自贡和乐山的菌株毒力基因检出的种类最多,共9种;而南充、德阳、成都和眉山的菌株检测出的毒力基因有7种。
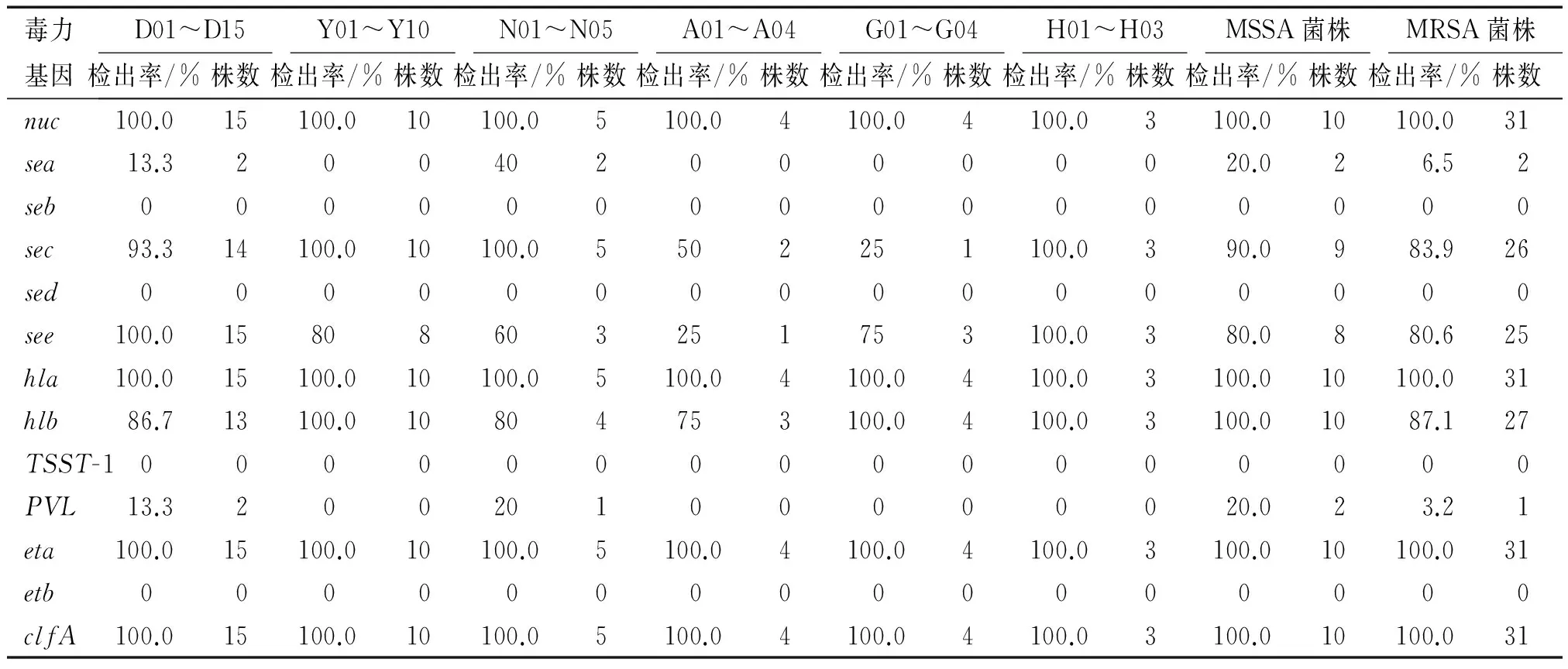
表1 兔源金黄色葡萄球菌毒力基因的检测结果1)Tab.1 PCR detection of virulence genes of Staphylococcus aureus isolated from rabbit
1)检出率:指阳性检出率,株数:指革兰染色阳性的菌株数;菌株D01~D15来源于自贡,Y01~Y10来源于南充,N01~N05来源于乐山,A01~A04来源于成都,G01~G04来源于德阳,H01~H03来源于眉山。
2.3 MLST分析
如表2和图2所示,41株金黄色葡萄球菌只存在2种序列型(ST398、ST3320)和1个克隆群CC398。其中ST3320是ST398的克隆衍生物, ST3320和ST398有单一位点的差异。ST398为本次试验菌株中的优势序列型,占97.6%。只有分离自乐山的N04菌株为ST3320,其余区域的菌株序列型均相同,为ST398。其中10株MSSA菌株均属于序列型ST398,31株MRSA菌株中30株属于序列型ST398,只有1株为序列型ST3320。但MSSA菌株和MRSA菌株均同属于1个克隆群CC398。
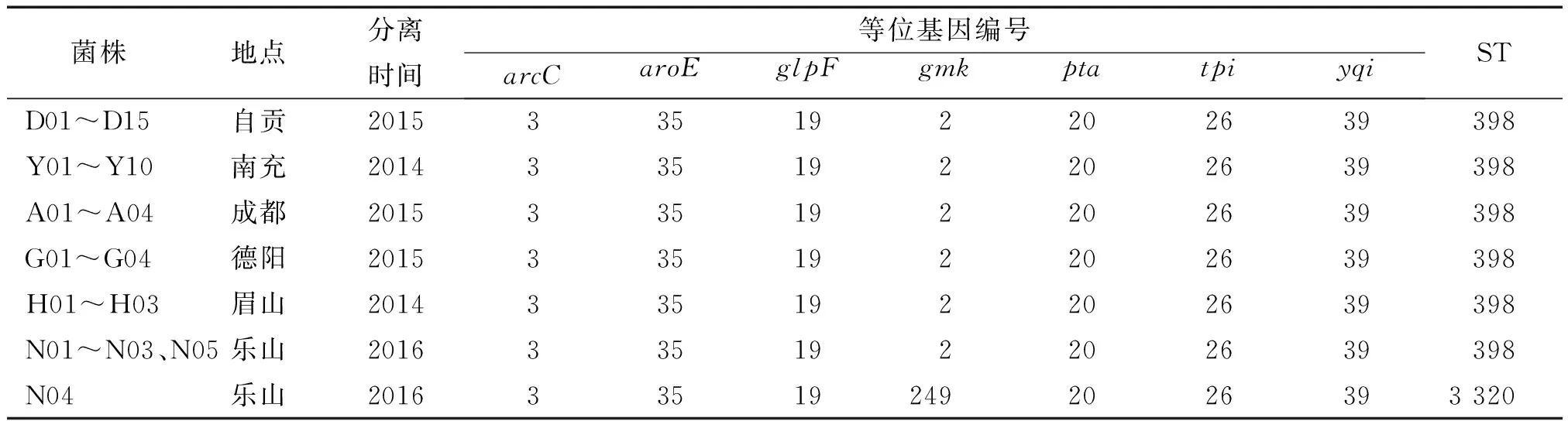
表2 金黄色葡萄球菌基本信息、等位基因编号及序列号Tab.2 Basic information, allele numbers and sequence types of Staphylococcus aureus strains
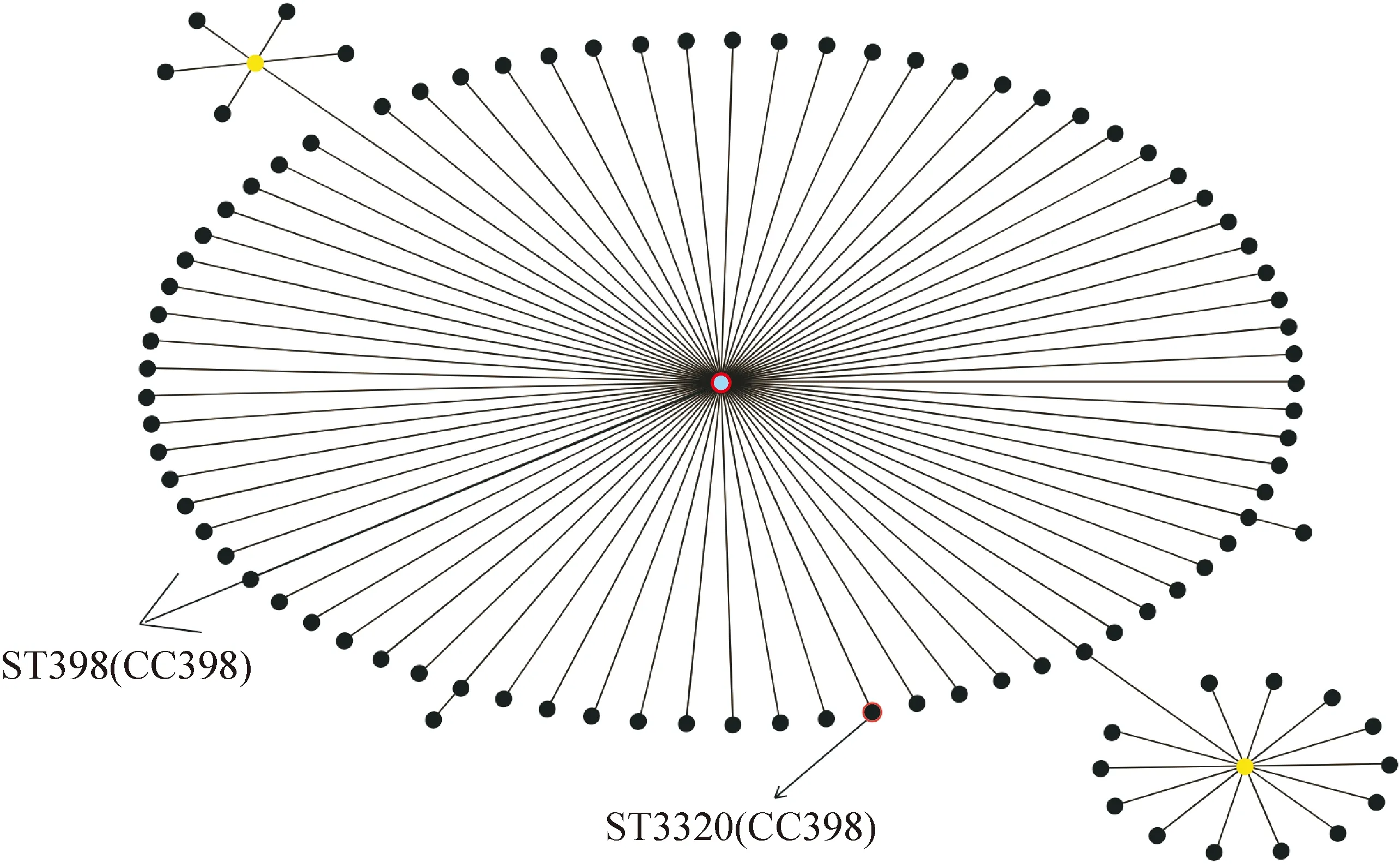
每个ST用1个圆点表示; 位于聚类中心的圆点是主要的创建者(蓝色)或者子群创建者(黄色); 红色的圆圈表明此ST是在本次试验菌株中发现的,且用箭头标记。
图2 金黄色葡萄球菌eBRUST图
Fig.2 eBURST diagram ofStaphylococcusaureuspopulation
2.4 PFGE分型分析
41株兔源金黄色葡萄球菌聚类分18个PFGE带型(图3)。其中有8个带型是只包含单一菌株的谱型(Cluster B、E、G、I、J、K、N、Q),其余带型均以77%以上的相似性聚类。有8个带型中包含的金黄色葡萄球菌分离来自四川不同区域(Cluster D、F、H、L、M、O、P、R)。只有Cluster A和Cluster C含有的菌株均分离于同一区域(自贡)。由图3可以看出在相似性聚类上,只有Cluster O、P同时包含MSSA菌株和MRSA菌株。
3 讨论与结论
金黄色葡萄球菌是引起人类和动物感染疾病的重要病原菌之一,可产生多种致病因子,现共检测出了超过30种以上的毒力因子,主要是在侵袭组织、逃避宿主免疫等方面起着重要作用[19],但不同菌株所携带的毒力因子存在一定的差异。本研究通过PCR检测13种金黄色葡萄球菌常见的毒力基因的分布情况。结果显示,nuc、hla、eta和clfA在所有菌株中均存在,而除了seb、sed、TSST-1和etb之外,sea、sec、see、hlb和PVL均有不同程度的检出,其阳性检出率分别为9.7%、85.4%、80.5%、90.2%和7.3%。而MSSA菌株的毒力因子阳性检出率要略高于MRSA菌株,可以看出相较之下MSSA菌株保持了较高的毒力,MRSA菌株的毒力则较弱,这与陆军等[20]报道的不同来源金黄色葡萄球菌毒力基因的携带情况相似。所有检测菌株至少携带7种以上的毒力因子,其中溶血素是金黄色葡萄球菌的主要毒力因子之一,有报道称人源金黄色葡萄球菌主要产α溶血素,而从动物分离的金黄色葡萄球菌主要产β溶血素[21]。但本试验中,所有兔源金黄色葡萄球菌均存在α溶血因子,部分菌株同时携带α和β溶血因子,检出率为90.2%。而PVL是有lukF-PV和lukS-PV基因共同编码的一种双组份成孔蛋白,可引起皮肤坏死、毛细血管扩张、白细胞渗出等[22]。PVL基因曾被认为在金黄色葡萄球菌中的存在率不到5%[23],但PVL基因与MRSA引起的感染密切相关,PVL基因的检出率不断升高,Gillet等[24]报道人源金黄色葡萄球菌中PVL基因的检出率为9.0%,童俊等[25]报道的研究中PVL基因的检出率高达11.7%。在本研究中41株兔源金黄色葡萄球菌共检出3株PVL基因阳性菌株,检出率为7.3%,虽然其检出率较目前人源金色葡萄球菌低,但也值得我们进一步关注兔源金色葡萄球菌PVL基因的携带率是否会不断增加,从而增强金色葡萄球菌对家兔的致病风险。
在分析了41株四川部分区域兔源金黄色葡萄球菌的毒力因子分布情况的基础上,本研究进一步进行了MLST和PFGE基因分型的研究。MLST分型结果显示,41株金黄色葡萄球菌共鉴定出2种ST序列型(ST398、ST3320)和1个克隆群CC398。其中ST398为优势序列型(97.6%),且ST398为克隆群的主要创建者,而ST3320和ST398有单一位点的差异,二者只在gmk位点的基因序列存在差异,说明这2个序列型遗传关系较近。MSSA菌株只分出1种序列型ST398,而MRSA分出2种序列型ST3320和ST398,相比之下MRSA菌株表现出了克隆多样性,其中以ST398为主,占96.8%。有报道称世界大部分国家的主要流行菌株序列型为ST239,其次为ST5[26];我国大部分地区主要流行菌株序列型为ST239[27]。但也有在法国和北美ST398克隆株引起人类严重感染的报道[28-29],且ST398最初报道是分离于家畜[30],说明不同区域金黄色葡萄球菌的主要流行序列型存在差异。PFGE分型结果显示,41株四川部分区域兔源金黄色葡萄球菌都能被PFGE法分型。在PFGE基因分型中,序列型为ST398-MRSA和ST3320-MRSA的菌株可被同时聚类到Cluster R中,且分型为ST398-MSSA的菌株在聚类分析中相对较为集中,基因型差异较小。只有Cluster O、P 2个簇中同时包含了ST398-MSSA和ST398-MRSA菌株,说明四川部分地区序列型相同的金黄色葡萄球菌中耐甲氧西林金黄色葡萄球菌和甲氧西林敏感金黄色葡萄球菌的基因型差异不大。PFGE聚类分为18个基因型,其中四川地区不同区域的菌株可被划分在同一PFGE基因型中,而同一区域的菌株又可存在于不同的PFGE基因型中,且PFGE分型的各基因型条带差异较小,说明四川部分区域间金黄色葡萄球菌的遗传变异程度小,菌株间亲缘关系较近。
本研究结果表明,四川部分区域兔源金黄色葡萄球菌的毒力因子携带率较高,具有较强的致病力。分子分型发现四川地区不同区域间菌株的基因型差异小,亲缘关系较近。考虑到样本量较少,后续将在四川更多区域分离兔源金黄色葡萄球菌补充分子分型的研究信息,这对进一步了解四川地区金黄色葡萄球菌菌株的分子流行情况和基因型总体结构特征具有重要意义。
参考文献:
[1] SCHAUMBURG F, PAULY M, ANOH E, et al.Staphylococcusaureuscomplex from animals and humans in three remote African regions[J]. Clin Microbiol Infect, 2015, 21(4): 345.e1.
[2] LOWY F D.Staphylococcusaureusinfections[J]. New Engl J Med, 1998, 339(27): 2026-2027.
[3] REN S Y, GENG Y, WANG K Y, et al.Streptococcusagalactiaeinfection in domestic rabbits,Oryctolaguscuniculus[J]. Transbound Emerg Dis, 2014, 61(6): e92-e95.
[5] BREEN J E, HUDSON C D, GREEN M J, et al. Diagnosis and management of intramammary infection caused byStaphyiococcusaureusfor dairy cows and herds[J]. Cattle Pract, 2014, 21:189-197.
[6] HIRAMATSU K, HANAKI H, INO T, et al. Methicillin-resistantStaphylococcusaureusclinical strain with reduced vancomycin susceptibility[J]. J Antimicrob Chemoth, 1997, 40(1): 135-136.
[7] YOUNGJU J, YOUNSUCK K, HONG S B, et al. Effect of vancomycin plus rifampicin in the treatment of nosocomial methicillin-resistantStaphylococcusaureuspneumonia[J]. Crit Care Med, 2010, 38(1): 175-180.
[8] DZIEKIEWICZMRUGASIEWICZ M. Role of adhesion and biofilm formation byStaphyloccusaureusin bovine mastitis[J]. Med Weter, 2009, 65(2): 84-87.
[9] VALSESIA G, ROSSI M, BERTSCHY S, et al. Emergence of SCCmec type IV and SCCmec type V methicillin-resistantStaphylococcusaureuscontaining the Panton-Valentine leukocidin genes in a large academic teaching hospital in central Switzerland: External invaders or persisting circulators?[J]. J Clin Microbiol, 2010, 48(3): 720-727.
[10]MCHUGH E E. MLST analysis ofStaphylococcusaureusisolates identified in a pediatric cohort in northwest Houston[D]. Houston: The University of Texas School of Public Health, 2012.
[11]GOLDING G R, CAMPBELL J, SPREITZER D, et al. Pulsed-field gel electrophoresis ofStaphylococcusaureus[J]. Methods Mol Biol, 2015, 1301:85-93.
[12]O′HARA F P, SUAYA J A, RAY G T, et al. Spa typing and multilocus sequence typing show comparable performance in a macroepidemiologic study ofStaphylococcusaureusin the United States[J]. Microb Drug Resist, 2015, 22(1): 88-96.
[13]ALIBAYOV B, BABA-MOUSSA L, SINA H, et al.Staphylococcusaureusmobile genetic elements[J]. Mol Biol Rep, 2014, 41(8): 5005-5018.
[14]熊咏民, 莫晓燕, 陈群, 等. 聚合酶链反应检测耐甲氧西林金黄色葡萄球菌mecA和femB基因[J]. 中华微生物学和免疫学杂志, 2003, 23(6): 452.
[15]JARRAUD S, MOUGEL C, THIOULOUSE J, et al. Relationships betweenStaphylococcusaureusgenetic background, virulence factors, agr groups (alleles), and human disease[J]. Infect Immun, 2002, 70(2): 631-641.
[16]PEACOCK S J, MOORE C E, JUSTICE A, et al. Virulent combinations of adhesin and toxin genes in natural populations ofStaphylococcusaureus[J]. Infect Immun, 2002, 70(9): 4987-4996.
[17]GLASNER C, SABAT A J, DREISBACH A, et al. Rapid and high-resolution distinction of community-acquired and nosocomialStaphylococcusaureusisolates with identical pulsed-field gel electrophoresis patterns and spa types[J]. Int J Med Microbiol, 2013, 303(2): 70-75.
[18]GOMES-NEVES E, ANTUNES P, TAVARES A, et al. Salmonella cross-contamination in swine abattoirs in Portugal: Carcasses, meat and meat handlers[J]. Int J Food Microbiol, 2012, 157(1): 82-87.
[19]李建平. 奶牛乳房炎金黄色葡萄球菌脉冲场凝胶电泳分型及其主要毒力因子和耐药性的研究[D]. 杭州:浙江大学, 2009.
[20]陆军. 不同来源耐甲氧西林金黄色葡萄球菌毒力基因的研究[D]. 温州:温州医学院, 2012.
[21]王英杰. 奶牛乳腺炎金黄色葡萄球菌相关毒力因子的研究[D]. 济南:山东师范大学, 2008.
[23]PANTON P N, VALENTINE F C O. Staphylococcal toxin[J]. Lancet, 1932, 219(5662): 506-508.
[24]GILLET Y, ISSARTEL B, VANHEMS P, et al. Association betweenStaphylococcusaureusstrains carrying gene for Panton-Valentine leukocidin and highly lethal necrotising pneumonia in young immunocompetent patients[J]. Lancet, 2002, 359(9308): 753-759.
[25]童俊, 占志平. 金黄色葡萄球菌毒力基因检测及分子分型研究[J]. 中华微生物学和免疫学杂志, 2015, 35(1):46-50.
[26]WINSTEL V, LIANG C, SANCHEZ-CARBALLO P, et al. Wall teichoic acid structure governs horizontal gene transfer between major bacterial pathogens[J]. Nat Commun, 2013, 4: 2345.
[27]XIA G, CORRIGAN R M, WINSTEL V, et al. Wall teichoic acid-dependent adsorption of staphylococcal siphovirus and myovirus[J]. J Bacteriol, 2011, 193(15): 4006-4009.
[28]VALENTINDOMELIER A S, GIRARD M, BERTRAND X, et al. Methicillin-susceptible ST398Staphylococcusaureusresponsible for bloodstream infections: An emerging human-adapted subclone[J]. PLoS One, 2011, 6(12): e28369.
[29]UHLEMANN A C, PORCELLA S F, TRIVEDI S, et al. Identification of a highly transmissible animal independentStaphylococcusaureusST398 clone with distinct genomic and cell adhesion properties[J]. Mbio, 2012,3(2):203-216.
[30]DE NEELING A J, VAN DEN BROEK M J, SPALBURG E C, et al. High prevalence of methicillin resistantStaphylococcusaureusin pigs[J]. Vet Microbiol, 2007, 122(3/4): 366-372.
【责任编辑 庄 延】
Virulence detection and molecular typing of Staphylococcus aureus isolated from rabbit in Sichuan area
XIANG Zhenggang, GENG Yi, ZHANG Yuwei, YANG Zexiao, OUYANG Ping, LI Yajun, MOU Weihao, WANG Shizhen
(College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China)
【Objective】 To understand genotyping characteristics, genetic variation and the distribution of virulence factors ofStaphylococcusaureusisolated from rabbits in Sichuan area. 【Method】Forty-oneS.aureusstrains were isolated from rabbits in Sichuan area. The strains were identified forfemBgene specifity. Methicillin-resistantS.aureus(MRSA) were screened out. Thirteen common virulence genes were detected using PCR. Genotyping characteristics were studied by using multilocus sequence typing (MLST) and pulsed field gel electrophoresis (PFGE). 【Result】There were 31 MRSA strains out of 41S.aureusstrains, and the detection rate was 75.61%. Totally nine virulence genes were detected,nuc,hla,etaandclfAgenes existed in all strains, and the positive detection rates ofsea,sec,see,hlbandPVLgenes were 9.7%, 85.4%, 80.5%, 90.2% and 7.3%, respectively. MLST results showed that 41S.aureusstrains belonged to two sequence types (ST398, ST3320) and one clonal complex CC398. ST398 was the preponderant sequence type, and the proportion was 97.6%. PFGE analysis divided 41S.aureusstrains into 18 banding types, whereas strains from different regions had low variation in banding patterns.【Conclusion】S.aureusstrains isolated from rabbits in Sichuan area have high carrying rates of virulence factors, and therefore are potential security risk to rabbit farming industry. The genotyping analysis indicates that the prevalent strains ofS.aureusisolated from parts of Sichuan Province have low genetic variation, and there are close genetic relationships among different strains.
Staphylococcusaureus; rabbit; virulence gene; multilocus sequence typing; pulsed field gel electrophoresis; genotyping
2016- 10- 27 优先出版时间:2017- 06-21
向正刚(1990—),男,硕士研究生; 通信作者:耿 毅(1974—),男,教授,博士,Email: gengyisicau@126.com
四川省科技支撑计划(2016NZ0002)
S941.41
A
1001- 411X(2017)04- 0062- 07
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.s.20170621.1924.022.html
向正刚, 耿 毅, 张雨薇, 等.四川兔源金黄色葡萄球菌毒力检测及分子分型[J].华南农业大学学报,2017,38(4):62- 68.
