2017年第1季度7种猪传染病实验室监测数据分析
2017-08-07
2017年第1季度7种猪传染病实验室监测数据分析

图1 样品分布
2017年1~3月份,通过全国20个省市68个规模猪场的181份病料(肺脏、脾脏和淋巴结等组织)样品和99份(粪便或肠道组织)样品,采用PCR和RT-PCR方法对7种病毒类疾病病原如猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)、猪流行性腹泻病毒(PEDV)、传染性胃肠炎病毒(TGEV)和猪轮状病毒(PoRV)等进行检测。
通过对检测数据进行整理和统计分析得知,CSFV阳性检出率(1/159)0.63%,PRRSV阳性检出率(44/170)25.88%,PCV2阳性检出率(36/136)26.47%,PRV阳性检出率(8/147)5.44%,PEDV阳性检出率(48/99)48.48%,TGEV阳性检出率(0/93)0.00%,PoRV阳性检出率(3/88)3.41%。其中PRRSV、PCV2、PRV、PEDV、PoRV等5种病原检出率高,仍是危害规模猪场的主要病原。CSFV、TGEV检出率低,说明猪场控制得较好。2017年我国规模猪场要把PRRSV、PCV2、PRV、PEDV及PoRV等5种常见病毒类疾病病原作为防控重点,但混合感染和新毒株出现是目前疫病防控的难点,建议猪场加强疫病监测,优化防疫方案,避免防疫误区。
1 材料与方法
1.1 样品来源及分布
样品来源于全国20个省市,样品包括肺脏、脾脏和淋巴结等组织以及肠道内容物和粪便,通过调查了解猪场免疫背景和临床发病情况以及剖检典型发病猪取组织样品,-20℃冷冻送检。
1.2 主要试剂和仪器
PCR和RT-PCR扩增试剂盒、饱和酚、TaqDNA聚合酶、dNTPs、EB、DEP水、TRIZOL(总RNA抽提试剂,主要成分苯酚等)、DL2000 Marker、TaKaRaRNA PCRKit(AMV) Ver.3.0均购自宝生物工程(大连)有限公司。生物安全柜、分析天平、高速离心机、迷你掌上离心机、涡旋振荡器、PCR扩增仪、电泳仪、电泳槽、紫外凝胶成像仪、冰箱、微波炉、水浴锅、高压蒸汽灭菌锅等。
1.3 引物设计与合成
根据GenBank登陆的PRRSV、CSFV、PRV、PCV2、PEDV、TGEV、PoRV的基因序列,用Oligo6.0软件设计引物,由宝生物工程(大连)有限公司合成。引物序列见表1。
1.4 样品处理及核酸提取
按检测需求分别取肺脏、脾脏、淋巴结样品混合,对肠内容物和粪便混合用研磨器充分研磨,利用MEM营养液进行10倍稀释,然后利用DNA和RNA提取试剂盒进行核酸抽提。
1.5 病毒核酸检测
1.5.1 PRRSV、CSFV、PEDV、TGEV、PoRV的扩增 分别用BIOZOL总RNA提取试剂盒(博日公司)从病毒培养液提取总RNA为模板,采用TaKaRa One Step RNA PCR Kit(AMV)试剂盒进行RT-PCR扩增,反应条件RT:50℃ 30min,94℃ 2min;PCR:(94℃ 30s,58℃ 30s,72℃ 1min)×35个循环,72℃延伸7min,PCR产物经1.2%琼脂糖凝胶电泳鉴定。
1.5.2 PRV、PCV2的扩增 分别用天根生物科技有限公司DNA提取试剂盒,从病毒培养液提取DNA为模板,采用TaKaRa One Step DNA PCR Kit试剂盒进行PCR扩增,反应条件94℃ 2min;(94℃ 30s,55℃ 30s,72℃ 1min)×35个循环,72℃延伸10min,PCR产物经1.2%琼脂糖凝胶电泳鉴定。

表1 用于PCR和RT-PCR反应的引物
2 结果与分析

图2 2017年1~3月各常见病毒检出率统计

图3 2017年1~3月PRRSV与其他病毒混合感染变化
2.1 PCR或RT-PCR扩增结果
2.1.1 2017年第1季度(1月份、2月份、3月份)对20个省68个规模猪场送检181份肺脏、脾脏和淋巴结等组织样品与99份肠道内容物、粪便等组织样品,分别进行了PRRSV、CSFV、PRV、PCV2、PEDV、TGEV、PoRV等7种病原的检测。结果显示,CSFV(1/159)阳性检出率0.63%,PRRSV(44/170)阳性检出率25.88%,PCV2(36/136)阳性检出率26.47%,PRV(8/147)阳性检出率5.44%,PEDV(48/99)阳性检出率48.48%,TGEV(0/93)阳性检出率0.00%,PoRV(3/88)阳性检出率3.41%。7种常见感染猪的病原中PEDV、PCV2、PRRSV、PRV等4种病原检出率明显高于其他3种病原,其中TGEV检出率最低(如图2)。2.1.2 对44份检测到PRRSV阳性样品统计PRRSV单独感染和PRRSV与PCV2、PRV、PEDV等病原混合感染情况。PRRSV与PCV2的混合感染检出率40.91%,PRRSV单一检出率为59.09%。未检出与除PCV2其他病原的混合感染情况(如图3)。
2.1.3 对36份PCV2抗原阳性样品统计PCV2与PRRSV、CSFV、PRV、PEDV等病原混合感染情况,PCV2单独感染和PCV2与PRRSV、PRV、PEDV等混合感染情况。其中PCV2单一检出率占50.00%,PCV2与PRRSV混合感染检出率为50.00%(如图4)。
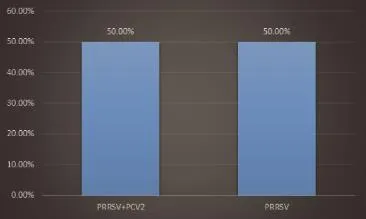
图4 2017年1~3月PCV2与其他病毒混合感染变化

图5 1季度CSFV、PRRSV、PRV、PCV2四种病毒检出率动态变化

图6 PEDV、TGEV、PoRV三种病毒检出率动态变化

图7 2017年1~3月与2016年1~3月病原阳性检出率对比
2.1.4 2017年送检样品中CSFV在第1、2、3月份检出率分别为0.00%、0.00%、1.64%,检出率均较低。PRRSV在第1、2、3月份检出率分别为58.00%、14.81%、10.61%,检出率较高,1、2、3月份呈明显下降趋势。PRV在第1、2、3月份的检出率分别为4.08%、4.55%、7.41%。PCV2在第1、2、3月份检出率分别为37.84%、15.38%、26.67%,检出率最高为1月份,其次为3月份。检出率的动态变化如图5。
2.1.5 2017年1季度送检肠道内容物和粪便中PEDV在第1、2、3月份的检出率分别为22.86%、87.10%、39.39%,检出率均较高,尤其2月份检出率明显高于1、3月份。TGEV在第1、2、3月份的检出率均为0.00%。PoRV在第1、2、3月份的检出率分别为6.25%、0.00%、3.57%,显著低于PEDV(如图6)。
2.1.6 比较2016年1~3月份与2017年1~3月份7种病原检出率的变化显示,2016年1~3月份CSFV检出率0.87%,2017年1~3月份0.63%略有下降。PRRSV检出率由2016年1~3月份的28.57%下降2017年1~3月份的25.88%。PCV2检出率由2016年1~3月的34.82%下降至26.47%。PRV的检出率由2016年1~3月份的13.64%下降为5.44%。PEDV检出率由46.07%上升至48.48%。TGEV检出率由2016年同期的4.88%下降到0.00%。PoRV检出率由2016年同期0.00%上升到3.41%(如图7)。

3 讨论
3.1 2017年1~3月份通过对68个规模猪场的181份肺脏、脾脏和淋巴结等组织样品和99份粪便或肠道组织,采用PCR和RT-PCR方法对常见7种病毒类疾病病原检测和数据统计分析得知,CSFV阳性检出率(1/159)0.63%,PRRSV阳性检出率(44/170)25.88%,PCV2阳性检出率(36/136)26.47%,PRV阳性检出率(8/147)5.44%,PEDV阳性检出率(48/99)48.48%,TGEV阳性检出率(0/93)0.00%,PoRV阳性检出率(3/88)3.41%。其中PRRSV、PCV2、PRV、PEDV、PoRV等5种病原检出率高,仍是危害规模猪场的主要病原。CSFV、TGEV两种病原检出率低,说明猪场控制得较好。
3.2 2017年1季度病原检测数据显示,虽然蓝耳病(PRRS)和圆环病毒2型 (PCV2)病原阳性检出率相比上年同期有所下降,但与其他几种疾病病原检出率相比依然较高。在病原混合感染方面,1季度只检测到蓝耳病(PRRS)和圆环病毒2型(PCV2)的混合感染,两者相互作用可使猪场保育和生长猪呼吸道疾病加重,生长猪死淘率高。猪场要重视这两种病毒的危害,科学地使用蓝耳病弱毒活疫苗与圆环病毒2型灭活苗联合免疫。
3.3 2017年1月份对保育猪慢性消瘦和呼吸道病严重病例PRRSV、PCV2检出率高,保育猪均匀度差,死淘率高;2月份对新生仔猪暴发腹泻病例PEDV检出率高,造成哺乳仔猪成活率低,损失严重。可见冬春季节交替,气温下降和昼夜温差大等环境因素,加上一些猪场由于春节期间管理松懈导致猪体抗病能力下降容易感染PRRSV、PCV2、PEDV等病原。所以1季度加强猪场保温和强化免疫等措施是预防病毒类传染病发生的关键。■
