miR-21对运动性右室心肌纤维化发生的影响
2017-08-07饶志坚常芸王世强
饶志坚常芸王世强
1国家体育总局体育科学研究所(北京 100061)2上海体育学院运动科学学院3湖南工业大学体育学院
miR-21对运动性右室心肌纤维化发生的影响
饶志坚1,2常芸1王世强3
1国家体育总局体育科学研究所(北京 100061)2上海体育学院运动科学学院3湖南工业大学体育学院
目的:研究在长期大强度运动引起的右室心肌纤维化中miR-21表达水平的变化,探讨miR-21在运动性心肌纤维化中的作用。方法:72只雄性SD大鼠,随机分为安静对照组(Sed,n=24)、中强度运动组(ME,n=24)和大强度运动组(IE,n=24),每组按照训练周期又分为8周、12周和16周,各8只。安静对照组自由活动,中强度组和大强度组分别以速度15.2 m/min、坡度5°和速度28 m/min、坡度10°的条件每天运动1 h,每周运动5天。各组最后一次运动结束24小时后,下腔静脉采血并处死,迅速分离心脏取右心室。天狼星红染色测定右心室的胶原容积分数(CVF);免疫荧光检测Ⅰ胶原蛋白(ColⅠ)的含量;RTPCR检测miR-21的表达水平。结果:12周(P<0.05,P<0.05)和16周(P<0.01,P<0.01)大强度运动后大鼠右室心肌胶原容积分数显著高于安静对照组与中强度运动组;与安静对照组和中强度运动组比,12周(P<0.01,P<0.01)和16周(P<0.01,P<0.01)大强度运动使右室Ⅰ胶原蛋白的含量显著增多。与安静对照组相比,8周、12周和16周大强度运动都可使大鼠miR-21表达水平显著升高(P<0.01、P<0.05和P<0.05),且在16周时miR-21的表达水平与Ⅰ胶原蛋白的含量正相关(r=0.443,P=0.03)。结论:长期大强度运动后右室心肌纤维化与miR-21表达水平增高有关,miR-21是潜在的运动性心肌纤维化的新生物标志物和干预靶点。
运动;右心室;纤维化;miR-21;胶原蛋白
有研究表明心肌纤维化是由于组织损伤后成纤维细胞生成过量的细胞外基质而引起的[1]。心肌纤维化是许多慢性心血管疾病的最终阶段,以白细胞浸润、心肌细胞凋亡和细胞间质中成纤维细胞增值及细胞外基质堆积为特征[2]。目前,尽管取得了一些研究进展,但心肌纤维化的具体病理生理过程还不甚明了,因而其临床干预方案极其有限。
研究证实长期大强度耐力运动可导致心肌纤维化,许多细胞和分子参与了运动性心肌纤维化的形成过程,包括促纤维化因子和促纤维化生长因子的基因表达增多,炎症细胞浸润增多及成纤维细胞的增殖等[3]。近年研究发现,microRNAs(miRNAs)参与了许多病理生理过程的调控,多种疾病的发生和发展与miR⁃NAs表达紊乱有关,如癌症、糖尿病和心血管疾病等[4]。
miRNAs是一种非编码小RNA,长度大约为22nt。它可结合到靶基因mRNA的3’-UTR,通过抑制靶基因mRNA的翻译或降解靶基因mRNA来发挥它的调控作用。大量实验数据表明病理条件下,包括心肌纤维化,miRNAs的表达水平会发生显著变化,主要包括miR-21、miR-29、miR-192和miR-200[5]。其中,研究人员对miR-21的研究兴趣越来越大,尤其是在癌症和心血管疾病方面[6]。几乎所有类型的癌症都伴随着miR-21表达水平的显著升高,miR-21可促进癌症细胞的增殖、迁移和存活,因此被认为是onco-miR[7,8]。然而,最近研究发现组织损伤后miR-21是所有发生变化的miRNAs中变化最大的,在组织修复过程中miR-21持续高表达,且miR-21参与了多种组织的纤维化过程[9-11]。已有报道[12-14]在心肌梗死和缺血再灌注诱导心肌纤维化模型中,miR-21的表达水平升高,但miR-21在运动性心肌纤维化中的表达变化还不明确。因此,本实验对此进行探索性研究。
1 材料与方法
1.1 实验对象
72只8周龄雄性SD大鼠,体重为220±8g,购自北京维通利华实验动物技术有限公司,许可证号为SCXX(京)2012-0001。所有大鼠均以啮齿类动物普通饲料喂养,饲养于国家体育总局体育科学研究所AB⁃SL-3级动物房,室温为20°C~25°C,相对湿度为55%~70%,饲养室昼夜循环为12/12(7:00~19:00)。
1.2 分组与运动方案
所有大鼠适应性喂养3天后,进行1周的适应性跑台训练,15 min/天,速度为15 m/min。随后将大鼠随机分为安静对照组(Sed,n=24)、中强度运动组(ME,n=24)和大强度运动组(IE,n=24),每组按照训练周期的长短又分为8周、12周和16周。运动强度参照Bedford方案,中强度组为:速度15.2 m/min,坡度5°(约等于58.4%±1.7%VO2max);大强度组为:坡度10°,先以15 m/min的速度跑5 min,然后在随后的5 min内逐渐增到28 m/min(约等于81.0%±3.5%VO2max),运动频率为5天/周,1次/天,1小时/次。安静对照组大鼠自由活动。
1.3 取材
各组在训练8周、12周和16周运动结束后24小时后分别进行取材,每组8只。麻醉后快速分离心脏取右心室,一部分浸入4%的多聚甲醛固定液,用于石蜡包埋进行天狼星红染色;一部分−80℃保存用于免疫荧光蛋白检测和RT-PCR。
1.4 天狼星红染色
天狼星红染色及胶原容积分数(collagen volume fraction,CVF)的计算方法参考本课题组之前的方案[15]。
1.5 免疫荧光蛋白检测
采用免疫荧光技术检测Ⅰ胶原蛋白(CollagenⅠ,ColⅠ)含量,检测方法参考本课题组之前的方案[16]。
1.6 RTT--PPCCRR检测mmiiRR--2211的表达水平
采用Trizol法提取右心室总RNA,采用TAKARA公司的Mir-X miRNA First-Strand Synthesis试剂盒,按操作说明书添加试剂,然后37℃反应60 min,之后85℃反应5 min以使酶失活。最后添加90 μl的去离子水,得到100 μl的cDNA用于后面的荧光定量。荧光定量采用TAKARA公司的SYBR Premix Ex Taq,以U6为内参,miR-21和U6分别按操作说明书添加试剂,引物信息见表1,反应条件为预变性90℃30s,PCR反应40个循环95℃5 s、60℃31 s。得到的数据采用2–ΔΔCt的方法计算miR-21的相对表达量。

表1 miR-21引物信息
1.7 数据统计与分析
所有数据用SPSS 22.0进行分析处理,数据用平均值±标准差表示,同一时间点组间比较用单因素方差分析,P<0.05有显著性差异,P<0.01有非常显著性差异。采用GraphPad Prism 6.0和SPSS作图。
2 研究结果
2.1 长期大强度运动可导致右心室心肌纤维化
天狼星红染色结果如图1所示,根据右心室天狼星红染色的结果计算胶原容积分数,结果如图2所示,长期中强度运动后右心室胶原容积分数与安静对照组相比没有显著性差异;与8周安静对照组和8周中强度运动组相比,8周大强度运动后右心室胶原容积分数有增加的趋势,但没有统计学意义(P>0.05);与12周安静对照组和12周中强度运动组相比,12周大强度运动后右心室胶原容积分数显著增加(P<0.05);与16周安静对照组和16周中强度运动组相比,16周大强度运动后右心室胶原容积分数显著增加(P<0.01)。
2.2 长期大强度运动上调Ⅰ胶原蛋白含量
各组大鼠右心室Ⅰ胶原蛋白含量如图3所示,中强度运动组与安静对照组右心室Ⅰ胶原蛋白含量没有显著差异。与8周安静对照组和8周中强度运动组相比,8周大强度运动后右心室Ⅰ胶原蛋白含量无显著差异(P>0.05);与12周安静对照组和12周中强度运动组相比,12周大强度运动后右心室Ⅰ胶原蛋白含量显著增加(P<0.01);与16周安静对照组和16周中强度运动组相比,16周大强度运动后右心室Ⅰ胶原蛋白含量显著增加(P<0.01)。
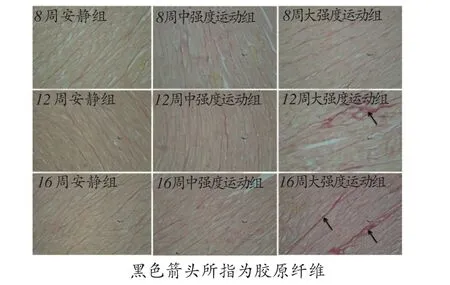
图1 各组大鼠右心室天狼星红染色结果(×400)
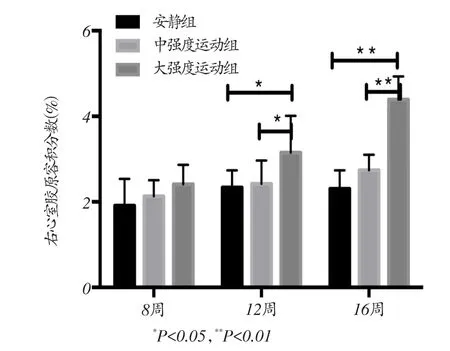
图2 各组大鼠右心室胶原容积分数
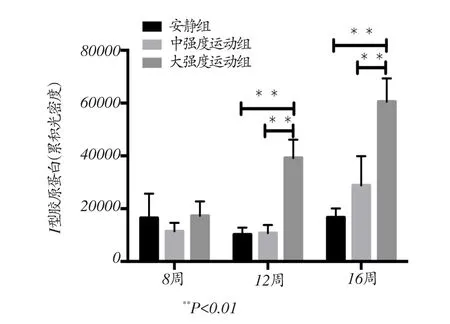
图3 各组大鼠右心室Ⅰ胶原蛋白含量
2.3 长期大强度运动促使右室mmiiRR--2211表达水平升高
各组大鼠右心室miR-21的相对表达水平如图4所示,中强度组与安静对照组右心室miR-21表达水平没有显著差异(P>0.05);与安静对照组相比,8周、12周和16周大强度运动后右心室miR-21的表达水平显著升高(P<0.01、P<0.05和P<0.05)。
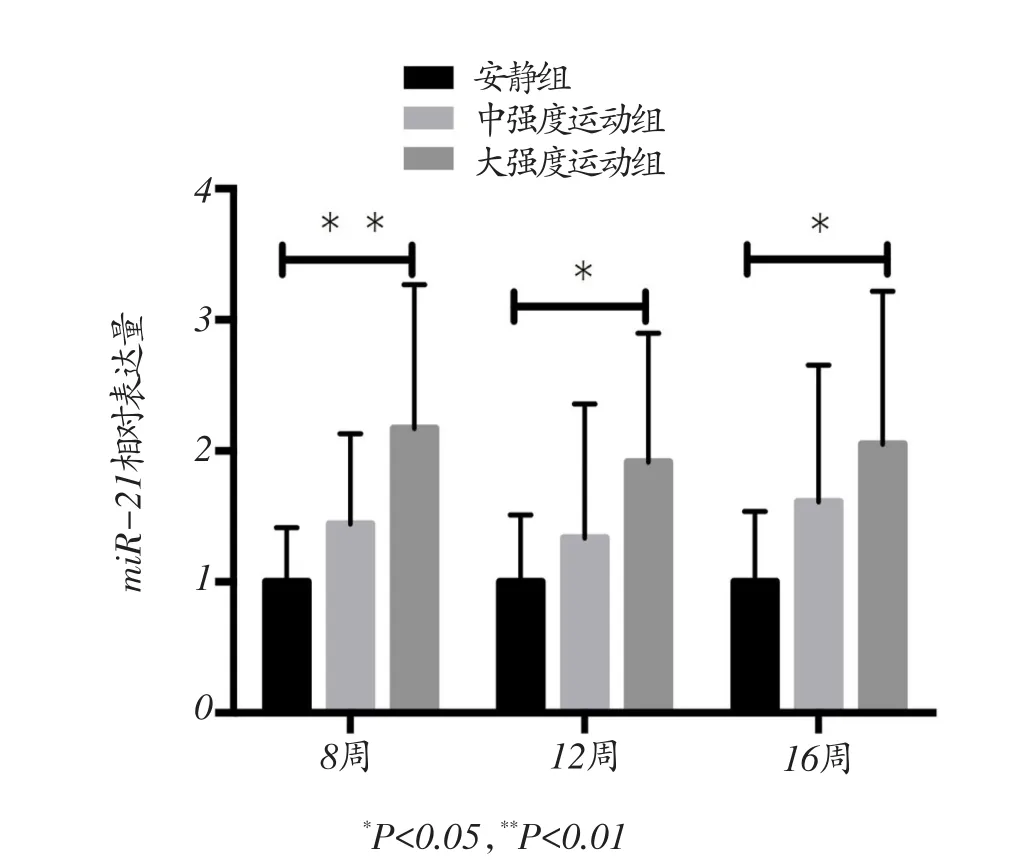
图4 miR-21的相对表达量
2.4 右室mmiiRR--2211表达水平与CCoollⅠ含量呈正相关
分析miR-21的表达水平与ColⅠ含量的相关性发现,16周时miR-21的表达水平与ColⅠ含量正相关(图5,r=0.443,P=0.03)。
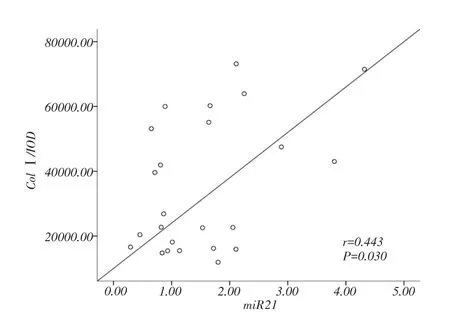
图5 16周大鼠右心室miR-21相对表达量与Ⅰ型胶原蛋白含量的相关性
3 分析与讨论
运动性心肌纤维化是指长期大强度运动导致的心脏细胞外基质过度堆积,其发生机制仍不清楚,La Gerche等[17]认为可能是由大强度运动时心脏血液动力负荷急剧增加引起的。运动性心肌纤维化主要发生在耐力和超耐力运动员身上,尤其是老耐力运动员[18]。
心肌纤维化是一种不良的心肌重塑,可降低心脏的顺应性,轻则影响心脏的正常功能,重则诱发心律失常、导致心力衰竭或心源性猝死[19]。在心肌梗死和高血压所致心肌纤维化的动物模型中已经证实,纤维化的发生与发展需要满足以下几点条件[20]:(1)基质金属蛋白酶(MMP)上调诱导细胞外基质合成增多,基质金属蛋白酶抑制因子(TIMP)下调使细胞外基质降解减少;(2)促纤维化因子的刺激,如转化生长因子β1(TGFβ1)、α-平滑肌肌动蛋白(α-SMA)、血小板源生长因子等;(3)成纤维细胞转化为肌成纤维细胞,肌成纤维细胞可分泌α-SMA;(4)内皮细胞的募集,以实现内皮细胞间充质转化,生成的细胞仍可表达内皮细胞标志物但获得成纤维细胞样特性。此外,固有和获得性免疫反应在纤维化发生和发展过程中也发挥重要作用[21]。
在运动性心肌纤维化动物模型中也有实验数据证实[22],大鼠经16周大强度运动后,TGFβ1通过调节MMP/TIMP表达上调Ⅰ胶原蛋白的含量,最终导致心肌纤维化,但4周和8周的大强度运动并未引起心肌纤维化。本研究在此基础上增加12周大强度运动组,并增加中强度运动对照组,结果显示,8周大强度运动后右心室胶原容积分数有增加的趋势,12周和16周大强度运动后胶原容积分数显著增加,但中强度运动不会引起胶原容积分数的变化;Ⅰ胶原蛋白含量的变化与胶原容积分数的变化一致。此外,也有实验证据表明TNF-α是运动性心肌纤维化发生过程中的核心调节因子之一,它可通过P38和NFκB信号通路激活成纤维细胞[23]。表明运动性心肌纤维化模型和心肌梗死及高血压心肌纤维化模型病理过程具有一定的相似性。
尽管TGFβ1已经被证实是纤维化过程中的核心调节因子,但是以TGFβ1为靶点的治疗方案并没有取得理想的效果,因而研究人员一直在探索治疗纤维化的有效方法。miR-21是参与人类癌症发生和发展过程的主要miRNAs之一[24],TGFβ1可上调miR-21的表达[25,26],而在肝脏[10]、肾脏[9]、心脏[27]、肺[11]等器官中都可检测到miR-21的表达。因此,miR-21可能参与了TGFβ1诱导的这些器官的纤维化过程,是潜在的治疗纤维化的靶点。Thum等[28]发现,伴随心肌纤维化的心衰小鼠心脏成纤维细胞miR-21表达水平显著升高,而抑制miR-21的表达则可防止心肌纤维化的出现且心功能得到改善。他们还发现miR-21的促纤维化效果似乎主要针对成纤维细胞,而对心肌细胞的作用并不是很大[28]。然而随后大量研究[6,29,30]发现,miR-21对不同细胞有特异性的效果,不仅对成纤维细胞,还包括心肌细胞、血管内皮细胞和炎症细胞(表2)。此后,大量研究[31-34]在其他器官如肾脏、肝脏和肺纤维化过程中也发现,纤维化的出现伴随miR-21表达水平的升高,抑制miR-21的表达可减轻纤维化程度,而用miR-21质粒干预则可加剧纤维化程度。表明miR-21是多种病因导致器官纤维化的关键因子。本研究发现8周、12周和16周大强度运动都可以引起右心室miR-21表达升高,且与右心室胶原容积分数和Ⅰ型胶原蛋白的含量正相关。值得注意的是,虽然在8周和12周大强度运动后右心室并未出现心肌纤维化,但miR-21的表达水平却显著升高,提示miR-21的表达水平可作为运动性右心室心肌纤维化的生物标志物之一。当然,miR-21并不是运动性右室纤维化的特异性生物标志物,因为在其他器官纤维化过程中miR-21的表达水平也显著升高,包括肝脏[35]、肾脏[36]和肺[37,38]。
鉴于miR-21在纤维化过程中发挥了重要作用,研究人员对miR-21促进不同器官纤维化的机制进行了探索。目前实验证实纤维化发生过程中TGFβ1是miR-21的上游调节因子,而TGFβ1主要通过Smads蛋白来调节miR-21的表达[39]。Zhong等[32]研究发现TGFβ 1通过Smad3来上调miR-21的表达,敲除Smad3则可防止miR-21的上调和肾纤维化的出现。此外,可负向调控TGFβ1通路的TGFβRⅢ[40]和Smad7[41]在器官纤维化过程中表达量下降,而通过基因或药物的方法增加两种蛋白的表达量,则可减轻器官纤维化程度。相比miR-21比较单一的上游调节因子,其下游靶基因则较多(表2),主要包括PTEN、SPRY-1、PDCD4、DDAH-1和Bcl-2。PTEN是细胞周期、细胞运动和凋亡的关键调节因子[42],在正常修复过程中,细胞外基质收缩导致PTEN上调,可抑制Akt/PI3K通路并促发成纤维细胞凋亡、终止修复反应。在纤维化过程中PTEN的表达下降,Akt/PI3K通路上调,因此成纤维细胞增殖、存活,最终形成纤维化[43]。Zanotti等[44]发现成纤维细胞PTEN下调和Akt/PI3K的激活与miR-21的上调有关;若沉默miR-21则可恢复PTEN的表达及降低Akt/PI3K的激活,并减少Ⅰ型胶原蛋白的含量。SPRY-1在心衰过程中表达减少,导致ERK信号通路上调,进而促进成纤维细胞的存活和间质纤维化[28]。Adam等人发现,心房纤维化过程中miR-21上调导致SPRY-1下降;而Zanotti等人[44]证实抑制miR-21的表达可上调SPRY-1的表达水平。PDCD4是miR-21的另一个靶基因,它参与炎症反应和细胞凋亡过程[45]。Sheedy等[46]发现miR-21可通过抑制PDCD4的表达来促进抗炎因子IL-10的表达;Cheng等[47]也发现miR-21的表达与PDCD4的表达及细胞凋亡负相关,这可能是由于miR-21下调PDCD4的表达从而减少细胞凋亡[48]。DDAH1属于二甲基精氨酸二甲胺水解酶家族基因,DDAH1可通过调节细胞非对称二甲基精氨酸(asymmetric dimethylarginine,ADMA)的浓度来影响一氧化氮的生成,而实验证实ADMA的生成可降低一氧化氮的浓度,进而导致慢性低氧和纤维化[49,50]。Liu等[51]证实miR-21可直接与AADH1的3’-UTR结合,从而下调DDAH1的表达进而引起纤维化,而转染DDAH1则可有效减少α-SMA和Ⅰ型胶原蛋白的含量。Bcl-2基因是一种重要的抗凋亡因子,抑制Bcl-2的表达可促进心脏成纤维细胞的凋亡[52]。Ji等发现miR-21可直接作用于它的靶基因Bcl-2,从而影响细胞的增殖/凋亡[53]。Dong等[54]发现miR-21通过上调抗凋亡因子Bcl-2的表达抑制心脏成纤维细胞的凋亡从而促进心脏纤维化。总之,miR-21可通过多种通路促进胶原蛋白的分泌和成纤维细胞的增殖,抑制成纤维细胞的凋亡和炎症来促进多种器官的纤维化。
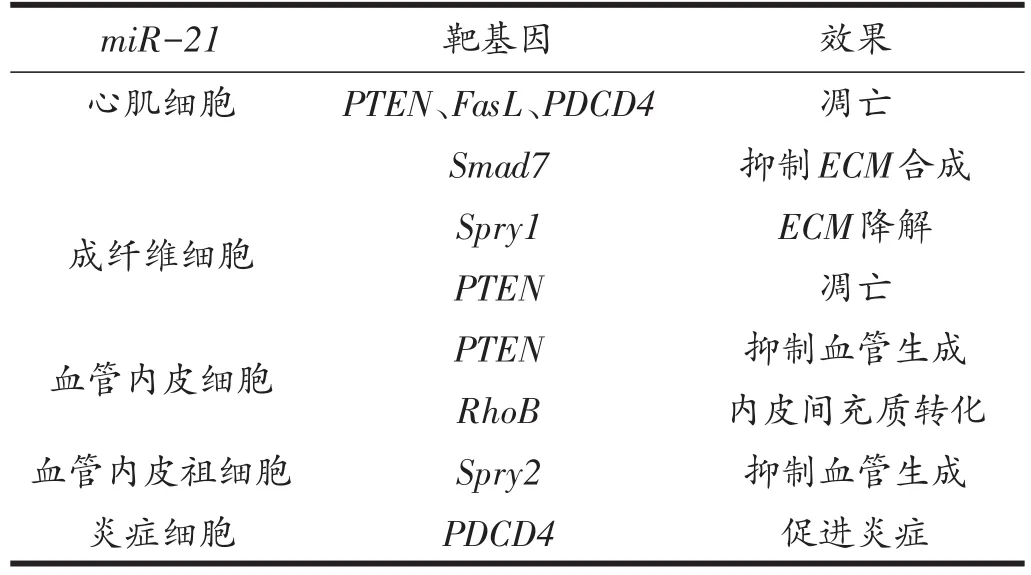
表2 miR-21对不同细胞的特异性效果
本研究存在一些缺陷,尽管本研究直接证实了大强度运动引起的右室纤维化与miR-21表达量升高有关,但我们没有采用miR-21抑制剂观察miR-21表达被抑制后能否减轻运动性右室纤维化,或者采用miR-21相似物质粒对大鼠进行转染观察miR-21过表达是否能加重运动性右室纤维化。希望今后的工作能对此进行研究,并探索在运动性右室纤维化过程中miR-21是通过哪个或哪些下游靶基因发挥作用的,以增加以miR-21为靶点治疗运动性右室纤维化的可能性。
4 结论
长期大强度运动后右室心肌纤维化与miR-21表达水平增高有关,是潜在的运动性心肌纤维化的新生物标志物和干预靶点。
[1]White ES,Mantovani AR.Inflammation,wound repair,and fibrosis:Reassessing the spectrum of tissue injury and resolution[J].J Pathol,2013,229(2):141-144.
[2]Prabhu SD,Frangogiannis NG.The biological basis for cardiac repair after myocardial infarction:From inflamma⁃tion to fibrosis[J].Circ Res,2016,119(1):91-112.
[3]饶志坚,常芸,王世强,等.长期大强度耐力运动对心脏的不利影响[J].体育科学,2016,36(6):46-54.
[4]Singh A.Introduction:Micrornas in health and disease[J].Molecular&Cellular Pharmacology,2011,
[5]Vettori S,Gay S,Distler O.Role of micrornas in fibrosis[J].Open Rheumatol J,2012,6130-139.
[6]KumarswamyR,VolkmannI,ThumT.Regulationand function of mirna-21 in health and disease[J].Rna Biolo⁃gy,2011,8(5):706-713.
[7]Calin GA,Croce CM.Microrna signatures in human can⁃cers[J].Nat Rev Cancer,2006,6(11):857-866.
[8]Garzon R,Marcucci G,Croce CM.Targeting micrornas in cancer:Rationale,strategies and challenges[J].Nat Rev Drug Discov,2010,9(10):775-789.
[9]Glowacki F,Savary G,Gnemmi V,et al.Increased circu⁃lating mir-21 levels are associated with kidney fibrosis[J].Plos One,2013,8(8):e58014.
[10]Noetel A,Kwiecinski M,Elfimova N,et al.Microrna are central players in anti-and profibrotic gene regulation during liver fibrosis[J].Frontiers in Physiology,2012,3(3):49.
[11]Liu G,Friggeri A,Yang Y,et al.Mir-21 mediates fibro⁃genic activation of pulmonary fibroblasts and lung fibrosis[J].Journal of Experimental Medicine,2010,207(8):1589-1597.
[12]Zhu H,Fan GC.Role of micrornas in the reperfused myocardium towards post-infarct remodelling[J].Cardiovas⁃cular Research,2012,94(2):284-292.
[13]SashwatiRoy,SavitaKhanna,Hussain SRA,et al.Microrna expression in response to murine myocardial infarction:Mir-21 regulates fibroblast metalloprotease-2 via phospha⁃tase and tensin homologue[J].Cardiovascular Research,2009,82(1):21-29.
[14]Haghikia A,Hilfiker-Kleiner D.Mirna-21:A key to con⁃trolling the cardiac fibroblast compartment?[J].Cardiovas⁃cular Research,2009,82(1):1-3.
[15]饶志坚,常芸,王世强.运动强度和时间对左右心室影响的比较研究-饶志坚[J].中国运动医学杂志,2017,36(2):111-121,105.
[16]王世强,常芸,马晓雯,等.不同强度耐力运动对大鼠心房i型、iii胶原蛋白的影响及结缔组织生长因子的调节作用[J].中国运动医学杂志,2015,34(10):971-976.
[17]La Gerche A,Claessen G.Is exercise good for the right ventricle?Concepts for health and disease[J].Can J Car⁃diol,2015,31(4):502-508.
[18]Wilson M,O'Hanlon R,Prasad S,et al.Diverse patterns of myocardial fibrosis in lifelong,veteran endurance ath⁃letes[J].J Appl Physiol(1985),2011,110(6):1622-1626.
[19]Felker GM,Thompson RE,Hare JM,et al.Underlying causes and long-term survival in patients with initially unexplained cardiomyopathy[J].N Engl J Med,2000,342(15):1077-1084.
[20]Thannickal VJ,Zhou Y,Gaggar A,et al.Fibrosis:Ulti⁃mate and proximate causes[J].J Clin Invest,2014,124(11):4673-4677.
[21]Wynn TA,Ramalingam TR.Mechanisms of fibrosis:Ther⁃apeutic translation for fibrotic disease[J].Nat Med,2012,18(7):1028-1040.
[22]Benito B,Gay-Jordi G,Serrano-Mollar A,et al.Cardiac ar⁃rhythmogenic remodeling in a rat model of long-term in⁃tensive exercise training[J].Circulation,2011,123(1):13-22.
[23]Roozbeh Aschar-Sobbi FI,Adam S.Korogyi,Qiongling Wang,Gerrie P.Farman.Increased atrial arrhythmia sus⁃ceptibilityinducedbyintenseenduranceexercisein mice requires tnfalpha[J].Nat Commun,2015,6(6018):1-14.
[24]Jazbutyte V,Thum T.Microrna-21:From cancer to car⁃diovascular disease[J].Curr Drug Targets,2010,11(8):926-935.
[25]Davis BN,Hilyard AC,Lagna G,et al.Smad proteins con⁃trol drosha-mediated microrna maturation[J].Nature,2008,454(7200):56-61.
[26]Davis BN,Hilyard AC,Nguyen PH,et al.Smad proteins bind a conserved rna sequence to promote microrna mat⁃uration by drosha[J].Mol Cell,2010,39(3):373-384.
[27]Bronnum H,Andersen DC,Schneider M,et al.Mir-21 promotes fibrogenic epithelial-to-mesenchymal transition of epicardial mesothelial cells involving programmed cell death 4 and sprouty-1[J].PLoS One,2013,8(2):e56280.
[28]Thum T,Gross C,Fiedler J,et al.Microrna-21 contrib⁃utes to myocardial disease by stimulating map kinase sig⁃nalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[29]Tijsen AJ,Pinto YM,Creemers EE.Non-cardiomyocyte micrornasinheartfailure[J].CardiovascularResearch,2012,93(4):573-582.
[30]Bauersachs J,Thum T.Biogenesis and regulation of car⁃diovascular micrornas[J].Circulation Research,2011,109(3):334-347.
[31]Zarjou A,Yang S,Abraham E,et al.Identification of a microrna signature in renal fibrosis:Role of mir-21[J].Am J Physiol Renal Physiol,2011,301(4):F793-801.
[32]Zhong X,Chung AC,Chen HY,et al.Smad3-mediated up⁃regulation of mir-21 promotes renal fibrosis[J].J Am Soc Nephrol,2011,22(9):1668-1681.
[33]Zhang J,Jiao J,Cermelli S,et al.Mir-21 inhibition reduc⁃es liver fibrosis and prevents tumor development by in⁃ducingapoptosisofcd24+progenitorcells[J].Cancer Res,2015,75(9):1859-1867.
[34]Zhong X,Chung AC,Chen HY,et al.Mir-21 is a key therapeutic target for renal injury in a mouse model of type 2 diabetes[J].Diabetologia,2013,56(3):663-674.
[35]Zhao J,Tang N,Wu K,et al.Mir-21 simultaneously regu⁃lates erk1 signaling in hsc activation and hepatocyte emt in hepatic fibrosis[J].PLoS One,2014,9(10):e108005.
[36]Glowacki F,Savary G,Gnemmi V,et al.Increased circu⁃lating mir-21 levels are associated with kidney fibrosis[J].PLoS One,2013,8(2):e58014.
[37]Makiguchi T,Yamada M,Yoshioka Y,et al.Serum extra⁃cellular vesicular mir-21-5p is a predictor of the progno⁃sis in idiopathic pulmonary fibrosis[J].Respir Res,2016,17(1):110.
[38]Li P,Zhao GQ,Chen TF,et al.Serum mir-21 and mir-155 expression in idiopathic pulmonary fibrosis[J].J Asth⁃ma,2013,50(9):960-964.
[39]Loboda A,Sobczak M,Jozkowicz A,et al.Tgf-beta1/smads and mir-21 in renal fibrosis and inflammation[J].Mediators Inflamm,2016,20168319283.
[40]Liang H,Zhang C,Ban T,et al.A novel reciprocal loop between microrna-21 and tgfbetariii is involved in cardi⁃ac fibrosis[J].Int J Biochem Cell Biol,2012,44(12):2152-2160.
[41]McClelland AD,Herman-Edelstein M,Komers R,et al.Mir-21 promotes renal fibrosis in diabetic nephropathy by targeting pten and smad7[J].Clin Sci(Lond),2015,129(12):1237-1249.
[42]Yamada KM,Araki M.Tumor suppressor pten:Modulator ofcellsignaling,growth,migrationandapoptosis[J].J Cell Sci,2001,114(Pt 13):2375-2382.
[43]Nho RS,Xia H,Diebold D,et al.Pten regulates fibro⁃blast elimination during collagen matrix contraction[J].JBiol Chem,2006,281(44):33291-33301.
[44]Zanotti S,Gibertini S,Curcio M,et al.Opposing roles of mir-21 and mir-29 in the progression of fibrosis in duchenne muscular dystrophy[J].Biochim Biophys Acta,2015,1852(7):1451-1464.
[45]Frankel LB,Christoffersen NR,Jacobsen A,et al.Pro⁃grammed cell death 4(pdcd4)is an important function⁃al target of the microrna mir-21 in breast cancer cells[J].J Biol Chem,2008,283(2):1026-1033.
[46]Sheedy FJ,Palsson-McDermott E,Hennessy EJ,et al.Neg⁃ative regulation of tlr4 via targeting of the proinflammato⁃ry tumor suppressor pdcd4 by the microrna mir-21[J].Nat Immunol,2010,11(2):141-147.
[47]Cheng Y,Zhu P,Yang J,et al.Ischaemic preconditioningregulated mir-21 protects heart against ischaemia/reperfu⁃sion injury via anti-apoptosis through its target pdcd4[J].Cardiovasc Res,2010,87(3):431-439.
[48]Xu X,Kriegel AJ,Liu Y,et al.Delayed ischemic precon⁃ditioning contributes to renal protection by upregulation of mir-21[J].Kidney Int,2012,82(11):1167-1175.
[49]Siervo M,Corander M,Stranges S,et al.Post-challenge hyperglycaemia,nitricoxideproductionandendothelial dysfunction:The putative role of asymmetric dimethylargi⁃nine(adma)[J].Nutr Metab Cardiovasc Dis,2011,21(1):1-10.
[50]Matsumoto Y,Ueda S,Yamagishi S,et al.Dimethylargi⁃nine dimethylaminohydrolase prevents progression of re⁃nal dysfunction by inhibiting loss of peritubular capillar⁃ies and tubulointerstitial fibrosis in a rat model of chron⁃ic kidney disease[J].J Am Soc Nephrol,2007,18(5):1525-1533.
[51]Liu XJ,Hong Q,Wang Z,et al.Microrna21 promotes in⁃terstitial fibrosis via targeting ddah1:A potential role in renal fibrosis[J].Mol Cell Biochem,2016,411(1-2):181-189.
[52]Mayorga M,Bahi N,Ballester M,et al.Bcl-2 is a key factorforcardiacfibroblastresistancetoprogrammed cell death[J].J Biol Chem,2004,279(33):34882-34889.
[53]Ji R,Cheng Y,Yue J,et al.Microrna expression signa⁃ture and antisense-mediated depletion reveal an essen⁃tial role of microrna in vascular neointimal lesion forma⁃tion[J].Circ Res,2007,100(11):1579-1588.
[54]Shuguang Dong WM,Bohan Hao.Microrna-21 promotes cardiacfibrosisanddevelopmentofheartfailurewith preserved left ventricular ejection fraction by up-regulat⁃ing bcl-2[J].Int J Clin Exp Pathol,2014,7(2):565-574.
Effects of MiR-21 on Exercises-induced Right Ventricularfibrosis
Rao Zhijian1,2,Chang Yun1,Wang Shiqiang3
1 China Institute of Sport Science,Beijing 100061,China 2 Shanghai University of Sport,Shanghai 200438,China 3 College of Physical Education,Hunan University of Technology,Zhuzhou 412000,China Corresponding Author:Chang Yun,Email:changyun@ciss.cn
ObjectiveTo explore the expression level of miR-21 in exercise-induced right ventricular(RV)fibrosis,and to analyze the role of miR-21 in exercise-induced right ventricular fibrosis.Meth⁃odsSeventy-two male Sprague-Dawley rats were randomly divided into a sedentary(Sed)group,a mod⁃erate exercise(ME)group and an intensive exercise(IE)group,each of 24.Rats in the Sed group were free of exercises,while those in ME and IE groups ran an hour on treadmill at 5°and 10°slopes at the speed of 15.2 m/min and 28 m/min respectively for 8 weeks,12 weeks or 16 weeks every day,5days per week.Twenty-four hours after the last training,all rats were sacrificed after blood sampling.The right ventricles were removed,and the collagen volume fraction(CVF)was tested using Sirius red staining,CollagenⅠ(ColⅠ)content was quantified using Immunofluorescence.The expression level of miR-21 was measured using the reverse transcription-polymerase chain reaction(RT-PCR).ResultsAf⁃ter 12 weeks(P<0.05,P<0.05)and 16 weeks(P<0.01,P<0.01)of intensive exercises,the averageCVF in the right ventricular was significantly higher than that of Sed and ME rats.Compared to Sed and ME groups,12 weeks(P<0.01,P<0.01)and 16 weeks(P<0.01,P<0.01)of intensive exercises sig⁃nificantly increased RV collagenⅠcontent.Compared to the Sed group,the expression of miR-21 in RV increased significantly in the IE group(P<0.01,P<0.05 and P<0.05).After 16-week intensive exer⁃cises,the miR-21 expression was positively correlated with the RV ColⅠcontent.ConclusionThe right ventricular fibrosis induced by long-term intensive exercises is associated with increased miR-21 expression level.Therefore,miR-21 is a potent therapeutic target and novel biomarker of the exerciseinduced right ventricular fibrosis.
exercises,right ventricular,fibrosis,miR-21,collagen
2016.12.01
国家体育总局体育科学研究所基本科研业务经费(基本15-37和16-21)
第1作者:饶志坚,Email:1101294556@qq.com;
常芸,Email:changyun@ciss.cn
