不同运动方式对大鼠血清与肝脏中hepcidin水平及相关调节因素的影响
2017-08-07沙继斌张成岗
沙继斌张成岗
1山东体育学院运动与健康学院(济南 250102)2军事医学科学院放射与辐射医学研究所(北京 100850)
不同运动方式对大鼠血清与肝脏中hepcidin水平及相关调节因素的影响
沙继斌1,2张成岗2
1山东体育学院运动与健康学院(济南 250102)2军事医学科学院放射与辐射医学研究所(北京 100850)
目的:比较耐力运动及力竭运动对大鼠血液及肝脏中铁调素(hepcidin)表达的影响,并测定分析与之相关的铁代谢指标、低氧应答因子、炎性因子、抗菌肽活性相关指标的变化趋势。方法:雌性SD大鼠30只,随机分为对照组(n=10)、耐力运动组(n=10)、力竭运动组(n=10),对照组不运动,耐力运动组和力竭运动组分别采用为期4周的中等运动强度跑台训练和力竭运动强度跑台训练对大鼠进行干预,而后分别采集血样,进行血常规指标及血清中铁转运因子、低氧应答因子、炎性因子及抗菌肽活性相关指标测定;取肝脏标本,固定、包埋、切片后,利用免疫组织化学染色分别测定不同组别动物肝脏中hepcidin、低氧诱导因子(HIF-1α)、核转录因子kappa b(NF-κB)含量。结果:与对照组相比,4周耐力性运动后大鼠血清中hepcidin水平降低(P<0.05),促红细胞生成素(EPO)浓度升高(P<0.05),白细胞介素6(IL-6)浓度下降(P<0.01)。与对照组相比,4周力竭性运动后大鼠血清及肝脏中hepcidin水平升高(P<0.01),EPO浓度降低(P<0.01),同时伴有血清及肝脏中HIF-1α表达增加(P<0.01),血清转铁蛋白(TF)、可溶性转铁蛋白受体(sTFR)水平降低(P<0.01),血清中白细胞介素1(IL-1)、IL-6、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)水平显著升高(P<0.01,P<0.001,P<0.001,P<0.001);同时血清中与hepcidin抗菌肽活性相关的toll样受体4(TLR4)、NF-κB水平均显著升高(P<0.001)。结论:4周耐力性运动可下调大鼠血清中hepcidin水平;而4周力竭性运动可使大鼠血清及肝脏中hepcidin水平显著上调,提示不同运动方式对hepcidin的影响存在明显差异。
铁调素;铁代谢;低氧诱导因子;炎症
青少年及女性运动员易出现因体内贮存铁耗竭所导致的功能性缺铁或绝对性缺铁,如得不到合理补充,将会发展成为缺铁性贫血。因缺铁导致的“运动性贫血”是限制耐力型运动员竞技能力的重要因素[1,2]。机体铁元素的吸收、回收及转运主要由以下因子调控:①铁贮存调节因子;②红细胞生成调节因子;③炎性调节因子。目前研究证实,上述三类因子可聚焦于同一个铁代谢调节激素——hepcidin[3,4]。钱忠明、段相林等学者根据hepcidin对铁代谢的负调节作用,将之定名为铁调素[5-7]。hepcidin可通过对铁的吸收、储存和利用这三个重要环节的作用而调节铁代谢,运动后血清hepcidin的水平直接受到运动强度及运动方式等因素影响[8,9]。
除运动之外,机体内hepcidin水平还受到炎症、低氧等诸多因素影响。Nemeth等报道炎性细胞因子IL-6可上调hepcidin表达[10];Kemma等观察到健康个体在注射内毒素(脂多糖,LPS)诱发急性炎症反应后,IL-6水平显著上升,进而使hepcidin水平上升至峰值[11]。Peys⁃sonnaux等发现视网膜血管瘤肿瘤抑制蛋白/低氧诱导因子通路(vHL/HIF轴)是体内调控hepcidin表达及铁代谢平衡的重要因素[12]。
髓源性细胞在防御细菌入侵时,其hepcidin表达会显著上调,该反应具备toll样受体4(toll like receptor 4,TLR4)依赖性,之后会因其对铁代谢的负调节作用而诱发炎性贫血[13]。由此提示hepcidin的抗菌肽活性与铁代谢负调节作用之间可能存在内在联系,其联系的交汇点可能集中于低氧及炎症应答[14]。
本研究探讨不同运动方式对大鼠血清及肝脏hep⁃cidin表达的影响,同时比较分析与之有密切关系的铁转运因子、低氧应答因子、炎性因子及抗菌肽活性相关指标的变化趋势,进一步探讨hepcidin自身所具备的双重生物学活性的可能内在联系。
1 材料与方法
1.1 实验动物分组
6周龄雌性SD大鼠30只,体重169.7±6.98 g,购自北京华阜康实验动物中心,动物许可证号:SCXK(京)2009-0015,随机分为对照组(n=10)、耐力运动组(n=10)、力竭运动组(n=10)。自由饮水,普通标准啮齿类动物饲料喂养,适应性饲养1周后,对照组不运动,耐力运动组和力竭运动组分别按照如下方案进行跑台运动干预。
1.2 不同跑台训练运动方案
耐力运动组依据陈文鹤等文献[15]制定运动方案:跑台坡度0°;初始速度为10 m/min,依次按照2.5 m/min速度递增,每级持续5 min,递增至15 m/min并维持运动负荷在此水平,总运动时间为60 min,每日定时训练,每周6次,持续4周。
力竭运动组依据Bedford[16]建立的大鼠递增负荷力竭性运动模型制定运动方案:第1级运动负荷:跑台坡度0°,速度12 m/min(约相当于64%最大摄氧量),持续运动15 min;第2级运动负荷:跑台坡度5°,速度15 m/min(约相当于76%最大摄氧量),持续运动15 min;第3级运动负荷:跑台坡度5°,速度18 m/min(约相当于85%最大摄氧量),维持此负荷直至动物无法坚持本级负荷,腹卧位贴于跑道上并滞留跑道后1/3处达3次以上,刺激驱赶无效,行为特征表现为:呼吸急深、幅度大、垂头,刺激无反应。总运动时间为120 min,每日定时进行训练,每周6次,持续4周。
1.3 血液常规指标测定
4周不同强度跑台训练干预结束后第2天,以10%水合氯醛腹腔注射麻醉动物,心内取血,将1 ml全血置于EDTA抗凝采血管中,轻轻颠倒混匀,而后在流式细胞仪上进行血液常规指标测定,包括红细胞(RBC)、白细胞(WBC)、血小板(PLT)计数及血红蛋白(HGB)含量测定。
1.4 EELLIISSAA测定血清中铁转运因子、低氧应答因子、炎性因子及抗菌肽活性相关指标
心内取血,3000 g离心收集血清,采用ELISA试剂盒(R&D Systems,USA)分别测定血清中hepcidin,铁转运因子包括转铁蛋白(transferrin,TF)、可溶性转铁蛋白受体(soluble transferring receptor,sTFR),低氧应答因子包括低氧诱导因子1 alpha(hypoxia induced factor 1,HIF-1α)、红细胞生成素(erythropoietin,EPO)及炎性因子包括白细胞介素1(interleukin 1,IL-1)、白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子alpha(tumor necrosis factor,TNF-α)、C反应蛋白(C reaction pro⁃tein,CRP),抗菌肽活性相关指标包括toll样受体4(TLR4)、核因子kappa b(nuclear factor kappa b,NF-κB)水平变化,按照试剂盒说明书利用Bio-Rad酶标仪进行测定。
1.5 免疫组化法检测大鼠肝脏中hepcciiddiinn、HHIIFF-- 11 α、NNFF-- κ BB表达
将大鼠肝脏置于5%多聚甲醛中固定,石蜡包埋切片;二甲苯脱蜡后梯度酒精水化;3%H2O2水溶液室温避光孵育10 min,而后在柠檬酸缓冲液中进行抗原修复;10%正常羊血清37℃孵育30分钟后,分别于切片上加50 μL稀释的HIF-1α、NF-κB、hepcidin抗体(购自abcam,浓度分别为:1︰200、1︰400、1︰200),37℃孵育1小时;其中加HIF-1α、hepcidin孵育的在切片上加30 μL生物素标记羊抗小鼠IgG工作液、加NF-κB孵育的在切片上加30 μL生物素标记羊抗兔IgG工作液(上述两种二抗均购自中杉金桥),37℃孵育60 min;在切片上加30 μL辣根过氧化物酶标记链霉卵白素工作液,37℃孵育30 min;DAB避光显色,脱水,透明,封片。
1.6 数据统计分析
2 结果
2.1 耐力运动及力竭性运动对大鼠血常规指标的影响
4周不同方式运动干预结束后,与对照组相比,耐力运动组及力竭运动组RBC、WBC、PLT、HGB数目均未见有明显改变。具体见表1。

表1 各组大鼠血液常规指标
2.2 耐力运动及力竭性运动对大鼠血清hepcciiddiinn及铁转运因子表达的影响
4周不同方式运动干预结束后,与对照组相比,耐力运动组hepcidin水平显著降低(P<0.05),而力竭运动组hepcidin水平则显著升高(P<0.01);与对照组相比,耐力运动组转铁蛋白(TF)、转铁蛋白受体(sTFR)水平未见有显著改变;而力竭运动组转铁蛋白TF、sTFR水平均显著降低(P<0.01)。具体见表2。

表2 各组大鼠血清hepcidin表达及铁转运因子比较
2.3 耐力运动及力竭性运动对大鼠血清低氧应答指标的影响
4周不同方式运动干预结束后,与对照组相比,耐力运动组HIF-1α水平降低,EPO水平显著升高(P<0.05);力竭运动组HIF-1α水平显著升高(P<0.01),EPO水平显著降低(P<0.01);具体见表3。

表3 各组大鼠血清低氧应答指标比较
2.4 耐力运动及力竭性运动对大鼠血清炎性因子表达的影响
4周不同方式运动结束后,与对照组相比,耐力运动组IL-6浓度显著降低(P<0.01),提示有氧运动具备一定抗炎作用;力竭运动组上述炎性因子水平则均有显著升高(P<0.01,P<0.001,P<0.001,P<0.001),提示力竭性运动可使动物体内炎症反应加剧。具体见表4。

表4 各组大鼠血清炎性细胞因子比较
2.5 耐力运动及力竭性运动对大鼠血清中hepcciiddiinn抗菌肽活性相关指标的影响
4周不同方式运动干预结束后,与对照组相比:耐力运动组NF-κB水平显著降低(P<0.01),与其hepcidin变化趋势一致;力竭运动组NF-κB及TLR4水平均显著升高(P<0.001),与其hepcidin变化趋势一致。具体见表5。
2.6 耐力运动及力竭性运动对大鼠肝脏中hepcciiddiinn、HHIIFF-- 11 α、NNFF-- κ BB表达的影响
4周不同方式运动干预结束后,与对照组相比,耐力运动组动物肝脏hepcidin、HIF-1α、NF-κB表达量均有升高,无显著性差异;力竭运动组动物肝脏hepcidin、HIF-1α、NF-κB表达量均有显著上升(P<0.01,P<0.01,P<0.001),提示力竭性运动可使动物肝脏蛋白表达发生更为显著变化。结果见图1,表6。

表5 各组大鼠血清hepcidin抗菌肽活性相关指标比较

表6 各组大鼠肝脏hepcidin、HIF-1α、NF-κB表达水平比较
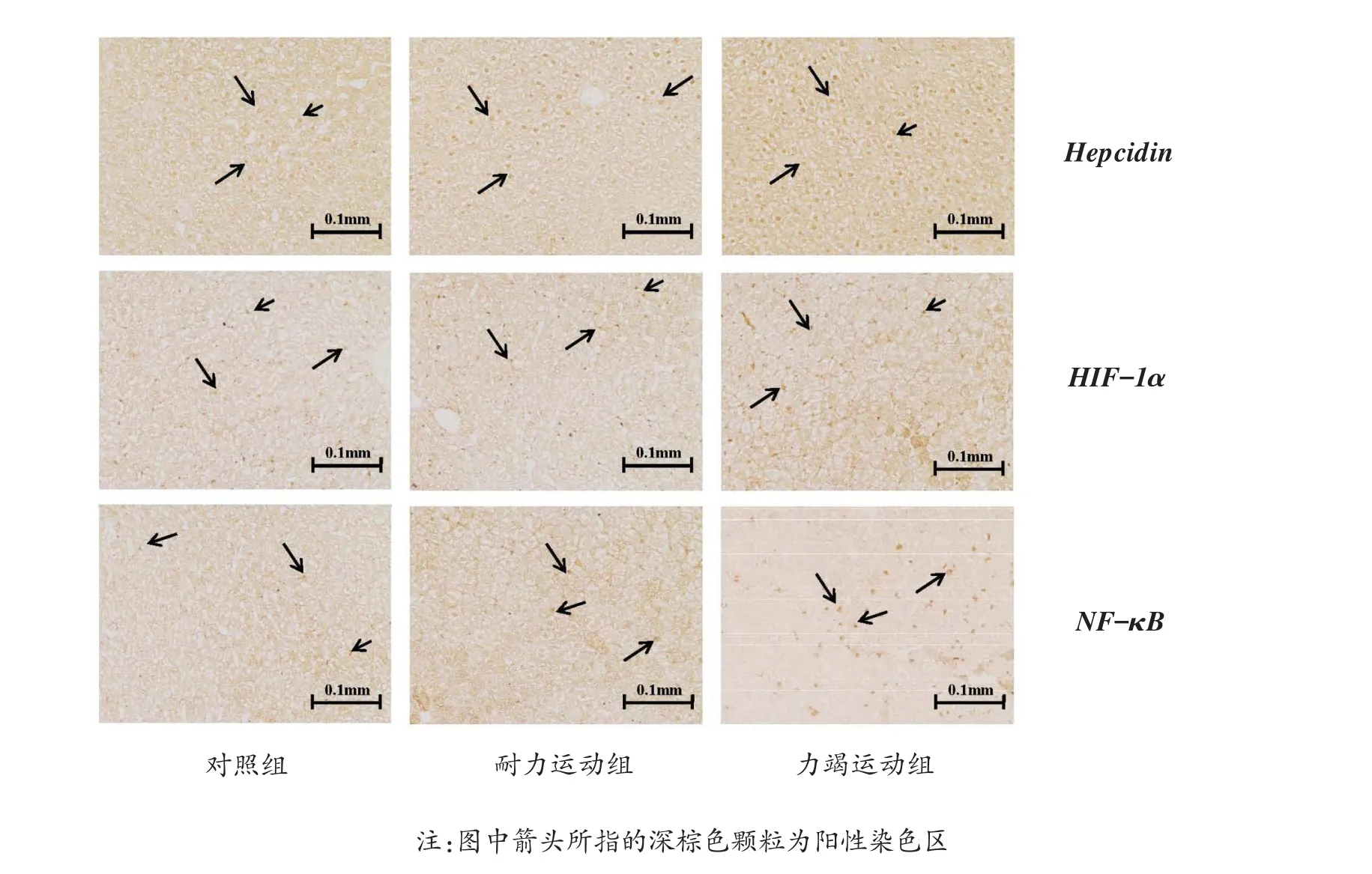
图1 各组大鼠肝脏免疫组化染色
3 讨论
自1959年Yoshimura首次提出大强度运动可导致“运动性贫血”以来,研究者逐渐认识到大强度运动引起的细胞缺铁是贫血的重要诱因[3,17]。在Nicolas报告hepcidin的铁代谢调节功能之后[18],研究者开始关注不同方式、不同强度运动对机体铁代谢调节系统的作用及其与肝脏hepcidin表达之间的关系[17,19-21]。
3.1 不同方式运动干预对大鼠血清hepcciiddiinn及血常规指标的影响
此前Roecker等[22]对14名参加柏林马拉松比赛的女性运动员尿液中hepcidin浓度进行了观察,Troadec等[23]对14名进行亚最大强度自行车运动志愿者hepci⁃din表达进行了验证分析,Marc等[24]比较了7天负重训练(跑步)与无负重训练(骑自行车)对尿液中hepcidin的影响,上述人体试验结果表明不同训练方式、运动强度等因素对机体血液及尿液中hepcidin浓度的影响并不一致。刘玉倩等[25]观察到适度运动使大鼠肝脏hep⁃cidin mRNA水平下降,血红蛋白含量升高,而剧烈运动则未见有显著影响。本文观察到耐力运动可使大鼠血清hepcidin水平显著降低,与其肝脏中hepcidin变化趋势不一致。而力竭性运动则可使大鼠血清hepcidin水平及其肝脏hepcidin表达同步显著上调。这种结果上的差异可能与所选择动物运动模型及运动强度密切相关。
hepcidin浓度改变与血液常规指标改变二者之间并不同步,有时血常规指标改变可能由于其发生改变时程上的滞后性而观察不到。McClung等对进行7天冬季军事训练的受试者血红蛋白、铁转运因子及hepci⁃din的影响进行了观察[26],Auersperger等比较了14名跑步运动员在为期8周的训练前后及调整恢复10天后血液中hepcidin及红细胞及血红蛋白含量的改变[27],这两项人体试验均发现血常规指标改变存在滞后或不够敏感。本实验中同样发现不同运动方式均可改变大鼠血液及肝脏中hepcidin的表达,但两组动物的大鼠血液常规指标虽有小幅波动,均未见有显著改变。其原因可能在于无论耐力性运动导致hepcidin表达下调所诱发的机体铁代谢促进效应,还是力竭性运动导致hepcidin表达上调所诱发机体铁代谢抑制作用,二者均需要较长时程才可能会影响到血液常规指标的改变。上述结果提示:运动对hepcidin水平的影响与所采取的运动强度、运动量、运动方式密切相关,且存在一定差异。
3.2 不同方式运动干预对大鼠血清hepcciiddiinn及铁转运因子的影响
铁是包括氧运输在内的多个生物学反应过程的必需微量元素,铁的供应受到hepcidin的精确调控。hep⁃cidin在肝内合成,是哺乳动物体内铁吸收及铁代谢平衡的关键调节者。在机体铁超载时,其含量上调;而在低氧、贫血等因素使血中铁浓度降低时,肝脏分泌的hepcidin随之减少,最终使血液中铁浓度逐渐恢复正常[4,28,29]。
本文观察到耐力运动可使大鼠血清hepcidin水平显著降低,但对TF、sTFR未见有显著影响;力竭性运动可使大鼠血清hepcidin水平显著上升,使TF、sTFR水平显著降低,其肝脏中hepcidin表达也有显著上调。这与刘玉倩等对不同强度游泳运动对大鼠十二指肠二价金属离子转运蛋白(DMT1)、FP1蛋白及肝脏hepcidin mRNA表达比较分析的结果不一致[30]。其原因可能在于下肢需承重的跑台运动训练模型的运动负荷大于下肢无承重的游泳运动训练模型,而力竭性跑台运动对大鼠肝脏的运动应激效应又强于耐力性跑台运动所致。尽管不同实验的结果不尽一致,但仍可证实hepci⁃din确系机体铁代谢的有效负调节因子。
3.3 不同方式运动干预对大鼠血清hepcciiddiinn及低氧应答指标的影响
通过氧运输、红细胞生成及铁代谢等过程,使得机体低氧应答与铁的利用密切联系在一起。缺氧可使HIF-1α表达增加,促红细胞生成素表达上调,红细胞生成增多,由此使得红细胞系统组织可获得更多的铁,而使hepcidin表达下调[12,29,31]。
习惯认为EPO变化趋势应与HIF-1α变化趋势一致,而hepcidin变化趋势应与HIF-1α变化趋势相反,即当机体处于缺氧状态时,可显著降低hepcidin的表达[29,32]。本文观察到耐力运动组血清中促红细胞生成素(EPO)水平显著升高,与其血清中hepcidin的变化趋势一致;但观察到其血清中HIF-1α呈下降趋势,这与报道较多的HIF-1α变化趋势与EPO变化趋势结果不一致。力竭运动组血清及肝脏中HIF-1α水平均显著升高,但其血清中EPO水平显著下降,而且HIF-1α变化趋势与血清及肝脏中hepcidin表达的变化趋势也与已知研究结果存在较明显差异。本实验中之所以观察到了hepcidin与HIF-1α变化趋势相矛盾的原因,可能在于不同运动方式影响所致。即耐力性运动具有抗炎作用,可下调hepcidin表达,由此抵消了因运动使机体氧供应改善后HIF-1α下降所引发的hepcidin表达上调,最终表现为hepcidin表达量降低。而力竭性运动则使机体炎症反应加剧,上调hepcidin表达,也由此抵消了因力竭运动使机体缺氧所诱发的HIF-1α稳化上调,进而引发的hepcidin表达下调,最终表现为hepcidin表达量增多。事实上HIF-1α对机体的炎症反应也存在密切的调节作用[31],上述结果提示低氧诱导因子在机体因缺铁后所发生的一系列代偿反应调节中发挥着重要作用,其中力竭性运动的影响更为深刻。
而对于4周不同方式运动干预对大鼠血清中HIF-1α与EPO的变化趋势与之前所报道实验结果不一致的原因,尚有待进一步验证分析。
3.4 不同方式运动干预对大鼠血清hepcciiddiinn及炎性因子指标的影响
机体炎症状态下hepcidin表达会显著上调,可影响到小肠细胞铁吸收及脾脏巨噬细胞铁回收,使吸收效率下降,回收减少,造成血浆中铁浓度下降[33-35]。目前有关炎性因子对hepcidin影响的研究报道中,IL-6得到最多关注,Nemeth等报道的第一个可上调hepcidin表达的炎性细胞因子就是IL-6[10]。
本文较系统的观察了4周不同方式运动干预对大鼠血清炎性因子浓度的影响。与对照组相比,耐力运动组IL-6水平显著降低(P<0.01),提示耐力性运动具有一定的抗炎作用,而且IL-6对运动应激应答表现的较为敏感。而力竭运动组的上述炎性因子水平均有显著上升,提示力竭运动可使动物体内炎症反应加剧,而炎性因子水平升高会显著激活hepcidin的转录和表达,最终诱发运动性贫血的发生。本文中所观察到炎性因子改变对hepcidin变化趋势的影响,与前述不同运动干预所诱发的低氧应答对hepcidin变化趋势的影响,可能存在一定的交叉或相互调节作用,而这种作用可能通过HIF-1α来实现。
这与澳大利亚Peeling等针对不同个体运动后hep⁃cidin的应答进行了一系列研究结果基本一致。Peeling的研究结果提示IL-6浓度改变与血清中hepcidin水平之间存在密切同步改变,运动可通过改变血清IL-6水平直接影响血清hepcidin水平,进而影响机体铁代谢[36,37]。而Banzet等采用可抑制IL-6表达的环孢菌素处理动物后发现,用环孢菌素干预过的动物在同等强度运动后血浆IL-6浓度低约50%,同时IL-6α受体表达显著减少,其hepcidin mRNA峰值显著降低[38],提示血浆IL-6水平改变确实是运动所诱发hepcidin基因表达增加的重要诱因,即IL-6可激活hepcidin的转录和表达。
3.5 不同方式运动干预对大鼠血清hepcciiddiinn抗菌肽活性指标的影响
hepcidin是一个在不同物种间结构高度保守的肝源性抗菌肽,属防御素(defensin)家族,其序列中的8个Cys残基间共可形成4个链内二硫键连接在一起,在调节哺乳动物铁代谢平衡过程中发挥着关键作用[4]。之前运动人体科学领域与其相关的研究多着眼于其铁代谢负调节因子的作用,对其抗菌肽活性缺乏关注。
本文观察到耐力运动组NF-κB水平显著下降,与其HIF-1α变化趋势一致;力竭运动组NF-κB及TLR4水平均显著上升,与其HIF-1α变化趋势一致。在此前的研究中,研究者已发现HIF-α可激活NF-κB,而NF-κB也可调节HIF-1α的转录,NF-κB是HIF-1a必不可缺的转录激活因子[14]。
哺乳动物的TLR是重要的模式识别受体,可以精确识别病原体相关PAMPs。TLR4是首先发现也是研究最多的TLR受体,其重要特征是识别革兰阴性菌的脂多糖(lipopolysaccharide,LPS)[13,14]。不同运动方式干预后血清hepcidin、HIF-1α、NF-κB、TLR4变化趋势基本一致,提示低氧可通过上调模式识别受体TLR4的表达,从而促进NF-κB浓度提升,继而可激活作为肝源性抗菌肽的hepcidin的转录及表达。
此前已初步探究过HIF-1α不仅仅是细胞能量平衡稳态及细胞对低氧适应的主要调节者。HIF-1α同样可以激活细胞抗病原微生物的活性,有效支持巨噬细胞及上皮化细胞的固有免疫应答[13]。已知抗菌肽是机体固有免疫应答的重要组成部分,作为肝源性抗菌肽的hepcidin自然也不例外。而与此同时,不同的运动干预方式同样可通过影响机体对低氧刺激做出适应性应答的核心调节因子HIF-1α以调节机体氧代谢,进而调节机体铁代谢。由此提示,hepcidin的铁代谢负调节因子作用与其肝源性抗菌肽活性均受到HIF-1α的调节,或者说是通过HIF-1α的调节作用将其二者有机的联系起来。HIF-1α在此过程中很可能既是机体铁代谢的感受器,同时也是机体铁代谢的重要调节因子。在hepcidin功能调节过程中发挥着关键作用,同时与其它调节因素如炎症反应之间存在相互交叉作用。
4 总结
本研究观察比较了不同运动方式对大鼠血清与肝脏hepcidin表达的影响,探讨了与之相关的铁转运因子、低氧应答因子、炎性因子及抗菌肽活性相关指标的变化趋势。发现耐力运动具有一定抗炎作用,可通过下调hepcidin表达以改善铁代谢;力竭性运动则使机体炎症反应加剧,其中IL-6的影响最为显著;使hepcidin表达显著上调,铁代谢发生障碍。
对hepcidin的抗菌肽活性相关指标测试结果发现:当炎症反应加剧刺激hepcidin表达显著上调时,已知与抗菌肽表达增加的一系列因子如HIF-1α、NF-κB、TLR4水平均显著上升。提示其所兼备的铁代谢负调节因子活性变化趋势与肝源性抗菌肽活性变化趋势完全一致,二者之间存在内在联系。
[1]Wei-Na Kong,Guofen Gao,Yan-Zhong Chang.Hepcidin and sports anemia[J].Cell&Bioscience,2014,4(19):1-11.
[2]Marc Sim,Brian Dawson,Grant Landers,et al.Iron regula⁃tion in athletes:exploring the menstrual cycle and ef⁃fects of different exercise modalities on hepcidin produc⁃tion[J].Int J Sport Nutr Exerc Metab,2014,24(2):177-187.
[3]Peter Peeling.Exercise as a mediator of hepcidin activi⁃ty in athletes[J].Eur J Appl Physiol,2010,110:877-883.
[4]Tomas Ganz,Elizabeta Nemeth.Hepcidin and iron homeo⁃stasis[J].Biochimica et Biophysica Acta,2012,1823:1434-1443.
[5]付丽娟,段相林,钱忠明.铁代谢与铁调素hepcidin[J].生理科学进展,2005,36(3):233-236.
[6]钱忠明,柯亚.主编铁代谢与相关疾病[M].科学出版社,2010,pp:64-79;188-211;244-253.
[7]常彦忠,段相林.主编铁代谢失衡疾病的分子生物学原理[M].人民卫生出版社,北京,2012,pp:23-101.
[8]Tomas Ganz.Hepcidin,a key regulator of iron metabo⁃lism and mediator of anemia of inflammation[J].Blood,2003,102:783-788.
[9]Claire E,Badenhorst,Brian Dawson,et al.Influence of post-exercise hypoxic exposure on hepcidin response in athletes[J].Eur J Appl Physiol,2014,114:951-959.
[10]Elizabeta Nemeth,Seth Rivera,Victoria Gabayan,et al.IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin[J].J Clin Invest,2004,113:1271-1276.
[11]ErwinKemna,PeterPickkers,ElizabetaNemeth,etal.Time-course analysis of hepcidin,serum iron,and plasma cytokine levels in humans injected with LPS[J].Blood,2005,106:1864-1866.
[12]CarolePeyssonnaux,AnneliesSZinkernagel,RetoA.Schuepbach,et al.Regulation of iron homeostasis by the hypoxia-inducible transcription factors(HIFs)[J].J Clin Invest,2007,117:1926-1932.
[13]Carole Peyssonnaux,Annelies S.Zinkernagel,et al.TLR4-dependent hepcidin expression by myeloid cells in re⁃sponse to bacterial pathogens[J].Blood,2006,107:3727-3732.
[14]沙继斌.HIF-1--低氧与固有免疫的联系者[J].生物学杂志,2013,30(3):77-80.
[15]谈艳,薛雨平,陈文鹤,等.运动、膳食干预对肥胖大鼠胰岛素抵抗作用机制的研究[J].中国运动医学杂志,2014,33(8):797-802.
[16]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxy⁃gen consumption of rats and its changes with various ex⁃perimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[17]PeterPeeling,BrianDawson,CarmelGoodman,etal.Training surface and intensity:inflammation,hemolysis,and hepcidin expression[J].Medicine and Science in Sports and Exercise,2009,1138-1145.
[18]GaelNicolas,MyriamBennoun,IsabelleDevaux,etal.Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2(USF2)knock⁃out mice[J].PNAS,2001,98(15):8780-8785
[19]Peter Peeling,Brian Dawson,Carmel Goodman,et al.Cu⁃mulative effects of consecutive running sessions on hemo⁃lysis,inflammation and hepcidin activity[J].Eur J Appl Physiol,2009,106:51-59.
[20]Jedrzej Antosiewicz,Jan J.Kaczor,Katarzyna Kasprowicz,et al.Repeated“all out”interval exercise causes an in⁃crease in serum hepcidin concentration in both trained and untrained men[J].Cellular Immunology,2013,283:12-17.
[21]Peter Peeling,Brian Dawson,Carmel Goodman,et al.Athletic induced iron deficiency:new insights into the role of inflammation,cytokines and hormones[J].Eur J Appl Physiol,2008,103:381-391.
[22]L Roecker,R Meier-Buttermilch,L Brechtel,et al.Ironregulatory protein hepcidin is increased in female ath⁃letes after a marathon[J].Eur J Appl Physiol,2005,95:569-571.
[23]Marie-Bérengère Troadec,Fabrice Lainé,Vincent Daniel,et al.Daily regulation of serum and urinary hepcidin is notinduencedbysubmaximalcyclingexerciseinhu⁃mans with normal iron metabolism[J].Eur J Appl Physi⁃ol,2009,106:435-443.
[24]Marc Sim,Brian Dawson,Grant J Landers,et al.A seven day running training period increases basal urinary hepci⁃din levels as compared to cycling[J].J Int Soc Sports Nutr,2014,11:14,1-9.
[25]Yu Qian Liu,Xiang Lin Duan,Yan Zhong Chang,et al.Molecular analysis of increased iron status in moderately exercised rats[J].Molecular and Cellular Biochemistry,2006,282:117-123.
[26]James P Mcclung,Svein Martini,Nancy E Murphy,et al.Effects of a 7-day military training exercise on inflamma⁃tory biomarkers,serum hepcidin,and iron status[J].Nutri⁃tion Journal,2013,12:141,1-4.
[27]Irena Auersperger,Branko Skof,Bojan Leskosek,et al.Ex⁃ercise-induced changes in iron status and hepcidin re⁃sponse in female runners[J].PLoS ONE,2013,8(3):e58090,1-8.
[28]Elizabeta Nemeth,Marie S Tuttle,Julie Powelson,et al.Hepcidin regulates cellular iron efflux by binding to fer⁃roportinandinducingitsinternalization[J].Science,2004,306:2090-2093.
[29]CarolePeyssonnaux,VictorNizet,RandallS.Johnson.Role of the hypoxia inducible factors in iron metabolism[J].Cell Cycle,2008,7(1):28-32.
[30]刘玉倩,常彦忠,王海涛,等.不同强度运动对大鼠十二指肠DMT1、FP1蛋白和肝Hepcidin mRNA表达的影响[J].体育科学,2006,26(9):68-71.
[31]Victor Nizet,Randall S Johnson.Interdependence of hy⁃poxic and innate immune responses[J].Nat Rev Immu⁃nol,2009,9:609-617.
[32]Andrew D,Govus,Chris R Abbiss,et al.Acute hypoxic exercise does not alter post-exercise iron metabolism in moderately trained endurance athletes[J].Eur J Appl Physiol,2014,114(10):2183-2191.
[33]Hoi Lun Cheng,Christian E Bryant,Kieron B Rooney,et al.Iron,hepcidinandinflammatorystatusofyoung healthyoverweightandobesewomeninAustralia[J].PLoS ONE,2013,8(7):e68675,1-6.
[34]Victor Diaz,Ana B Peinado,Laura Barba-Moreno,et al.Elevated hepcidin serum level in response to inflammato⁃ry and iron signals in exercising athletes is independent of moderate supplementation with vitamin C and E[J].Physiol Rep,2015,3(8):e12475,1-6.
[35]Marc Sim,Brian Dawson,Grant Landers,et al.Effect of exercise modality and intensity on postexercise interleu⁃kin-6 and hepcidin levels[J].Int J Sport Nutr Exerc Metab,2013,23:178-186.
[36]Peter Peeling,Brian Dawson,Carmel Goodman,et al.Ef⁃fects of exercise on hepcidin response and iron metabo⁃lism during recovery[J].Int J Sport Nutr Exerc Metab,2009,19:583-597.
[37]Peter Peeling,Marc Sim,Claire E Badenhorst,et al.Iron status and the acute post-exercise hepcidin response in athletes[J].PLoS ONE,2014,9(3):e93002,1-6.
[38]Sebastien Banzet,Herve Sanchez,Rachel Chapot,et al.In⁃terleukin-6 contributes to hepcidin mRNA increase in re⁃sponse to exercise[J].Cytokine,2012,58:158-161.
The Effects of Different Treadmill Exercises on Serum-and Liver-Hepcidin and its Modulators in Rats
Sha Jibin1,2,Zhang Chenggang2
1 School of Sports and Health Science,Shandong Sports University,Jinan 250102,China 2 Beijing Institute of Radiation Medicine,Beijing 100850,China Corresponding Author:Zhang Chenggang,Email:zcgweb@126.com
ObjectivesTo compare the different effects of endurance and exhaustive exercises on hepcidin in the blood and liver,and determine the changes of related indexes about iron metabolism and hypoxia response,and of inflammatory and antimicrobial activity factors.MethodsThiry female Sprague Dawley rats were randomly divided into a control group(n=10),an endurance exercise group(n=10)and an exhaustive exercise group(n=10).Then 4 weeks of endurance and exhaustive tread⁃mill training were given to different exercise groups respectively.Blood samples were collected,the rou⁃tine indexes of the whole blood,and the serum indexes about iron metabolism,hypoxia response,inflam⁃matory and antimicrobial activity factors were measured.Meanwhile,liver samples were fixed,embeddedand sliced,and the expression of hepcidin,hypoxia-inducible factor(HIF)-1α and nuclear factor of kappa b(NF-κB)of different groups were measured using the immunochemistry staining.ResultsCompared with the control group,after 4-week endurance exercises,there was significant increase in the concentration of erythropoietin(EPO),but significant differences in the level of serum hepcidin and interleukin 6(IL-6).However,after 4 weeks of exhaustive exercise,significant increase was ob⁃served in the level of hepcidin and the expression of HIF-1α in the serum and liver,as well as the serum interleukin 1(IL-1),IL-6,tumor necrosis factor-α and C reactive protein,but significant de⁃crease was found in the concentration of serum EPO and the level of serum TF and sTFR compared to the control group.Moreover,there was significant increase in the level of toll-like receptor 4 and NF-κB,which is correlated with the antimicrobial peptide activity of hepcidin compared between the ex⁃haustive and control group.ConclusionsFour-week endurance exercise down-regulates the level of se⁃rum hepcidin,while 4-week exhaustive exercise increases the hepcidin level in the serum and liver sig⁃nificantly.Therefore,different exercises can result in totally different effect on the hepcidin level.
hepcidin,iron metabolism,hypoxia inducible factor,inflammation
2016.10.29
山东省自然科学基金(ZR2014JL024);山东省高等学校科技计划项目(J13LE04);国家重点基础研究发展计划资助项目子课题(2012CB518206)
第1作者:沙继斌,Email:mengxiaosha@hotmail.com;
张成岗,Email:zcgweb@126.com
