CT对心外膜脂肪体积与升主动脉弹性的相关性
2017-08-07柴亚欣CHAIYaxin
柴亚欣 CHAI Yaxin
牛玉军1 NIU Yujun
陈大鹏2 CHEN Dapeng
CT对心外膜脂肪体积与升主动脉弹性的相关性
柴亚欣1CHAI Yaxin
牛玉军1NIU Yujun
陈大鹏2CHEN Dapeng
目的 运用CT测量结果探讨心外膜脂肪体积与升主动脉弹性的相关性,借以通过心外膜脂肪(EAT)体积早期评估升主动脉病变。资料与方法 收集2016年1-9月在锦州医科大学附属第一医院行冠状动脉CT血管造影和冠状动脉造影检查的疑似冠心病患者169例,并根据有无冠状动脉硬化分为对照组(60例)和研究组(109例)。研究组按冠状动脉粥样硬化程度评分分为轻微组、轻度组、中度组和重度组。以文献记载EAT体积的阈值107.2 cm3为界分为暴露组,其余为非暴露组。测量并计算EAT体积及升主动脉弹性值。分析EAT体积与升主动脉弹性值的相关性以及EAT体积与冠状动脉粥样硬化关系。结果 对照组EAT体积与升主动脉弹性值无相关性(r=-0.156,P>0.05);轻微、轻度、中度、重度组EAT体积与升主动脉弹性值间均呈负相关(r=-0.378、-0.340、-0.514、-0.459,P<0.05);EAT体积是升主动脉弹性值的独立影响因子(β=-0.009,t=-2.653,P<0.05);暴露组发生冠心病的风险是非暴露组的9.318倍。结论 冠心病患者的EAT体积与升主动脉弹性有明显的相关性。EAT体积的评价能为临床早期预测冠心病患者升主动脉病变的发生提供有效参考。
冠心病;体层摄影术,螺旋计算机;冠状血管造影术;心包;脂肪组织;主动脉;弹性
心包脂肪(pericardial adipose tissue,PAT)是沉积在心脏周围的局部脂肪库,是一个代谢旺盛的组织。PAT包括心外膜脂肪(epicardial adipose tissue,EAT)和心包外脂肪(paracardial adipose tissue,PDT)。EAT是心肌与心包脏层之间的脂肪组织,在成年人心脏中覆盖了80%的心脏表面[1]。有研究表明,EAT是冠状动脉粥样硬化发生潜在的影响因素[2-3]。主动脉弹性是一项血管功能学指标,其变化是主动脉粥样硬化的早期表现。主动脉弹性与冠状动脉粥样硬化、心血管疾病的发生有密切关系[4-5]。然而,目前国内外对EAT体积与升主动脉弹性关系方面的研究相对较少。本研究利用CT研究EAT体积与升主动脉弹性的关系,旨在为临床预防及评估升主动脉粥样硬化提供参考。
1 资料与方法
1.1 研究对象 收集2016年1-9月于锦州医科大学附属第一医院经冠状动脉CT血管造影(CTA)及冠状动脉血管造影(coronary angiography,CAG)检查的疑似冠心病的患者。排除标准:各种心律失常以及心肌、心脏瓣膜病,心力衰竭,感染,电解质紊乱,严重肝、肾功能不全,呼吸疾病不能屏气10 s以上,主动脉夹层,主动脉瘤,壁间血肿,对碘造影剂过敏及未签署知情同意书拒绝接受上述检查者。研究最终共纳入169例,其中男79例,女90例;年龄27~84岁,平均(56.14±10.52)岁。根据是否患有冠状动脉粥样硬化分为对照组和研究组。将研究组按冠状动脉粥样硬化程度评分(Gensini score,GS)分为:轻微病变组(GS<5分),轻度病变组(GS 5~25 分),中度病变组(GS 26~ 59分),重度病变组(GS≥60分)[6]。本研究以文献记载EAT体积的阈值107.2 cm3为界,分为暴露组和非暴露组[7]。所有患者一般资料见表1。高血压和糖尿病的构成比组间差异有统计学意义(χ2=16.491、6.833,P<0.05);性别、血脂异常的构成比组间差异无统计学意义(χ2=1.795、3.573,P>0.05)。
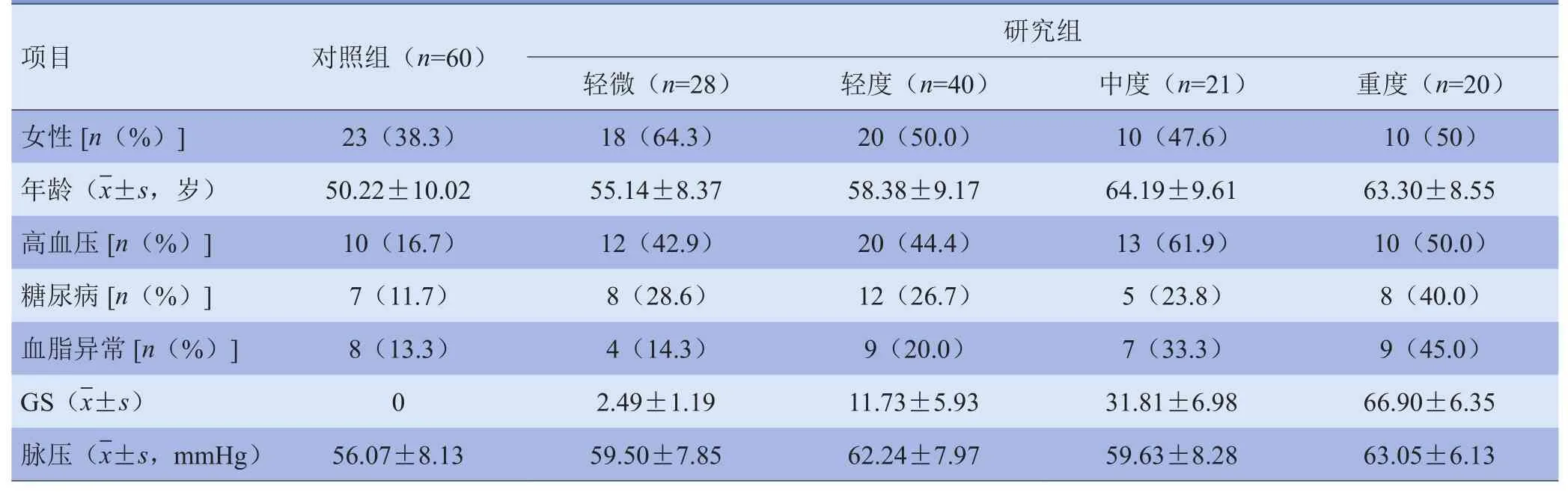
表1 纳入疑似冠心病患者一般资料比较
1.2 仪器与方法 使用Philips 256 Briliance iCT(极速CT),扫描层厚0.90 mm,层距0.45 mm,螺距0.27,转速0.27 s/r,120 kV自动毫安秒,非离子型碘对比剂碘海醇350 mgI/ml,静息心率>70 次/分时服用酒石酸美托洛尔片控制心率。先进行双定位扫描,再从左冠状动脉开口层面行对比剂跟踪电影扫描。设左冠状动脉开口层面主动脉根部为感兴趣区(ROI)并测量时间-密度曲线,计算扫描延迟时间,扫描范围自气管隆突至心脏膈面,以5.5 ml/s注入对比剂75 ml,随后注入生理盐水40 ml,在回顾性心电门控下自头侧向足侧扫描。
1.3 心外膜脂肪体积测量方法 将冠状动脉 CTA 原始图像数据导入GE ADW 4.5工作站,选取左冠状动脉开口上5 mm至心尖层面的范围,每隔3层手动勾画各层面完整的心外膜轮廓,得到EAT三维立体图像。设定脂肪密度范围为-250~-30 HU,利用阈值工具分割出该部分组织,伪彩工具设定红色区域表示EAT,然后使用体积测量工具测得EAT体积。由2名医师单独完成测量,取平均值。偏差较大时,请第3名医师测量。见图1。
1.4 升主动脉弹性测量方法 在GE ADW 4.5工作站自动生成主动脉-冠状动脉的曲面重组图像。于冠状动脉窦上方约15 mm处测量升主动脉横断面积,取最大面积A(收缩末期)及最小面积Ao(舒张末期),由2名影像专业住院医师测量上述数据,每名研究对象连续测量2个心动周期后取平均值(图2)。获得主动脉弹性指标:弹性值D=ΔA/Ao×ΔP,ΔA代表管腔最大与最小面积的差值,ΔP 代表脉压差[8]。在所有患者中随机抽取30例,并于2周内通过超声测量升主动脉壁弹性。检查前后2次测量患者血压,取平均值。
1.5 冠状动脉的评估 由2名影像专业主任医师对CTA结果独立进行评估。偏差较大时,请第3名医师评估。当CAG和CTA 检查显示的冠状动脉狭窄程度不同时,以 CAG结果为准。采用GS系统对所有冠状动脉病变的血管狭窄程度给予评定[9]。
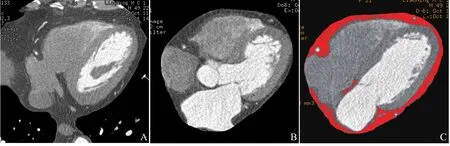
图1 男,49岁,冠心病。在冠状动脉CTA原始轴位图像上勾画心外膜轮廓(A);心脏三维立体图像的轴位观(B);伪彩图像上红色区域代表EAT(C)
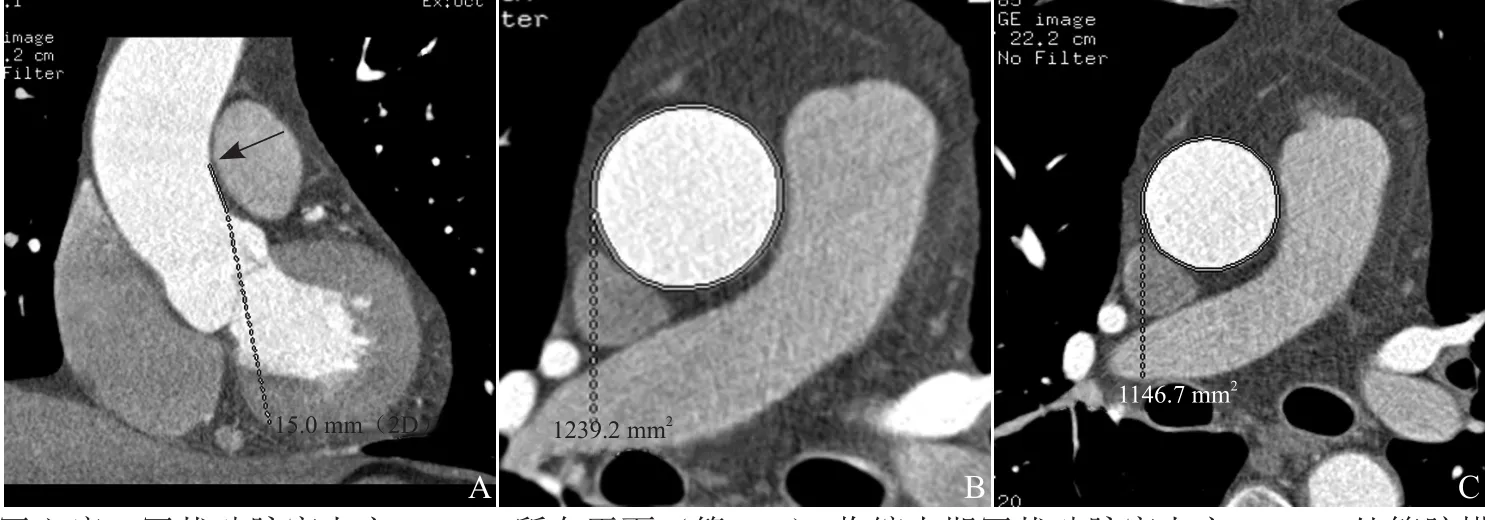
图2 男,49岁,冠心病。冠状动脉窦上方15 mm所在平面(箭,A);收缩末期冠状动脉窦上方15 mm处管腔横截面积(B);舒张末期冠状动脉窦上方15 mm处管腔横截面积(C)
1.6 统计学方法 采用SPSS 17.0软件。计量资料以x±s表示,组间比较采用成组资料t检验;计数资料组间比较采用χ2检验。EAT体积与升主动脉弹性的关系采用Pearson相关分析;使用多重元线性回归分析包括EAT体积在内的与升主动脉弹性相关的各种独立影响因子;一致性检验采用Bland-Altman和ICC法。P<0.05表示差异有统计学意义。
2 结果
2.1 EAT体积与左心功能的关系 Pearson相关分析结果显示,对照组与研究组的舒张末期容积(end diastolic volume,EDV)、收缩末期容积(end systolic volume,ESV)、心肌质量 (myocardial mass,MM)均与EAT体积呈正相关;心输出量(cardiac output,CO)、射血分数(ejection fraction,EF)与EAT体积无相关性。见表2。

表2 心外膜脂肪体积与左心功能的相关性
2.2 超声与CT测量升主动脉弹性的一致性 CT和超声测得弹性值的Bland-Altman图(图3)中,所有测得数值均位于95%一致性界限之内,提示两种测量手段所测得弹性值的一致性良好;且ICC=0.963(P<0.05),表明2种方法具有较好的一致性。

图3 CT和超声测得弹性值的Bland-Altman一致性检验
2.3 EAT体积与升主动脉弹性的关系 Pearson相关分析结果显示,对照组EAT体积与升主动脉弹性无相关性,研究组内的不同程度分组均呈负相关。见表3。
2.4 升主动脉弹性影响因子的多重线性回归分析 多重线性回归分析结果显示,校正其他影响因子后,高血压、糖尿病、血脂异常、EAT体积、GS均是升主动脉弹性的独立影响因子(P<0.05),性别、年龄、脉压差均不是升主动脉弹性的独立影响因子(P>0.05)。见表4。2.5 EAT体积与冠状动脉粥样硬化的关系 对照组与研究组EAT体积差异有统计学意义(t=6.389,P<0.05);暴露组发生冠状动脉粥样硬化斑块的危险性是非暴露组的9.318倍,差异有统计学意义(χ2=39.318,P<0.05)。见表5。
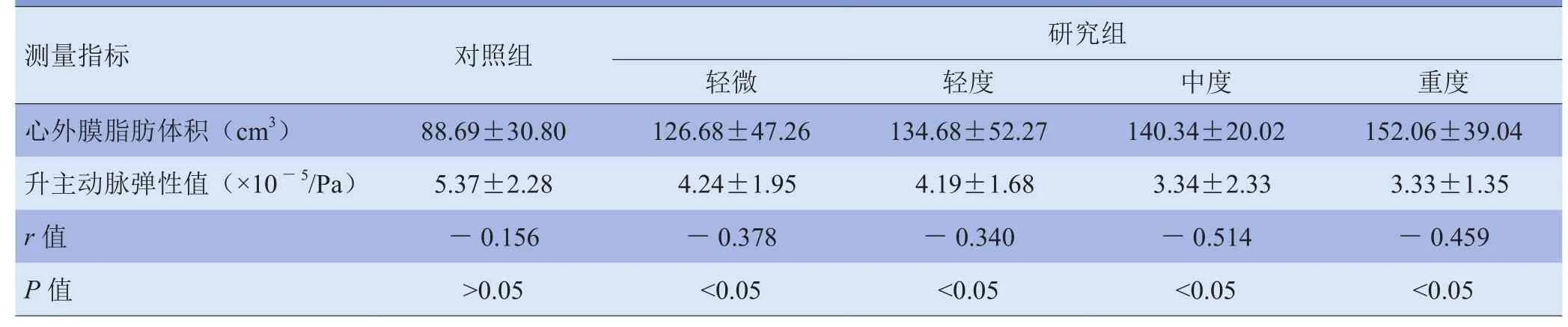
表3 EAT体积与升主动脉弹性的Pearson相关分析(x±s)
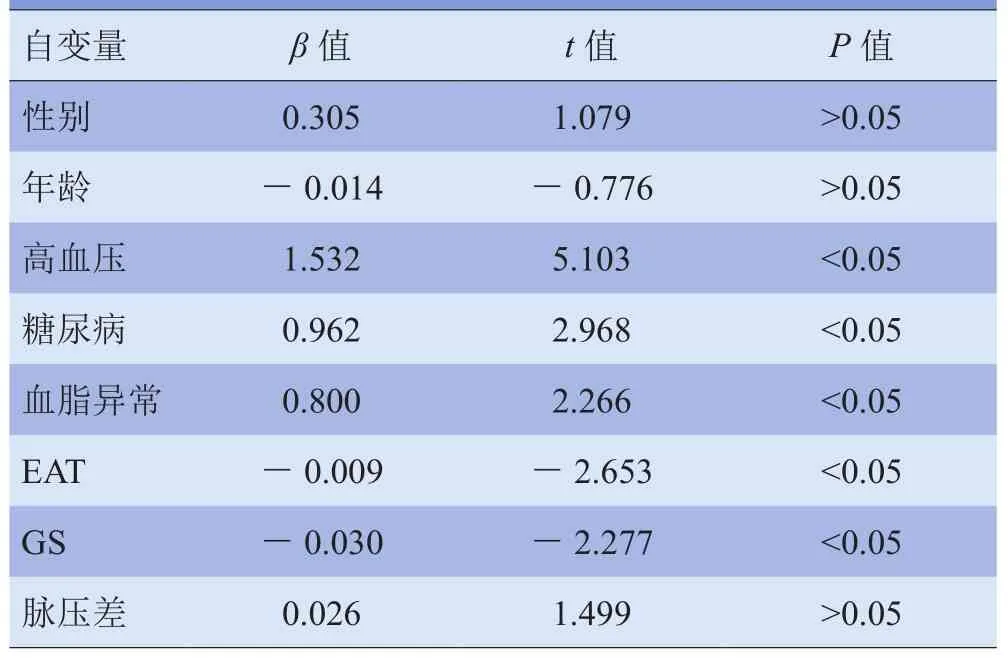
表4 升主动脉弹性影响因子的多重线性回归分析
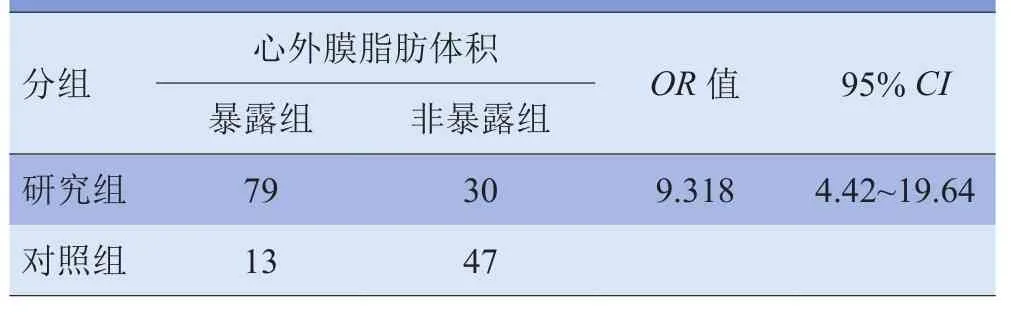
表5 EAT与冠状动脉粥样硬化的关系
3 讨论
EAT是沉积在心脏表面心外膜下的内脏脂肪组织,属于内脏型肥胖的一种,大多分布于房室沟、室间沟、右心室游离壁。心包内脂肪组织可缓冲冠状动脉因动脉脉冲和心脏收缩引起的扭转,起到保护心脏的作用。目前,测量EAT的方法包括超声、MRI、CT等。超声测量费用低,准确度较高,在临床中广泛应用;但其重复性较差,仅能测得右心室游离壁的厚度,且探头的方向和位置会造成极大的误差。MRI重复性好、准确性高,但易受呼吸运动伪影的影响,且空间分辨率较低,在临床应用中受到限制。近年来CT的空间分辨率及时间分辨率不断提高,在临床中越来越多地用于EAT的测量,并在胸主动脉病变的诊断中起着十分重要的作用[10]。本研究结果证实CT与超声测得值具有良好的一致性,这与王振威等[11]的研究结果一致。CT可以一站式分析冠状动脉、升主动脉病变和测量EAT体积,在临床中广泛应用,在评估EAT体积方面也起着越来越重要的作用。本研究利用CT分析EAT体积与升主动脉弹性的关系。
EAT是动脉粥样硬化性疾病和代谢综合征的一个重要危险因素[12]。主动脉弹性降低是多种心血管危险因素对血管壁早期损害的综合反映,是动脉粥样硬化的早期表现[13]。EAT和腹部脂肪组织一样,既是能量储存器官,又是内分泌器官,其特殊位置和多方面的代谢特点成为心血管疾病的影响因素[14]。有研究显示,用超声测得高血压患者的心外膜脂肪的厚度是主动脉弹性的独立影响因子[15]。本研究结果表明,对照组的EAT体积与升主动脉弹性无相关性,研究组各分组的EAT体积均与升主动脉壁弹性呈明显负相关,且多重线性回归分析校正影响升主动脉弹性的其他因子后,仍是升主动脉动脉弹性的影响因子。Park等[16]研究结果显示,通过心踝血管指数测得的主动脉弹性与EAT相关,与本研究结果相符。EAT影响升主动脉弹性的机制可能为EAT即包绕心肌、冠状动脉,也包绕部分出入心脏的大血管(如升主动脉近段),并与升主动脉壁之间无筋膜隔开。EAT合成分泌的各种生物活性分子如血管紧张素原、肿瘤坏死因子、白细胞介素、单核细胞趋化蛋白、抵抗素、脂联素、瘦素和内脂素等也可以通过内分泌或旁分泌途径直接作用于升主动脉壁,从而促进其内皮功能的失调、交感神经过度活跃、内皮氧化损害、脂质堆积等,进而引起动脉粥样硬化[17-19]。因此,EAT体积增加会促进升主动脉粥样硬化的形成。
目前许多国内外相关研究结果显示,EAT能够通过分泌多种细胞脂肪因子及炎症因子促进冠状动脉粥样硬化的发生与发展[20-21]。本研究结果也已证实,对照组与研究组EAT体积差异有统计学意义(P<0.05);χ2分析显示暴露组发生冠心病的概率是非暴露组的9.318倍,说明EAT体积的增加会提高冠心病的发生风险。李健等[22]的研究结果显示EAT暴露组发生冠心病的概率是非暴露组的5.3倍。本研究的发病风险较李健等[22]的研究结果偏高,可能是由于EAT的阈值选择不同所致。总之,EAT体积的增加与冠心病的发病率有关。本研究中,对照组与研究组的EAT体积均与EDV、ESV、MM呈正相关,与CO、FE无相关性,说明EAT体积与左心功能具有一定的相关性,这与国内外研究结果一致[23]。有研究证实EAT体积与急性心肌梗死有明显的相关性,进一步证实EAT体积的增加会提高心血管疾病的发生率[24]。
本研究的局限性为:研究对象设定为心血管疾病的高危人群,这种选择偏倚会对研究结果造成一定的影响。通过酒石酸美托洛尔片控制患者心率,可能会对主动脉弹性产生影响。多因素影响升主动脉壁弹性,本研究仅对高血压、糖尿病、血脂异常、年龄、性别等因素进行校正。本研究未对年龄进行分组分析,每组中高血压、糖尿病患者构成比的不同也可能会对结果造成一定的影响。
总之,冠心病患者的EAT体积与升主动脉壁弹性呈明显负相关。EAT会同时对升主动脉、冠状动脉造成影响。临床可以通过冠脉CTA对EAT、主动脉弹性、冠状动脉进行一站式评估,为临床预防冠心病患者升主动脉粥样硬化并及时进行抗脂治疗提供一定的参考依据。
[1]何彪, 郭庆乐. 64层CT对心外膜脂肪组织与冠心病相关性的研究进展. 中国当代医药, 2015, 22(6): 17-19.
[2]Lee HY, Despres JP, Koh KK. Perivascular adipose tissue in the pathogenesis of cardiovascular disease. Atherosclerosis, 2013, 230(2): 177-184.
[3]Lim S, Meigs JB. Links between ectopic fat and vascular disease in humans. Arterioscler Thromb Vasc Biol, 2014, 34(9): 1820-1826.
[4]Aslan AN, Ayhan H, Çiçek ÖF, et al. Relationship between aortic stiffness and the left ventricular function in patients with prediabetes. Intern Med, 2014, 53(14): 1477-1484.
[5]吴磊, 查云飞, 陈文, 等. MSCT评价冠心病患者降主动脉弹性与冠状动脉粥样硬化相关性. 湖北医药学院学报, 2014, 33(1): 32-35.
[6]谢美艳, 牛玉军. 应用多层螺旋CT分析冠心病心外膜脂肪体积与左心室功能的相关性. 解放军医学院学报, 2015, 36(11): 1081-1084, 1092.
[7]Kunita E, Yamamoto H, Kitagawa T, et al. Prognostic value of coronary artery calcium and epicardial adipose tissue assessed by non-contrast cardiac computed tomography. Atherosclerosis, 2014, 233(2): 447-453.
[8]Dogui A, Kachenoura N, Frouin F, et al. Consistency of aortic distensibility and pulse wave velocity estimates with respect to the Bramwell-Hill theoretical model: a cardiovascular magnetic resonance study. J Cardiovasc Magn Reson, 2011, 13(1): 11.
[9]Li N, Beck T, Chen J, et al. Assessment of thoracic aortic elasticity: a preliminary study using electrocardiographically gated dual-source CT. Eur Radiol, 2011, 21(7): 1564-1572.
[10]周长武, 赵锡海, 李澄. 胸主动脉粥样硬化斑块影像学研究进展. 中国医学影像学杂志, 2016, 24(5): 384-387, 391.
[11]王振威, 王志铭, 宋丽萍, 等. 多层螺旋CT评价主动脉弹性与冠状动脉斑块性质的相关性. 解放军医学院学报, 2013, 34(7): 740-743.
[12]Sacks HS, Fain JN. Human epicardial adipose tissue: a review. Am Heart J, 2007, 153(6): 907-917.
[13]Aslan AN, Sarı C, Özer Sarı S, et al. Association between aortic stiffness and left ventricular function in inflammatory bowel disease. Cardiol J, 2016, 23(2): 202-210.
[14]Kaikita K. Epicardial adipose tissue as a predictor for the development of non-calcified coronary plaque. J Atheroscler Thromb, 2017, 24(3): 254-255.
[15]Doğan M, Turak O, Akyel A, et al. Increased epicardial adipose tissue thickness is linked to aortic stiffness in patients with primary hypertension. Blood Press, 2014, 23(4): 222-227.
[16]Park HE, Choi SY, Kim HS, et al. Epicardial fat reflects arterial stiffness: assessment using 256-slice multidetector coronary computed tomography and cardio-ankle vascular index. J Atheroscler Thromb, 2012, 19(6): 570-576.
[17]Iacobellis G, Pistilli D, Gucciardo M, et al. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with coronary artery disease. Cytokine, 2005, 29(6): 251-255.
[18]Canga A, Kocaman SA, Cetin M, et al. Increased epicardial adipose tissue thickness is correlated with ascending aortic diameter. Tohoku J Exp Med, 2012, 226(3): 183-190.
[19]Iacobellis G. Local and systemic effects of multifaceted epicardial adipose tissue depot. Nat Rev Endocrinol, 2015, 11(6): 363-371.
[20]Wang J, Wang LJ, Peng YP, et al. Association of pericardial adipose tissue volume with presence and severity of coronary atherosclerosis. Clin Invest Med, 2013, 36(3): E143-E150.
[21]杜俣, 吉庆伟, 王志坚, 等. 心外膜脂肪组织与冠状动脉粥样硬化性心脏病关系及其机制的研究进展. 临床心血管病杂志, 2016, 32(4): 324-327.
[22]李健, 周瑞臣, 刘景旺, 等. 心外膜脂肪组织体积与冠状动脉粥样斑块的关系. 中国医学影像技术, 2015, 31(6): 850-853.
[23]Kusayama T, Furusho H, Kashiwagi H, et al. Inflammation of left atrial epicardial adipose tissue is associated with paroxysmal atrial fibrillation. J Cardiol, 2016, 68(5): 406-411.
[24]王昌, 徐勇, 智光, 等. 心外膜脂肪组织厚度与急性心肌梗死的关系. 中国医学影像学杂志, 2014, 22(4): 256-258.
(本文编辑 闻 浩)
Correlation Between Epicardial Adipose Tissue and Ascending Aortic Stiffness Measured by CT
Purpose To explore the relationship between epicardial adipose tissue (EAT) volume and ascending aortic stiffness by CT, so as to early evaluate the lesions of ascending aortic by measuring EAT. Materials and Methods 169 patients with suspected coronary artery disease who underwent coronary CT angiography and coronary angiography in First Affiliated Hospital of Jinzhou Medical University from January 2016 to September 2016 were enrolled. According to the presence of coronary atherosclerosis or not, the patients were divided into research group (109 cases) and control group (60 cases). The research group were further divided into slight, mild, moderate and severe group according to the Gensini score of coronary atherosclerosis. The recorded threshold of EAT volume was 107.2 cm3. The patients with EAT volume higher than 107.2 cm3belonged to the exposure group, and the rest belonged to the non exposure group. The EAT volume and ascending aortic stiffness were measured, and the relationship between them was assessed. The relationship between EAT volume and coronary atherosclerosis was also analyzed. Results In the control group, there was no correlation between EAT volume and ascending aortic stiffness (r= - 0.156, P>0.05). However, there were negative correlations between EAT volume and ascending aortic stiffness in slight, mild, moderate and severe group (r=-0.378,-0.340,-0.514 and -0.459, P<0.05). The EAT volume was an independent risk factor of ascending aortic stiffness (β=-0.009, t=-2.653, P<0.05). The incidence of CAD in the exposure group was 9.318 times of that in the non exposure group. Conclusion There is obvious correlation between EAT volume and ascending aortic stiffness in patients with CAD. The evaluation of EAT volume can provide an effective reference for the early prediction of ascending aortic lesions in patients with CAD.
Coronary disease; Tomography, spiral computed; Coronary angiography; Pericardium; Adipose tissue; Aorta; Elasticity
10.3969/j.issn.1005-5185.2017.07.012
1. 锦州医科大学附属第一医院放射科 辽宁锦州 121001
2. 唐山市人民医院放射科 河北唐山
063000
牛玉军
Department of Radiology, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China
Address Correspondence to: NIU Yujun E-mail: nyjcrx@163.com
2016-12-27
修回日期:2017-02-06
R541.4;R445.3
中国医学影像学杂志
2017年 第25卷 第7期:525-529
Chinese Journal of Medical Imaging 2017 Volume 25 (7): 525-529
