大鼠卵巢去势后颌骨和股骨骨髓基质干细胞性能观察
2017-08-07惠亚玲何勇郭丽
惠亚玲 何勇 郭丽
1.武警工程大学武警医院急诊科,陕西 西安 710032 2.武警工程大学武警医院口腔中心,陕西 西安 710032 3.西安市第九人民医院口腔科,陕西 西安 710038
骨质疏松具有较高的发病率,尤其是女性绝经后因雌激素的缺乏可导致每年骨量丢失达到3%~5%,严重影响中老年女性患者的生活。骨质结构和功能的变化是骨髓干细胞生物学活性变化的结果。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs) 是目前研究较多的成体干细胞之一,在适宜的诱导下具有向骨、软骨、脂肪、神经等多向分化潜能,也是组织工程中较理想的种子细胞[1,2]。
大量资料提示雌性大鼠去除卵巢后机体雌激素和骨密度将迅速下降,在短时间内极好地模拟绝经后骨质疏松症(osteoporosis postmenopausal,OPM)的病理生理变化,是较为理想的动物观察模型[3];有学者发现骨质疏松对颌骨的影响在程度和时效上均弱于全身其他骨骼[4],这种差异是否也表现在干细胞的生物学活性尚不确切。本实验通过构建骨质疏松模型进行颌骨和股骨来源的BMSCs增殖和成骨分化能力的比较研究,旨在观察骨质疏松对不同部位骨髓基质干细胞增殖和成骨分化的影响。
1 材料和方法
1.1 实验动物和材料
1.1.1实验动物:健康雌性未孕SD大鼠40只(购于第四军医大学动物中心),18 w龄,体质量(160.12±7.12) g,同等条件下分笼适应性饲养1 w 后,随机分为对照组及实验组。实验过程严格遵照第四军医大学动物伦理委员会准则。
1.1.2实验试剂及仪器:DMEM培养基(Gibco,美国);胎牛血清(杭州四季青生物工程有限公司);地塞米松(Sigma,美国);L-谷氨酰胺(Gibco, 美国);抗坏血酸(Sigma,美国);0.25%胰蛋白酶(Amresco,美国);青、链霉素(Gibco,美国);CCK-8 检测试剂盒 (博士德生物工程有限公司,武汉)。
超净工作台(苏州 SW-CJ-1SD);酶联免疫检测仪(南京华东DG5032);二氧化碳恒温孵箱(Forma,美国);离心机(Kubota,日本);六孔培养板(Nunc公司, 美国);96孔培养板(Nunc公司, 美国);倒置相差显微镜及照相系统((Olympus,日本)。
1.2 实验方法
1.2.1去卵巢骨质疏松大鼠模型的建立:清洁级SD大鼠20只,经2%戊巴比妥钠麻醉腹腔注射麻醉生效后,消毒铺巾, 自背部切开,完整摘除双侧卵巢,关闭术区。术后定量喂食, 自由饮水, 饲养温度20~25℃, 相对湿度为40%~70%。
1.2.2实验分组:16只未去卵巢大鼠和术后10 w建模成功的16只去卵巢大鼠分成4组各8只分别用于提取原代颌骨及股骨骨髓间充质干细胞。4只未去卵巢大鼠用于体内实验。
1.2.3大鼠骨髓基质细胞的分离及培养:采用全骨髓贴壁法分别培养去卵巢大鼠和健康大鼠的颌骨骨髓基质干细胞(mBMSCs)和股骨骨髓基质干细胞(fBMSCs)。大鼠处死后即刻浸泡于75%乙醇中10 min,于超净工作台下剥离下颌骨,拔出牙齿,暴露骨髓腔;切取双侧股骨,清理骨表面组织,去除股骨两端,露出骨髓腔,用DMEM 培养基经2 mL注射器反复冲洗骨髓腔,转移冲洗液至离心管中,1000 r/min离心5 min,弃上清,重复离心2次,用含10%胎牛血清的DMEM 培养基轻轻吹打制备单细胞悬液,并接种于60 mm2培养皿中,标记,于37 ℃,5% CO2孵箱培养48 h,贴壁细胞即为BMSCs,原代细胞铺满瓶底约85%时即常规传代培养。
1.2.4骨髓基质干细胞增殖能力
1.2.4.1CCK-8 实验:调整四组第二代细胞以每孔100 μL,2×103个/孔密度接种于96孔板,各组分别于接种后第1、3、5、7d加入CCK-8溶液10 μL/孔,孵育4 h后酶标仪测定450 nm处吸光度。操作严格按照CCK-8试剂盒的步骤说明进行。
1.2.4.2MTT分析:将四组干细胞分别以2×103/孔的密度接种于96孔培养板,按0.2 mL/孔加入培养液,37℃下5%CO2孵箱中连续培养7d,隔日换液。连续6 d每组每日定时测量6个孔,加入20 μL 5 mg/mL的MTT液,继续孵养4 h。去除孔内培养液上清液,每检测孔加入150 μL的DMSO,低速震荡10 min,确保结晶物充分融解。酶联检测仪测量490 nm波长处各孔吸光度(OD),分别以时间为横坐标,吸光值为纵坐标绘制生长曲线。
1.2.5骨髓基质干细胞膜片的制备与体内移植
1.2.5.1体内异位移植实验:将增殖状态良好的第3代BMSCs胰酶消化5 min,调整细胞悬液密度,以5×105个数量分别均匀接种于直径90 mm培养皿,加入10 mL DMEM培养液(含10%FBS、50 μg/mL 抗坏血酸),隔日换液,连续孵育10 d后培养皿出现底部贴合紧密,边缘微卷的乳白色膜样物质,此即为成熟的BMSCs单层细胞膜片。
1.2.5.2体内异位移植实验:A 网膜下移植:4只SD大鼠经2%苯巴比妥钠麻醉,固定、腹部脱毛、消毒铺巾,腹部横切口暴露大网膜,于网膜中份分离两层网膜制备移植囊,分别将4种干细胞膜片与TCP复合置于植床内,适度内折固定,复位网膜,关闭创口。B 组织学评价:观察6 w处死动物,完整切取移植物,10%福尔马林固定,冲洗,脱钙,系列脱水、石蜡包埋、切片,HE染色,光镜观察。
1.3 统计学处理
采用SPSS13.0软件对实验数据进行统计分析,进行单因素方差分析。
2 结果
2.1 去卵巢骨质疏松大鼠模型
本组20只去卵巢大鼠因4只出现手术并发症先后死亡,其余16只大鼠在去卵巢后体质量2w内平均增加37+8.1g,术后8w时经股骨骨密度检测显示BMD平均降低了97%,证实了模型的建立。
2.2 BMSCs形态学观察
本实验健康及骨质疏松状态下原代BMSCs均贴壁迅速,二者贴壁速度及形态学特征均未见显著性差异。4组细胞接种6 d后倒置相差显微镜下均分布较为均匀,贴壁细胞形态呈多样化,以纺锤形为主,短梭形、多角形、星形等均可察见。8d后可见梭形细胞呈漩祸状集落生长,其间散在少许圆形细胞,集落间呈现融合趋势。颌骨和股骨BMSCs间以及健康与骨质疏松状态下BMSCs间细胞贴壁及增殖速度未见明显差异,传代后4类细胞均生长均匀,胞体明显增加,倾于均一的长梭形。
2.3 4种骨髓基质干细胞增殖情况
采用CCK-8法检测OD值,比较不同部位及全身骨状况对BMSCs的影响,结果显示,随着培养时间的延长,BMSCs的增殖活性呈升高趋势;骨质疏松状态下颌骨及股骨BMSCs的增殖速度初期与健康状态下的细胞无显著性差异(P>0.05),3d后增殖速度则逐渐缓慢于健康组(P<0.05);健康组颌骨和股骨不同部位间两种BMSCs的OD值比较无统计学差异(P>0.05),骨质疏松状态下颌骨来源BMSCs后期的增殖能力明显优于股骨来源的BMSCs(P<0.05)。见图1。
2.4 MTT分析
4组细胞不同时间段的单因素方差分析结果显示,去卵巢组在同等时间条件下与未去卵巢组比较,1d时总体均数差异无显著统计学意义,2d后各时段均数差异具有显著统计学 意义(P<0.05)。由此可见,骨质疏松对BMSCs的增殖的影响具有时间依赖性。颌骨和股骨BMSCs在健康骨质环境下,细胞的OD值各时间段均未出现统计学差异,骨质疏松状态下颌骨的增殖速度初期与股骨BMSCs无显著性差异(P>0.05),48h后增殖速度则逐渐快于对照组(P<0.05);提示骨质疏松对BMSCs的增殖可能存在着部位因素影响。见表1。

表1 不同部位及骨质状况培养的BMSCs的吸光度(OD)值Table 1 Optical density of cultured BMSCs in different location and bone condition
注:去卵巢组内比较,aP<0.05;去卵巢股骨BMSCs与未去卵巢股骨BMSCs比较,bP<0.05;去卵巢颌骨BMSCs与未去卵巢颌骨BMSCs比较,cP<0.05; 未去卵巢股骨BMSCs 与去卵巢颌骨BMSCs比较,dP<0.05
2.5 不同来源BMSCs细胞膜片的性能
4类细胞采用低密度接种法均能获取骨髓基质干细胞膜片,膜片的成熟时间为7~10 d,去卵巢组BMSCs的成膜及成熟时间略慢于未去卵巢组。动态观察显示,从成骨诱导第三天开始就能观察到细胞外基质的沉积,相对而言未去卵巢组BMSCs基质分泌量及分布较骨髓基质干细胞更为迅速、均匀,后期镜下观察未见显著差异。4种膜片随孵育时间增长,细胞外基质大量分泌,细胞极性化排列更为整齐紧密、胞体更丰满,细胞的梭形外形变得相对圆润,细胞突起伸展自然且完整,细胞间有序地连接,细胞复层化趋势更为明显。成熟的膜片厚度上未见明显差异,剥离后均能迅速收缩。
4种膜片的大网膜移植结果,显示体内移植6w后,在TCP诱导下均可形成不均质的矿化物沉积和纤维样组织穿通,似牙周膜/牙骨质复合体样结构;去卵巢组BMSCs膜片组再生的纤维束更为粗大,走形不一致,仅见少量的矿化物质的生成,颌骨来源BMSCs组较股骨来源BMSCs再生矿化物能力强;未去卵巢组颌骨来源BMSCs组较股骨来源BMSCs组纤维穿通性更明显,表面矿化沉积更均衡,有满意的牙骨质/牙周膜样复合体的形成(见图2)。
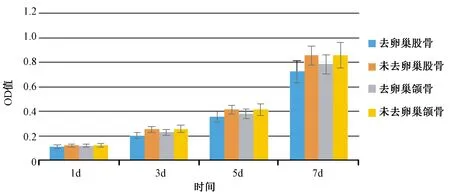
图1 不同部位及骨质状况对BMSCs增殖能力的影响Fig.1 The effect different location and bone condition on the proliferation of cultured BMSCs
3 讨论
骨质疏松是一种以骨量减少为特征的骨代谢性疾病,其发病因素众多,各种诱因导致的病理归宿均为骨组织成骨能力弱于破骨能力、骨微结构破坏、骨量丢失、骨强度下降,增加患者骨折的风险[5-7]。骨组织的健康是骨形成与骨吸收之间动态平衡的结果,成骨细胞和破骨细胞的生物学活性及状态直接影响着骨组织的转归。骨髓间充质干细胞广泛存在于全身骨髓组织和松质骨内,作为成骨细胞的前体细胞,具有成骨、成脂、成软骨等多向分化能力,对于调控骨吸收和骨形成的相对平衡起着至关重要作用[8,9]。随着现代分子生物学技术的深入运用,大量资料证明BMSCs的异常表现与骨质疏松症的发病密切相关。干细胞的生物学活性极大程度上受骨髓局部微环境的调控,机体激素水平、营养状况以及局部应力和炎症变化等因素均可使微环境中细胞因子发生改变,继而通过调节成骨细胞的生存时间及状态来适应内环境的变化,当BMSCs的功能异常导致骨吸收-骨形成的偶联失调时将导致骨质疏松的发生[10,11]。对OPM的BMSCs生物学状态的研究尚存争议,有学者发现OPM患者BMSCs对成骨诱导分化的敏感性和钙沉积程度均明显下降;也有学者观察到OPM患者因雌激素缺乏,BMSCs的多向分化和增殖能力适应性增强以满足骨吸收而代偿性地增加骨形成,进而导致骨重建的失衡。这些研究结果均提示在骨质疏松状态下BMSCs的生物学活性异常,其活性对于疾病的发展及转归具有重要意义。
膜片技术通过细胞外基质的大量沉积进而有序地将细胞连接成一种不需要外源性材料,完全由细胞及细胞外基质组成的片状结构。膜片内这些精细构建的复杂的信号及结构系统可以提高细胞的生物学活性,更便于对干细胞的生长、发育及分化过程进行全方位的调控及干预,是干细胞移植定向分化的一个重要的研究方向[12]。
目前关于骨质疏松对全身骨组织和口腔骨组织的影响是否具有差异性尚存争议,但多数数据显示由雌激素缺乏所引起的骨质疏松对全身骨组织与颌骨的作用是不同步的,颌骨结构在骨质疏松早期尚无明显改变,相对滞后于全身骨组织[13]。颌骨发育于颅神经嵴源外胚间充质,具有独特的膜内成骨机制,这些资料均提示颌骨来源的BMSCs具有BMSCs的生物学特性,但依然可能存在着一定的部位差异性。本组将4种细胞膜片与骨替代物的异位移植拟观察四种BMSCs在成骨分化方面的性能差异,结果显示颌骨来源的BMSCs能够形成不均质的矿化物沉积和纤维样组织穿通,再生类牙周膜/牙骨质复合体样结构的能力较股骨来源的BMSCs相对较强,这证实了BMSCs分化潜能的区域性,颌骨来源的BMSCs倾向于向颌面部组织细胞分化,更有利于牙源性组织工程的应用。在矿物质的诱导下骨质疏松状态的股骨来源的BMSCs的成骨活性有所降低,移植6w未见显著的矿物质沉积,仅有大量的无序的成纤维组织的再生,但在同等骨条件下其颌骨来源的BMSCs依然表现出一定的成骨分化能力;细胞实验也提示健康和去卵巢骨质疏松大鼠的骨髓间充质干细胞培养未见形态学的显著差异;但BMSCs的增殖实验发现接种初期去卵巢骨质疏松大鼠与健康状态下的细胞增殖速度无显著性差异,随培养时间的延长,各类BMSCs的增殖活性均出现显著差异性,骨质疏松状态下干细胞的活性显著弱于健康组,但骨质疏松状态下颌骨来源的干细胞后期的增殖能力虽然较健康组有所减弱,但明显强于股骨来源的BMSCs,本组结果部分印证了上述研究,但这是否提示骨质疏松状态下颌骨来源的BMSCs的生物学活性受影响的程度相对较小,尚待进一步探讨。
