外源性胰岛素在老年2型糖尿病患者骨质疏松治疗中的作用
2017-08-07徐蓉丘凌汪思阳曲毅
徐蓉 丘凌 汪思阳 曲毅
上海市徐汇区中心医院老年病科,上海 200031
随着社会老龄化加剧,糖尿病、骨质疏松症成为老年人群常见的代谢性疾病,由于骨质疏松易致疼痛和病理性骨折[1],使患者的治疗和康复更加困难,因而不断探索和研究2型糖尿病合并骨质疏松的发病机制,对临床诊疗工作具有重要意义。研究表明,糖尿病胰岛素缺乏和高血糖均可损害骨形成[2]。胰岛素可通过多种途径使骨钙素与骨胶原合成增加,还能与PTH协同调节1-a羟化酶活性.促进1,25二羟D3[l,25-(OH)2D3]的合成[3]。然而,2型糖尿病患者存在胰岛素相对不足或胰岛素敏感性降低,其促进l,25-(OH)2D3合成和分泌骨钙素作用降低[4],从而抑制成骨细胞活性,是导致骨质疏松的主要机制之一。动物实验发现,减少小鼠成骨细胞上胰岛素受体可使成骨细胞数目和骨胶原合成减少,导致骨质减少30%[5]。另一方面,糖尿病患者胰岛素分泌减少,降低了骨胶原的合成及成骨细胞数量,使骨基质分解增加,钙盐减少[6],形成骨质疏松。
本研究旨在观察2型糖尿病患者在相同骨质疏松治疗方案中,胰岛素降血糖组与口服降糖药治疗组相比较,其骨代谢、骨密度(bone mineral density,BMD)是否受益更大。
1 材料和方法
1.1 一般资料
收集2013年8月至2015年8月来本院就诊的2型糖尿病合并骨质疏松患者98例(男性57例,女性41例)。平均年龄74.0±5.3岁,其空腹血糖(fasting blood-gloucose, FPG)均大于7.0mmoL/L,糖化血红蛋白(glycosylated hemoglobin,HbAlc)6.5%~8.0%,体重指数(body mass index,BMI)21.2~29.4 kg/m2。纳入标准①按2007年ADA糖尿病诊断标准确,诊为2型糖尿病;②根据WH0推荐的根据骨密度测量的T值制定的诊断标准,T值<-2.5 SD为骨质疏松。排除标准:①1型糖尿病患者;②急性并发症如糖尿病酮症、高渗综合征等;③严重肝、肾功能损害者(血浆ALT水平>正常上限的3倍,血浆肌酐水平 ≥178μmol/L);④肿瘤、甲亢、甲旁亢或长期服用激素类药物患者。
1.2 方法
1.2.1研究者治疗分组:98例患者以简单数字法随机分为2组(每组49人):A组:阿仑膦酸钠、维D3片联合胰岛素(诺和灵30R)治疗组(男性29例,女性20例);B组:阿仑膦酸钠、维D3片联合口服降糖药物(亚莫利)组(男性28例,女性21例)。入组当日即签署告知书,并测定患者静脉FPG、HbAlc、碱性磷酸酶(alkaline phosphatase,AKP)、N端骨钙素(N-MID osteocalcin,N-MID)、25(OH)D2+D3、血钙(calcium, Ca)、BMI及BMD。
1.2.2研究者具体治疗方案:骨质疏松治疗:两组均给予阿仑膦酸钠、维D3片70 mg/周口服。每周固定一天清晨,空腹以温水100 mL送服。碳酸钙600 mg/d,睡前口服。降血糖治疗:A组患者早、晚餐前给予中长效胰岛素诺和灵30R皮下注射,剂量24~80U/d;B组患者给予磺脲类胰岛素促泌剂亚莫利 2~4 mg/d,早餐前口服。记录2组患者治疗第12周、24周及52周后的FPG、HbAlc、AKP、N-MID、25(OH)D2+D3、血Ca、BMI及BMD。因老年患者多伴腰椎骨质增生,故以左侧股骨颈骨密度值为基准。
1.2.3仪器检测方法:采用美国LUNAR公司DPX-LBMD双能X线骨密度仪(精确度5%,变异系数3%)。抽取患者空腹血清,采用LC-MS/MS法,以25羟基维生素D2-氘3和25羟基维生素D3-氘6为内标测定25(OH)D2和25(OH)D3,经过色谱分离、质谱分析,结果数据由Analyst 1.5软件采集,然后作定量分析处理;记录25羟基维生素D3和内标以及25羟基维生素D2和内标的峰面积的比值对相应样品的浓度值进行加权(1/X)线性回归,采用标准曲线法推出未知血样在线性范围内的浓度值。低、中、高浓度质控的准确度在85%~115%范围,CV<15%。采集静脉血用全自动生化仪测定FBG、血Ca、ALP。N-MID用罗氏诊断产品电化学发光法,Roche cobase411分析仪。
1.3 统计学处理
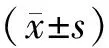
2 结果
2.1 2组患者基本情况比较(表1)
两组在年龄(age)、身高(height)、体重(kg)、BMI、病程(course)、HbAlc及BMD等指标基线水平差别无统计学意义(P>0.05)。
2.2 治疗12周后两组各项指标的比较(表2)
两组患者治疗第12周后FPG及HbAlc较治疗前显著下降(P<0.05);BMI、血Ca、25(OH)D2+D3、AKP及BMD轻度上升,与治疗前相比无明显统计学差异(P>0.05); N-MID轻度下降,与治疗前相比无统计学差异(P>0.05)。两组间患者治疗后各指标相比无明显统计学差异(P>0.05)。
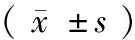

项目(Group/Index)A组(A Group)N=49B组(B Group) N=49年龄(岁)age(year)74.2±6.272.8±6.8病程(年)course(year)7.8±2.18.0±2.0身高(厘米)height(cm)162.9±10.5161.6±11.5体重(kg)Weight(kg)68.2±6.369.4±6.1体重指数(kg/m2)BMI(kg/m2)24.9±3.625.2±3.3糖化血红蛋白(%)HbA1c(%)7.3±0.87.2±0.7骨密度(g/cm2)BMD (g/cm2)0.694±0.1020.689±0.103
2.3 治疗24周后两组各项指标的比较(表3)
两组患者治疗第24周后FPG及HbAlC较治疗前显著下降(P<0.05);血钙(Ca)、AKP轻度上升,与治疗前相比差异无统计学意义 (P>0.05); N-MID轻度下降,与治疗前相比差异无统计学意义(P>0.05)。A组的25(OH)D2+D3、BMI及BMD较治疗前显著增加(P<0.05),较B组治疗后结果差异具有统计学意义(P<0.05)。B组的BMI、25(OH)D2+D3、BMD较治疗前轻度上升,与治疗前相比差异无统计学意义 (P>0.05)。
2.4 治疗52周后两组各项指标的比较(表4)
两组患者治疗第52周后FPG及HbAlC较治疗前显著下降(P<0.05); AKP轻度上升,与治疗前相比差异无统计学意义 (P>0.05); N-MID轻度下降,与治疗前相比差异无统计学意义 (P>0.05)。A组的BMI及血钙(Ca)较治疗前显著增加(P<0.05);25(OH)D2+D3、BMD 也较治疗前显著增加(P<0.01)。B组的25(OH)D2+D3、血钙(Ca)及BMD较治疗前显著增加(P<0.05); BMI与治疗前相比差异无统计学意义 (P>0.05)。A组的BMI及BMD治疗后较B组增加更显著(P<0.05),其余指标两组间治疗后结果差异无统计学意义 (P>0.05)。
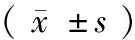
Note:Compared with before treatment in the same group,*P<0.05,#P<0.01;Comparison between the two groups after treatment,△P<0.05.
3 讨论
老年人群中2型糖尿病、骨质疏松症发病率高,众多研究指出,血胰岛素水平不足或胰岛素敏感性降低是糖尿病骨质疏松发生的主要原因。成骨细胞(OB)表面存在胰岛素受体,胰岛素能直接刺激成骨细胞,促进成骨细胞内氨基酸蓄积,骨胶原合成,分泌骨基质,发挥成骨作用[7]。胰岛素不足或敏感性降低可导致成骨细胞作用障碍和骨转换下降,合成骨钙素(BGP)减少,骨形成降低。同时,胰岛素可兴奋25-羟化酶,抑制腺苷酸环化酶和环磷酸腺苷(cAMP)合成的作用,抑制高血糖对成骨细胞分化和增殖的毒性作用[3]。
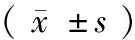

指标IndexA组A GroupN=49B组B GroupN=49BeforeAfterBeforeAfter空腹血糖FPG(3.9~6.1mmol/L)7.7±2.06.6±1.6∗7.6±1.86.5±1.7∗糖化血红蛋白HBA1c(4.0%~6.3%)7.3±0.86.7±0.9∗7.2±0.76.8±0.8∗体重指数BMI(18.5~24.9 kg/m2)24.9±3.627.8±3.4∗△25.2±3.325.9±3.4钙(mmol/L)Calcium(2.2~2.7mmol/L)2.20±0.082.28±0.072.15±0.072.21±0.07碱性磷酸酶AKP(35~125U/L)98.16±16.88102.11±17.6890.43±17.6696.77±17.4825(OH)D2+D3(30-60ng/mL)16.48±6.5423.48±7.12∗△15.49±7.1918.88±6.44骨密度BMD(0.88±0.17 g/cm2)0.694±0.1020.733±0.108∗△0.689±0.1030.702±0.104N端骨钙素N-MID(12.8~55ng/mL)16.07±8.3115.68±8.1517.65±8.1816.44±7.88
Note: Compared with before treatment in the same group,*P<0.05,#P<0.01;Comparison between the two groups after treatment,△P<0.05.

指标IndexA组A GroupN=49B组B GroupN=49BeforeAfterBeforeAfter空腹血糖FPG(3.9~6.1mmol/L)7.7±2.06.6±1.7∗7.6±1.86.4±1.7∗糖化血红蛋白HBA1c(4.0%~6.3%)7.3±0.86.5±0.8∗7.2±0.76.7±0.9∗体重指数BMI(18.5~24.9 kg/m2)24.9±3.627.9±3.4∗△25.2±3.325.7±3.4钙(mmol/L)Calcium(2.2~2.7mmol/L)2.20±0.082.37±0.07∗2.15±0.072.29±0.06∗碱性磷酸酶AKP(35~125U/L)98.16±16.88105.82±15.6890.43±17.66105.67±15.1825(OH)D2+D3(30~60ng/mL)16.48±6.5426.16±6.23#15.49±7.1926.83±6.28∗骨密度BMD(0.88±0.17 g/cm2)0.694±0.1020.743±0.104#△0.689±0.1030.718±0.104∗N端骨钙素N-MID(12.8~55ng/mL)16.07±8.3114.97±8.1417.65±8.1816.85±8.09
Note: Compared with before treatment in the same group,*P<0.05,#P<0.01;Comparison between the two groups after treatment,△P<0.05.
本研究发现对于老年2型糖尿病合并骨质疏松的患者,虽然在治疗52周后,两组患者25(OH)D2+D3、血钙及BMD值较治疗前都显著增加,但使用胰岛素组在治疗第24周时,其股骨颈的BMD值较治疗前已显著增加,较口服降糖药物更有效,胰岛素治疗延缓了糖尿病患者胰岛功能的衰退,同时外源性胰岛素有利于患者体内保持一定的血胰岛素水平,对骨代谢产生保护作用。之前已有研究发现,当糖尿病患者胰岛素分泌减少,而血糖水平保持较高时,胰岛素抑制糖毒性的作用减弱,从而引起成骨细胞的分化和增殖减弱,骨量丢失加速,可见高水平的胰岛素对骨密度有一定的保护作用[6]。胰岛β细胞分泌的内源性胰岛素通过门脉系统进入肝脏,首过效应代谢了约40%~50%的内源性胰岛素,然后再进入血循环。而外源性胰岛素注射后直接进入血循环,分布到全身的肌肉、脂肪组织和肝脏、肾脏等器官。不同于内源性胰岛素,外源性胰岛素入血后直接作用于成骨细胞上的胰岛素受体[8],促进成骨细胞增殖。其效果优于口服药物刺激所产生的内源性胰岛素,此现象从本研究结果可以证实。因此,2型糖尿病患者在早期使用胰岛素可能纠正由高血糖及胰岛素抵抗引起的骨量减少,维持骨重建平衡。
近年来,肥胖对骨量的保护作用和低体重对骨量的不利影响已得到大量研究的证实[9]。低BMI与骨质疏松有关,有研究[10]提示肥胖对骨密度的保护机制在于它增加了骨负荷,骨骼应力增加,促进骨形成。成熟的脂肪组织分泌瘦素和脂肪体积呈正相关,瘦素能刺激骨髓分化成成骨细胞,同时抑制向破骨细胞分化,且其可以直接作用于骨组织,刺激骨形成,发挥保护骨量的作用。同时因有胰岛素、雌激素、瘦素共同参与作用,使脂肪组织转化成雌激素维持骨量,特别是对绝经后妇女有保护作用。胰岛素治疗能提高2型糖尿病患者的BMI指数已在众多研究中得到证实。在本研究中发现,胰岛素强化治疗组患者体重指数增加明显,且在治疗第24周时,该组股骨颈的骨密度(BMD)值较治疗前已显著增加,与口服降糖药治疗组相比,也存在显著差异。更进一步证明了2型糖尿病患者早期、合理使用胰岛素治疗有利于改善骨质疏松。
糖尿病并发微血管病变可影响骨血管分布,造成骨组织供血不足和缺氧,引起骨代谢异常。临床研究发现[11]糖尿病患者腰椎、髋部各部位骨密度(BMD)值随下肢血管病变严重程度的加剧而下降。糖尿病周围神经病变则通过影响局部组织的神经营养,加重骨量丢失。胰岛素治疗在血糖控制、微血管及周围神经病变方面较口服降糖药更显著,胰岛素作用于破骨细胞表面的胰岛素受体,抑制其活性,减少骨质吸收[12]。
多项研究[13,14]发现, 糖尿病小鼠在骨密度减低的同时伴有钙、 磷、 镁、 锶、 钾等元素丢失,经胰岛素治疗后,钙、磷、镁等元素增加,骨密度上升,提示胰岛素可促进微量元素的吸收。本研究显示虽然在治疗52周后,两组患者25(OH)D2+D3、血钙值较治疗前都显著增加,但胰岛素治疗组,在治疗第24周时,其25(OH)D2+D3、血钙值较治疗前已明显增加,较单纯口服降糖药物组更有效,可见胰岛素有利于微量元素的吸收,有利于骨质形成。
综上所述,迅速、有效控制血糖是治疗糖尿病的根本,对于2型糖尿病合并骨质疏松患者,早期,合理使用胰岛素治疗,可以在相同的骨质疏松治疗方案中获益更大。
