绝经后妇女血肌肉生长抑制素与骨密度的关系
2017-08-07覃丽英曾丹丹马育林盛志峰
覃丽英 曾丹丹 马育林 盛志峰
1.南方医科大学附属小榄医院体检中心,广东 中山 528415 2.中山火炬开发区医院内分泌科,广东 中山 528437 3.中南大学湘雅二医院代谢内分泌研究所,湖南 长沙 410011
肌肉生长抑制素(moystatin,MS)是属于转化生长因子(transforming growth factor β,TGF-β)超家族的分泌性生长及分化因子,负性调节骨骼肌生长[1]。在小鼠、牛及人类中,MS功能缺失会导致肌量增加[2]。MS信号阻滞会改善肌萎缩蛋白缺乏mdx小鼠肌肉生长[3],能增加高脂饮食诱导肥胖大鼠股骨颈骨量丢失和骨微结构退变[4],MS抗体能提高18月龄去卵巢小鼠骨密度(bone mineral density,BMD)及血骨形成标志物水平[5]。目前资料显示MS可能直接影响骨形成细胞的增殖分化[6],MS拮抗剂及抗体能促进肌肉量及骨强度的增加。近期研究揭示MS能抑制前脂肪细胞的分化,可能影响脂代谢。在绝经后妇女,血MS水平与BMD、体成分、血骨转换标志物及血脂成分的关系尚不清楚。
本研究的目的是阐明绝经后妇女血MS水平与BMD、体成分、血骨转换标志物及血脂成分的关系。笔者在中国中南地区进行了一项横断面研究,纳入175名年龄在51~75岁的绝经后妇女。
1 材料和方法
1.1 研究对象
在社区中心,研究纳入居住在城区的175名年龄在51~75岁的绝经后妇女(见表1)。所有研究对象均身体健康、生活自理,未服用影响骨骼、软组织及肌肉代谢的药物。经调查问卷、询问病史及体格检查,吸烟、饮酒及喝咖啡者排除在外,其他影响骨代谢的情况、包括服用高血压及冠心病药物者亦排除在外。所有研究对象均签署知情同意书,研究经中南大学湘雅二医院伦理委员会同意。
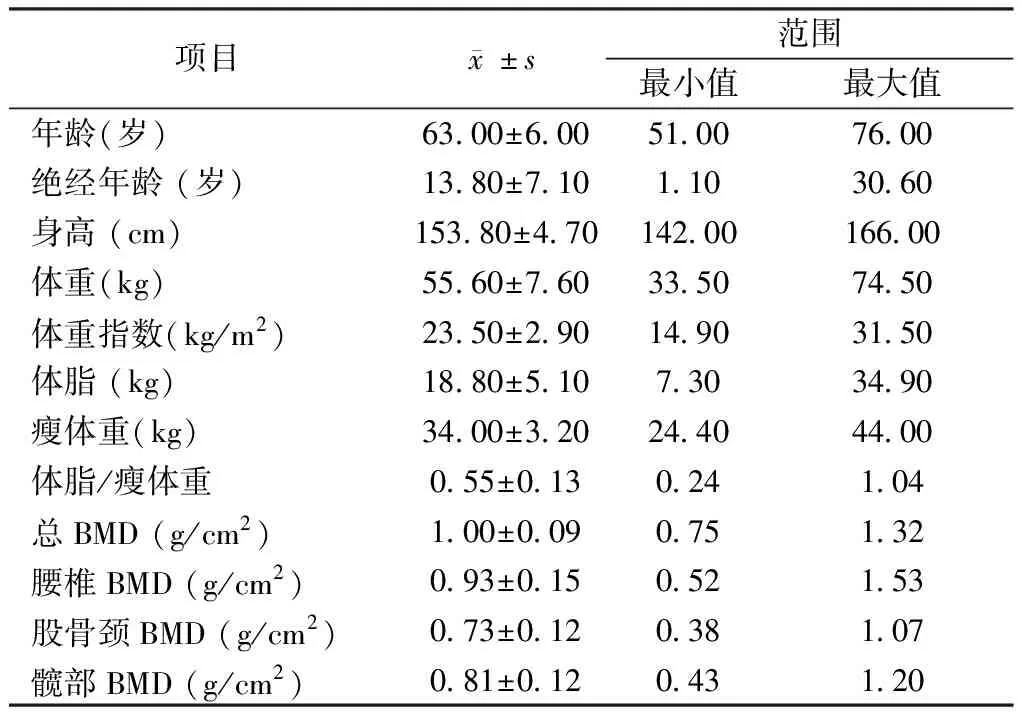
表1 175名妇女人体学测量、体成分测量及临床资料Table 1 Densitometric, anthropometric, and clinical data of the 175 women studied
1.2 临床资料
体重及身高测量分别精确到0.1 kg及0.1 cm,测量时脱去鞋子、穿单衣。体重指数(body mass index,BMI)等于体重(kg)除以身高(m)的平方。早晨8点抽取空腹血,储存于-80 ℃冰箱待检。
1.3 双能X线吸收(dual energy X-ray absorptiometry,DEXA)骨密度仪测量BMD及体成分
采用美国GE-Lunar Prodigy Advance扇形束DEXA骨密度仪测量每例研究对象腰椎正位腰1~4、左侧股骨颈、左侧全髋部面积BMD(g/cm2)。正位腰椎BMD、股骨颈BMD、全髋部BMD及体成分测量的变异系数(coefficient of variation,CV)分别为1.2%、1.1%、0.9%及1.4%。根据WHO推荐的骨质疏松诊断标准及笔者研究所建立的峰值骨密度参考数据库,研究个体的BMD低于同性别峰值骨量的2.5SD以上被确定为骨质疏松症。
血肌酐用自动酶色谱法测定(罗氏诊断),25羟维生素D[25 hydroxy vitamin D,25-(OH)D]用定量夹心酶联免疫吸附试剂盒测定(enzyme linked immunosorbent assay,ELISA)(IDS,Boldon,Wear,UK)。血骨碱性磷酸酶(bone alkaline phosphatase,BAP)及I型胶原C末端肽(type I collagen C terminal peptide,CTX)用ELISA试剂盒测定(IDS,Boldon,Wear,UK)。血MS采用ELISA试剂盒测定(皮内及批间变异系数分别为<8%和<5%,Immundiagnostik AG,Germany)。总胆固醇(total cholesterol,TCHO)、高密度胆固醇(high density cholesterol,HDL-C)、低密度胆固醇(low density cholesterol,LDL-C)和甘油三酯(triglyceride,TG)用酶法测定 (Roche Molecular Biochemicals,Mannheim,Germany)。
1.4 统计学处理
骨转换标志物经对数转换后呈正态分布,结果以均数±标准差表示。对数据进行正态分布性检验。骨质疏松和非骨质疏松组之间连续变量比较用独立样本t检验,采用Pearson相关分析各变量之间的相关性。分别以腰椎、股骨颈、全髋部、全身BMD为应变量,以年龄、绝经年龄、身高、体脂含量、瘦重、血BAP、CTX及MS等为自变量,通过多元逐步回归分析确定BMD的主要影响因素。应用SPSS 13.0统计软件进行分析。
2 结果
骨质疏松及非骨质疏松妇女体成分、人体学测量、血清MS、血清骨转换标志物及临床资料见表2。与骨质疏松妇女相比,非骨质疏松妇女BMI(P<0.01)、体脂含量(P<0.01)及瘦体重(P<0.01)更高。骨质疏松妇女年龄较非骨质疏松妇女大(P<0.01)。经年龄校正后,两组之间血清BAP、CTX、25-(OH)D、PTH、血脂及MS水平差异无统计学意义。见表2。
分别以腰1~4椎体、股骨颈、全髋部、全身BMD为应变量的多元逐步回归分析结果见表3。各部位BMD与绝经年龄、体脂含量及瘦体重成正相关,与年龄、血清BAP及身高成负相关。血清MS与TG负相关,与体成分及各部位骨密度无相关。
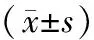
组别年龄 (岁)绝经年龄 (岁)绝经时间 (年)身高(cm)体重(kg)BMI(kg/m2)体脂 (kg)瘦体重 (kg)25(OH)D (nmol/L)BAP (μg/L)CTX (ng/mL)TG(mmol/L)T-CHOL(mmol/L)LDL-CHO(mmol/L)HDL-CHO (mmol/L)MS (ng/mL)总BMD (g/cm2)腰椎BMD (g/cm2)股骨颈BMD (g/cm2)髋部BMD(g/cm2)无骨质疏松妇女(n=111)61.7±5.849.6±3.812.1±6.4154.3±4.957.6±6.724.2±2.719.8±4.634.8±3.144.4±14.722.5±7.510.53±0.221.68±1.315.35±1.023.17±0.755.35±1.037.37±2.361.05±0.071.01±0.130.80±0.110.89±0.10骨质疏松妇女(n=64)64.3±5.649.0±3.415.3±6.6153. 7±4.853.5±6.822.6±2.617.4±4.933.2±2.743.0±13.722.7±7.820.56±0.251.54±1.105.35±0.723.11±0.715.35±0.727.59±2.110.95±0.070.82±0.110.63±0.080.71±0.08P<0.010.29<0.010.43<0.01<0.01<0.01<0.010.550.890.340.531.000.631.000.53<0.01<0.01<0.01<0.01
注:BMI:体重指数;BAP:骨源性碱性磷酸酶;CTX:I型胶原C末端肽;TG:甘油三酯;T-CHOL:总胆固醇;LDL-CHO:低密度脂蛋白;HDL-CHO:高密度脂蛋白;MS:肌肉生长抑制素
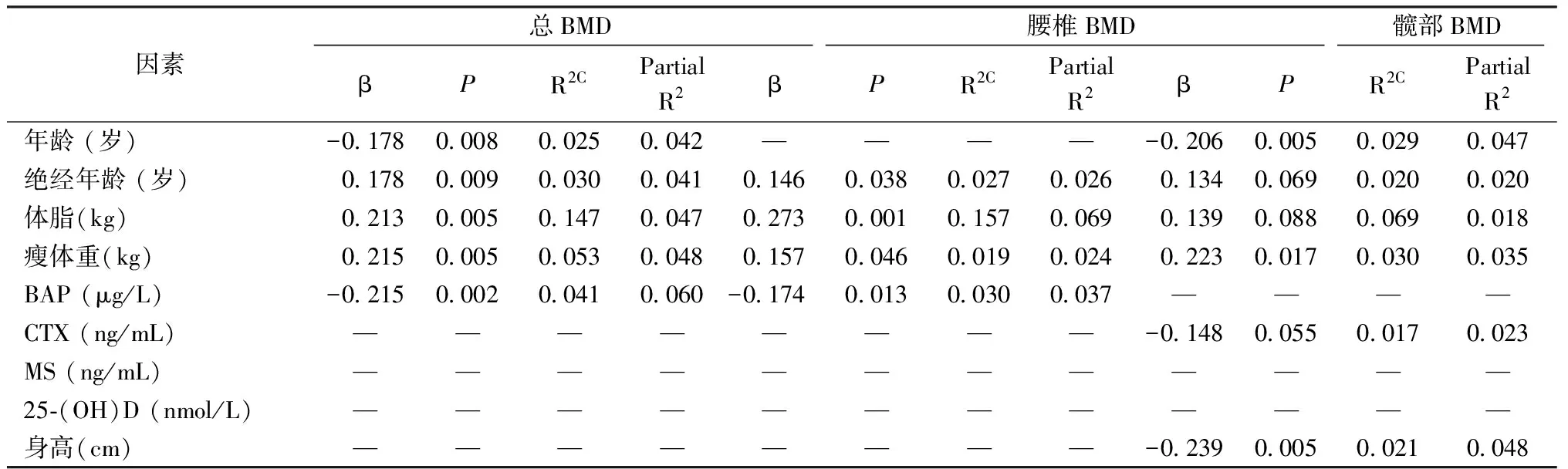
表3 以腰椎、全髋部、全身BMD为应变量的多元逐步回归分析结果Table 3 Multiple linear stepwise regression analysis with BMD at total body, BMD at Lumbar1-4 spine or BMD at total hip as the dependent variable
注:β:标化的回归系数,R2C:校正的R2C;—:剔除的值
3 讨论
研究资料表明非骨质疏松妇女瘦体重高于骨质疏松妇女,各部位BMD与瘦体重呈正相关,结果与肌肉量及强度的增加伴随骨量增加的共识一致[7-8]。另外,本研究发现,即使骨质疏松及非骨质疏松妇女瘦体重有显著差别,但血清MS并无显著差别,Ratkevicius等[9]在年轻男性及肌肉萎缩的老年男性中报告了相似的结果。然而,以前研究表明青年男性血MS水平高于老年男性[10-11],但无论青年还是老年男性血MS水平与瘦体重差异无统计学意义。最近研究发现血清MS与总体脂、腹部体脂及外周体脂含量呈负相关,与瘦体重无相关[11]。这些资料似乎表明血清MS水平不是肌肉量的决定因素,似乎是脂代谢的重要调节因子。
最初MS被认为只阻止肌肉量过度增加,而肌肉量会影响BMD,MS还能影响骨髓基质细胞的分化,进而影响脂肪、骨骼肌及骨量。但最近研究显示,在不同生理状况下MS的生理作用有差异。本研究是第一次揭示绝经后妇女血清MS水平与BMD的关系,研究资料表明在中国中南地区绝经后妇女,血清MS水平与各部位BMD无相关性。然而,Zhang 等[12]发现中国年轻妇女MS基因多态性影响峰值骨密度的获得,在青年男性则无影响[13]。最近研究发现抑制MS不能显著增加缺乏运动者的肌肉量[14],另一研究则发现抑制MS能增加肌肉量和肌纤维体积,但不能增加BMD和骨强度[15]。这些资料似乎表明,在青年男性及绝经后妇女,运动伴随的肌肉量增加对BMD的影响大于血清MS水平的影响。另一方面,参与调节肌肉和骨骼代谢的药物也可能促进或抑制MS的生理活性。需进一步研究来阐明MS在增龄相关的骨骼退变中的调节作用。
在普通饲料或高脂饲料喂养的小鼠,最新研究显示抑制脂肪组织MS信号转导对体成分、增重、糖代谢、胰岛素抵抗无影响[16]。相反,在高脂饮食诱导的肥胖小鼠,抑制肌肉组织MS信号转导增加瘦体重、减少体脂、改善糖代谢。Moster等[14]发现用siRNA抑制MS会显著降低小鼠血TG水平,而本研究发现血清MS与血TG呈负相关,提示MS对血脂代谢的影响是通过影响脂肪细胞代谢的改变,比如抑制肌肉间脂肪前体细胞的增殖分化[21]。MS不仅能抑制前脂肪细胞分化[17-20],还能通过降低甘油三酯脂肪酶和激素敏感脂肪酶在肌内脂肪细胞中的表达而减少甘油的释放[21]。最近研究发现,MS基因敲除小鼠体重显著降低,而脂肪合成增加可能是为了给肌肉生长供给足够营养[22]。上述研究似乎表明MS抑制脂肪细胞对TG的摄取。
本研究提示血清MS浓度与瘦体重及骨量无相关性,将来需要进行以多种族为基础的研究以揭示MS在调控骨代谢中的作用。肌肉、脂肪组织及骨组织之间的相互作用需要进一步研究来阐明。
