少肌症、维生素D缺乏在类风湿性关节炎合并脊柱骨质疏松性骨折中的临床研究
2017-08-07龚勋徐胜前刘文吴颖齐姗麻璨琛肖会徐建华
龚勋 徐胜前 刘文 吴颖 齐姗 麻璨琛 肖会 徐建华
安徽医科大学第一附属医院风湿免疫科,安徽 合肥 230022
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性炎症性、自身免疫性疾病,慢性滑膜炎症是导致RA患者骨与关节损伤,如局部骨侵蚀和全身骨质疏松(osteoporosis,OP)的主要原因。OP是一种以单位体积内骨组织量减少、骨的微观结构退化为特征,致使骨的脆性增加以及从而易于发生骨质疏松性骨折(osteoporotic fracture, OPF)的一种全身性骨骼疾病,其中脊柱是较为常见的骨折部位之一[1]。大多数研究已指出血清25羟基维生素D[25 hydroxy vitamin D, 25(OH)D]水平的降低可导致OP的发生,但其在RA患者合并脊柱OPF的文献少有报道。少肌症(sarcopenia)原意是缺少肌肉,1989年Irwin第一次用来描述老年性的肌肉减少与力量减退,2010年,欧洲少肌症工作组(EWGSOP)将其定义为:老年人骨骼肌质量和骨骼肌力量及功能下降的一种病征,主要强调骨骼肌量下降,或骨骼肌力量下降,或骨骼肌功能下降[2]。近年来的研究认为少肌症与OP的发生有关,但其与RA患者的OPF之间的研究罕有报道,少肌症对RA患者合并OPF的影响尚不清楚。本研究旨在通过对RA患者腰椎部位骨密度(bone mineral density,BMD)及X线片的检查、测定血清25(OH)D水平及各部位骨骼肌质量,探讨RA脊柱部位OPF的发生及其与维生素D(vitamin D,VitD)缺乏和少肌症之间的关系,为RA患者OPF的临床防治提供理论依据。
1 资料和方法
1.1 研究对象
2013年1月至2015年10月安徽医科大学第一附属医院风湿科936例住院的RA患者,其中男性173例,女性763例,年龄20~83岁,平均年龄(53.6±13.3)岁,平均体重(58.17±10.40)kg,平均身高(160.46±7.57)cm。RA患者的诊断均符合ACR 1987年及2009年ACR关于RA的分类标准。排除合并严重肝肾功能损害;长期服用雌激素、雄激素抗凝剂等可能影响骨代谢的药物史;排除合并甲状腺、甲状旁腺等疾病所致的原发性骨质疏松患者;排除急性及慢性感染的患者。选择同期158例年龄、性别相匹配的正常健康者作为对照组,其中男性30例,女性126例,年龄27~81岁,平均年龄(54.1±10.6)岁,平均体重(60.92±10.65)kg,平均身高(160.20±7.86)cm。
1.2 临床资料记录
详细记录研究对象的一般资料:性别、年龄、身高、体重,RA患者的各临床指标:晨僵时间、关节肿胀数(SJC)、关节压痛数(TJC)等。实验室指标:外周血C反应蛋白(C reactive protein, CRP)、血沉(erythrocyte sedimentation rate, ESR)、类风湿因子(rheumatoid factor, RF)、抗环瓜氨酸肽 (cyclocitrullinated peptides, CCP) 抗体。计算患者疼痛评分(visual analogue scale, VAS)、疾病活动性积分(disease activity score in 28 joints, DAS28)。每位患者填写健康状况问卷(health assessment questionnaire, HAQ),计算HAQ积分。本研究得到安徽医科大学伦理委员会支持,每位参与者均签署知情同意书。
1.3 脊柱X线检查及OPF的判断标准[3]
采用MECALL castor-50-hf型号X线扫描仪,对受试者进行脊柱正侧位X线(T5-L5)摄片;采用Genant半定量法(semi quantity,SQ)作为判断OPF的方法:OPF是指低骨量或非暴力性骨折,如从站高或小于站高跌倒或因其他日常活动而发生的骨折。判断标准:应用普通X线片对椎体进行形态计量,椎体在前、中及后3个高度上下降20%以上定义为OPF。
1.4 BMD测定和OP判断标准[4]
采用双能X线骨密度仪(Lunar Prodigy DF+310504,GE Healthcare, USA)测量所有648例RA患者和158例正常对照组股骨(股骨颈、Ward区、大转子、总股骨区)和腰椎(lumbar spine,L2、L3、L4、L2-4)的BMD,以g/cm2表示。参照OP推荐诊断标准,如有1个或以上部位BMD低于正常同性别骨峰值1.0个标准差则诊断为骨量减少,低于正常同性别峰值2.5个标准则诊断为OP。
1.5 四肢骨骼肌质量测定和少肌症定义及评定
采用韩国Inbody720人体成分分析仪,以直接节段多频率生物电阻抗测试法(DSM-BIA法)测量骨骼肌肉量等各项人体成分指标。目前国际上尚无一致公认的少肌症诊断标准,应用较多的是由Baumgartner于1988年提出的标准:老年人四肢骨骼肌质量(kg)与身高(m)的平方比值,即骨骼肌质量指数(skeletal muscle mass index,SMI),低于相应族群青年人平均值的1个标准差以上即可诊断为少肌症[5]。
1.6 25(OH)D水平测定
采用罗氏公司E-601型号的骨代谢标志物测定仪,试剂盒为25(OH)D检测试剂盒(产品标准:YZB/GER4825-2011),以电化学发光法进行检测。其中25(OH)D测定低于20 ng/mL(50 nmol/L)称为VitD缺乏,25(OH)D在20~30 ng/mL(50~75 nmol/L)称为VitD不足,25(OH)D测定在30~100 ng/mL (75~250 nmol/L) 称为VitD理想或正常。
1.7 统计学处理
2 结果
2.1 RA和对照组OP、OPF和少肌症发生率比较
通过测定BMD,648例RA患者有245例发生OP,发生率为37.8%,对照组OP发生率为13.9%(22/158,χ2=32.712,P<0.001)。936例RA患者中有141例发生OPF,发生率为15.1%,是正常对照组中OPF发生率3.8%(6/158)的4.0倍(χ2=18.658,P<0.0001),其中第12胸椎和第1腰椎部位发生脊柱OPF最多。267例测定四肢骨骼肌质量的RA患者有149例存在少肌症,发生率为55.8%,对照组发生率为9.0%(14/156)(χ2=91.176,P<0.0001),见图1。
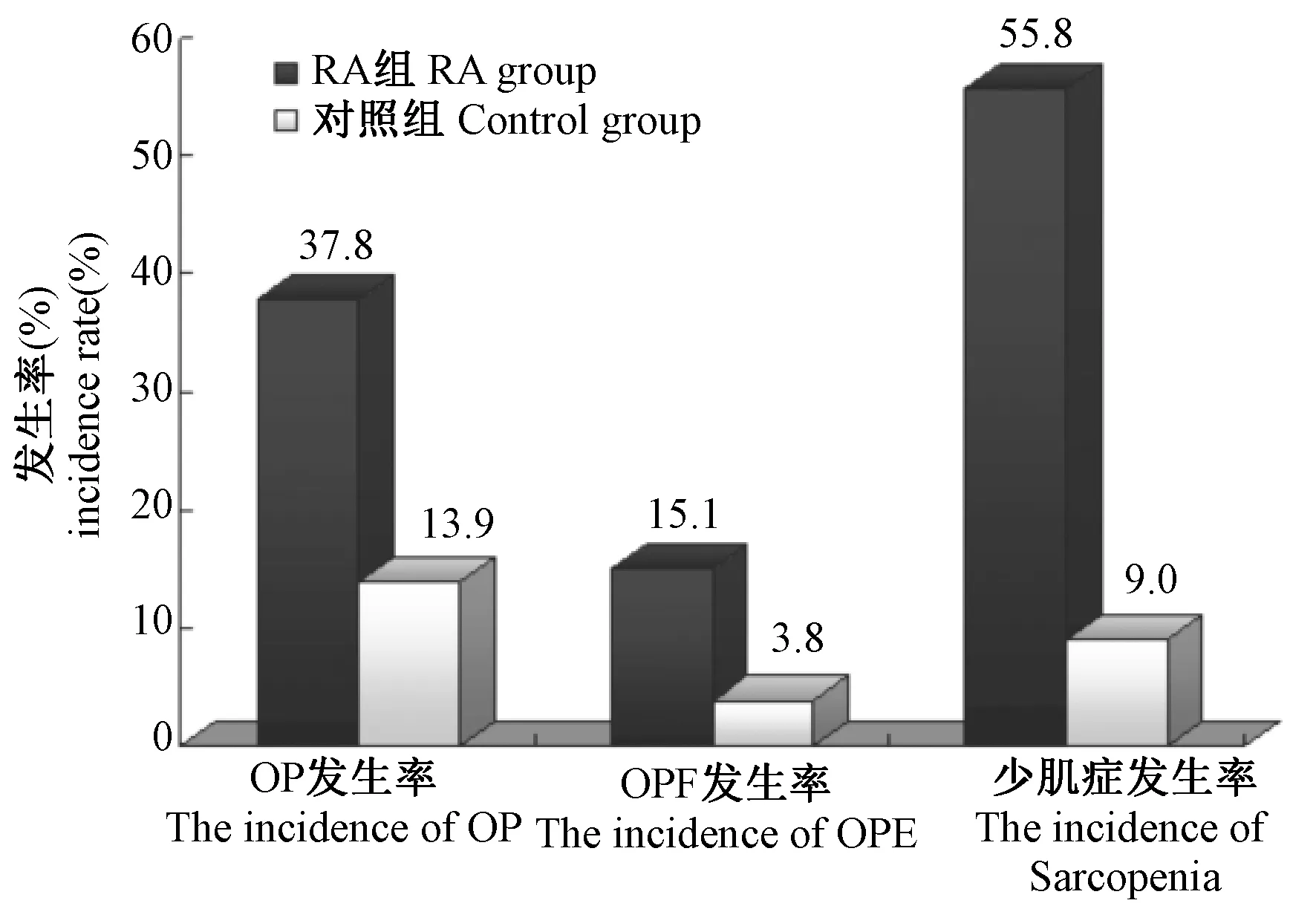
图1 RA患者与对照组间OP、脊柱OPF和少肌症发生率比较Fig.1 Comparison of incidence of OP, vertebral OPF, and sarcopenia between RA patients and the controls
2.2 RA组和对照组血清25(OH)D水平比较
234例RA组血清25(OH)D水平明显低于对照组[(13.41±9.71)ng/mL,(22.40±6.26)ng/mL,t=9.063,P<0.0001]。RA组中有36例25(OH)D水平不足,发生率为15.5%,189例25(OH)D水平缺乏,发生率为80.8%;68例测定血清25(OH)D的对照组中有36例25(OH)D水平不足,发生率为52.9%,25例25(OH)D水平缺乏,发生率为36.8%,两组间差别有统计学意义(χ2=49.412,P<0.0001),见图2。
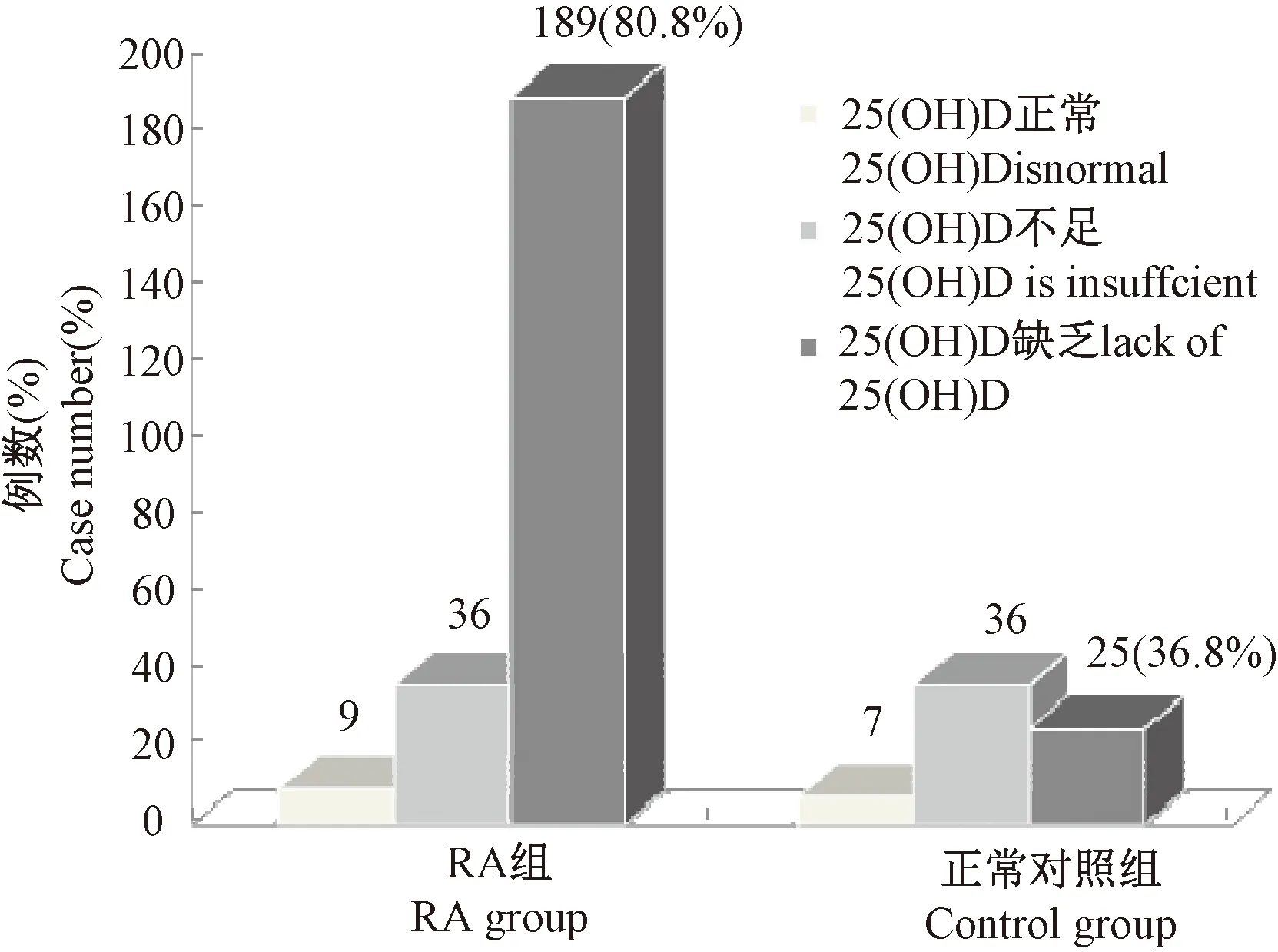
图2 血清25(OH)D状况在RA患者与对照组间的比较Fig.2 Comparison of serum 25 (OH) D status between RA patients and the controls
2.3 RA患者有无OPF组间25(OH)D水平和肌肉质量比较
RA患者伴OPF组中VitD缺乏的发生率为89.2%(33/37),明显高于无OPF组的69.8%(74/106)(χ2=5.467,P=0.019);其血清25(OH)D水平亦明显低于无OPF组[(12.28±5.67)ng/mL,(17.16±10.90) ng/mL,t=2.600,P=0.01],各部位肌肉质量和SMI均明显低于无OPF组(P<0.01~0.05),见表1。
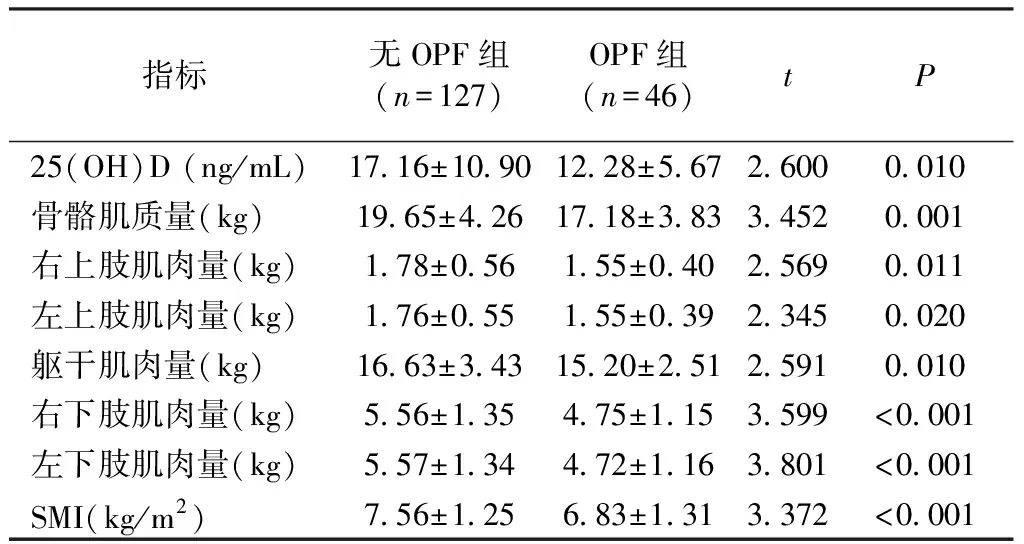
指标无OPF组(n=127)OPF组(n=46)tP25(OH)D (ng/mL)17.16±10.9012.28±5.672.6000.010骨骼肌质量(kg)19.65±4.2617.18±3.833.4520.001右上肢肌肉量(kg)1.78±0.561.55±0.402.5690.011左上肢肌肉量(kg)1.76±0.551.55±0.392.3450.020躯干肌肉量(kg)16.63±3.4315.20±2.512.5910.010右下肢肌肉量(kg)5.56±1.354.75±1.153.599<0.001左下肢肌肉量(kg)5.57±1.344.72±1.163.801<0.001SMI(kg/m2)7.56±1.25 6.83±1.313.372<0.001
2.4 线性相关分析
RA患者的血清25(OH)D水平与骨骼肌质量(r=0.146,P=0.036)、右上肢肌肉量(r=0.140,P=0.044)、左上肢肌肉量(r=0.149,P=0.032)和躯干肌肉量(r=0.141,P=0.043)呈正直线相关关系。RA患者骨骼肌质量与股骨颈BMD(r=0.380,P<0.001)、Ward区BMD(r=0.402,P<0.001)、股骨转子区(r=0.602,P<0.001)、总髖部区BMD(r=0.541,P<0.001)、L2-BMD(r=0.441,P<0.001)、L3-BMD(r=0.459,P<0.001)、L4-BMD(r=0.440,P<0.001)、总腰椎区BMD(r=0.456,P=0.001)均呈正直线相关关系。
2.5 RA患者多元回归分析
采用二项分类Logistic Regression(Backward LR法)分析,以是否发生少肌症(0=无少肌症,1=少肌症)为应变量,以年龄、性别(1=男性,2=女性)、病程、HAQ积分、血清25(OH)D水平、总髖部和总腰椎部有无OP发生(0=无OP,1=OP)为自变量,结果显示:女性(OR=10.833,P<0.001,95% CI:3.154~37.207)、HAQ积分(OR=2.535,P=0.001,95% CI:1.463~4.392)和总髖部OP的发生(OR=5.376,P=0.015,95% CI:1.391~20.777)为RA患者发生少肌症的危险因素。以是否发生脊柱OPF(0=无OPF,1=OPF)为应变量,以年龄、性别(1=男性,2=女性)、病程、HAQ积分、SMI、总髖部和总腰椎部有无OP的发生(0=无OP,1=OP)为自变量,结果显示:年龄(OR=1.075,P=0.002,95% CI:1.028~1.124)为RA患者发生脊柱OPF的危险因素,SMI(OR=0.649,P=0.020,95% CI:0.451~0.933)为RA患者发生脊柱OPF的保护因素。
3 讨论
大量研究指出,RA患者易合并OP,而OP最大的危害就是导致OPF的发生,会导致RA患者的生存及生活质量显著下降,并且加重其经济负担,使RA患者死亡率明显增高,其中脊柱部位和髋部为OPF中较为常见。通过查阅文献发现,国内外关于RA患者合并OPF的报道并不多,但从有限的文献报道来看,探讨RA患者OPF发生的危险因素对于指导临床针对性的防治工作非常重要。
Maria 等[6]收集了480名RA患者,发现共有130名RA患者曾经或最近发生过脊柱部位的骨折,发生率为27.1%,并指出胸椎骨折的发生率比腰椎高,约占2/3左右。Ghazi等[7]在2010年收集了101例女性、病程超过10年的女性RA患者以及303名正常对照组研究发现,101例女性RA患者中有22例发生脊柱OPF,发生率为21.7%,是正常对照组4.2%的5.2倍。刘文等[8]收集644例RA患者及158例正常对照组,发现RA患者中有107例发生脊柱OPF,发生率为16.6%,是正常对照组中OPF发生率3.8%(6/158)的4.4倍。由此可见,RA患者中脊柱OPF的发生率较高,及早对OPF,尤其是无症状的椎体OPF患者进行诊断及干预,可能会改善RA患者的预后。
25(OH)D是VitD的中间代谢产物,其血清水平常被作为反应体内VitD水平的主要指标[9]。虽然VitD在OP的预防中起到重要作用,但目前关于VitD与RA患者继发OPF的研究并不多。Jérme等[10]在2012年收集139例RA和227例正常对照组,研究发现RA患者OPF更易发生在高龄、低25(OH)D 水平(<30 ng/mL)、有OP及低钙制剂服用量的患者中(P<0.05),其中25(OH)D 每降低1ng/mL,RA患者发生OPF的风险增加3.31倍。罗改莹等[11]在2013年收集RA患者98例,根据RA病情活动性DAS28评分,将所有患者分为稳定组51例和活动组47例,研究发现活动组RA患者的血清25(OH)D 水平较稳定组显著下降(P<0.05),研究还发现血清25(OH)D水平与全髋及股骨颈BMD呈显著正相关(P<0.01),与Sharp评分间呈显著负相关(P<0.05),提示25(OH)D 作为反映骨代谢的指标,不仅可以较好地反映RA患者的疾病活动度,还与RA患者的骨与关节损伤的两大表现:OP和骨侵蚀的发生密切相关。本研究发现:RA组血清25(OH)D水平明显低于对照组,RA组中25(OH)D水平缺乏发生率高达80.8%;OPF组RA患者血清25(OH)D水平低于无OPF组患者,这和上述文献研究的结果是一致的。由此可见,RA患者普遍存在VitD缺乏,且与RA患者OPF的发生是密切相关的。
经文献检索,目前国内外探讨RA患者合并少肌症的文献较少,且并未发现RA患者发生OPF与少肌症之间关联性的研究报道。Sami等[12]在2015年收集30名女性RA患者及30名对照组研究发现,RA患者SMI明显低于正常对照组(5.83±0.807 vs 7.30±1.640,P<0.05),RA患者少肌症总体发生率为43.3%,是正常对照组10.0%的4.3倍。Giles等[13]收集117例女性、72例男性RA及年龄、性别相匹配的189名正常对照组研究发现,RA患者少肌症总体发生率为25.9%,约为正常对照组(13.2%)的2倍,并指出女性、RF阳性、关节畸形、高水平HAQ评分及CRP为RA患者发生少肌症的危险因素,其中女性发生少肌症的可能性比男性高2.41倍(OR=3.41,95% CI:1.51~7.69),提示RA患者发生少肌症与性别,疾病活动性,进行性的关节破坏导致关节功能减退密切相关,这与本研究结果是一致的。Iolascon 等[14]对67名有椎体骨折的女性患者的研究发现,35例发生一个椎体部位的骨折,发生率为52.23%,8例(22.85%)骨骼肌肉量减低;其余32例发生多个部位的椎体骨折,发生率为47.76%,其中14例(43.75%)骨骼肌肉量减低。Di Monaco 等[15]对313例发生髋部骨折的老年女性的研究发现,其中180例患者的骨骼肌肉量减低,发生率为58%,同时230例患者伴发有OP(74%),经过年龄,性别等相关数据校正后,少肌症与OP的发生之间是有统计学意义的(P=0.026),少肌症患者发生OP的可能性是无少肌症患者的1.80倍(OR=1.80,95%CI=1.07~3.02)。由上述文献可发现RA患者少肌症的发生率明显高于正常对照组,且均与OP有关,这些与本文的研究发现是一致的,总体来看,国内外关于正常健康者少肌症的研究发生率在4.8%~59%不等[16],导致这种差异的原因可能与地域、人种及BMI水平,尤其是测定仪器和评估方法不同等有关。本研究同时发现脊柱OPF组较无脊柱OPF组的总体骨骼肌质量及四肢肌肉量均明显减低(P<0.05),提示RA患者脊柱OPF的发生与少肌症之间存在相关性,线性相关分析发现RA患者骨骼肌含量与髋部及腰椎各部位BMD均呈正直线相关,多元回归分析发现SMI为RA患者发生脊柱OPF的保护因素,SMI每增加1kg/m2,RA患者发生OPF的风险减低35.1%,由此可见,RA患者发生脊柱OPF与少肌症、维生素D缺乏关系密切,RA患者易伴发OP,OP是少肌症的危险因素,而少肌症又对OPF的发生有不良影响。
综上所述,RA患者不仅普遍存在OP,而且存在着较高的OPF发生率,OPF的发生与血清25(OH)D缺乏、少肌症等密切相关,正所谓“骨肉相连”,我们应当重视并尽早对RA患者发生OPF的风险进行评估,定期监测血清25(OH)D的水平,关注RA患者的少肌症及抗OP治疗,从而降低OPF的发生。
