体外条件下地塞米松和骨髓细胞对肺组织细胞的影响
2017-08-02徐凯智刘庆阳
高 岩 徐凯智 陈 楠 文 翠 刘庆阳
华北理工大学 河北唐山 063000;①唐山工人医院麻醉科;②煤炭总医院
体外条件下地塞米松和骨髓细胞对肺组织细胞的影响
高 岩 徐凯智①陈 楠 文 翠 刘庆阳②
华北理工大学 河北唐山 063000;①唐山工人医院麻醉科;②煤炭总医院
①目的 研究在体外条件下地塞米松及骨髓细胞对肺组织细胞的影响。②方法 取小鼠肺组织细胞体外培养,通过脂多糖(LPS,10μg/mL)刺激建立肺组织损伤模型,给予骨髓细胞(5×106)及经过不同浓度地塞米松(2ng/mL,4ng/mL,10ng/mL,1μg/mL)处理的骨髓细胞(5×106)进行处理,5天后检测各组细胞的形态及凋亡情况。再通过LPS滴鼻制作急性肺损伤小鼠模型(50μg/只),再分别给予回输生理盐水、地塞米松、荧光骨髓细胞、地塞米松和荧光骨髓细胞,比较各组死亡率。③结果 与单纯肺组织细胞组相比,其他各实验组细胞的形态均较好,凋亡率均较低,其中同时给予地塞米松2ng/mL处理的骨髓细胞实验组的细胞数量最多,形态最好,凋亡率最低(P<0.05);给予地塞米松和荧光骨髓细胞处理的实验组小鼠死亡率最低(P=0.034)。 ④结论 在体外培养条件下,地塞米松2ng/mL可以加强骨髓细胞对损伤肺组织的保护作用,维持肺组织细胞的形态,降低肺组织细胞的凋亡。
体外条件 地塞米松 荧光骨髓细胞 肺组织细胞 凋亡
目前研究认为,脓毒症是由感染引起的全身炎症反应综合征(SIRS),多由细菌、病毒、真菌、支原体、寄生虫感染引起。其中细菌感染占绝大多数,以凝固酶阴性的葡萄球菌、大肠埃希菌、金黄色葡萄球菌、肠球菌、肺炎克雷伯杆菌多见[1]。脓毒症病情十分凶险,死亡率非常高。肺脏是最易受到脓毒症影响的靶器官之一,机体发生脓毒症时,一旦并发急性肺损伤(ALI),患者的死亡率将会大大增加。地塞米松是临床的常用药物,应用一定剂量具有很好的抗炎作用[2]。骨髓中除了造血干细胞外,还有间充质干细胞(BMSCs),将BMSCs移植到损伤的肺组织可以起到保护肺组织的作用[3,4]。为探讨地塞米松是否可以通过激活骨髓细胞加强对脂多糖(LPS)损伤的肺组织的保护作用,本实验选取正常C57BL-6小鼠肺组织细胞作为研究材料,以LPS 10μg/mL炎症反应为模型,探讨地塞米松及骨髓细胞对LPS诱导的小鼠肺组织细胞的影响,从而证明地塞米松对骨髓细胞保护肺组织有较强的协同作用。
1 材料与方法
1.1 实验动物 健康雄性C57BL-6小鼠,6~8周龄,体质量(20±1)克,清洁级,购自于北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2014-0004。动物房采用12小时光照,温度控制在(25±2)℃,相对湿度为40%~65%。实验小鼠先饲养1周适应环境,然后进行正式实验。本实验已经获得国家伦理委员会的批准,并依据国家对实验动物管理的相关规定进行操作。
1.2 实验药物和试剂 脂多糖(LPS,美国Sigma公司);DMEM-高糖(4.5g/L)培养基(Hyclone 公司);胎牛血清(FBS)和含EDTA胰蛋白酶(中国北京索来宝生物科技有限公司);7-AAD(美国ebioscience公司);地塞米松磷酸钠注射液(吉林敖东药业集团延吉股份有限公司,国药准字H22022889) 。
1.3 实验方法
1.3.1 小鼠肺组织细胞及荧光骨髓细胞的获取 取正常健康的C57BL-6小鼠,颈椎脱臼法处死后放入酒精中消毒5分钟,消毒后放在无菌超净台上解剖取出肺组织,在无菌条件下进行研磨,离心,重悬,计数;再取正常的荧光小鼠,颈椎脱臼法处死后放入酒精中消毒5分钟,然后在无菌超净台上取四肢长骨,用无菌磷酸盐缓冲液(PBS)冲出管腔内的骨髓,离心,重悬,计数。
1.3.2 实验分组及干预 将取得的正常荧光小鼠的骨髓细胞分成5组,分别放入无菌离心管中,标记为A、B、C、D、E, 每组荧光骨髓细胞5×106,在A、B、C、D组中分别加入不同浓度地塞米松(2ng/mL,4ng/mL,10ng/mL和1μg/mL,E组不加地塞米松,各组加细胞完全培养基至1mL。细胞完全培养基为含10%胎牛血清的DMEM(-)高糖培养基(含4.5g/L葡萄糖),加入青链霉素混合液(青霉素的工作浓度为100U/mL,链霉素的工作浓度为0.1g/L),然后将各管细胞放入温度为37℃,CO2浓度为5%的无菌培养箱中培养24小时。
将取得的正常C57BL-6小鼠的肺组织细胞分成6组,分别放入无菌离心管中,标记为a、b、c、d、e、f,每组肺组织细胞5×106,然后加入LPS,使离心管内LPS的浓度是10μg/mL。各组加细胞完全培养基至1mL。然后将各管细胞放入温度为37℃,CO2浓度为5%的无菌培养箱中培养24小时。
24小时后分别取出培养的骨髓细胞和LPS处理的肺组织细胞,离心,重悬。将在无菌条件下离心重悬取得的经LPS处理的C57BL-6小鼠的肺组织细胞分别放入各个培养瓶,共6个,标记为a、b、c、d、e、f,将离心得到的荧光骨髓细胞按对应的字母分别加入其中的5个培养瓶中,f瓶内只加肺组织细胞,作为对照组。每组加细胞完全培养基至5mL。将各个培养瓶放入温度为37℃,CO2浓度为5%的无菌培养箱中培养5天。
1.3.3 倒置荧光显微镜下观察细胞生长情况 取出在CO2培养箱孵育5天后的细胞,置于倒置荧光显微镜下,观察细胞的数量及形态,并照相。
1.3.4 流式细胞术检测细胞凋亡情况 取出在CO2培养箱孵育5天后的细胞,按7-AAD试剂说明书要求,分别收集各培养瓶中的细胞,用PBS漂洗2次,加入一定量缓冲液,使细胞浓度为106个/mL,取100μL细胞悬液于流式管中,加入检测中性粒细胞和单核巨噬细胞的抗体30分钟后加入7-AAD 试剂2μL,混匀,于4℃避光静置30分钟后采用流式细胞仪(BD Calibur,美国BD公司)检测细胞凋亡的百分率,认定7-AAD阳性为凋亡细胞,试验重复5次,结果取平均值。
1.3.5 死亡率的观察 取正常C57BL-6小鼠80只,分成4组,每组20只,分别标记为a、b、c、d 4组,均体外滴鼻LPS 50μg/只,制作成ALI模型,其中a组回输生理盐水1mL;b组回输地塞米松3mg/只,共1mL;c组回输荧光骨髓细胞107,共1mL;d组回输地塞米松(3mg/只)和荧光骨髓细胞107,共1mL。48小时后观察各组小鼠的死亡数目及生存状态。
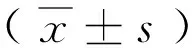
2 结果
2.1 倒置相差显微镜下观察细胞生长情况 经过处理的细胞培养5天后,即可看见细胞的数量及形态均发生改变,如图1所示。通过对比,在10倍镜视野下可以发现各个实验组与f组相比,数量都多,并且a组细胞数量最多,并且视野内可以发现组织团块,这说明可能有肺组织细胞在生长分化。而其他实验组细胞数量基本相同,并且没有发现组织团块。在40倍镜视野下可以发现各个实验组与f组相比,细胞形态均较好,细胞碎片都比f组少,其中a组细胞形态最完好,大多数细胞呈椭圆形,细胞碎片较少。而其他实验组之间差异不大。

注:f单纯肺组织组,e单加骨髓细胞组,a 2ng地塞米松处理的骨髓细胞组,b 4ng地塞米松处理的骨髓细胞组,c 10ng地塞米松处理的骨髓细胞组,d 1μg地塞米松处理的骨髓细胞组
图1 倒置相差显微镜下各组细胞成像
2.2 地塞米松及骨髓细胞对LPS诱导小鼠肺组织细胞凋亡的影响 流式细胞术检测的结果如图2所示,与f组相比,其他各组均有不同程度的细胞凋亡,差异有统计学意义(P<0.05)。通过对比,a组细胞凋亡率较f组最低,e组也比f组凋亡率低。而b、c、d组凋亡率较f、e和a组有所上升,并且随着地塞米松浓度的增加而增加。
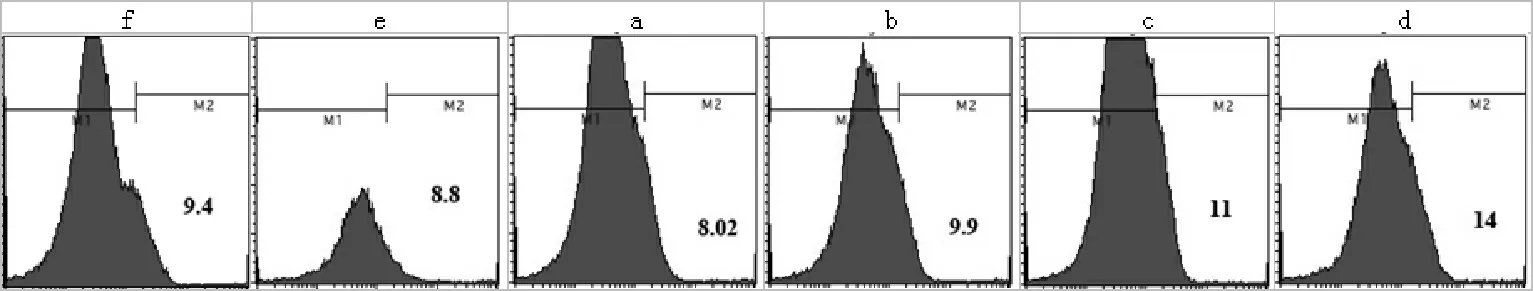
图2 小鼠肺组织细胞凋亡的流式分析
2.3 地塞米松及骨髓细胞对LPS诱导急性肺损伤小鼠死亡率的影响

表1 小鼠的生存数与死亡数(只)
注:A、B、C、D不同处理组之间通过列联表卡方检验得到,P=0.034;A组回输生理盐水1mL,B组回输地塞米松3mg/只,共1mL,C组回输荧光骨髓细胞107,共1mL D组回输地塞米松3mg/只和荧光骨髓细胞(107),共1mL。
D组小鼠死亡数量最少,C组和B组分别位于第二和第三,而A组死亡数最高,并且通过列联表χ2检验,差异具有统计学意义(P<0.05)。
3 讨论
脓毒症是一种发展不可控的全身炎症反应综合征,多继发于严重感染、大面积烧伤、创伤及大手术严重应激等。脓毒症发病机制十分复杂,同时又有多种信号传导途径参与其中[5]。在脓毒症早期,病原微生物,主要是细菌内毒素和LPS与LPS结合蛋白(LBP)结合,形成免疫复合物,然后再与单核、巨噬细胞表面的Toll样受体(TLR)结合,启动细胞内信号传输系统,促使这些细胞合成并释放多种炎症介质,如PGs、C3a、C5a[6],最终导致脏器细胞凋亡。脓毒症时,全身炎症反应可使机体产生较多的氧自由基、血管紧张素-Ⅱ,这些氧自由基和血管紧张素-Ⅱ可使机体血流动力学发生改变,使内皮细胞损伤[7],进而引起内皮细胞的凋亡。机体发生脓毒症后,微循环的核心变化之一是血管通透性增加及内皮细胞屏障功能丧失,从而导致机体组织水肿和循环物质移位[8]。有研究发现,脓毒症常常可以引起肺损伤,这种ALI以弥漫性肺细胞损伤为病理生理基础[9],可导致肺血管损伤,从而引起肺水肿和肺组织炎性细胞浸润[10]。而肺损伤又会促进脓毒症的进展和恶化。所以,如果能够及时发现并有效治疗脓毒症引起的ALI,就能够有效的改善脓毒症的预后和降低脓毒症的死亡率。
地塞米松是临床上的一种常用糖皮质激素,虽然目前认为ALI发病机制错综复杂,迄今尚未完全阐明[11],但是糖皮质激素治疗ALI已有近50年的历史,可以通过直接、间接作用抑制与炎症反应有关的炎性细胞及细胞因子,从而有效缓解ALI时的炎症反应,保护肺组织,降低肺组织细胞的凋亡率[12]。随着对糖皮质激素的广泛研究和应用,国内外学者发现糖皮质激素治疗ALI的主要机制是抗炎和抗纤维化[13]。研究表明,在体外间充质干细胞可以分化为成骨细胞、脂肪细胞和成软骨细胞,将骨髓间充质干细胞移植后,可以被动员到肺组织损伤部位,并通过释放可溶性因子,减轻肺毛细血管内皮的通透性,减轻肺泡水肿,缓解肺部的炎症反应,促进细胞增殖,抑制细胞凋亡,帮助肺部血管重建,起到治疗ALI的效果[4]。既然地塞米松和骨髓细胞都可以对ALI有一定的治疗效果,那么它们的治疗效果一定不是简单的相加关系。
本实验结果显示,在体外培养,经过LPS 10μg/mL诱导造成肺组织损伤模型的条件下,加入经过地塞米松2ng/mL处理的荧光骨髓细胞实验组其肺组织的细胞数量最多,形态最好,而不加地塞米松和骨髓细胞的对照组细胞数量最少,形态最差,而其它各实验组虽然比对照组细胞数量多,形态好,但是它们之间的差异不明显。通过检测凋亡率发现,经过2ng/mL地塞米松处理的荧光骨髓细胞组的细胞凋亡率最低,单独加入荧光骨髓细胞的实验组也比对照组低。但是,地塞米松浓度超过2ng/mL的其他3个实验组的凋亡率反而高于对照组(P<0.05),说明经过2ng/mL地塞米松处理的骨髓细胞对损伤肺组织细胞的保护作用有所增强,由此说明同时应用地塞米松和骨髓细胞治疗ALI时其疗效并不是简单的两者治疗效果的加和,而是出现了相互增强的结果。本实验通过观察小鼠的死亡率发现,同时给予地塞米松和骨髓细胞的实验组其死亡率均低于其它各实验组,而未给予药物治疗的对照组死亡率最高,说明地塞米松能够加强骨髓细胞对损伤肺组织的保护。虽然在本实验中地塞米松浓度为2ng/mL时细胞凋亡率最低,但是在4ng/mL时凋亡率却超过了f组,说明在0ng/mL到4ng/mL的浓度范围内可能存在一个最适宜的浓度,使细胞凋亡率最低。
综上所述,地塞米松可以加强骨髓细胞对损伤肺组织的保护作用,其可能机制除了药物本身的治疗效果外,还可能是地塞米松刺激了骨髓细胞的分化和迁移,加强了骨髓细胞对肺组织的保护作用,但其具体机制及最适宜的浓度还需要进一步的实验研究。
[1] 王 荃.小儿感染性休克的诊治[J].中国临床医生,2012,40(7):14-18
[2] Seibel MJ,Cooper MS,Zhou H.Glucocorticoid-induced osteoporosis:mechanisms,management,and future perspectives[J].Lancet Diabetes & Endocrinology,2013,1(1):59-70
[3] 赵玉华.核因子kB与糖皮质激素受体途径的拮抗作用[J].生物科学进展,2002,33(3):261-264
[4] Pati S,Gerber M H,Menge TD,et al.Bone Marrow Derived Mesenchymal Stem Cells Inhibit Inflammation and Preserve Vascular Endothelial Integrity in the Lungs after Hemorrhagic Shock[J].Plos One,2012,6(9):e25171
[5] 吴晓飞.脓毒症的诊断和治疗[J].中华全科医学,2014,12(10):1538-1539
[6] 石佑根.小儿感染性休克发病机制与治疗[J].淮海医药,2010,28(2):186-188
[7] 赵光举,卢中秋.脓毒症内皮细胞损伤与微循环障碍[J].临床急诊杂志,2012,13(1):8-13
[8] Ait-Oufella H,Maury E,Lehoux S,et al.The endothelium: physiological functions and role in microcirculatory failure during severe sepsis[M]// Applied Physiology in Intensive Care Medicine 2. Springer Berlin Heidelberg,2012.237-249
[9] 雷传江.RIP140对脓毒症急性肺损伤PPARγ调控作用的研究[D].重庆:第三军医大学,2015
[10] Matthay MA,Ware LB,Zimmerman GA.The acute respiratory distress syndrome[J].Ann Intern Med,2012,141(6):460-470
[11] Matthay MA,Zimmerman GA,Esmon C,et al.Future research directions in acute lung injury:summary of a National Heart,Lung,and Blood Institute working group[J].Am J Respir Crit Care Med,2003,167(7):1027
[12] Uccelli A,Moretta L,Pistoia V.Uccelli A,Moretta L,Pistoia VMesenchymal stem cells in health and disease[J].Nat Rev Immunol,2008,8(9):726-736
[13] 周 绚,杨文贤.糖皮质激素治疗急性肺损伤/急性呼吸窘迫综合征的抗炎机制研究进展[J]. 中国药房,2015,(23):3306-3308
(2017-02-10 收稿)(库雪飞 编辑)
Effects of dexamethasone and bone marrow cells on lung tissue cells in vitro
GAO Yan, XU Kaizhi,CHEN Nan,et al
(North China University of Science and Technology,Tangshan 063000,China)
Objective To study the effects of dexamethasone and bone marrow cells on lung tissue in vitro. Methods Mouse lung tissue cells were cultured in vitro, Bone marrow cells (5×106) treated with different concentrations of dexamethasone (2ng/mL, 4ng/mL, 10ng/mL, 1μg/mL) were treated with lipopolysaccharide (LPS,10μg/mL) to induce lung injury model. And the morphology and apoptosis of the cells were detected after 5 days. And then made LPS intranasal acute lung injury model (50μg/only). Then the rats were treated with normal saline,dexamethasone, fluorescent bone marrow cells, dexamethasone and fluorescent bone marrow cells. The mortality of each group was compared. Results Compared with the pure lung cell group,the other groups had good cell morphology,apoptosis rate was low,while dexamethasone treatment 2ng/mL number of bone marrow cells in the experimental group were the most and best form, and the apoptosis rate of the lowest (P<0.05); and at the same time,dexamethasone and fluorescence of bone marrow cells in the experimental group the lowest mortality (P=0.034). Conclusion In vitro culture,dexamethasone 2ng/mL can enhance the protective effect of bone marrow cells on damaged lung tissue,maintain the morphology of lung cells and reduce the apoptosis of lung tissue cells.
In vitro conditions.Dexamethasone.Fluorescent bone marrow cells.Lung tissue cells.Apoptosis
国家自然科学基金(编号:81272140);中国博士后面上项目(编号:201150M1530); 中国博士后第五批特别资助项目(编号:2012T50863)。
高 岩(1990-),男,硕士研究生,医师。研究方向:脓毒症的基础与临床研究。
徐凯智,刘庆阳。
R 614.1
A
2095-2694(2017)04-263-05
