TNF—α诱导人肺鳞癌细胞发生EMT促进转移的机制研究
2017-08-01洪琼川唐绮玲迈进
洪琼川 唐绮玲 迈进


[摘要]目的 明确TNF-α引起人肺鳞癌细胞发生EMT改变并促进肿瘤细胞侵袭、转移的潜在相关机制。方法 采用TNF-α处理后的人肺鳞癌SK-MES-1细胞,通过划痕-愈合实验、Transwell实验方法检测肿瘤细胞运动、迁移及侵袭能力,采用Western blot方法检测细胞是否发生EMT(标志物Vimentin和E-cadherin)改变。结果 TNF-α能促进人肺鳞癌SK-MES-1细胞的运动、迁移、侵袭能力,且能使细胞发生EMT改变,上皮标志物E-cadherin降低,间充质标志物Vimentin表达升高。结论 TNF-α能够诱导人肺鳞癌SK-MES-1细胞发生EMT改变从而具有更强的转移能力。
[关键词]肺鳞癌;TNF-α;EMT;转移
[中图分类号] R734.2 [文献标识码] A [文章编号] 1674-4721(2017)06(a)-0013-04
[Abstract]Objective To clarify the potential mechanism of TNF-α inducing human squamous cell carcinoma of lung to produce EMT changing and promoting the invasion and metastasis of carcinoma cells.Methods SK-MES-1 cells of Human lung squamous cell carcinoma treated with TNF-α,and the motion,migration and invasion ability of lung cancer cells were detected by Scratch-wound assay and Transwell chamber assay,and Western blot was performed to examine whether the cell producing EMT change or not (markers Vimentin and E-cadherin).Results TNF-α could promote the motion,migration and invasion ability of SK-MES-1 cells of Human lung squamous cell carcinoma,and could make the cell produce EMT change,the epithelial marker (E-cadherin) decreased and the expression of the mesenchymal marker (Vimentin) increased.Conclusion TNF-α can induce EMT change in squamous cell carcinoma of lung and promote metastasis.
[Key words]Squamous cell carcinoma of lung;TNF-α;EMT;Metastasis
肺癌是全球范圍内较为常见的恶性肿瘤类型,在我国其发生率及死亡率均位居恶性肿瘤首位。肺癌中非小细胞肺癌(non-small cell lung cancer, NSCLC)占80%以上,包括腺癌、鳞癌和大细胞癌等[1]。虽然现代医疗技术飞速发展,但是大多数患者在确诊时已为中晚期,失去手术切除治愈的机会[2],且术后患者复发及远处转移率高[3],导致肺癌的治疗效果差,5年生存率较低[4]。
上皮细胞间充质转化(EMT)的发生在肿瘤转移中发挥重要作用,TNF-α能促进多种肿瘤的侵袭和转移[5-6],其机制可能与EMT的发生有关,本实验研究意在探讨TNF-α对人肺鳞癌SK-MES-1细胞发生EMT及侵袭转移能力的影响,并了解其内在可能的机制。
1 材料与方法
1.1 细胞的培养
人肺鳞癌SK-MES-1细胞株在37℃条件下在浓度为5%的 CO2培养箱中放入含有胎牛血清的培养基中,进行传代培养,每周2~3次。以人肺鳞癌SK-MES-1细胞为实验材料,TNF-α(10 ng/ml)处理组为实验组,TNF-α(-)未处理组为对照组。
1.2 细胞划痕-愈合实验观察TNF-α(10 ng/ml)对人肺鳞癌SK-MES-1细胞的运动能力的影响
①实验组:TNF-α(10 ng/ml)处理组;对照组:TNF-α(-)未处理组。
②常规细胞培养,取对数生长期的细胞,接种于平板中,分别在两组细胞的平板中利用枪头尖(2.5 μl)轻轻划出痕迹,然后采用标记笔将划痕处进行标记。待使用PBS缓冲液将细胞进行冲洗后,继续进行培养,时间为24 h,利用倒置相差显微镜对划痕处的间细胞距离进行观察,并对细胞的运动能力进行判断。
1.3 Transwell实验检测TNF-α(10 ng/ml)干预后对人肺鳞癌SK-MES-1细胞迁徙及侵袭能力的影响
1.3.1实验组 TNF-α(10 ng/ml)处理组;对照组:TNF-α(-)未处理组。
1.3.2迁移实验 ①取对数生长期细胞,制备无血清细胞悬液,并计数为2×105/ml。每组均分别加入100 μl细胞悬液于上室,并在下室中加入500 μl浓度为10%的FBS开始培养,培养条件为37℃浓度为5%的CO2培养箱,时间为24 h。②将下室中的培养基吸去,然后采用棉签对上室的内胶,采用PBS缓冲液进行清洗,并利用浓度为4%的多聚甲醇将其进行固定处理,结晶紫染色,倒置显微镜下(×100),每张膜取上、下、左、右、中 5 个视野计数连续5次进行拍照,求取平均值。
1.3.3侵袭实验 ①取无血清培养基,总量为200 μl,向其中加入50 μl Matrigel胶模仿基底膜,构建侵袭性检测系统,混匀,4℃操作,向上室各加入60 μl;放入37℃培养箱中,培养时间为4~5 h。②同迁移实验步骤。
1.4 EMT相关标志物(E-cadherin,Vimentin)的检测
为了明确TNF-α(10 ng/ml)对人肺鳞癌SK-MES-1细胞的标志物E-cadherin、Vimentin的影响,采用Western blot检测TNF-α(10 ng/ml)处理人肺鳞癌SK-MES-1细胞不同时间(0、1、3、5 h)时E-cadherin,Vimentin的表达情况。
1.4.1实验组 TNF-α(10 ng/ml)处理组;对照组:TNF-α(-)未处理组。
1.4.2细胞总蛋白的提取 ①将培养瓶中陈旧的培养基弃除后采用PBS缓冲液对细胞洗涤3次,并采用挂勺将细胞轻轻刮掉;②向其中加入PBS缓冲液吹打,剂量为1 ml,然后将细胞转移至1.5 ml预冷的Ep管中,离心分离,转速为12 000 r/min,时间为2 min;③将上清液撇去后采用细胞裂解液处理,混合均匀后放置于冰中,时间为30 min,并且需要每间隔4 min进行混合操作;④4℃ 12 000 r/min离心5 min;⑤取上清液并将其置于全新的Ep管中,并且在-80℃的恒温冰箱中保存。
1.4.3 BCA法蛋白定量 ①首先需要根据样品的数量,向其中加入适量的工作液,并且將其混合均匀;②在完全溶解蛋白标准品中加入10 ml浓度为0.9%的氯化钠溶液并将其按照100∶1比例进行稀释,终浓度需要调整为0.5 mg/ml;③将标准品依次介入培养办中,并且需要向其中加入稀释液;④在96孔培养办中添加标准品,并且需要将其进行稀释处理,然后向其中加入BCA工作液,在37℃的条件下放置30 min;⑤在波长570 nm的条件下对各个小孔的OD值进行测定,绘制标准曲线后对各组的蛋白浓度进行准确检测。
1.4.4 Westen blot检测各蛋白表达 采用Westen blot的标准检测方法测定两组细胞中E-cadherin、Vimentin的表达情况。(抗体:美国Cell signal公司的Vinment抗体,美国Santan Cruz公司的E-cadherin抗体,及相关的二抗IG/FITC,二抗IG/TRITC ),利用Image J软件对各种蛋白的相对含量进行定量分析。
1.5 统计学分析
利用SPSS 15.0软件,计量资料以均数±标准差(x±s)表示,两样本和多样本比较分别采用t检验和方差分析,以P<0.05为差异有统计学意义。
2 结果
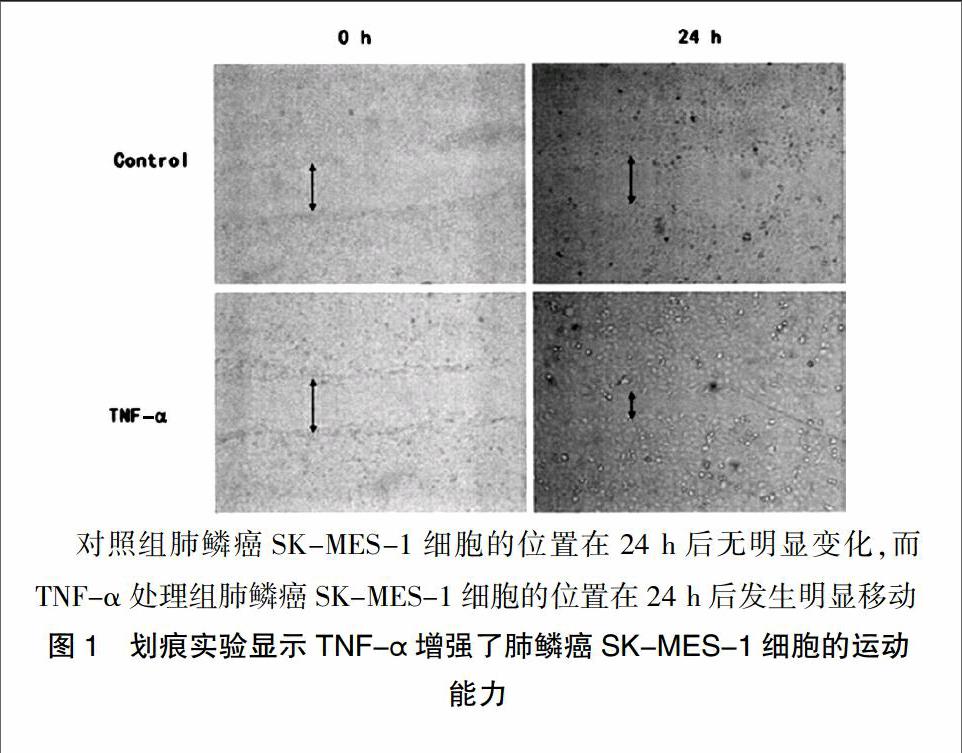
2.1 人肺鳞癌SK-MES-1细胞划痕试验
TNF-α作用细胞24 h后,TNF-α处理组中,细胞的迁移速度比对照组明显加快(图1)。
2.2 Transwell实验
迁移实验中,处理组和对照组细胞数分别是(257±29)、(118±14)个,组间差异有统计学意义(P<0.05);侵袭实验中,TNF-α处理后两组的细胞数分别为(98±5)、(61±6)个,组间差异有统计学意义(P<0.05)(图2)。
2.3 Western blot检测EMT相关蛋白
Western blot检测发现TNF-α(10 ng/ml)处理组中,上皮标志物E-cadherin降低,间充质标志物Vimentin表达升高,表明TNF-α诱导人肺鳞癌SK-MES-1细胞发生EMT变化(图3)。
3 讨论
肺鳞癌是最常见的恶性肿瘤之一, 在疾病晚期发生肿瘤细胞血管及淋巴结转移的风险较高并且危险性也较为严重[7],在该病发展及转移过程中存在有多种基因和多种物质因子的改变[8-9]。TNF-α是一种单核因子,分子质量为26kD的跨膜小分子蛋白,主要由单核细胞和巨噬细胞产生,属于炎症调节因子之一,是肿瘤微环境中重要的组成部分,多项研究表明TNF-α在炎症、免疫、细胞稳态及肿瘤增殖,血管形成,侵袭和转移等进展过程中发挥重要作用[10-11]。
EMT即上皮细胞间充质转化,上皮细胞是高度有序均一的单层细胞,其主要特点为彼此之间紧密附着,当上皮细胞转化为间充质细胞时,则形态各异,表现出更多的迁移和侵袭能力[12]。EMT作为肺鳞癌转移过程中的重要阶段,尤其是在发生转移现象的运动细胞的前缘的出现频率最高[13-14],并且上皮细胞标志物丢失,故此间质细胞标志物水平升高,是恶性肿瘤患者发生远处转移的过程中向血管侵袭的根本条件[15-16]。
本研究中观察TNF-α对人肺鳞癌SK-MES-1细胞迁移及侵袭能力的影响,以期对其相关机制进行进一步了解。首先,通过细胞划痕-愈合实验观察到经TNF-α作用后的人肺鳞癌SK-MES-1细胞的运动速度比对照组(未用TNF-α处理组)明显加快;其次,通过Transwell的迁移和侵袭实验发现,TNF-α作用细胞组的迁移和侵袭能力较对照组明显增强(P<0.05);最后,检测实验组细胞EMT相关蛋白的表达量,经TNF-α作用后细胞发生EMT改变,上皮标志物E-cadherin降低,间充质标志物Vimentin表达升高,提示TNF-α可能通过诱导人肺鳞癌SK-MES-1细胞发生EMT改变而增强肿瘤细胞的运动、迁移及侵袭能力。本实验可以从以下方面进行更进一步的研究:TWIST是调控EMT的重要转录因子,在乳腺癌及其他肿瘤中,也发现该因子能够增强细胞的转移和侵袭能力[17],且很可能与诱导细胞发生EMT有关;而TNF-α能够上调TWIST的表达水平,借此诱导EMT发生改变,还可增强细胞的运动、转移和侵袭能力;在该病理变化过程中,NF-κB作为关键性的诱导因子,能够增强肿瘤细胞的增殖和生存能力,在其中起至关重要的作用,因而抑制NF-κB表达能够对TNF-α的作用产生抑制效应,进而能够减轻该因子对肿瘤细胞增殖能力的提升作用,因此,可以通过检测NF-κB信号通路的活性、利用免疫荧光、Western blot、细胞转染等多种实验技术,进一步证实TNF-α可能通过激活经典的NF-κB信号通路,从而导致TWIST表达升高,进而诱导细胞发生EMT及增强细胞的转移能力。
肺鳞癌的发生、发展是多种因素、多种基因参与和作用的结果[18-19]。TNF-α可能通过诱导人肺鳞癌SK-MES-1细胞发生EMT改变而增强肿瘤细胞的运动、迁移及侵袭能力只是其中一种可能的机制,仍需要更多的临床及实验进一步证实。
[参考文献]
[1]陈香丽,陈小燕,陈报国,等.非小细胞肺癌病理分型与分子标记物关系研究[J].临床肺科杂志,2014,9(6):590-592.
[2]吴一龙.肺癌的外科治疗进展[J].中国肺癌杂志,2015,13(3):263-269.
[3]马刚,高劲松,仝明,等.非小细胞肺癌術后复发的临床病理因素分析[J].临床肺科杂志,2016,11(5):533-535.
[4]李连弟,鲁凤珠,张思维,等.中国恶性肿瘤死亡率20年变化趋势和近期预测分析[J].中华肿瘤杂志,2014,5(3):132-139.
[5]Drake JM,Strohbehn G,Bair TB,et al.Henry MD:ZEB1 enhances transendothelial migration and represses the epithelial phenotype of prostatecancer cells[J].Mol Biol Cell,2009,20(8):2207-2217.
[6]Cheng GZ,Zhang Wj,Wang LH.Regulation of cancer cell survival,migration,and invasion by Twist:AKT2 comes to interplay[J].Cancer Res,2015,68(4):957-960.
[7]Weiss GJ,RoseR,Fossella F,et al.The impact of induction chemotherapyon the outcome of second-line therapy with pemetrexed ordocetaxel in patients with advanced non-small-cell lung cancer[J].Ann Oncol,2016,18(3):453-460.
[8]Gervais R,Ducolone A,Breton JL,et al.Phase Ⅱ randomised trialcomparing docetaxel given every 3 weeks with weekly schedule assecond-line therapy in patients with advanced non-small-cell lungcancer (NSCLC)[J].Ann Oncol,2015,16(1):90-96.
[9]Di Maio M,Perrone F,Chiodini P,et al.Individual patient data metaanalysisof docetaxel administered with once every week second-line treatment of advanced non-smallcelllung cancer[J].Clin Oncol,2007,25(11):1377-1382.
[10]Katschinski DM,Robins HI,Schad M,et al.Role of tumor necrosisfactor alpha in hyperthermia-induced apoptosis of human leukemiacells[J].Cancer Res,1999,59(14):3404-3410.
[11]Karin M,Greten FR.NF-kappaB:linking inflammation and immunity tocancer development and progression[J].Nat Rev Immunol,2005,5(10):749-759.
[12]Mailk ST,Griffin DB,Fiers W,et al.Paradoxical effects of tumournecrosis factor in experimental ovarian cancer[J].Int J Cancer,1989,44(5):918-925.
[13]Thompson EW,Newgreen DF,Tarin D.Carcinoma invasion and metastasis:a role for epithelial-mesenchymal transition[J].Cancer Res,2005,65(14):5991-5995.
[14]Thiery JP,Sleeman JP.Complex networks orchestrate epithelial-mesenchymal transitions[J].Nat Rev Mol Cell Biol,2006,7(2):131-142.
[15]Schiller JH,Harrington D,Belani CP,et al.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N Engl J Med,2002,346(2):92-98.
[16]Hiramoto RN,Ghanta VK,Lilly MB.Reduction of tumor burden in amurine osteosarcoma following hyperthermia combined with cyclophosphamide[J].Cancer Res,1984,44(4):1405-1408.
[17]Kalapurakal JA,Mittal BB,Sathiaseelan V,et al.Re-irradiation and external hyperthermia in locally advanced,radiation recurrent,hormonerefractory prostate cancer:a preliminary report[J].Br J Radiol,2001,74(884):745-751.
[18]Kouloulias VE,Dardoufas CE,Kouvaris JR,et al.Liposomal doxorubicin in conjunction with reirradiation and local hyperthermia treatment in recurrent breast cancer: a phase Ⅰ/Ⅱ trial[J].Clin Cancer Res,2002,8(2):374-382.
[19]Aupérin A,Le Péchoux C,Pignon JP,et al.Concomitant radio-chemotherapybased on platin compounds in patients with locally advancednon-small cell lung cancer (NSCLC):a meta-analysis of individual data from 1764 patients[J].Ann Oncol,2006,17(3):473-483.
(收稿日期:2017-04-18 本文编辑:许俊琴)
