离子膜法氢氧化钾工艺对标与生产成本降低
2017-08-01赵井瑞徐欣宇王小青周杨陈琴徐得禄
赵井瑞,徐欣宇,王小青,周杨,陈琴,徐得禄
(青海盐湖工业股有限公司,青海 格尔木 816099)
【电 解】
离子膜法氢氧化钾工艺对标与生产成本降低
赵井瑞*,徐欣宇,王小青,周杨,陈琴,徐得禄
(青海盐湖工业股有限公司,青海 格尔木 816099)
氢氧化钠;氢氧化钾;离子交换膜;对标;过碱量;节能降耗
将离子膜法电解氯化钠生产氢氧化钠的工艺变更为电解氯化钾工艺生产后,对设计控制指标进行理论计算,通过实验证明:将一次盐水、脱氯及合成氯化氢指标修订在合理控制范围,在节能减排降低生产成本上取得较好的效果,为离子膜法电解氯化钾生产氢氧化钾提供合理的行业控制指标及参考依据。
青海100万t/a钾肥综合利用项目是国务院确定的西部首批十大重点工程之一“青海 100 万t/a钾肥项目”的延续,该项目的建设将改变青海省及西北地区尚没有大型聚氯乙烯生产装置的现状,使国家氯碱工业产品的布局更为合理;使柴达木盆地的天然气资源优势与察尔汗盐湖的无机盐资源优势紧密地结合起来,弥补当地距内地主要市场运输距离远的缺陷。其综合利用第2期项目是以氯化钠和天然气为原料生产聚氯乙烯、氢氧化钠、尿素的大型联合化工工厂;氯化钠电解得到氢氧化钠和氯气、氢气,32%氢氧化钠送至盐湖海虹公司 ADC 发泡剂项目;氯气和氢气则合成氯化氢送氯乙烯装置。天然气用空分装置送来的氧气,采用天然气部分氧化法制得稀乙炔,稀乙炔经提浓、净化得到精乙炔送至氯乙烯装置,乙炔装置副产的合成气用于生产合成氨、尿素。上述装置生产的乙炔和氯化氢在氯乙烯装置生产氯乙烯单体并进一步聚合生成聚氯乙烯树脂。合成氨装置中8.658 万t/a液氨送至盐湖元通钾盐综合利用项目用于生产硝酸钾,剩余部分液氨作为产品销售。主要产品及规模为:氢氧化钠 10万t/a、PVC 12 万t/a、尿素 33 万t/a。
1 青海盐湖综合利用项目第2期离子膜电解生产概况
综合利用项目第2期电解装置原设计是以氯化钠为原料生产氢氧化钠,副产氯气和氢气,氢气和氯气合成氯化氢送VCM装置。设计生产能力为10万t/a 32%NaOH(折100%),年设计操作8 000 h。本装置土建工程2010年3月开工建设,2013年5月烧碱项目机械竣工。综合利用项目第2期工程电解装置原设计为56%氯化钠精制后生产32%氢氧化钠、副产氯气和氢气,生产的氯气和32%氢氧化钠送至盐湖海虹公司ADC发泡剂项目。由于盐湖海虹公司当时整体负荷不高,生产运行不稳定,出于整体考虑,将烧碱装置变更为10万t/a KOH离子膜法电解装置。设计变更后,部分工艺指标未变更,试生产运行中参考综合利用第1期钾碱项目设计消耗指标。
通过探索,对第2期工艺进行分析修订和对标,在生产运行中逐步优化工艺控制指标,降低消耗,取得一定经济效益。
2 盐水精制中除去Ca2+、Mg2+等杂质的工艺及原理
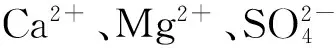
2.1 一次盐水工艺指标确定依据及对标后的经济效益
2.1.1 KOH过量控制指标修订
综合利用项目第2期电解装置一次盐水除镁工艺,采用浮上澄清桶工艺及凯膜过滤技术,浮上澄清法除去盐水中杂质原理是盐水在前反应槽中加入氢氧化钾反应生成难溶物氢氧化镁,在加压下将空气溶解在带有悬浮物的粗盐水中,然后突然减压,溶解的空气再形成微小的气泡释出,并在凝聚剂三氯化铁水解成氢氧化铁的作用下,附聚在沉淀的颗粒上,因而密度大大低于盐水,其在盐水中的浮力大于沉淀颗粒本身的重力和盐水的重力,于是以一定的速度向上浮起,并从澄清桶的上部排出。少量密度较大的沙粒则沉积于桶底,定时排出。在试生产中参考综合利用第1期钾碱设计消耗指标,造成运行成本上升。通过查阅相关理论和实验操作,在2016年3月修订KOH过碱量控制指标,将KOH过碱量由0.3~0.5 g/L变更为0.25~0.30 g/L[1]。
(1)盐水中过量KOH指标变更的理论依据。
依据《氯碱工业理化数据手册》,盐水温度在50 ℃、NaOH质量浓度低于0.1 g/L时,化学分析法检不出。所以将工艺改造为生产氢氧化钾时,一次盐水氯化钾溶液精制过程中过碱量KOH只需要在盐水质量浓度为0.14 g/L时就能在预处理过程中将Mg2+很好地去除。在实际控制中,保证设备正运行,温度、盐水浓度指标稳定,进行分段取样试验。结论:盐水中KOH在0.2 g/L时,盐水中Mg2+采用化学分析法未检出,工艺指标达到生产要求[2]。
饱和盐水中NaOH质量浓度与Mg(OH)2质量浓度的关系如表1所示。

表1 饱和盐水中NaOH质量浓度与Mg(OH)2质量浓度的关系Table 1 Relationship between NaOH mass concentration and Mg(OH)2 mass concentration in saturated brine
Mg(OH)2溶解度与NaOH过量的关系如图1所示。
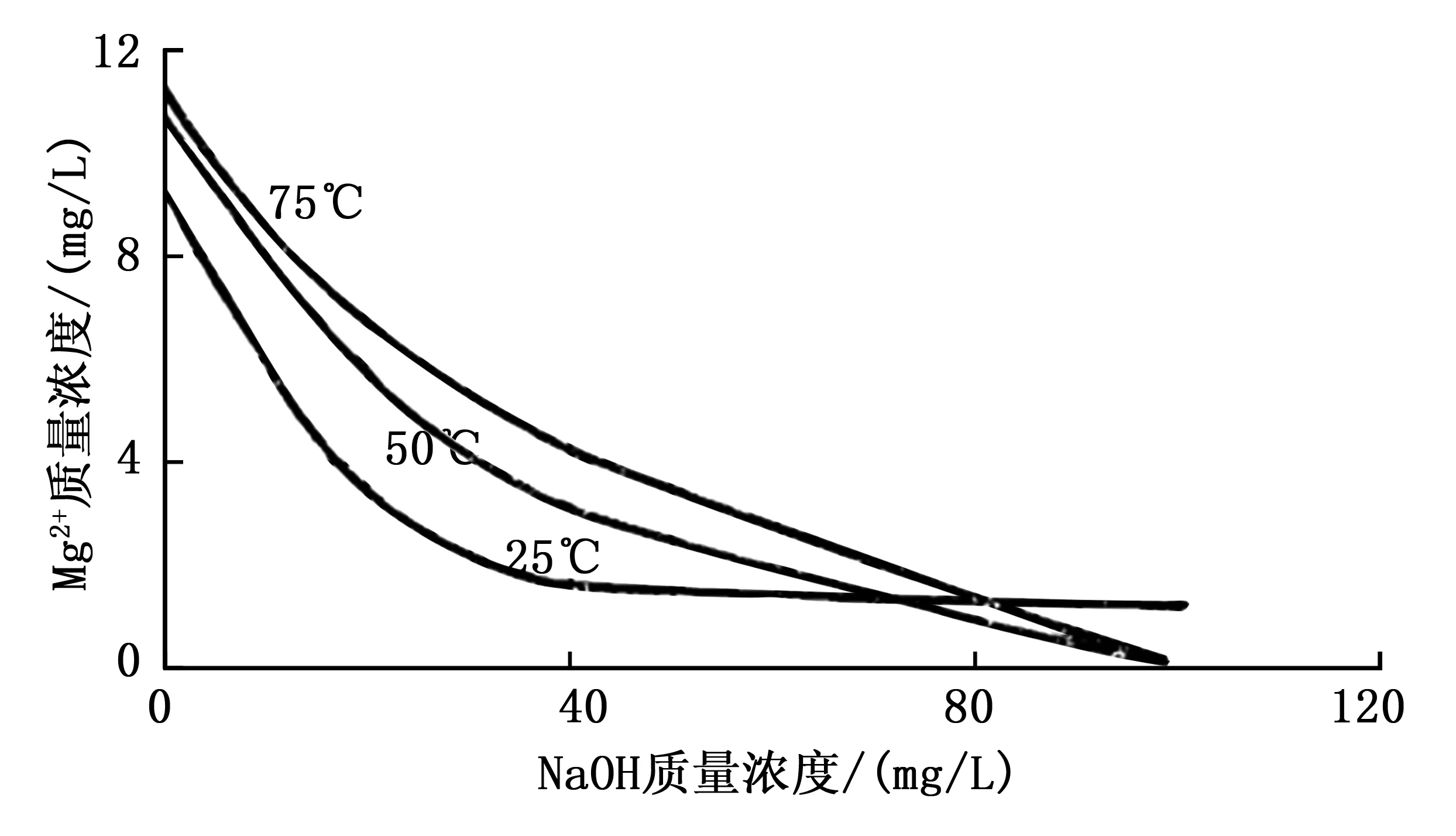
图1 Mg(OH)2溶解度与NaOH过量的关系图Fig. 1 Relationship between Mg(OH)2 solubility and NaOH excessive concentration
(2)实践研究结论。
依据上述试验数据,在实际生产过程中逐步将过碱量KOH由原参考第1期设计值0.3~0.5 g/L逐步下降控制在0.20~0.30 g/L,预处理浮上澄清桶盐水出口Mg2+未检出(见表2)。
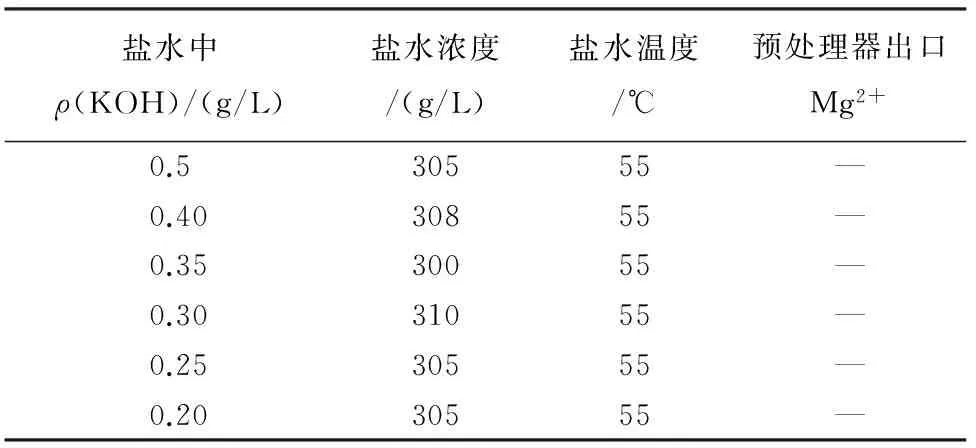
表2 过碱量控制盐水中镁含量检测对比表Table 2 Controlled KOH excessive concentration and the corresponding detected magnesium content in brine
2.1.2 KOH过量工艺指标变更后成本核算
理论上,只须过碱量超过0.14g/L,盐水中Mg2+就会被很好地除去。在生产过程中过碱量控制越高,固然能很好地去除Mg2+,但必然会造成运行成本上升,因此将一次盐水过碱量控制修订在0.25~0.3 g/L,与第1期钾碱设计过碱量控制值在0.5 g/L比较,以满负荷盐水120 m3/h计算,按2016年1—3月一次盐水平均过量KOH控制指标0.3 g/L核算单位成本,则单位时间节约KOH(折100%)为:
120×(0.5-0.3)=24 (kg/h)。
按1年生产8 000 h设计,则1年节约KOH(折100%):
8 000×24=192 000 (kg)。
KOH(折100%)按目前市场价5 000元/t,则1年节约的成本费用为96万元。
从以上数据可以看出:在保证工艺、设备正常运行的条件下严格控制过碱量,可以降低能耗,节约生产成本。
2.1.3 K2CO3过量控制指标修订
综合利用项目第2期电解装置一次盐水除钙工艺,采用后反应系统加入K2CO3,与盐水中Ca2+生产难溶物CaCO3,利用凯膜过滤除去沉淀,定时反冲洗,除去凯膜管上的CaCO3沉淀。
(1)盐水中过量K2CO3指标变更的理论依据。
氯碱工业理化数据手册中,精制氯化钠盐水温度在50 ℃、Na2CO3质量浓度在0.45 g/L时,Ca2+在盐水中质量分数为3.8×10-6,满足一次盐水精制指标要求。所以在精制氯化钾盐水过量控制时,K2CO3过量只需要0.586 g/L,实际控制中在设备正常、其他指标稳定运行、盐水中K2CO3过量控制在0.6 g/L时,Ca2+就不会超出工艺指标[3]。通过试验将K2CO3过碱量控制指标由0.5~0.8 g/L修订为0.5~0.65 g/L,数据见表3。
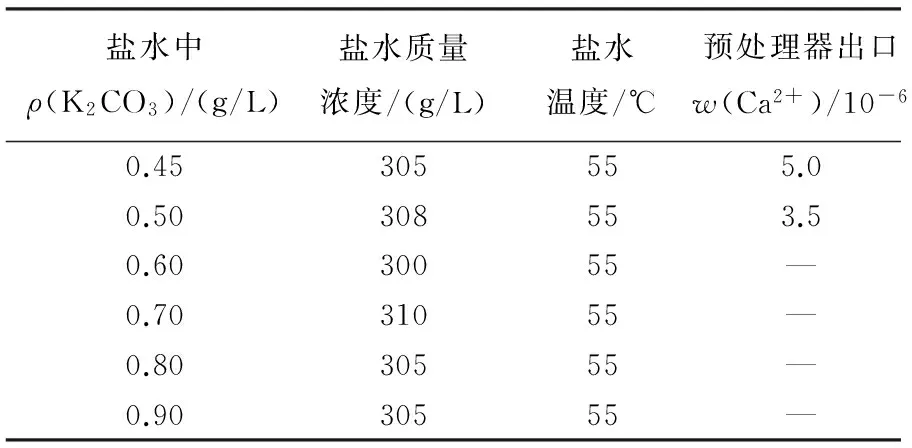
表3 过碳酸钾量控制盐水钙含量检测对比表Table 3 Detected calcium content controlled by K2CO3 excessive concentration in brine
(2)K2CO3过量工艺指标变更后成本核算。
理论上,只须K2CO3过量超过0.56 g/L时,盐水中Ca2+就会被很好地除去。现以满负荷时盐水流量120 m3/h,以目前一次盐水平均控制指标0.65 g/L核算单位成本。
修订后节约碳酸钾:
120×(0.8-0.65)=18 (kg/h)。
按1年生产8 000 h设计,则1年节约碳酸钾:
8 000×18=144 000 (kg)=144 t。
碳酸钾按目前市场价6 000元/t,则1年节约生产成本为86.4万元。
从以上数据可以看出:在保证工艺条件下严格控制碳酸钾过量程度,可以降低能耗,节约生产成本。
2.1.4 一次盐水精制过程中过碱量实际控制高于试验控制量的说明
依照斯托克定律,固体粒子在重力作用下的沉降速度可用公式表示为:
式中:W为固体粒子沉降速度,m/s;d为固体粒子直径,m;r1为固体粒子密度,kg/m3;r2为清液密度,kg/m3;μ为悬浮液黏度;s/m2[4]。
从上述公式可以看出:固体悬浮粒子的沉降分离速度与悬浮粒子的直径平方、固体悬浮粒子与清液的密度差成正比。盐水温度也是盐水精制的一个重要指标,提高盐水温度,可以使盐水黏度和密度减小,有利于过滤;反应时间长短和过碱量程度都是控制的关键,为了有效去除Mg2+、Ca2+,精制剂的加入量要比反应所须的理论量稍多些,因此通过试验将KOH过量控制在0.25~0.3 g/L、K2CO3过量0.5~0.65 g/L,在保证盐水指标合格的基础上降低消耗节约成本费用。再者,如果控制过高的过碱量或过碳酸钾量,不仅增加KOH和K2CO3的消耗,还必须加31%高纯盐酸中和,使之溶解成离子状态。加酸量的增加,也大大增加了生产运行成本。
2.2 氯化氢纯度控制的优化
2.2.1 氯化氢纯度工艺控制指标
在生产中,由于电解液氯系统未投用,废氯及尾氯全送往废气系统吸收,生产NaClO。再加上西北地区偏远,NaOH运输远,采购32%氢氧化钠不易储存,运输成本高,采购固体NaOH须加水配制增加人工成本,次氯酸钠也无法及时处理,外排环保压力大,只能排入公司污水处理装置。由于次氯酸钠主要成分为活性游离氯,给污水处理装置带来危害,造成设备管道腐蚀,严重影响生产的正常运行。为了尽可能降低NaOH消耗、减少次氯酸钠产量,在安全稳定前提下,唯一可行的方法即提高氯化氢纯度。针对以上问题,经过理论数据分析,对如何提高氯化氢纯度、减少尾氯,进而降低NaOH消耗,减少副产品次氯酸钠产量进行研究。
以4组电解槽为例,每台118个单元槽、生产负荷10 kA、电流效率96%参数下,分析得出如下数据。
4组电解槽负荷10 kA电流效率为96%,氯气、氢气实际产气量如下。
氯气实际产气量=氯气理论产气量×0.96
=1 972.5×0.96=1 893.6 (m3);
氢气实际产气量=氢气理论产气量×0.96
=1 972.5×0.96=1 893.6 (m3)。
在氯化氢合成工序,氢气及氯气发生以下反应:

H2(过量)+2HCl(产物)。
设氢气过量a, 氢气反应量为b,则由反应式及氯化氢纯度公式,可得:
a+b=实际产气量,

联立以上两式可得:
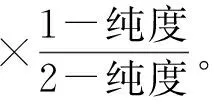
a为过量氢气值,也是过量氯气值,则:
以设计控制氯化氢体积分数由95%提升至98%,每小时降低NaOH消耗量计算如下。
氯化氢体积分数为95%时过量氯气为:
=187.8 (m3)。
氯化氢体积分数为97%时过量氯气为:
=77.35 (m3)。
氯气与NaOH反应方程式为:
则氯化氢体积分数为95%时比氯化氢体积分数为98%时,每小时多消耗NaOH量:
则氯化氢体积分数为95%时,比氯化氢体积分数为98%时,每小时多消耗0.7 t NaOH。
以年生产时间8 000 h、NaOH价格2 000 元/t计算,则每年节约成本:
0.7×8 000×2 000=11 200 222(元)
≈1 120(万元)。
以氯化氢体积分数95%为基准,提升不同氯化氢纯度所节约成本如表3所示。
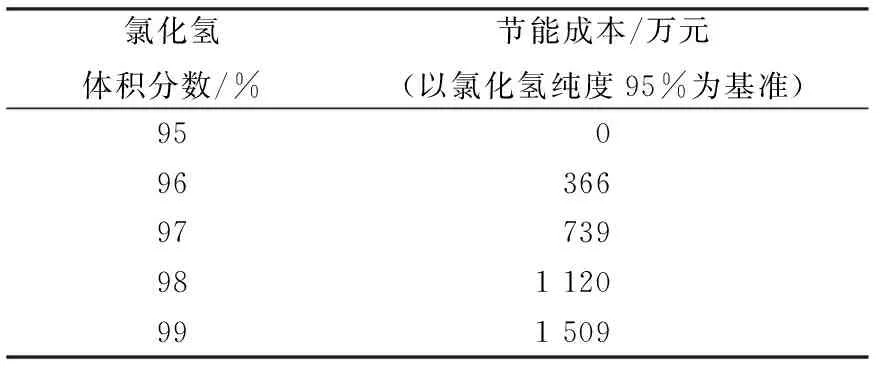
表3 不同氯化氢体积分数所节约成本Table 3 Cost saving resulted from increase in hydrogen chloride purity
从图2可以看出:随着氯化氢纯度提升,可以减少NaOH消耗,降低消耗成本。纯度对在当前生产负荷下的影响极大。在HCl气体中,无游离氯情况下,尽可能提高氯化氢纯度,可以节约成本,也可以减少人力物力,减少次氯酸钠对环境的污染,为公司节约成本和减少因污水处理系统设备腐蚀带来的检修成本压力及环保压力。
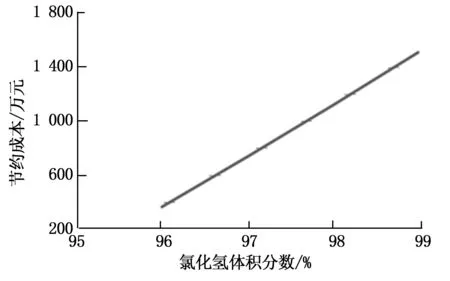
图2 氯化氢体积分数与节约成本关系图Fig.2 Relation between hydrogen chloride purity and cost saving
2.2.2 氯化氢纯度变更控制指标的实际控制情况
VCM生产要求的氯化氢质量指标说明如表4所示。
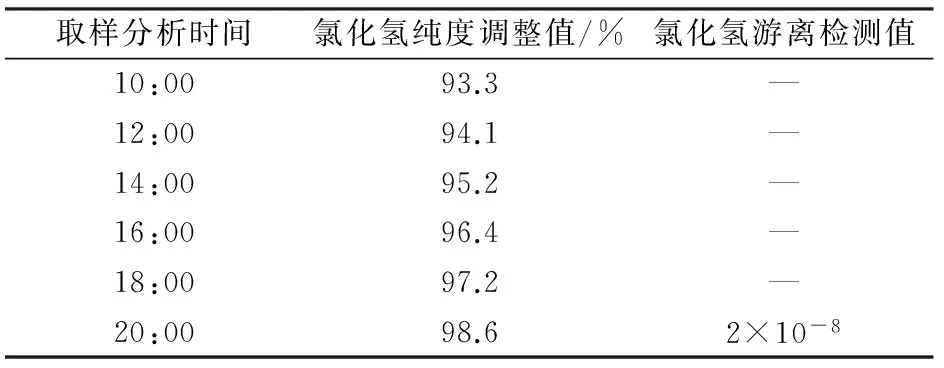
表4 氯化氢纯度与氯化氢产品质量检测的对比表Table 4 Comparison between hydrogen chloride purity and detected hydrogen chloride purity
因此,把氯化氢体积分数控制指标范围97%~98%,既保证下游VCM的安全生产,又节约富余氯气的NaOH消耗,减少成本。
2.2.3 氯化氢体积分数变更控制在98%时,次氯酸钠排污量变化计算
以4组电解槽负荷10 kA、电流效率为96%,计算不同氯化氢体积分数下次氯酸钠产量(配制碱质量分数约18%)。
4组电槽负荷10 kA电流效率为96%,氯气、氢气实际产气量如下:
氯气实际产气量=氯气理论产气量×0.96
=1 972.5×0.96=1 893.6 (m3);
氢气实际产气量=氢气理论产气量×0.96
=1 972.5×0.96=1 893.6 (m3),
消耗所需NaOH(折100%)量为:
则生产出的次氯酸钠的量为:

表5 不同体积分数的氯化氢完全吸收的NaOH量(折100%)Table 5 The quantity of NaOH for fully absorbing different purity of hydrogen chloride
氯化氢体积分数由原设计控制指标95%提升到98%,每年按8 000 h计算,次氯酸钠排污量减少
(4.97-2.05)×8 000=23 360 (m3)。
次氯酸钠处理费用2元/m3,年为公司节约成本46 720元,减轻环保压力,具有社会效益。
2.2.4 氯化氢体积分数变更控制在98%时,氯气利用率及PVC增产带来的经济效益
实施后小时氯气尾气产生的HCl(折100%)量为77.35×2=154.7 (m3/h)。
年产HCl增产1 237 600 m3,生产1 t PVC耗HCl按0.60 t计,年可增产PVC 3 361 t。PVC价格按目前出产价6 000 元/t计, PVC成本按统计平均在5 900元/t计,则年创造利润33.61万元。
3 结语
在离子膜电解氯化钠工艺变更为电解氯化钾工艺生产后对设计控制指标进行理论计算,并通过试验证明:将指标修订在合理控制范围,在节能减排降低生产成本上取得较好的经济效益,为离子法电解氯化钾生产氢氧化钾提供合理的行业控制指标提供的参考依据。离子膜法电解氯化钾生产氢氧化钾配套氯化氢合成PVC项目按此控制指标作为企业的消耗定额,10万t/a离子膜氢氧化钾装置年节约成本1 307.1万元,直接利润604.98万元,减排23 360 t化工污水,创造了经济效益和环保效益。
[1] 陈殿彬,陈伯森,施孝奎.离子膜法制碱生产技术[M].北京:化学工业出版社,1998:165.
[2] 北京石油化工工程公司.氯碱工业理化常数手册修订版[M].北京:化学工业出版社,808.
[3] 刘立初.氯碱一次盐水生产技术浅析[J].氯碱工业,2008,44(2):7-11.
[4] 曹亚格.膜极距改造的降耗效果和经济分析[J].氯碱工业,2015,51(1):20-21.
[编辑:蔡春艳]
Benchmarking of ion-exchange membrane process for potassium hydroxide and reduction in production cost
ZHAOJingrui,XUXinyu,WANGXiaoqing,ZHOUYang,CHENQin,XUDelu
(Qinghai Salt Lake Industry Co., Ltd., Golmud 816000, China)
sodium hydroxide; potassium hydroxide; ion-exchange membrane; benchmarking; excessive soda amount; energy saving and cost reduction
The ion-exchange membrane electrolytic process for producing sodium hydroxide from sodium chloride was changed into the one for electrolysis of potassium chloride. The design control index was calculated theoretically. Experimental results proved that the revised indexes of primary brine, dechlorination and hydrogen chloride synthesis were in reasonable control range, and better effects could be achieved in energy saving, emission reduction and production cost reduction. These indexes were proposed as the control ones in the production of potassium hydroxide by ion-exchange membrane electrolysis of potassium chloride.
赵井瑞(1981—),女,助理工程师,2002年毕业于兰州石化职业技术学院,长期从事氯碱化工工艺技术管理工作。现于青海盐湖工业股份有限公司化工分公司生产部从事生产技术管理工作。
2017-02-02
TQ114.262
B
1008-133X(2017)06-0013-05
