AMPK与氧化应激及其与运动关系的研究进展
2017-08-01罗琳,张缨
罗 琳,张 缨
LUO Lin1,2,ZHANG Ying1
AMPK与氧化应激及其与运动关系的研究进展
罗 琳1,2,张 缨1
LUO Lin1,2,ZHANG Ying1
细胞能量代谢改变可以激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),氧化应激同样也能激活AMPK,参与机体抗氧化还原反应的调节。综述AMPK与氧化应激及其与运动关系的最新研究进展,以期为慢性病的形成、防治以及运动性疲劳的发生机制等相关领域的研究提供理论依据。
AMPK;氧化应激;氧化还原反应;能量代谢;运动
腺苷酸激活蛋白激酶(AMPK)在机体物质代谢及能量代谢中的作用已被充分证实。然而,近年来有实验发现,AMPK不仅参与细胞能量代谢调节,还可被氧化应激激活,进而参与机体抗氧化物质的调节。目前AMPK的信号调节作用已得到人们越来越多的关注,因此,本文以近些年的动物和细胞实验为基础,从细胞能量代谢与AMPK激活、细胞能量代谢与氧化应激通路、氧化应激与AMPK激活、AMPK与机体抗氧化物质的调节以及运动、AMPK与氧化应激等5个方面进行综述,旨在为更好地了解和认识AMPK的作用,为慢性病的预防和治疗以及运动性疲劳的发生机制提供新思路。
1 细胞能量代谢与AMPK激活
AMPK 是一种位于真核生物细胞中广泛存在的丝氨酸/苏氨酸蛋白激酶,是一种异源三聚体蛋白,由 α、β、γ 3 种亚基组成,每种亚基存在2或3种亚型 ( αl、α2、β1、β2、γ1、γ2、γ3),其中α亚基是AMPK的主要催化亚基,β和γ亚基主要起调节作用,并且在不同的哺乳动物组织中各种亚基的表达有所不同[32]。
通常,AMPK可在多种情况下被激活,如运动、饥饿、糖尿病、缺氧、缺血再灌注损伤等都能通过细胞内ATP浓度下降、AMP浓度增加,使AMPK各亚基发生变构重排,AMPKα亚基( Thr172位点) 磷酸化,从而激活AMPK参与调节细胞内糖、脂肪酸氧化和能量代谢[11、、23、24]。
2 细胞能量代谢与氧化应激通路
机体细胞正常生物学功能的发挥,需要营养物质的分解代谢提供能量。葡萄糖等营养物质通过有氧代谢进入三羧酸循环,代谢物脱下的氢通过线粒体呼吸链的氧化磷酸化作用进一步生成ATP和水。同时,会伴有活性氧(ROS)的产生[30]。进而,ATP可为还原型谷胱甘肽(GSH)和还原型硫氧还蛋白[Trx(SH)2]的合成提供能量。GSH和Trx(SH)2是体内重要的抗氧化物质,在相应酶的作用下,GSH和Trx(SH)2可转变为氧化型谷胱甘肽(GSSG)和氧化型硫氧还蛋白(Trx(s-s)),从而消除生成的ROS[38]。糖除了有氧氧化途径外,也可通过旁路途径(磷酸戊糖途经)分解代谢,此过程为GSSG和 Trx(s-s)还原为GSH和Trx(SH)2提供必要的NADPH[40](图1)。

图1 细胞中能量代谢与氧化应激通路Figure 1. Energy Metabolism and Oxidative Stress Pathways in Cells
正常情况下,线粒体氧化磷酸化产生的ROS和一氧化氮合酶(NOS)催化NO产生的活性氮(RNS),可以通过具有抗氧化作用的GSH、Trx等物质清除。但如果机体处于某些刺激条件下,ROS或RNS急剧增加,超过机体的清除能力,就会造成机体能量代谢与氧化还原反应之间的平衡被破坏,发生氧化应激现象。
3 氧化应激与AMPK激活
当细胞内AMP/ATP比值增加时,AMPK可被激活从而开始复杂的能量代谢调控,而越来越多的研究显示,机体氧化应激通过ROS或RNS也可直接或间接激活AMPK,并且AMPK可参与细胞氧化还原反应的调节。
3.1 ROS与AMPK激活
ROS主要包括代谢产生的超氧阴离子(.O2)、过氧化氢(H2O2)及羟基自由基(.OH)等[2]。在适宜的PH值条件下,半胱氨酸可以轻易地与H2O2或NO发生氧化还原反应,分别形成S-羟基化或S-亚硝基化衍生物,变为更为稳定的化合物。而这一可逆的反应过程可引起一些氧化还原敏感蛋白的结构和功能发生改变[36]。越来越多的研究认为,氧化应激时,ROS的增多是造成AMPK激活的主要原因,但目前对ROS是间接还是直接激活AMPK存有争议。
Choi等人的研究发现[16],AMPK的激活与H2O2的增加有关。研究认为,H2O2对AMPK激活是细胞内ATP水平减少造成的间接结果。Emerling等人的研究表明[17],在适度的低氧条件下,AMPK的激活具有ROS依赖性,而无需腺苷酸池(ATP、AMP等)的改变,并且外源性给予抗氧化剂,可抑制AMPK的活性,而不改变细胞内AMP/ATP比值。由于该研究没有显示AMPK上游激酶,如肝激酶B1 (LKB1),是否受该外源性抗氧化剂作用而影响AMPK活性,因此,在低腺苷酸能荷下,ROS可直接激活AMPK仍缺乏证据。
然而,有研究报道,采用高浓度葡萄糖或脂肪酸培养血管内皮细胞的离体实验发现,细胞内ROS产生增多,从而引起细胞凋亡。而加入AMPK的药理激活剂AICAR,可减少ROS的生成,防止内皮细胞氧化损伤,抑制细胞凋亡的发生[29]。该研究表明,ROS可以直接激活AMPK。 另有研究报道[45],暴露于H2O2会导致AMPK的α、β亚基上半胱氨酸(Cys)残基氧化,从而激活AMPK。同时,该研究还发现,Cys的Cys299突变子可降低H2O2对AMPK活性的影响,而Cys304突变子甚至可阻止H2O2对AMPK的激活。这表明,这种硫醇结构在氧化应激对AMPK激活中具有重要的调节作用。Hawley等人进一步研究发现[22],当细胞遭遇氧化应激时,可引起对AMP/ATP浓度变化不敏感的AMPKγ2亚基上的R513G突变子高表达,从而完全抑制AMPK磷酸化激活[35]。研究提示,氧化应激可不依赖于细胞内AMP/ ATP比值升高,而独立激活AMPK活性。同时,也提示,氧化应激激活AMPK位点可能与能量代谢改变激活AMPK位点有所不同。
因此,ROS是直接还是间接激活AMPK以及ROS激活AMPK的机制,仍有待进一步深入探讨。
3.2 RNS与AMPK激活
NO、NOS和RNS类物质,如过氧亚硝基阴离子(ONOO_)[6]都与AMPK激活有关(如图2所示)。有研究报道,正常生理状态下,NO可以通过提高内皮细胞鸟苷酸环化酶活性,增加Ca2+水平,从而增强AMPK活性[44]。这是经典的NO诱导Ca2+水平增加引发鈣调蛋白激酶激酶β(CaMKKβ)调节AMPK活性途径。NOS也可通过磷酸化AMPK Ser1177位点激活AMPK[15]。另有报道,在生理或病理条件下,提高NOS酶活性,可增加NO的合成,从而诱导AMPK激活[26、37]。有实验证实,激活AMPK的二甲双胍药物,对NOS敲除鼠内皮细胞的AMPK激活没有作用,说明内源性NO在激活AMPK中具有重要的作用[12]。在某些ONOO_生成过剩的病理状态下,ONOO_可激活蛋白激酶Cζ(PKCζ)[43],促进LKB1磷酸化,进而激活AMPK,增强下游通路的能量变化[7、47]。
此外,NO在NOS的催化下可与GSH反应,生成亚硝基谷胱甘肽(GSNO)。GSNO被认为是机体内运输和储存NO的工具[5]。它可进一步通过作用于蛋白质的半胱氨酸残基位点进行亚硝基化修饰,对特定蛋白质的结构、功能和活性产生影响。在这一过程中,将消耗ATP能量[28、18],造成细胞内AMP/ATP比值增加,从而激活AMPK。
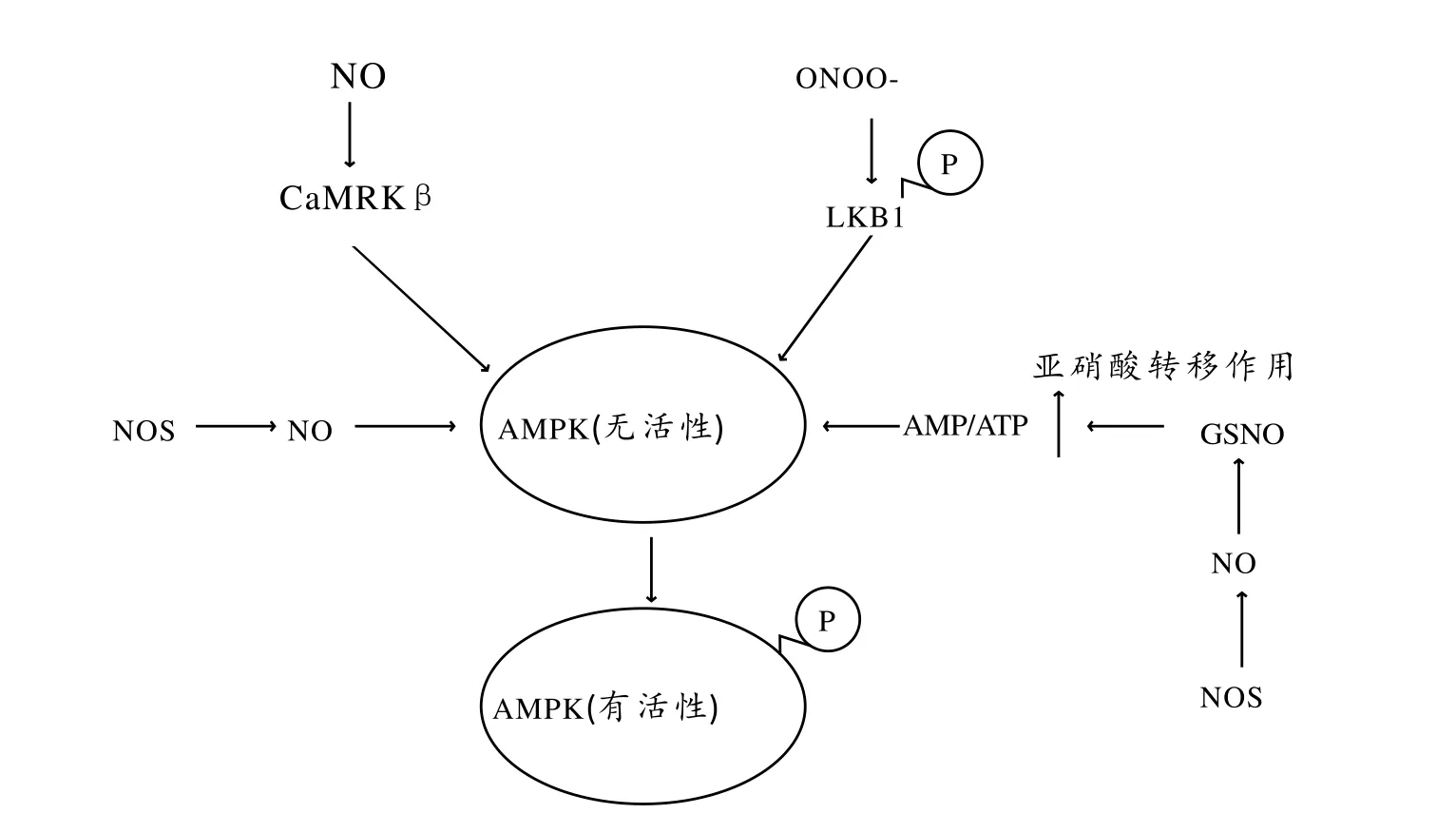
图2 RNS激活AMPK的可能信号通路Figure2 RNS Signaling Pathways that Activate AMPK
RNS激活AMPK的可能机制很多,有待于更深入的研究去发现和证实。
4 AMPK与机体抗氧化物质的调节
4.1 AMPK与谷胱甘肽
谷胱甘肽(GSH) 是一种由谷氨酸,半胱氨酸和甘氨酸3个氨基酸组成的短肽,存在于几乎身体的每一个细胞中,在机体的抗氧化系统中起着关键作用。细胞中GSH是以还原形式存在的,分子中半胱氨酸的活性巯基(-SH)是最主要的功能性基团。巯基可提供电子给自由基,而后GSH转化生成稳定的二聚体GSSG,以阻止自由基持续的释放电子,保护巯基蛋白和酶的活性,防止组织的自由基损伤。GSH/GSSG的稳态是维持细胞正常生理过程的关键,是细胞最重要的抗氧化系统之一[33]。GSH浓度下降是糖尿病、心肌病等多种疾病的致病的因素,同时伴随GSH浓度下降,还会出现AMPK活性降低的现象[21]。华楠等人的研究发现[1],AMPKα2转基因鼠4周低氧训练后,骨骼肌GSH /GSSG 比值显著增加,说明低氧训练促进了AMPK参与GSH抗氧化系统的调节。Wang等人的研究表明,二甲双胍或AICAR处理肝细胞后,磷酸化AMPK水平提高的同时,GSH/GSSG比值增加;而使用AMPK抑制剂Compound C物质后, 出现GSH /GSSG 比值下降[41]。
另外,当GSH缺失或生成障碍时,机体可能通过AMPK诱导其他抗氧化系统的激活,以维持机体氧化还原反应的平衡[31]。有研究报道,谷氨酸-半胱氨酸连接酶m亚基(GCLm)基因敲除鼠体内的GSH含量只有正常鼠的15%,当其受到氧化应激刺激时,AMPK可通过激活核因子 E2相关因子2(nuclear factor E2related factor 2,Nrf2)介导的信号通路来代偿提高机体抗氧化能力[14]。
4.2 AMPK与Nrf2
近年大量研究表明,Nrf2介导的抗氧化信号通路,在机体抗氧化作用中起关键性作用[9、19、20]。在氧化应激条件下,可激活Nrf2,诱导其下游一系列靶基因,如醌氧化还原酶(NQO1)、血红素加氧酶1(HO-1)、超氧化物岐化酶(SOD),过氧化氢酶(CAT)、谷胱甘肽过氧化物酶1(GPx-1)和GCL等的转录,增强细胞抗氧化酶的表达,减轻氧化应激反应[3、31]。
已有多项研究表明,激活的AMPK与Nrf2信号通路的调节有关。Wu等人的研究报道,使用二甲双胍激活AMPK后,细胞ROS下降。同时Nrf2下游抗氧化酶HO-1、NQO-1、GPx-1表达增加[42]。将具有抗肿瘤作用的β-内酰胺酶作用于大鼠神经胶质细胞,可抑制细胞ROS的生成,增加Nrf2下游抗氧化酶HO-1、NQO1和CAT的表达;但如果加入AMPK抑制剂,则这些酶的表达受到抑制[33]。Park等人的研究发现,使用大黄素刺激神经胶质细胞后Nrf2对HO-1和NQO1的转录活性增强,而加入AMPK抑制剂后,这一作用受到抑制[34]。Nrf2敲除鼠和野生鼠通过药物诱导成为肝癌小鼠,培养其肝细胞,而后分别给予AICAR孵育,结果表明,野生肝癌鼠的肝细胞出现Nrf2活化及有益的氧化还原反应的改变,而Nrf2敲除鼠的肝细胞,则没有这一变化[39]。另一项研究报道,采用AICAR孵育离体血管内皮细胞,Nrf2和HO-1的mRNA和蛋白表达量随AICAR孵育时间和浓度的增加而增加;而采用AMPK抑制剂Compound C则阻断这一变化[29]。然而,也有研究认为,AMPK可以不通过Nrf2参与HO-1的调节。有研究报道,用AICAR孵育野生鼠和Nrf2敲除鼠离体心肌细胞24 h后,这两种鼠心肌细胞的HO-1表达均显著增加[46]。推测AMPK下游的一些物质,如有丝分裂原活化蛋白激酶(MAPK )等可能参与了HO-1表达的调节[8,13,43,46]。
目前AMPK是否通过Nrf2调节一些抗氧酶的表达,仍有待于进一步的确定。
5 运动、AMPK与氧化应激的关系
运动可造成氧化应激,同时伴有自身能量代谢的改变,因此,运动应激对AMPK的激活可能更为复杂。目前,关于运动与AMPK关系的研究多为运动中AMPK与能量代谢的变化、细胞凋亡、自噬作用等方面。而关于运动中AMPK与氧化应激关系的研究甚少。有文献报道,SD肥胖大鼠8周跑台训练后,其心肌细胞AMPK活性提高,ROS水平下降,SOD生成增加[27]。王大磊等人报道,8周有氧运动训练可使大鼠海马组织AMPK 蛋白表达增加,ROS、丙二醛(MDA)含量显著降低,SOD、 GPx-1 活性显著升高[4]。进而,人们也开始关注探讨运动中AMPK与氧化应激关系的可能的分子机制。Brandauer等人研究发现,4周AMPKα2基因敲除鼠和野生鼠跑台运动训练,并伴随每日AICAR肌肉注射后,野生鼠比AMPKα2基因敲除鼠骨骼肌ROS水平显著下降[10]。另有报道,4周低氧训练可显著增强AMPKα2转基因鼠骨骼肌GSH /GSSG 比值水平[1]。以上提示AMPKα2在运动中骨骼肌ROS的调节中起重要作用。关于运动、AMPK与氧化应激的进一步关系,许多问题仍有待于澄清和证实。
6 小结
细胞能量代谢的改变可激活AMPK,氧化应激同样也可激活AMPK,但目前研究仍还无法确定氧化应激是直接,还是间接地激活AMPK。虽然已有较多的研究发现,AMPK与机体氧化还原系统之间存在着共变关系,但AMPK参与机体抗氧化作用的调节机制仍未得到清晰的阐明。因此,AMPK与氧化应激的研究才刚起步,探讨以AMPK变化为切入点的细胞氧化还原变化的网络关系,为深入研究AMPK提供了全新的视角,未来在与氧化应激相关疾病的形成、预防和治疗以及科学运动训练等研究领域将会有着非常广阔的应用前景。
[1] 华楠,张华,张缨.低氧训练后AMPKα2转基因鼠骨骼肌谷胱甘肽氧化还原状态的变化[J].北京体育大学学报,2013,12(33):73-76+81.
[2] 李洪民.基于微流控芯片的细胞内活性氧(O2-、H2O2)多组分的同时分析[D].济南:山东师范大学,2012.
[3] 林晓萍,李雯,沈华浩.抗氧化应激转录因子Nrf2的研究进展[J].中国病理生理杂志,2011,27(6):1234-1239.
[4] 王大磊,王童.有氧运动对老年大鼠海马氧化应激水平、AMPK及PGC-1α蛋白表达的影响[J].西安体育学院学报,2014,24(3):350-354,363.
[5] 吴凯源,张玉英,粟文婷,等.亚硝基化谷胱甘肽还原酶:一个调控炎症反应的新分子[J].生物化学与生物物理进展,2013,(22)08:731-738.
[6] ALMEIDA A,CIDAD P,DELGADO-ESTEBAN,et al.Inhibition of mitochondrial respiration by nitric oxide:its role in glucose metabolism and neuroprotection[J].J Neurosci Res,2005(79):166-171.
[7] AN Z,WANG H,SONG P,et al.Nicotineinduced activation of AMP-activated protein kinase inhibits fatty acid synthase in 3T3L1 adipocytes:a role for oxidant stress[J].J Biol Chem,2007,282(37):26793-26801.
[8] ANWAR A A,LI F Y,LEAKE D S,et al.Induction of heme oxygenase 1 by moderately oxidized low-density lipoproteins in human vascular smooth muscle cells:role of mitogen-activated protein kinases and Nrf2 [J] .Free Radic Biol Med,2005,39(2):227-236.
[9] ASGHAR M,GEORGE L,LOKHANDWALA M F.Exercise decreases oxidative stress and inflammation and restores renal dopamine D1 receptor function in old rats [J].Am J Physiol Renal Physiol,2007,293(3):F914-F919.
[10] BRANDAUER J,ANDERSEN M A,KELLEZI H, et al.AMP-activated protein kinase controls exercise training- and AICAR-induced increases in SIRT3 and MnSOD[J]. Front Physiol ,2015,24(5):85-86.
[11] CACICEDO J M,GAUTHIER M S,LEBR ASSEUR N K,et al.Acute exercise activates AMPK and eNOS in the mouse aorta [J]. Am J Physiol Heart Circ Physiol,2011,301( 4) :H1255 -65.
[12] CALVERT J W,GUNDEWAR S,JHA S,et al.Acute metformin therapy confers cardioprotection against myocardial infarction via AMPK-eNOS-mediated signaling[J]. Diabetes 2008,57(3):696-705.
[13] CHEN K,MAINES M D.Nitric oxide induces hemeoxygenase-1 via mitogen-activated protein kinases ERKand p38 [J].Cell Mol Biol,2000,46(3):609-617.
[14] CHEN Y, SINGH S, MATSUMOTO A,et al.Chronic glutathione depletion confers protection against alcohol-induced steatosis:implication for redox activation of AMP-activated protein Kinase Pathway [J].Sci Rep, 2016,6:29743.
[15] CHEN Z P,MITCHELHILL K I,MICHELL B J,et al.AMP-activated protein kinase phosphorylation of endothelial NO synthase [J]. FEBS Lett,1999(443):285-289.
[16] CHOI S L,KIM S J,LEE K,et al.The regulation of AMP-activated protein kinase by H(2)O(2) [J].Biochem Biophys Res Commun,2001,287(4):92-97.
[17] EMERLING BM,WEINBERG F,SNYDER,et al.Hypoxicactivation of AMPK is dependent on mitochondrial ROS but independent of an increase in AMP/ATP ratio [J].Free Radic Biol Med,2009,(46):1386-1391.
[18] FOSTER M W,HESS D T,STAMLER J S. Protein S-nitrosylation in health and disease:a current perspective [J].Trends Mol Med,2009,15(9):391-404.
[19] GANAN-GOMEZ I,WEI Y,YANG H,et al.On cogenic functions of the transcription factor Nrf2 [J].Free Radic Biol Med,2013,65(6):65750-65764.
[20] GOMEZ-CABRERA M C,DOMENECH E,VINA J.Moderate exercise is an antioxidant:upregulation of antioxidant genes by training [J].Free Radic Biol Med,2008,44(2):126-131.
[21] GUAN Y,CUI Z J,SUN B,et al.Celastrol attenuates oxidative stress in the skeletal muscle of diabetic rats by regulating the-AMPK-PGC1α-SIRT3 signaling pathway[J].Int J Mol Med,2016,37(5):1229-1238.
[22] HAWLEY S A,ROSS F A.Use of expressing gamma subunit variants to identify diverse mechanisms of AMPK activation [J]. Cell Metab,2010(11):554-565.
[23] JENSEN T E,WOJTASZEWSKI J F,RICHTER E A.AMP-activated protein kinase in contraction regulation of skeletal muscle metabolism:necessary and/or sufficient? [J]Acta Physiol,2009,196(1):155-174.
[24] KARAGOUNIS L G,HAWLEY J A.The 5’adenosine monophos-phate-activated protein kinase:Regulating the ebb and flow of cellular energetics[J].Int J Biochem Cell Biol,2009,41(12):2360-2363.
[25] KRSTIC A,ILIC V,MOJSILOVIC S,et al. p38 MAPK signaling mediates IL-17-induced nitric oxide synthase expression in bone marrow cells [J].Growth Factors,2009,27(2):79-90.
[26] LEVINE Y C,LI G K,MICHEL T. Agonist-modulated regulation of AMPactivated protein kinase (AMPK) in endothelial cells. Evidence for an AMPK / Rac1 / Akt / endothelial nitric-oxide synthase pathway [J]. J Biol Chem,2007,282(28):20351-20364.
[27] LI L,MENG F,LI N,et al.Exercise training prevents the attenuation of anesthetic pre-conditioning-mediated cardioprotection in diet-induced obese rats[J].Acta Anaesthesiol Scand, 2015 59(1):85-97.
[28] LIU L,HAUSLADEN A,ZENG M,et al.A metabolic enzyme for S-nitrosothiol conserved from bacteria to humans [J]. Nature,2001,410(6827):490-494.
[29] LIU X M,PEYTON K J,SHEBIB A R,et al.Activation of AMPK stimulates heme oxygenase -1 gene expression and human endothelial cell survival [J].Am J Physiol Heart Cir Physiol,2011,300( 1) :H84 -93.
[30] MCCONELLl G K,LEE-YOUNG R S,CHEN Z P,et al.Shortterm exercise training in humans reduces AMPK signalling during prolonged exercise independent of muscle glycogen [J].J Physiol,2005,568 ( Pt2) :665-76.
[31] MIN K J,LEE J T,JOE E H,et al.An IκBα phosphorylation inhibitor induces heme oxygenase-1 (HO-1) expression through the activation of reactive oxygen species (ROS)-Nrf2-ARE signaling and ROS PI3K /Akt signaling in an F-κB-independent mechanism[J]. Cell Signal,2011,23(9):1505-1513.
[32] MISERA P.AMP activated protein kinase:a next generation target for total metabolic control [J]. Expert Opin Ther Targets,2008,12(1):91-100.
[33] PARK J S, LEE Y Y, KIM J ,et al. β-Lapachone increases phase II antioxidant enzyme expression via NQO1-AMPK/PI3KNrf2/ARE signaling in rat primary astrocytes[J]. Free Radic Biol Med,2016,97(28):168-178
[34] PARK S Y, JIN M L,KO M J,et al.Anti-neuroinflammatory effect of emodin in LPS-Stimulated microglia:involvement of AMPK/Nrf2Activation[J].Neurochem Res, 2016,307(4):138-149.
[35] PIANTADOSI C A. Regulation of mitochondrial processes by protein S-nitrosylation [J]. Biochim Biophys Acta,2012,1820(6):712-721.
[36] POELS J,SPASIC M R,CALLAERTS P,et al.Expanding roles for AMP-activated protein kinase in neuronal survival and autophagy [J].Bioessays 2009,31(9):944-952.
[37] REIHILL J A,EWART M A,HARDIE D G,et al.AMP-activated protein kinase mediates VEGF-stimulated endothelial NO production[J].Biochem Biophys Res Commun,2007,354(4):1084-1088.
[38] SCHULZE P C,YOSHIOKA J,TAKAHASHI T,et al. Hyperglycemia promotes oxidative stress through inhibition of thioredoxin function by thioredoxin-interacting protein [J].Biol Chem,2004,279(29):30369-30374.
[39] SID B,GLORIEUX C, VALENZUELA M,et al.AICAR induces Nrf2 activation by an AMPK-independent mechanism in hepatocarcinoma cells[J].Biochem Pharmacol,2014,91(2):168-80.
[40] SIMONE C,GIUSEPPE F,MARIA R C. Redox implications of AMPK-mediated signal transduction beyond energetic clues [J]. J Cell Sci,2012,125 (9):2115-2125.
[41] WANG L, WANG Z, YANG K, et al. Epigallocatechin gallate reduces slow-twitch muscle fiber formation and mitochondrial biosynthesis in C2C12 cells by repressing AMPK activity and PGC-1α expression [J].J Agric Food Chem,2016,64(34):6517-6523.
[42] WU P, YAN Y, MA L L,et al. Effects of the Nrf2modulator salvianolic acid A alone or combined with metformin on diabetes-associated macrovascular and renal injury[J].J Biol Chem, 2016.
[43] XIE Z,DONG Y,ZHANG M,et al.Activation of protein kinase C zeta by peroxynitrite regulates LKB1-dependent AMP-activated protein kinase in cultured endothelial cells[J].J Biol Chem,2006,281(10):6366-6375.
[44] ZHANG J,XIE Z,DONG Y,et al.Identification of nitric oxide as an endogenous activator of the AMP-activated protein kinase in vascular endothelial cells[J].J Biol Chem,2008,(283):27452-27461.
[45] ZMIJEWSKI J W,BANERJEE S,BAE H,et al.Exposure to hydrogen peroxide induces oxidation and activation of AMP-activated protein kinase[J].J Biol Chem,2010,(285):33154-33164.
[46] ZHOU G,SEBHAT I K,ZHANG B B.AMPK activators-potential therapeutics for metabolic and other diseases [J].Acta Physiol,2009,196( 1) :175 -190.
[47] ZOU M H,KIRKPATRICK S S,DAVIS B J,et al.Activation of the AMP-activated protein kinase by the anti-diabetic drug metformin in vivo.Role of mitochondrial reactive nitrogen species[J]. J Biol Chem,2004,279(42):43940-43951.
Research Progress of AMPK and Oxidative Stress and Its Relationship with Exercise
Changes in cellular energy metabolism can activate AMPK (AMP-activated protein kinase),and oxidative stress can also activate AMPK,which is involved in the regulation of antioxidant response. This paper reviews the latest research progress of the relationship between AMPK and oxidative stress and its relationship with exercise,so as to provide a theoretical basis for the study of the formation and prevention of chronic diseases and the mechanism of exercise-induced fatigue.
AMPK;oxidative stress;redox reaction;energy metabolism;exercise
1002-9826(2017)04-0125-06
10. 16470/j. csst. 201704018
G804.7
A
2016-12-30;
2017-02-22
国家自然科学基金项目(31471134);中央高校基本科研业务费资助北京体育大学自主课题(2016BS026);贵州省教育厅青年科技人才成长项目(黔教合KY字[2016]129)。
罗琳,女,副教授,研究生在读博士,研究方向为运动与骨骼肌代谢,Email:5925860@qq.com。
张缨,女,教授,博士,博士研究生导师,研究方向为运动与骨骼肌代谢,Tel:010-62989584,Email:zhyi9256@126.com。
1.北京体育大学 运动人体科学学院,北京100084;2.贵州师范大学 体育学院,贵州 贵阳550001。
1.Beijing Sport University, Beijing 100084,China;2.Guizhou Normal University,Guiyang 550001,China.
