NF-κB信号通路在小鼠阻塞性黄疸及运动与黑果枸杞多糖干预中的差异表达
2017-08-01罗赤苗陈嘉勤毛海峰周柏存
郭 音,罗赤苗,陈嘉勤,毛海峰,4,周柏存,郑 核
GUO Yin1,2,LUO Chi-miao3,CHEN Jia-qin1,MAO Hai-feng1,4,ZHOU Bai-cun1,ZHENG He3
NF-κB信号通路在小鼠阻塞性黄疸及运动与黑果枸杞多糖干预中的差异表达
郭 音1,2,罗赤苗3,陈嘉勤1,毛海峰1,4,周柏存1,郑 核3
GUO Yin1,2,LUO Chi-miao3,CHEN Jia-qin1,MAO Hai-feng1,4,ZHOU Bai-cun1,ZHENG He3
目的:探讨NF-κB信号通路在小鼠阻塞性黄疸致肝损伤的机理及阐述运动联合黑果枸杞多糖改善肝损伤的效果。方法:KM小鼠随机分为5组:假手术组、模型组、枸杞组、运动组、枸杞+运动组。应用HE染色、免疫组化法、Realtime-PCR技术对肝组织进行检测。结果:1)HE染色显示,假手术组肝细胞索排列整齐;模型组大鼠肝细胞纤维化,可见片状肝细胞变性、坏死,乃至肝细胞索结构紊乱;枸杞组、运动组可见肝细胞少量点、片状坏死,肝小叶结构改变,肝索排列欠整齐;枸杞+运动组无明显组织坏死,肝小叶结构基本正常,肝索排列较整齐。免疫组织化学染色结果显示,枸杞+运动组小鼠肝组织NF-KB P65、TNF-α阳性表达均显著低于模型组。Real-time PCR结果显示,与模型组比较,枸杞+运动组小鼠血清NF-kB、TNF-α、TGF-β、IL-6 mRNA表达降低。结论:运动联合黑果枸杞多糖能改善肝损伤小鼠的免疫功能,对阻塞性黄疸小鼠的肝细胞具有修复作用。
黑果枸杞多糖;有氧运动;阻塞性黄疸致肝损伤;NF-κB,TNF-α
阻塞性黄疸(obstructive jaundice,OJ)是由各种原因造成肝内外胆管阻塞,形成胆汁淤积的一种肝胆系统的疾病,并发感染率高,死亡率高达15%~20%[19]。黑果枸杞茄科枸杞属多年生灌木,是我国西北地区特有的一种珍贵野生植物。黑果枸杞多糖是从黑果枸杞中分离提取的糖类复合物,已有研究表明[1,10,12],黑果多糖有明显的肝细胞保护活性,且无毒副作用;可滋补肝肾,降低低密度胆固醇,增强机体免疫力,具有抗氧化活性及对线粒体有保护作用,同时具有调节血糖和血脂的功能[9,13,14]。中等强度的有氧运动[17]对慢性病有积极的预防和治疗作用,但有氧运动联合黑果枸杞多糖共同辅助治疗阻塞性黄疸,目前国内外鲜有报道。
本课题以阻塞性黄疸 KM小鼠为实验对象,通过黑果枸杞多糖及中等强度运动进行干预,观察肝组织NF-κB、TNF-α、IKK-α、IκB-α mRNA的表达,试阐述TNF-α介导的NF-κB信号通路及相关因子在不同干预下表达差异的可能机理,并为阻塞性黄疸免疫干预提供参考方案,为黑果枸杞资源的进一步开发利用提供理论基础和实验依据。
1 实验方法
1.1 动物模型制作
将50只KM小鼠随机分为5组:假手术组、模型组、枸杞组、运动组、枸杞+运动组,每组 10 只,均给予基础饲料和自由饮水。假手术组小鼠只在腹部剪开一个长约1~1.5 cm的切口,缝合作为空白对照组。
模型组、枸杞组、运动组、枸杞+运动组小鼠均构建黄疸模型,进行参考胆总管扎结[26],操作如下:镊子轻轻夹起备皮皮肤,用小剪刀纵向剪开一个长约1~1.5 cm的切口,露出肝脏右叶。距肝门1 cm处分离胆总管,用4-0不可吸收手术线将胆总管结扎,避开胰腺组织,再缝合手术伤口,术后常规喂养。
1.2 黑果枸杞多糖的提取与含量测定
黑果枸杞多糖的提取流程如下:将已清洁的黑果枸杞干果进行碾碎,粉末放入8倍体积的80%乙醇溶液中,70 ℃浸泡40 min,滤渣中加入一定量的蒸馏水,水浴1 h,过滤,滤液利用旋转蒸发仪进行干燥,剩下的浓缩液用无水乙醇醇沉,去除上清液,将沉淀再进行烘干处理后提取出较纯的黑果枸杞粗多糖。再利用蒽酮-硫酸法测定黑果枸杞多糖提取物中多糖的含量。
1.3 运动方案
采用中等强度跑台训练,坡度为 0%,速度10 m/min,每天固定时间训练30 min,每周6 d,共6周。正常供水和食物。运动组、枸杞 + 运动组于手术剪断胆总管固定线7天后再进行跑台训练。
1.4 给药方案
黑果枸杞多糖提取物加入一定比例的蒸馏水,按人与小鼠体表面积折算等效剂量经口灌胃。枸杞组和枸杞+运动组小鼠于手术后2天剪断胆总管固定线后固定时间灌胃黑果枸杞多糖,1次/天,剂量0.3 ml/ 次,共6周。其他组小鼠灌胃等量生理盐水。
1.5 样品采集与处理
6周后,取材前5组小鼠禁食,第2天早上用 0.03 ml/g的 10%水合氯醛麻醉处理,用已消毒的镊子以摘眼球的方法取血至5 ml 抗凝管中,4℃、4 500 rpm 离心 15 min,用移液枪套上TIP头吸取血清样品,并做好标签,用小号离心管分装并保存于-20℃的冰箱中。用手术剪剪开腹腔后立即分离出肝脏组织,并进行分解。取一定大小的肝组织放入事先准备好的trizol试剂中,用于肝组织mRNA的提取,部分置于10% 多聚甲醛溶液(0.1M,p H =7.4)固定12 h以上,用于HE染色观察病理形态及免疫组化染色分析,剩余的肝组织放入5 ml离心管中,在-70℃的超低温冰箱中保存备用。
1.6 病理学观察
HE染色操作步骤:取好肝脏组织,放入装有10%多聚甲醛的烧杯中固定,利用乙醇由低浓度往高浓度依次进行脱水;二甲苯透明使石蜡便能更好地渗入组织,用石蜡进行包埋处理,熔点为50~60℃。利用切片机切成3.0 mm厚的切片,捞片法贴片,HE染色,标本过二甲苯至透明后,滴加树胶进行封片,使切片能够永久保存。
1.7 免疫组织化学染色
采用链霉亲和素生物素复合物免疫组织化学染色法(SABC 法) 检测肝脏组织NF-kBP65、TNF-α表达,按照说明书的步骤操作。Olympus(Jarm日本)光学显微镜下(×200)观察肝脏组织形态学,拍照记录结果并保存,PBS替代一抗作阴性对照。
采用Simple PCI图像分析系统(C-imaging公司,美国)对免疫组化阳性产物的表达面积进行结果分析,10×20倍Olympus (Jarm日本)光学显微镜下,观察NF-kBP65、TNF-α阳性表达面积,并计算阳性反应面积/测量面积的数值,即阳性表达面积的百分比。
1.8 Real-time PCR程序
仪器:ABI 7900HT,试剂:SYBR® Premix Ex Taq™Ⅱ(Takara)试剂盒,总反应体系为25 μl。取1μl cDNA 模板,加入Go Taq@ Green Master Mix,2×12.5 μl、上游引物1μl、下游引物1μl、Naclease-Free water 9.5μl。上述操作均在冰浴上进行。PCR 反应程序为:94℃ 5 min,94℃ 30 s,引物退火温度30 s,72℃ 30 min,33个循环,72℃延伸5 min。
1.9 Realtime-PCR技术检测NF-kB、TNF-α、IKK-α、IκB-α mRNA表达
总 RNA 提取以及反转录,mRNA 的逆转录。PCR数据统计:将各样本值代入公式:表达量=2-ΔΔCt,其中ΔΔCt=[目的基因的Ct值(样本组)-管家基因的Ct值(样本组)-目的基因的Ct值(校正组)-管家基因的Ct值(校正组)]
1.10 血清学指标检测
利用生物化学分析法检测血清中TBIL、ALT和AST的浓度,试剂盒购于南京建成生物工程研究所。
1.11 统计学分析
2 实验结果
2.1 一般情况
在模型构建过程中,需要建模的小鼠均未出现手术或其他原因造成的死亡情况;阻塞性黄疸模型构建成功后,小鼠食欲较正常。随着梗阻时间的增加,小鼠活跃性减弱、嗜睡。手术 24 h 后,模型组小鼠尿液颜色变黄,约48 h 后毛发、皮肤、耳尖开始出现局部发黄,术后第2天剖腹检查时可见结扎近端胆总管囊性扩张加重,肝脏肿大呈淤胆性改变,血液生化显示胆红素水平超标,由此现象我们推断出造模成功,经过一段时间的干预后,枸杞组、运动组和枸杞+运动组小鼠症状均轻于模型组。
2.2 肝脏形态学观察
HE 染色结果(图1)显示,假手术组肝细胞索呈放射状排列;模型组小鼠肝细胞出现纤维化,纤维间隔增宽,排列紊乱,肝索断裂,核固缩,肝血窦有中性粒细胞的浸润等;枸杞组、运动组可见肝小叶结构不规则,肝索排列欠整齐,局部可见脂肪变性细胞,无明显坏死,肝小叶结构变化不大,肝纤维化均得到一定的改善,枸杞+运动组效果最为显著,肝小叶完整,无变形及坏死现象。
从表1可见,模型组小鼠血清TBIL 、ALT 和AST含量最高,枸杞组血清TBIL、ALT 和AST含量较模型组明显降低,差异有统计学意义(P<0.05)。枸杞+运动组血清TBIL、 ALT和AST含量较枸杞组明显降低,差异有统计学意义(P<0.05)。枸杞+运动组血清TBIL、ALT和AST含量与模型组比较有非常显著性差异(P<0.01)。
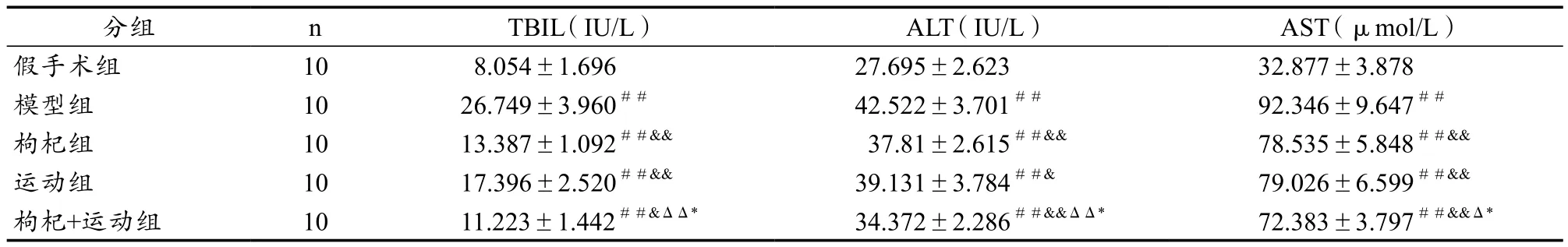
表1各组血清TBIL、ALT、AST含量的比较(n=10)Table 1 Changes in Serum Levels of TBIL,ALT and AST in Mice (n = 10).
2.3 各组小鼠肝脏NF-kB P65、TNF-α免疫组织化学染色结果
从图2可以看出:NF-kB P65、TNF-α表达多数在细胞质上,偶见于细胞核上,NF-kB P65、TNF-α(棕黄色阳性颗粒的散布程度)均依次为模型组、运动组、枸杞组、枸杞+运 动组、假手术组。
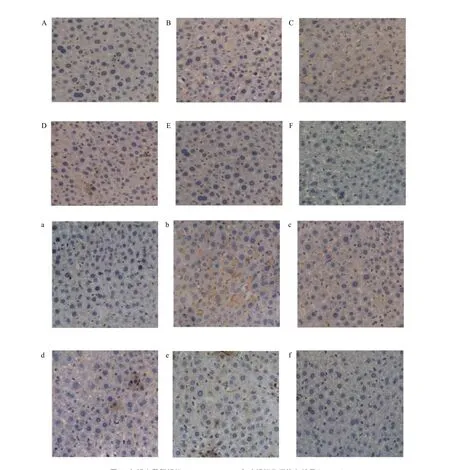
图2 各组小鼠肝组织NF-kB P65、TNF-α免疫组织化学染色结果 (200×)Figure 2. Immunohistochemistry,Paraffin Sections,DAB,200 ×
从表2可知,假手术组的小鼠中 TNF-α,IKK-α,NF-κB P65 mRNA几乎都有少量的表达,小鼠肝组织中NF-kB P65、TNF-α mRNA的含量相对比,模型组最高,运动组、枸杞组表达均水平明显下调,低于模型组(P<0.01);枸杞+运动组肝组织中NF-kB P65、TNF-α阳性表达与模型组对比有一定比例的下降,两组间有显著性差异(P<0.01)。
2.4 各组小鼠肝脏NF-kB 、TNF-α、IKK-α、IκB-α mRNA检测结果
从表3可见,模型组小鼠肝组织NF-κB、TNF-α、IKK-α、IκB-α mRNA的CT值最低,假手术组CT数值高于枸杞组、运动组,枸杞+运动组与模型组相比具有显著性差异(P<0.01);IκB-α 表达成相反趋势,枸杞+运动组与假手术组比较差异有统计学意义(P<0.01)。

表2 各组小鼠肝组织NF-kB P65、TNF-α 免疫组织化学阳性表达率Table 2 Positive Immunohistochemical Staining (n = 10).

表3 各组小鼠肝组织NF-kB 、TNF-α、IKK-α、IκB-α mRNA的Ct值Table 3 Mice Liver Tissue NF-kB,TNF-α,IL-6,TGF-β Ct Value
从表4可见,小鼠NF-KB 、TNF-α、IKK-α、IκB-α mRNA的相对表达倍数与CT值成反比。枸杞组、运动组、枸杞+ 运动组与假手术组小鼠肝组织NF-κB、TNF-α、IKK-α mRNA表达倍数作为对比,表达倍数高低依次为:枸杞+运动组、枸杞组、运动组。枸杞+运动组表达与假手术组的表达最接近,说明其治疗效果最好(P<0.01),;IκB-α 表达成相反趋势,因为IκB-α是NF-κB的抑制因子,它下调了NF-κB、TNF-α、IKK-α mRNA及蛋白的表达,上调IκB-α mRNA及蛋白的表达,可以减弱小鼠的炎症反应,减轻了阻塞性黄疸导致的肝功能损伤。
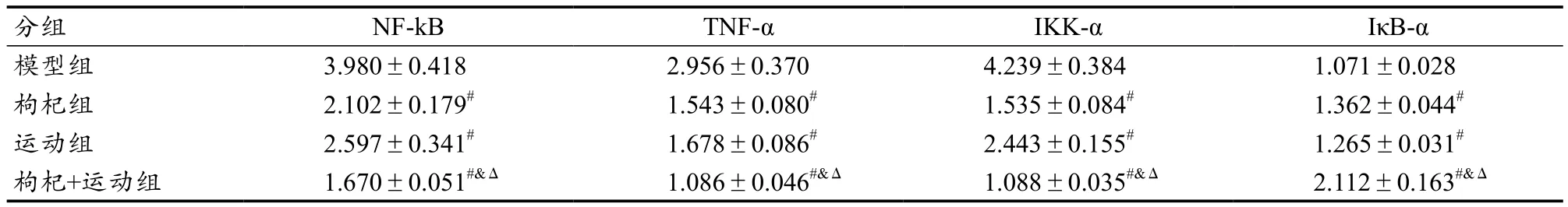
表4 各组小鼠肝组织NF-κB 、TNF-α、IKK-α、IκB-α与假手术组的相对表达倍数Table 4 Relative Expression in Liver Tissue Compared to Control Group
3 讨论
阻塞性黄疸主要由于肝外或肝内胆管部分性或完全性阻塞所致,皮肤呈暗黄色,血液检查可见胆红素浓度显著升高。因此,降低炎症反应及细胞因子的释放,提高机体免疫功能,抵抗其他并发症的发生,成为治疗阻塞性黄疸致肝损伤的关键。而建立合适的动物模型非常关键,在以往黄疸造模中,多以大鼠为主[3]。虽然在手术难度、成活率上,大鼠有一定优势,但是,大鼠没有胆囊,生理结构与人类的差异较大,且造模时间较长。经过文献查询,本实验室使用KM小鼠作为实验对象[15]。在预实验中,我们采用结扎胆总管的方式造模,模拟人类黄疸手术后的效果。解除胆管悬挂后1周,小鼠手术后成活率高达94%,且毛色、尿液等黄疸症状明显;动物活动性良好,不影响运动。随机抽取7只切开腹腔后发现胆囊膨胀,肝脏斑点状发黄,胆管畸形。所以判断造模成功,并将此模型用于本实验。
近年来的细胞因子与免疫功能关系的研究甚多。发生阻黄时肝脏中的细胞因子的过量表达,使炎症反应加深是肝继发性损伤的主要原因[20]。人体免疫系统非常复杂,其功能被各种炎症介质网络所调节,单一的抑制或促进一种炎症介质表达,对整个免疫系统的影响非常渺小。因此,若能在炎症反应调控的上游寻找相关的调控因子,并清楚各种因子之间的相互作用,就能对认识炎症机制有所帮助。
肿瘤坏死因子α(TNF-α)由活化的单核/巨噬细胞分泌产生,能够与TNF受体结合[23],激活TNF受体死亡蛋白(TRADD),后者与TNF受体偶联因子2 (TRAF2)结合,激活NF-κB诱导激酶(NIK)。
NF-κB是一种受调蛋白水解酶,其信号通路的组成包括受体和受体近端信号接头分子、NF-κB二聚体、NF-κB抑制剂IκB蛋白和IκB激酶(IKK)复合物[4,16]。 NF-κB的抑制蛋白IκB包括I-κBα、I-κBβ 、I-κBε等亚基,大部分 NF-κB蛋白激活有赖于IκB蛋白泛素化和磷酸化[25,27]。
IKK 复合体(IκB激酶)是NF-κB信号通路的主要调节物,有3种蛋白组成,即 IKKα、IKKβ、IKKγ。激活NF-κB通路的过程非常复杂,IKK 复合体经上游激活物与IKKγ相互作用而活化,通过抑制 IKK 激活来阻止IκB磷酸化,从而间接抑制NF-κB的激活。许多通路及细胞因子可导致NF-κB的激活[7,22],这些通路的进行几乎全部包括IKK的激活、IκB的降解以及NF-κB转录活性的增强。TNF-α就是一种NF-κB的刺激模式。
本实验中,运动组、枸杞组及枸杞+运动组NF-kB P65、TNF-α表达比模型组明显减弱,提示,6周有氧运动、黑果枸杞多糖灌胃、运动联合黑果枸杞多糖灌胃,下调了NF-κB、TNF-α、IKK-α mRNA及蛋白的表达,上调IκB-α mRNA及蛋白的表达,减少与其下游的信号分子结合,从而减弱了小鼠的炎症反应,减轻了其肝功能的损伤。与运动组和黑果枸杞组的结果相比,运动联合黑果枸杞多糖组治疗阻塞性黄疸的效果最佳,表明两者具有协调作用。研究表明,TNF-α介导的NF-kB 信号通路在肝损伤中起到关键性作用。
阻塞性黄疸患者容易发生各种并发症,如感染、肝肾功能衰竭、内毒素血症等,直接影响病人的治愈。近年来研究表明,阻塞性黄疸患者机体免疫功能受到抑制,导致病人手术期并发症和死亡率居高不下。
蔡文丽[2]研究发现,长期进行中低强度的有氧运动可增强小鼠的免疫能力,减轻肝细胞微损伤,促进肝功能的恢复。Rough-neen[24]取结扎胆总管大鼠的脾淋巴细胞发现,大鼠的T淋巴细胞功能受到抑制。CD 4/CD 8的比值是目前最有说服力的免疫力指征[8]。适当运动引起机体CD 4/CD 8比值上升,血清 Ig G、Ig A 和 Ig M 水平提高,从而增强机体的免疫力[18]。运动的效果与运动的形式、强度大小、时间长短有着密切的联系,机体免疫机能会随着运动持续的时间发生适应性改善。
随着现代天然药物和医学研究的发展,人们关注到免疫系统与生物体衰老、癌变、炎症以及自由基代谢失衡有着直接关联,会导致各种慢性疾病的发生。天然生物多糖是非细胞毒物质,广泛参与细胞的生命活动,产生多种生物学功能,是理想的免疫增强剂[5],越来越受到研究人员的重视。现已进入临床研究的有香菇多糖、人参多糖等。
黑果枸杞多糖[21]是从含多种营养成分的黑果枸杞中分离提取的多糖复合物,有明显的肝细胞保护活性,可滋补肝肾,增强免疫功能。李进[11]等对小鼠进行毒理学实验证明,黑果枸杞是无毒物质,最大耐受剂量及3项遗传毒性试验结果皆为阴性,未表现出致突变性,对受试动物的生长发育、肝肾等功能均无损害作用。这表明,黑果枸杞有较好的食用安全性,可药、食两用,有很好的开发利用前景。已有研究证实:黑果枸杞多糖具有抗疲劳作用[6],能促进糖尿病小鼠的血糖转变为肝糖元,对糖尿病也有防治作用。
本实验结果显示,枸杞组、枸杞+运动组血TBIL、ALT和AST均低于模型组,提示,黑果枸杞多糖用于阻塞性黄疸致肝损伤小鼠的辅助治疗方面作用明显。
4 展望
本实验结果提示,黑果枸杞多糖和中等强度有氧运动联用,对小鼠阻塞性黄疸致重症肝损伤有保护作用。作用机制可能与TNF-α介导的 NF-κB信号通路有关,小鼠的免疫能力和抗炎能力得以提高,阻塞性黄疸性肝损伤得以缓解。
[1] 陈海魁,蒲凌奎,曹君迈,等.黑果枸杞的研究现状及其开发利用[J].黑龙江农业科学,2008(5):155-157.
[2] 蔡文丽.有氧运动对酒精性脂肪肝损伤小鼠ALT,AST,IL-6,IL-10等的影响[J].沈阳体育学院学报,2013,32(3):89-92.
[3] 陈晓琴.黑果枸杞果实多糖的制备与抗疲劳、降血糖生物功效的研究[D].乌鲁木齐:新疆师范大学,2007.
[4] 邓韵婷,熊兴东,孙雪荣,等.NF-κB 信号通路与细胞衰老[J].生命的化学,2013,33(4):401-406.
[5] 冯薇,何恩鹏,陈晓琴,等.黑果枸杞果实多糖对小白鼠运动能力影响及量效研究[J].干旱区研究.2009,4(26):586-590.
[6] 李尔春,丁红军,金晓辉,等.天然植物多糖的结构及活性研究进展[J].食品与药品,2007,9(4):51-54.
[7] 刘杰,阚丹.IKK/IκB/NF-κB信号通路阻断及临床应用[J].实用医学杂志,2008,24(23):4147-4149.
[8] 刘莉,林建椂,成伟栋,等.T淋巴细胞及其亚群与运动免疫[J].中国临床康复,2003,7(18):26-34.
[9] 李淑珍,李进.黑果枸杞总黄酮降血脂作用[J].时珍国医国药,2012,23(5):1072-1074.
[10] 李林,王茂材,罗赤苗,等.大柴胡汤联合运动对阻塞性黄疸大鼠肝脏炎症细胞因子的影响[J].中国运动医学杂志,2011,30(9):836-844.
[11] 李进,原惠,曾献春,等.黑果枸杞色素的毒理学研究[J].食品科学,2007,28(7):470-475.
[12] 王超,蒋宝平,龙军,等.黑果枸杞对急性酒精性肝损伤的保护及其抗氧化作用的影响[J].中药新药与临床药理,2015,26(2):192-195.
[13] 汪建红,陈晓琴,张蔚佼,等.黑果枸杞果实多糖降血糖生物功效及其机制研究[J].食品科学,2014,35(22):162-166.
[14] 夏娜,赵丽凤.黑果枸杞功能性成分抗氧化活性及对线粒体的保护作用研究[J].食品工业科技,2014,30(5):162-166.
[15] 余水平,李坚,侯冰宗,等.急慢性大鼠梗阻性黄疸模型的建立[J].世界华人消化杂志,2011,19(12):1285-1289.
[16] 严明,陈万涛.NF-κB信号转导通路和肿瘤发生、转移关系的研究进展[J].北京口腔医学,2007,15(1):53-55.
[17] 周爱国.红景天对肝纤维化大鼠 TNF-α介导的 NF-κB 通路[D].西宁:青海大学,2011.
[18] 赵福临,刘奇才.有氧运动对人体细胞免疫功能影响的实验分析[J].闽江学院学报,2007,28(5):116-118.
[19] 赵艳平.阻塞性黄疸机体免疫功能的研究进展[J].江西医药,2009,44(11):147-149.
[20] BENJAMIN L.Toxicology and applied,Pharmacol[J].2015,283(3):168–177.
[21] CUI D,ZHONG S,M A J,et al.Short interfering RNA targetting NF-kappa B induces apoptosis of hepatic stellate cells and attenuates extracellular matrix production[J]. Dig Liver Dis,2010,42(11):813-817.
[22] HAYDEN M S,GHOSH S.Signaling to NF-kappaB.Genes Dev, 2004,18(7):2195-2224.
[23] LASZLO N,ROLAND A.Compromis of immune function in obsrtuctivejaundice[J].Eur J Surg,2002,168(6):315-328.
[24] ROUGHNEEN T P,KIDLARKE R,KUMART S C,et al.Impaired specific cell mediated immunity in experimental biliary obstruction[J].J Surg Res,1986,41(2):113-116.
[25] TRIPATHI P,AGGARWAL A.NF-k B transcription factor:a key player in the generation of immune response[J].Current Sci,2006,90(4):519-531.
[26] WARRDLE E N,WRIGHT N A. Edontoxin and acute renal failure associated with obstructive jaundice[J].BMJ,1970,4(2),472-477.
[27] VALLABHAPURAPU S,KARIN M.Regulation and its regulation and function of NF-kappaB transcription factors in the immune system[J].Ann Rev Immunol,2009,27(6):693-733.
The Differential Expression of NF-κB Signaling Pathways in Obstructive Jaundice-induced Liver Injury in Mice with Aerobic Exercise and Black Fruit Wolfberry Polysaccharide
Objective:To explore the mechanism of NF-κB signaling pathways in liver injury induced by obstructive jaundice in mice,and to discuss the effect of exercise combined with black fruit wolfberry polysaccharides on liver injury. Methods:KM mice were randomly divided into five groups:sham surgery group,model group,medlar group,aerobic exercise group,wolfberry-exercise group. The liver tissue was detected by HE staining,immunohistochemistry and Realtime-PCR. Results:HE staining:sham group hepatic cord neatly arranged cells;cells of rat liver fibrosis model group,visible patches of liver cell degeneration,necrosis,hepatic cord structure and even cell disorder;wolfberry group,aerobic exercise group showed hepatocytes a small amount of points,necrosis,lobular structural changes,hepatic cord neatly arranged owe;wolfberry + exercise group had no significant tissue necrosis,lobular structure normal hepatic cord arranged in neat. Immunohistochemical staining showed:Wolfberry + exercise group liver tissue NF-kB P65,expression of TNF-awere significantly lower than the model group. Real-time PCR results showed that:compared with the model group,Chinese wolfberry + exercise group serum NF-kB,TNF-a,TGF-b,IL-6 mRNA was decreased.Conclusion:Combined exercise with Lyciumbarbarum polysaccharide can improve the immune function of mice with liver injury,and repair the hepatocytes of obstructive jaundice mice.
black fruit wolfberry polysaccharide;aerobic exercise;obstructive jaundice induced liver injury;NF-κB;TNF-α
1002-9826(2017)04-0119-06
10. 16470/j. csst. 201704017
G804.5
A
2016-04-20;
2017-05-21
郭音,女,硕士研究生,研究方向为重大疾病的新药与运动干预。
陈嘉勤,女,教授,博士研究生导师,研究方向为运动医学,生物化学。
1.湖南师范大学 体育学院, 湖南 长沙,410012;2.湖南
中医药高等专科学校, 湖南 株洲,412012;3.邵阳市中心医院, 湖南 邵阳,420000;4.宜春学院, 江西 宜春,336000
1.Hunan Normal University,Changsha,410012 China;2.Hunan Traditional Chinese Medical College,Zhuzhou,412012,China;3. Shaoyang Central Hospital,Shaoyang 420000,China;4.Yichun University,Yichun336000,China.
