风轮菜酚酸类化学成分研究
2017-07-31王凌天孙忠浩钟明亮吴海峰张海晶
王凌天+孙忠浩+钟明亮+吴海峰+张海晶+朱乃亮,孙桂波+叶晓霞+许旭东+朱寅荻+杨峻山
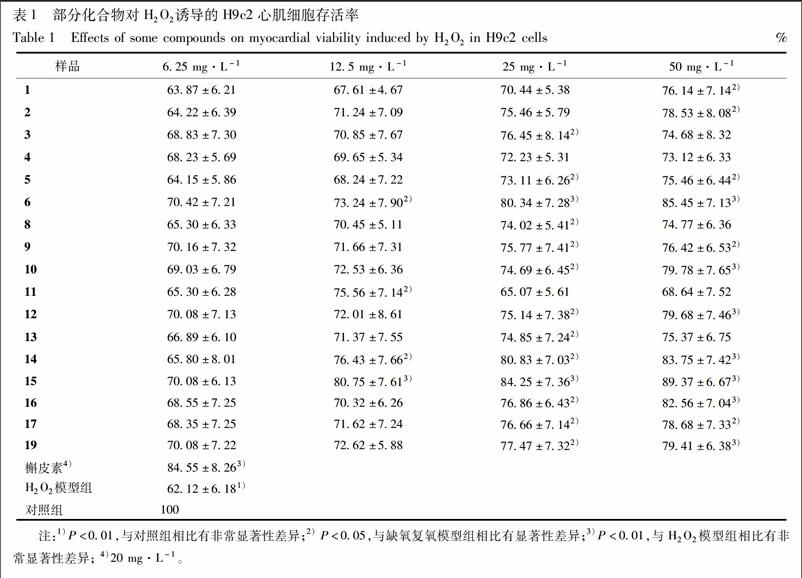
[摘要] 綜合运用硅胶Sephadex LH-20,ODS,MCI gel等柱色谱及制备高效液相色谱等方法,对风轮菜酚类部位进行化学成分分离纯化得到28个化合物。利用NMR和MS解析技术鉴定为芹菜素(1)、芹菜素-7-O-葡萄糖苷(2)、芹菜素-7-O-葡萄糖醛酸苷(3)、羊红膻酯(4)、芹菜素-7-O-芸香糖苷(5)、木犀草素(6)、木犀草素-4′-O-葡萄糖苷(7)、木犀草素-7-O-葡萄糖醛酸苷正丁醇酯(8)、木犀草素-7-O-芸香糖苷(9)、木犀草素-7-O-新橙皮糖苷(10)、金合欢素(11)、金合欢素-7-O-葡萄糖醛酸苷(12)、蒙花苷(13)、柚皮素(14)、江户樱花苷(15)、柚皮素-7-O-芸香糖苷(16)、异樱花素(17)、异樱花苷(18)、香蜂草苷(19)、橙皮苷(20)、山柰酚(21)、槲皮素(22)、山柰酚-3-O-α-L-鼠李糖苷(23)、对羟基桂皮酸(24)、咖啡酸(25)、cis-3-[2-[1-(3,4-dihydroxy-phenyl)- 1-hydroxymethyl]-1,3-ben-zodioxol-5-yl]-(E)-2-propenoic acid (26)、mesaconic acid (27)、gentisic acid 5-O-β-D-(6′-salicylyl)-glucopyranoside (28),其中化合物7, 9~10, 12, 23, 26~28首次从风轮菜属植物中分离得到。采用H2O2氧化心肌细胞损伤为模型,对化合物1~6, 8~17和19进行心肌保护活性筛选,江户樱花苷(15)显示出显著的心肌保护作用;与模型组的细胞存活率(62.12±6.18)%,阳性对照(槲皮素)在20.0 mg·L-1下的细胞存活率为(84.55±8.26)%,江户樱花苷在25.0 mg·L-1下的细胞存活率为(84.25±7.36)%。
[关键词] 唇形科;风轮菜属;风轮菜;黄酮;心肌保护
[Abstract] Twenty-eight compounds were isolated and purified from Clinopodium chinense by Sephedax LH-20, ODS, MCI and preparative HPLC. Their structures were identified as apigenin (1), apigenin-7-O-β-D-glucopyranoside (2), apigenin-7-O-β-D-glucuronopyranoside (3), thellungianol (4), apigenin-7-O-β-D-rutinoside (5), luteolin (6), luteolin-4′-O-β-D-glucopyranoside (7), apigenin-7-O-β-D-pyranglycuronate butyl ester (8), luteolin-7-O-β-D-rutinoside (9), luteolin-7-O-β-D-noehesperidoside (10), acacetin (11), acacetin-7-O-β-D-glucuronopyranoside (12), buddleoside (13), naringenin (14), pruning (15), nairutin (16), isosakuranetin (17), isosakuranin (18), didymin (19), hesperidin (20), kaempferol (21), quercetin (22), kaempferol-3-O-α-L-rahmnoside (23), p-hydroxycinnamic acid (24), caffeic acid (25), cis-3-[2-[1-(3,4-dihydroxy-phenyl)-1 -hydroxymethyl]-1,3-ben-zodioxol-5-yl]-(E)-2-propenoic acid (26), mesaconic acid (27), gentisic acid 5-O-β-D-(6′-salicylyl)-glucopyranoside (28). Among them, compounds 7, 9-10, 12, 23, 26-28 were isolated from the Clinopodium for the first time. The protective effects of compounds 1-6, 8-17 and 19 against H2O2-induced H9c2 cardiomyocyte injury were tested, compounds 15 exhibited significantly protective effects. Compared with the cell viability of (62.12±6.18)% in the model, pruning exhibited viabilities of (84.25±7.36)% at 25.0 mg·L-1, respectively, using quercetin as a positive control [cell viability of (84.55±8.26)%, 20 mg·L-1].
[Key words] Lamiaceae;Clinopodium;Clinopodium chinense;favonoid;myocardial protection
风轮菜Clinopodium chinense(Benth.) O. Kuntze为唇形科风轮菜属植物。风轮菜属植物约20种,我国产12种,5变种,2变型,主要分布于浙江、江苏、安徽、江西、福建等地。首载于《救荒本草》(1406年)草部,在我国有悠久的民间药用历史。现已被2015年版《中国药典》收载为断血流药用,具有收敛止血的功效,用于治疗崩漏、尿血、鼻衄,牙龈出血,创伤出血[1]。风轮菜的止血作用对治疗和预防心血管疾病方面具有独特的优势,有着良好的研究開发前景。本研究希望通过对风轮菜的化学成分研究,从中获得结构多样的天然产物,筛选心肌保护活性显著成分,为进一步深入研究风轮菜化学成分及其药理活性奠定基础。
1 材料
Bruker Avance Ⅲ 600 型核磁共振仪核磁共振仪(德国Bruker 公司);LTQ-Obitrap XL质谱仪(美国ThermoFisher 公司);LC3000高效液相色谱仪(北京创新通恒科技有限公司);YMC Pack ODS-A半制备色谱柱(10 mm×250 mm,5 μm,日本YMC公司);Sephadex LH-20凝胶为Pharmacia公司产品;柱色谱和薄层色谱硅胶GF254(青岛海洋化工厂);显色剂为10%硫酸乙醇溶液;常规所用试剂均为分析纯(北京化工厂)。
风轮菜药材于2013年购自安徽,经北京协和医学院药用植物研究所广西分所袁经权教授鉴定为唇形科风轮菜属植物C. chinense。样品标本现存于中国医学科学院药用植物研究所中草药物质基础与资源利用教育部重点实验室,编号201303012。
2 提取与分离
风轮菜地上部分15 kg粉碎后,以70%乙醇回流提取2次,回收乙醇得浸膏约1.8 kg。以6 000 mL水溶解此浸膏后,依次用6 000 mL石油醚萃取3次,每次2 000 mL,减压回收溶剂,得石油醚萃取物(FS,100 g);用18 000 mL乙酸乙酯萃取3次,每次6 000 mL,减压回收溶剂,得乙酸乙酯萃取物(FY,700 g),乙酸乙酯部分(FY,500 g)经硅胶柱色谱以氯仿-甲醇(100∶0~50∶50)进行梯度洗脱,分为FY-a~g 7个部分。FYa经过ODS柱,以甲醇-水(30∶70~75∶25)梯度洗脱,得到3个流分FYa-1~FYa-3。FYa-1~FYa-3经过MCI柱以甲醇-水(30∶70~75∶25)梯度洗脱,得到9个组分(FYa-1.1~ FYa-1.3,FYa-2.1~ FYa-2.3和FYa-3.1~ FYa-3.3);FYa-1.1经甲醇重结晶得到化合物27(15 mg),FYa-1.3经甲醇重结晶得到化合物1(64 mg),FYa-2.1经甲醇重结晶得到化合物25(10 mg),FYa-2.2经甲醇重结晶得到化合物24(30 mg);FYa-2.2经过高效制备液相色谱,以甲醇-水(55∶45)等度洗脱,得到化合物6(10 mg),21(5 mg) 和22(7 mg),FYa-3.2经过高效制备液相色谱,以甲醇-水(60∶40)等度洗脱,得到化合物11(6 mg)和14(8 mg),FYa-3.3经过高效制备液相色谱,以甲醇-水(65∶35)等度洗脱,得到化合物17(9 mg)和22(7 mg)。FYb甲醇重结晶得到化合物4(15g),剩余滤液经过ODS柱,以甲醇-水(30∶70~75∶25)梯度洗脱,得到3个流分FYb-1~ FYb-3。FYb-2分别经过Sephadex LH-20(甲醇)、高效制备液相色谱(甲醇-水50∶50)得到化合物28(11 mg)。FYc经甲醇重结晶得到化合物8(3 g),剩余滤液经过ODS柱,以甲醇-水(30∶70~75∶25)梯度洗脱,得到3个流分FYc-1~FYc-3。FYc-1~FYc-3分别经过Sephadex LH-20(甲醇)、高效制备液相色谱(甲醇-水45∶55),得到化合物2(10 mg),5(4 mg),18(2 mg)。FYd经甲醇重结晶得到化合物19(20 g),剩余滤液经过ODS柱,以甲醇-水(30∶70~75∶25)梯度洗脱,得到3个流分FYd-1~FYd-3。FYd-1~FYd-3分别经过Sephadex LH-20,以甲醇洗脱,得到9个组分(FYd-1.1~FYd-1.3,FYd-2.1~FYd-2.3和FYd-3.1~FYd-3.3);FYd-1.2经过高效制备液相色谱,以甲醇-水(35∶65)等度洗脱,得到化合物3(16 mg)和12(13 mg),FYd-2.2经过高效制备液相色谱,以甲醇-水(40∶60)等度洗脱,得到化合物7(3 mg)和15(13 mg),FYd-3.2经过高效制备液相色谱,以甲醇-水(40∶60)等度洗脱,得到化合物23(3 mg)。FYe经甲醇重结晶得到化合物13(6 g),剩余滤液经过ODS柱,以甲醇-水(30∶70~75∶25)梯度洗脱,得到3个流分FYe-1~FYe-3,FYe-1~FYe-3分别经过Sephadex LH-20(甲醇)、高效制备液相色谱(甲醇-水35∶65),得到化合物9(16 mg),10(8 mg),16(9 mg),20(4 mg)。
3 结构鉴定
化合物1 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.96(1H,s,5-OH),7.93(2H,d,J=8.4 Hz,H-2′,6′),6.92(2H,d,J=8.4 Hz,H-3′,5′),6.78(1H,s,H-3),6.48(1H,d,J=1.8 Hz,H-8),6.19(1H,d,J=1.8 Hz,H-6)。以上波谱数据与文献[2]对比,确定化合物为芹菜素。
化合物2 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.97(1H,s,5-OH),7.96(2H,d,J=8.4 Hz,H-2′,6′),6.94(2H,d,J=8.4 Hz,H-3′,5′),6.87(1H,s,H-3),6.83(1H,d,J=2.4 Hz,H-8),6.44(1H,d,J=2.4 Hz,H-6),5.07(1H,d,J=7.2 Hz,H-1″)。13C-NMR(DMSO-d6,150 MHz) δ:164.3(C-2),103.1(C-3),182.0(C-4),161.4(C-5),99.5(C-6),162.9(C-7),94.8(C-8),156.9(C-9),105.3(C-10),121.0(C-1′),128.6(C-2′),116.0(C-3′),161.1(C-4′),116.0(C-5′),128.6(C-6′),99.9(C-1″),73.1(C-2″),77.2(C-3″),69.5(C-4″),76.4(C-5″),60.6(C-6″)。以上波谱数据与文献[3]对比,确定化合物为芹菜素-7-O-葡萄糖苷。
化合物3 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.96(1H,s,5-OH),7.92(2H,d,J=8.4 Hz,H-2′,6′),6.92(2H,d,J=8.4 Hz,H-3′,5′),6.82(1H,br s,H-8),6.82(1H,s,H-3),6.43(1H,d,J=1.8 Hz,H-6),5.16(1H,d,J=7.2 Hz,H-1″)。13C-NMR(DMSO-d6,150 MHz) δ:164.3(C-2),103.0(C-3),181.9(C-4),161.5(C-5),99.4(C-6),162.7(C-7),94.6(C-8),156.9(C-9),105.3(C-10),120.8(C-1′),128.5(C-2′),116.0(C-3′),161.1(C-4′),116.0(C-5′),128.5(C-6′),99.5(C-1″),72.8(C-2″),74.6(C-3″),71.6(C-4″),76.0(C-5″),171.0(C-6″)。以上波谱数据与文献[4]对比,确定化合物为芹菜素-7-O-葡萄糖醛酸苷。
化合物4 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.96(1H,s,5-OH),7.95(2H,d,J=7.2 Hz,H-2′,6′),6.94(2H,d,J=7.2 Hz,H-3′,5′),6.87(1H,s,H-3),6.85(1H,d,J=1.8 Hz,H-8),6.46(1H,d,J=1.8 Hz,H-6),5.30(1H,d,J=7.2 Hz,H-1″),4.18(2H,t,J=7.2 Hz,H-1),1.55(2H,m,H-2),1.32(2H,m,H-3),0.83(3H,t,J=7.2 Hz,H-4)。13C-NMR(DMSO-d6,150 MHz) δ:164.3(C-2),103.1(C-3),182.0(C-4),161.4(C-5),99.2(C-6),162.4(C-7),94.7(C-8),156.9(C-9),105.5(C-10),121.0(C-1′),128.6(C-2′),116.0(C-3′),161.1(C-4′),116.0(C-5′),128.6(C-6′),99.4(C-1″),72.7(C-2″),75.2(C-3″),71.1(C-4″),75.5(C-5″),168.6(C-6″),59.7(OMe),64.3(C-1),30.0(C-2),18.4(C-3),13.4(C-4)。以上波譜数据与文献[5]对比,确定化合物为芹菜素-7-O-葡萄糖醛酸苷丁酯。
化合物5 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.96(1H,s,5-OH),7.94(2H,d,J=8.4 Hz,H-2′,6′),6.94(2H,d,J=8.4 Hz,H-3′,5′),6.87(1H,s,H-3),6.80(1H,s,H-8),6.38(1H,s,H-6),5.25(1H,d,J=7.2 Hz,H-1″),4.66(1H,s,H-1),1.18(3H,d,J=6.0 Hz,H-6)。13C-NMR(DMSO-d6,150 MHz) δ:165.5(C-2),104.4(C-3),183.2(C-4),162.6(C-5),101.5(C-6),163.7(C-7),95.7(C-8),159.1(C-9),106.7(C-10),122.1(C-1′),129.6(C-2′),117.1(C-3′),162.1(C-4′),117.1(C-5′),129.6(C-6′),99.1(C-1″),77.4(C-2″),78.2(C-3″),70.9(C-4″),78.5(C-5″),67.1(C-6″),100.6(C-1),71.5(C-2),71.7(C-3),73.1(C-4),69.6(C-5),19.2(C-6)。以上波谱数据与文献[6]对比,确定化合物为芹菜素-7-O-芸香糖苷。
化合物6 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:7.41(1H,d,J=8.4,2.4 Hz,H-6′),7.39(1H,d,J=2.4 Hz,H-2′),6.89(1H,d,J=8.4 Hz,H-5′),6.67(1H,s,H-3),6.44(1H,d,J=2.4 Hz,H-8),6.18(1H,d,J=2.4 Hz,H-6)。以上波谱数据与文献[7]对比,确定化合物为木犀草素。
化合物7 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:7.49(1H,br d,J=8.4 Hz,H-6′),7.48(1H,br s,H-2′),7.23(1H,d,J=8.4 Hz,H-5′),6.79(1H,s,H-3),6.44(1H,s,H-8),6.15(1H,s,H-6),4.88(1H,d,J=7.2 Hz,H-1″)。13C-NMR(MeOD,150 MHz) δ:162.8(C-2),102.1(C-3),182.3(C-4),160.2(C-5),98.4(C-6),160.8(C-7),93.9(C-8),156.8(C-9),103.3(C-10),121.6(C-1′),114.6(C-2′),145.5(C-3′),147.2(C-4′),116.4(C-5′),117.0(C-6′),100.8(C-1″),72.8(C-2″),76.5(C-3″),70.4(C-4″),75.2(C-5″),60.6(C-6″)。以上波谱数据与文献[8]对比,确定化合物为木犀草素-4′-O-葡萄糖苷。
化合物8 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.99(1H,s,5-OH),7.95(1H,d,J=2.4 Hz,H-2′),7.44(1H,dd,J=8.4,2.4 Hz,H-6′),7.42(1H,d,J=8.4 Hz,H-5′),6.81(1H,d,J=2.4 Hz,H-8),6.75(1H,s,H-3),6.46(1H,d,J=2.4 Hz,H-6),5.30(1H,d,J=7.2 Hz,H-1″),4.10(2H,t,J=7.2 Hz,H-1),1.55(2H,m,H-2),1.31(2H,m,H-3),0.82(3H,t,J=7.2 Hz,H-4)。13C-NMR(DMSO-d6,150 MHz) δ:164.5(C-2),103.1(C-3),181.9(C-4),161.2(C-5),99.4(C-6),162.4(C-7),94.6(C-8),156.9(C-9),105.5(C-10),119.1(C-1′),113.6(C-2′),145.8(C-3′),149.9(C-4′),116.4(C-5′),121.4(C-6′),99.3(C-1″),72.8(C-2″),75.2(C-3″),71.2(C-4″),75.5(C-5″),168.7(C-6″),64.4(C-1),30.0(C-2),18.4(C-3),13.4(C-4)。以上波譜数据与文献[9] 对比,确定化合物为木犀草素-7-O-葡萄糖醛酸苷正丁醇酯。
化合物9 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.96(1H,s,5-OH),7.40(2H,m,H-2′,6′),6.91(1H,d,J=8.4 Hz,H-5′),6.72(1H,s,H-3),6.72(1H,d,J=1.8 Hz,H-8),6.46(1H,d,J=1.8 Hz,H-6)。5.08(1H,d,J=7.2 Hz,H-1″),4.56(1H,s,H-1),1.09(3H,d,J=6.0 Hz,H-6)。13C-NMR(DMSO-d6,150 MHz) δ:164.7(C-2),103.2(C-3),182.1(C-4),161.3(C-5),100.8(C-6),162.9(C-7),95.1(C-8),157.2(C-9),105.6(C-10),121.4(C-1′),119.3(C-2′),146.2(C-3′),150.9(C-4′),116.5(C-5′),120.2(C-6′),99.9(C-1″),73.1(C-2″),76.0(C-3″),70.5(C-4″),75.2(C-5″),66.6(C-6″),99.6(C-1),70.5(C-2),70.2(C-3),72.2(C-4),68.3(C-5),18.1(C-6)。以上波谱数据与文献[10]对比,确定化合物为木犀草素-7-O-芸香糖苷。
化合物10 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.95(1H,s,5-OH),7.44(2H,m,H-2′,6′),6.91(1H,d,J=8.4 Hz,H-5′),6.79(1H,s,H-3),6.74(1H,d,J=1.8 Hz,H-8),6.39(1H,d,J=1.8 Hz,H-6)。5.22(1H,d,J=7.8 Hz,H-1″),5.16(1H,s,H-1),1.15(3H,d,J=6.6 Hz,H-6)。13C-NMR(DMSO-d6,150 MHz) δ:164.5(C-2),103.2(C-3),182.0(C-4),162.6(C-5),99.5(C-6),161.5(C-7),94.5(C-8),157.4(C-9),105.8(C-10),121.6(C-1′),114.1(C-2′),145.8(C-3′),149.9(C-4′),116.4(C-5′),119.5(C-6′),98.1(C-1″),77.3(C-2″),76.4(C-3″),70.4(C-4″)、77.2(C-5″),60.6(C-6″),100.7(C-1),70.5(C-2),69.6(C-3),70.2(C-4),68.2(C-5),18.1(C-6)。以上波谱数据与文献[11]对比,确定化合物为木犀草素-7-O-新橙皮糖苷。
化合物11 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.91(1H,s,5-OH),8.03(2H,d,J=8.4 Hz,H-2′,6′),7.11(2H,d,J=8.4 Hz,H-3′,5′),6.84(1H,s,H-3),6.51(1H,d,J=2.4 Hz,H-8),6.21(1H,d,J=2.4 Hz,H-6),3.86(3H,s,OMe)。以上波谱数据与文献[12]对比,确定化合物为金合欢素。
化合物12 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.97(1H,s,5-OH),7.95(2H,d,J=8.4 Hz,H-2′,6′),6.94(2H,d,J=8.4 Hz,H-3′,5′),6.86(1H,s,H-3),6.86(1H,J=1.8 Hz,H-6),6.47(1H,d,J=1.8 Hz,H-6),5.31(1H,d,J=7.2 Hz,H-1″),3.67(3H,s,OMe)。13C-NMR(DMSO-d6,150 MHz) δ:164.3(C-2),103.1(C-3),182.0(C-4),161.4(C-5),99.1(C-6),162.4(C-7),94.6(C-8),157.0(C-9),105.5(C-10),121.0(C-1′),128.6(C-2′),116.0(C-3′),161.2(C-4′),116.0(C-5′),128.6(C-6′),52.0(OMe),99.3(C-1″),72.7(C-2″),75.2(C-3″),71.3(C-4″),75.4(C-5″),169.2(C-6″)。以上波谱数据与文献[13]对比,确定化合物为金合欢素-7-O-葡萄糖醛酸苷。
化合物13 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.91(1H,s,5-OH),8.06(2H,d,J=9.0 Hz,H-2′,6′),7.15(1H,d,J=9.0 Hz,H-3′,5′),6.95(1H,s,H-3),6.79(1H,d,J=1.8 Hz,H-8),6.45(1H,d,J=1.8 Hz,H-6),5.06(1H,d,J=7.2 Hz,H-1″),4.55(1H,br s,H-1),3.86(3H,s,OMe),1.08(3H,d,J=6.0 Hz,H-6)。13C-NMR(DMSO-d6,150 MHz) δ:156.7(C-2),103.5(C-3),181.7(C-4),162.7(C-5),99.4(C-6),163.7(C-7),94.5(C-8),162.1(C-9),105.2(C-10),122.4(C-1′),128.2(C-2′),114.4(C-3′),160.8(C-4′),114.4(C-5′),128.2(C-6′),55.3(OMe),99.6(C-1″),72.8(C-2″),75.9(C-3″),69.3(C-4″),75.4(C-5″),65.8(C-6″),100.2(C-1),70.0(C-2),70.4(C-3),71.8(C-4),68.0(C-5),17.5(C-6)。以上波谱数据与文献[14]对比,确定化合物为蒙花苷。
化合物14 白色针状结晶,1H-NMR(DMSO-d6,600 MHz) δ:12.15(1H,s,5-OH),7.31(2H,d,J=8.4 Hz,H-2′,6′),6.79(2H,d,J=8.4 Hz,H-3′,5′),5.88(2H,br s,H-8,H-6),5.43(1H,dd,J=13.2,3.0 Hz,H-2),3.26(1H,dd,J=16.8,13.2 Hz,H-3a),2.68(1H,dd,J=16.8,3.0 Hz,H-3e)。以上波谱数据与文献[15]对比,确定化合物为柚皮素。
化合物15 淡黄色粉末1H-NMR(DMSO-d6,600 MHz) δ:12.11(1H,s,5-OH),7.36(2H,d,J=8.4 Hz,H-2′,6′),6.82(2H,d,J=8.4 Hz,H-3′,5′),6.15(2H,br s,H-6,8),5.51(1H,dd,J=12.6,2.4 Hz,H-2),4.98(1H,d,J=7.2 Hz,H-1″),3.17(1H,dd,J=16.8,12.6 Hz,H-3b),2.77(1H,dd,J=16.8,2.4 Hz,H-3a)。13C-NMR(DMSO-d6,150 MHz) δ:77.2(C-2),42.1(C-3),196.9(C-4),165.1(C-5),95.5(C-6),165.5(C-7),96.7(C-8),162.6(C-9),103.2(C-10),128.7(C-1′),128.5(C-2′),115.2(C-3′),158.1(C-4′),115.2(C-5′),128.5(C-6′),103.2(C-1″),73.2(C-2″),77.1(C-3″),69.7(C-4″),78.6(C-5″),60.6(C-6″)。以上波譜数据与文献[16]对比,确定化合物为江户樱花苷。
化合物16 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:7.34(2H,d,J=7.8 Hz,H-2′,6′),6.80(2H,d,J=7.8 Hz,H-3′,5′),6.14(1H,d,J=1.8 Hz,H-8),6.11(1H,d,J=1.8 Hz,H-6),5.40(1H,dd,J=13.2,3.0 Hz,H-2),3.15(1H,dd,J=16.8,12.6 Hz,H-3a),2.75(1H,dd,J=16.2,3.0 Hz,H-3e),4.99(1H,t,J=7.8 Hz,H-1″),4.52(1H,s,H-1),1.08(3H,d,J=6.0 Hz,H-6)。13C-NMR(DMSO-d6,150 MHz) δ:78.6(C-2),42.2(C-3),197.1(C-4),163.0(C-5),99.4(C-6),165.1(C-7),96.4(C-8),162.6(C-9),103.2(C-10),128.6(C-1′),128.4(C-2′),115.2(C-3′),157.7(C-4′),115.2(C-5′),128.4(C-6′),96.3(C-1″),72.9(C-2″),76.2(C-3″),69.6(C-4″),75.1(C-5″),66.0(C-6″),100.5(C-1),70.2(C-2),70.7(C-3),72.1(C-4),69.9(C-5),18.1(C-6)。以上波谱数据与文献[17]对比,确定化合物为柚皮素-7-O-芸香糖苷。
化合物17 白色针晶,1H-NMR(DMSO-d6,600 MHz) δ:12.15(1H,s,5-OH),7.53(2H,d,J=8.4 Hz,H-2′,6′),7.03(2H,d,J=8.4 Hz,H-3′,5′),5.94(1H,d,J=1.8 Hz,H-8),5.92(1H,d,J=1.8 Hz,H-6),5.56(1H,dd,J=13.2,3.0 Hz,H-2),3.32(1H,dd,J=16.8,13.2 Hz,H-3a),2.78(1H,dd,J=16.8,3.0 Hz,H-3e),3.82(3H,s,OMe)。以上波谱数据与文献[18]对比,确定化合物为异樱花素。
化合物18 白色粒状晶体,1H-NMR(DMSO-d6,600 MHz) δ:12.05(1H,s,5-OH),7.34(2H,d,J=8.4 Hz,H-2′,6′),6.80(2H,d,J=8.4 Hz,H-3′,5′),6.20(1H,d,J=2.4 Hz,H-8),6.16(1H,d,J=2.4 Hz,H-6),5.52(1H,dd,J=13.2,3.0 Hz,H-2),4.90(1H,d,J=7.8 Hz,H-1),3.36(1H,dd,J=16.8,13.2 Hz,H-3a),2.73(1H,dd,J=16.8,3.0 Hz,H-3e),3.65(3H,s,OMe)。13C-NMR(DMSO-d6,150 MHz) δ:77.3(C-2),41.0(C-3),196.0(C-4),161.8(C-5),95.4(C-6),164.2(C-7),94.4(C-8),161.7(C-9),102.1(C-10),129.2(C-1′),127.3(C-2′),113.1(C-3′),159.1(C-4′),113.1(C-5′),127.3(C-6′),98.6(C-1″),73.1(C-2″),76.2(C-3″),69.4(C-4″),76.8(C-5″),60.4(C-6″)。以上波谱数据与文献[19]对比,确定化合物为异樱花苷。
化合物19 白色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.01(1H,s,5-OH),7.46(2H,d,J=9.0 Hz,H-2′,6′),6.98(2H,d,J=9.0 Hz,H-3′,5′),6.14(1H,d,J=1.8 Hz,H-8),6.13(1H,d,J=1.8 Hz,H-6),5.57(1H,dd,J=12.6,2.4 Hz,H-2),3.10(1H,dd,J=17.4,12.6 Hz,H-3b),2.78(1H,dd,J=17.4,2.4 Hz,H-3a),3.77(3H,s,OMe),4.98(1H,t,J=7.8 Hz,H-1″),4.52(1H,br s,H-1),1.09(3H,m,rha-Me)。13C-NMR(DMSO-d6,150 MHz) δ:78.3(C-2),41.8(C-3),197.0(C-4),163.0(C-5),96.4(C-6) 165.1(C-7),95.4(C-8),162.5(C-9),103.3(C-10),130.4(C-1′),128.3(C-2′),113.9(C-3′),159.4(C-4′),113.9(C-5′),128.3(C-6′),55.2(OMe),100.6(C-1″),72.9(C-2″),75.5(C-3″),70.7(C-4″),76.2(C-5″),66.0(C-6″),99.3(C-1),69.6(C-2),70.2(C-3),72.0(C-4),68.3(C-5),17.8(C-6)。以上波譜数据与文献[20]对比,确定化合物为香蜂草苷。
化合物20 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.03(1H,s,5-OH),6.93(3H,m,H-2′,5′,6′),6.14(1H,d,J=2.4 Hz,H-8),6.12(1H,d,J=2.4 Hz,H-6),5.50(1H,dd,J=12.6,3.0 Hz,H-2),4.97(1H,d,J=7.8 Hz,H-1″),4.53(1H,br s,H-1),3.32(1H,dd,J=16.8,12.6 Hz,H-3b),2.78(1H,dd,J=16.8,3.0 Hz,H-3a),3.77(3H,s,OMe)。13C-NMR(DMSO-d6,150 MHz) δ:78.4(C-2),42.3(C-3),197.0(C-4),163.0(C-5),99.4(C-6),165.4(C-7),95.6(C-8),162.5(C-9),103.3(C-10),131.0(C-1′),114.1(C-2′),148.0(C-3′),146.5(C-4′),112.1(C-5′),117.9(C-6′),55.7(OMe),96.4(C-1″),73.0(C-2″),75.5(C-3″),70.7(C-4″),76.3(C-5″),66.1(C-6″),100.6(C-1),69.6(C-2),70.3(C-3),72.1(C-4),68.3(C-5),17.8(C-6)。以上波谱数据与文献[21]对比,确定化合物为橙皮苷。
化合物21 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.48(1H,s,5-OH),8.04(2H,d,J=8.4 Hz,H-2′,6′),6.92(2H,d,J=8.4 Hz,H-3′,5′),6.43(1H,d,J=1.8 Hz,H-8),6.18(1H,d,J=1.8 Hz,H-6)。以上波谱数据与文献[22]对比,确定化合物为山柰酚。
化合物22 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:12.49(1H,s,5-OH),6.18(1H,d,J=2.4 Hz,H-6),6.40(1H,d,J=2.4 Hz,H-8),7.67(1H,d,J=2.4 Hz,H-2′),6.88(1H,d,J=8.4 Hz,H-5′),7.53(1H,dd,J=8.4,2.4 Hz,H-6′)。该化合物碳氢谱数据与文献[23]对比,确定化合物为槲皮素。
化合物23 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ:7.76(2H,d,J=9.0 Hz,H-2′,6′),6.93(2H,d,J=9.0 Hz,H-3′,5′),6.38(1H,d,J=2.4 Hz,H-8),6.21(1H,d,J=2.4 Hz,H-6),5.21(1H,d,J=1.8 Hz,H-1″),0.99(3H,d,J=6.0 Hz,H-6″)。13C-NMR(DMSO-d6,150 MHz) δ:158.1(C-2),134.4(C-3),178.7(C-4),160.8(C-5),99.7(C-6) 161.8(C-7),94.8(C-8),159.4(C-9),109.5(C-10),122.8(C-1′),130.9(C-2′),116.4(C-3′),159.2(C-4′),116.4(C-5′),130.9(C-6′),99.7(C-1″),70.2(C-2″),70.3(C-3″),71.4(C-4″),70.1(C-5″),18.1(C-6″)。以上波谱数据与文献[24]对比,确定化合物为山柰酚-3-O-α-L-鼠李糖苷。
化合物24 白色针晶,1H-NMR(DMSO-d6,600 MHz) δ:7.51(1H,d,J=8.4 Hz,H-2,6),7.49(1H,d,J=16.2 Hz,H-7),6.79(1H,d,J=8.4 Hz,H-3,5),6.28(1H,d,J=16.2 Hz,H-8)。以上波谱数据与文献[25]对比,确定化合物为对羟基桂皮酸。
化合物25 白色针晶,1H-NMR(DMSO-d6,600 MHz) δ:7.41(1H,d,J=15.6 Hz,H-7),7.02(1H,d,J=1.8 Hz,H-2),6.96(1H,dd,J=8.4,1.8 Hz,H-6),6.75(H,d,J=8.4 Hz,H-5),6.16(1H,d,J=15.6 Hz,H-8)。以上波谱数据与文献[26]对比,确定化合物为咖啡酸。
化合物26 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ: 7.24(1H,s,J=1.2 Hz,H-2),6.85(1H,d,J=8.4 Hz,H-5),7.08(1H,dd,J=8.4,1.2 Hz,H-6),7.47(1H,d,J=16.2 Hz,H-7),6.34(1H,d,J=16.2 Hz,H-8),6.85(1H,br s,H-2′),6.68(2H,br s,H-5′,6′),4.64(1H,J=3.6 Hz,H-7′),6.25(1H,d,J=3.6 Hz,H-8′)。13C-NMR(DMSO-d6,150 MHz) δ: 129.9(C-1),105.9(C-2),148.5(C-3),149.7(C-4),107.8(C-5),124.2(C-6),144.0(C-7),116.7(C-8),129.9(C-1′),114.8(C-2′),144.8(C-3′),144.8(C-4′),115.0(C-5′),118.2(C-6′),72.4(C-7),112.9(C-8)。以上数据与文献[27]对比,确定化合物为cis-3-[2-[1-(3,4-dihydroxy-phenyl)-1-hydroxylmethyl]-1,3-ben-zodioxol-5-yl]-(E)-2-propenoic acid。
化合物27 白色针晶,1H-NMR(DMSO-d6,600 MHz) δ: 10.87(-OH),10.65(-OH),7.23(1H,s,H-3),1.72(3H,s,H-5);13C-NMR(DMSO-d6,150 MHz) δ: 164.8(C-4),151.4(C-1),137.6(C-2),107.6(C-3),11.7(C-5)。以上數据与文献[28]对比,确定化合物为mesaconic acid。
化合物28 黄色粉末,1H-NMR(DMSO-d6,600 MHz) δ: 6.75(1H,d,J=9.0 Hz,H-3),7.23(1H,dd,J=9.0,3.0 Hz,H-4),7.41(1H,d,J=3.0 Hz,H-6),10.25(1H,s,H-7),4.85(1H,d,J=7.8 Hz,H-1′),6.98(1H,br d,J=8.4 Hz,H-3′),7.54(1H,ddd,J=8.4,7.8,1.7 Hz,H-4″),6.94(1H,td,J=7.8,1.8 Hz,H-5″),7.76(1H,dd,J=7.8,1.8 Hz,H-6″)。13C-NMR(DMSO-d6,150 MHz) δ: 112.7(C-1),156.3(C-2),117.4(C-3),117.6(C-4),149.2(C-5),125.1(C-6),171.3(C-7),101.2(C-1′),73.4(C-2′),76.1(C-3′),70.1(C-4′),73.1(C-5′),64.6(C-6′),112.9(C-1″),160.2(C-2″),119.3(C-3″),135.8(C-4″),117.2(C-5″),129.9(C-6″),168.6(C-7″)。以上数据与文献[29]对比,确定化合物为gentisic acid 5-O-β-D-(6′-salicylyl)-glucopyranoside。
4 体外抗心肌保护活性的测定
采用H2O2氧化心肌细胞损伤为模型,对化合物1~6,8~17,19进行活性筛选,以槲皮素[31]为阳性对照见表1。将实验分为空白对照组:实验过程中使用无血清培养液处理;H2O2模型组:无血清培养液培养2 h后,加入终浓度为200 μmol·L-1H2O2 作用2 h;主要活性成分預处理组(4 h):分别将含有相应浓度的各种活性成分的无血清培养液作用4 h后,弃去含药培养液。加入终浓度为200 μmol·L-1H2O2作用 2 h;阳性对照组(4 h):将含有20 mg·L-1槲皮素[30]的无血清培养液作用4 h后,弃去含药培养液,后面操作与主要活性成分预处理组一致。
取对数生长期的H9c2心肌细胞以5×104个/孔的密度接种于96孔板中,在5% CO2,37 ℃ 条件培养36 h后,进行处理。处理结束后,每孔加入5 g·L MTT 溶液20 μL,37 ℃孵育4 h后小心移除培养液,每孔中加入100 μL DMSO,微孔板震荡器震荡10 min使甲臜结晶充分溶解后,在微孔板扫描酶标仪测570 nm处吸光度(A)。将各测试孔的A减去本底A(无血清培养基加MTT,无细胞),根据各孔A计算±s。细胞存活率=(A加药细胞-A本底)/(A对照细胞-A本底)×100%。
5 小结
本实验从风轮菜种分离得到28个化合物,其中化合物7,9~10,12,23,26~28首次从风轮菜属植物中分离得到,丰富了风轮菜的化学成分。风轮菜中分离得到的单体成分木犀草素(6) 木犀草素-7-O-新橙皮糖苷(10)、金合欢素-7-O-葡萄糖醛酸苷(12)、柚皮素(14)、江户樱花苷(15)、柚皮素-7-O-芸香糖苷(16)均可不同程度降低H2O2氧化引起的细胞损伤,其中江户樱花苷显示出较强保护作用,与模型组的细胞存活率(62.12±6.18)%,阳性对照(槲皮素)在20.0 mg·L-1下的细胞存活率为(84.55±8.26)%,江户樱花苷在25.0 mg·L-1下的细胞存活率为(84.25±7.36)%。二氢黄酮类抗H2O2氧化诱导的H9c2心肌细胞损伤活性较显著,且呈一定的剂量依赖性。
[参考文献]
[1] 中国药典.一部[S]. 2015: 326.
[2] 孔德云,戴金瑞,施大文. 风轮菜化学成分的研究(Ⅱ) [J].中草药,1985,16(11):38.
[3] 王晓飞,李辰,郑媛媛,等.油橄榄叶多酚类成分研究[J].中草药,2011,42(5):848.
[4] 范明松,叶冠,黄成钢.山莴苣化学成分研究[J].中国中药杂志,2004,29(12):1146.
[5] 洪俊丽,秦民坚,吴刚,等.水蔓菁中的酚性成分[J].中国天然药物,2008,6(2):126.
[6] 沈妍,周志宏,杨耀文,等.齿瓣石斛化学成分的研究[J].天然产物研究与开发,2012,24(3):339.
[7] 周立新,丁怡.水蜡树化学成分的研究[J].中国中药杂志,2000,25(9):541.
[8] 邱莉,姜志虎,刘红霞,等.酸浆宿萼的黄酮苷类化学成分[J].沈阳药科大学学报,2007,24(12):744.
[9] 苗得足,高峰,鞠建刚.风轮菜中黄酮苷类化合物的结构鉴定[J].药学与临床研究,2014,22(4):342.
[10] 牛宝静,马柱坤,廖志新,等.异叶青兰的化学成分研究[J].中草药,2013,44(2):147.
[11] 田冶,汤海峰,王晓娟,等.假奓包叶抗菌活性成分的研究(2)[J].中国中药杂志,2009,34(11):1377.
[12] 高美华,李华,张莉,等.野菊花化学成分的研究[J].中药材,2008,31(5):682.
[13] 靳鑫,时圣明,张东方,等.穿心莲化学成分的研究(Ⅱ)[J].中草药,2012,43(1):47.
[14] 吴疆,侯文彬,张铁军,等.墨旱莲的化学成分研究[J].中草药,2008,39(6):814.
[15] 陈靖宇.风轮菜属植物荫风轮和风轮菜的有效成分研究[D].北京:北京协和医科大学,1997.
[16] 曲桂武,岳喜典,安凤山,等.绒毛鼠尾草化学成分的研究[J].中国中药杂志,2012,37(13):1985.
[17] 柯樱,蒋毅.风轮菜的化学成分研究[J].中草药,1999,30(1):10.
[18] 袁经权,杨峻山,缪剑华.飞机草化学成分研究[J].中草药,2005,36(12):1771.
[19] 于磊,张东明.铁篱巴果化学成分的研究[J].中国中药杂志,2006,31(24):2049.
[20] 郭雨姗,王国才,王春华,等.牛至的化学成分研究[J].中国药学杂志,2012,47(14):1109.
[21] 巴寅颖,刘倩颖,石任兵,等.鬼箭羽中黄酮类化学成分研究[J].中草药,2012,43(2):242.
[22] 胡喜兰,朱慧,刘存瑞,等.凤仙花的化学成分研究[J].中成药,2003,25(10):833.
[23] 陈龙,杜力军,丁怡,等.罗布麻花化学成分研究[J].中国中药杂志,2005,30(17):1340.
[24] 肖梅,曹宁,樊晶晶,等.乌药叶黄酮类化学成分研究[J].中药材,2011,34(1):62.
[25] 付琛,陈程,周光雄.阳春砂仁化学成分研究[J].中草药,2011,42(12):2410.
[26] 段世廉,唐生安,秦楠,等.金鸡脚化学成分及其抗氧化活性[J].中国中药杂志,2012,37(10):1402.
[27] Wan X, Liu H L, Huang X F, et al. Biotransformation of caffeic acid by Momordica charantia peroxidase [J]. Can J Chem, 2008, 86(8):821.
[28] Collin P J, Sternhell S. NMR spectra of crotonic, mesaconic, citraconic and β,β-dimethylacrylic acids, their methyl esters and potassium salts[J]. Aust J Chem, 1966, 19(2):317.
[29] Gu X J, Li Y B, Mu J, et al. A new phenolic glycoside from Prunella vulgaris [J]. Acta Pharma Sinica, 2011, 46(5):561.
[30] Sun X, Sun G B, Wang M, et al. Protective effects of cynaroside against H2O2- induced apoptosis in H9c2 cardiomyoblasts [J]. J Cell Biochem, 2011, 112(8):2019.
[31] Liu Z, Chen J, Huang W, et al. Ginsenoside Rb1 protects rat retinal ganglion cells against hypoxia and oxidative stress [J]. Mol Med Rep, 2013, 8(5):1397.
[責任编辑 丁广治]
