温度、密度及投喂周期对水蛭生长和摄食的影响研究
2017-07-31卢昱希程搏幸郭巧生刘飞史红专勾
卢昱希+程搏幸+郭巧生+刘飞+史红专+勾玲
[摘要] 研究了不同水温(18,22,26,30,34,38 ℃),不同养殖密度(30,60,120,180,240条/L),不同投喂周期(2,5,10,20 d)对水蛭生长、摄食、存活的影响。结果表明,特定增长率与温度之间存在显著二次函数关系(P<0.05),且回归方程为y=-0.016 5x2+0.836 9x-6.847 5(R2=0.990 8)。回归分析显示当温度为25.36 ℃时,水蛭特定增长率最大,达到3.76。当温度高于30 ℃时,随着温度升高,存活率急剧下降。水蛭的特定增长率随着密度的增大而减小。随着密度增加,存活率呈现显著下降趋势(P<0.05)。投喂周期与特定增长率之间存在着显著负相关关系(P<0.05),且线性方程为y=-0.094 1x+3.832 9(R2=0.992 7)。经过实验研究可推测,30~120条/L为适合水蛭生长的密度,22~26 ℃为水蛭最适生长温度,投喂周期越小越好。
[关键词] 温度;养殖密度;投喂周期;特定增长率;饵料系数
[Abstract] Effects of different water temperature, stocking density and feeding cycle on growth, feeding and survival of Hirudo nipponica have been studied, six temperature gradients were set: 18, 22, 26, 30, 34 and 38 ℃, five stocking density gradients were set: 30, 60, 120, 180 and 240 leech/L, four feeding cycle gradients were set: 2, 5, 10 and 20 d, respectively. The results showed that there exists a significant regression relationship between water temperature and specific growth rate: y=-0.016 5x2+0.836 9x-6.847 5(R2=0.990 8)(P<0.05), a regression analysis indicated that specific growth rate reached the maximum (3.76) at 25.36 ℃. When water temperature was beyond 30 ℃, the survival rate significantly decreased as water temperature increased (P<0.05). The specific growth rate and survival rate decreased as stocking density increased. A linear relationship exists between the feeding cycle and the SGR: y=-0.094 1x+3.832 9(R2=0.992 7). From this study, it can be concluded that the optimal water temperature and stocking density for the growth of H. nipponica is 22-26 ℃ and 30-120 leech/L, respectively.
[Key words] temperature;stocking density;feeding cycle;specific growth rate;feed conversion rate
水蛭Hirudo nipponica,是《中國药典》2015年版动物药材水蛭的基原动物之一,《中国动物志》称日本医蛭,常年栖息于水田及其与之相通的沟渠中 [1]。作为一种吸血蛭类,水蛭具有较好的抗凝血酶活性[2-3],已广泛用于除瘀血、脓血、毒血等传统中医治疗及显微外科手术、心脑血管疾病等治疗[4-6]。但由于水蛭栖息环境的恶化及过度捕捞,水蛭的野外种群数量急剧减少,无法满足日益增长的市场需求[7]。因此,研究水蛭的相关生物学特性已迫在眉睫。目前,关于水蛭的研究主要集中在活性成分、遗传学等方面[8-10],对水蛭生长、摄食的研究还相对较少。本试验将考察温度、密度、投喂周期对水蛭的生长性能、摄食性能的影响,以期为以后的人工饲养提供科学的理论依据。
1 材料
实验用水蛭采集于辽宁大连地区,经中国科学院水生生物研究所动物学专家杨潼鉴定为无吻蛭目医蛭科动物日本医蛭H.nipponia。实验用水使用前已经过曝气处理,实验期间所有水蛭均用新鲜牛血投喂。
FPG3型三温区可编程光照培养箱(宁波莱福科技有限公司),奥克丹多参数水质分析仪(奥克丹科技有限公司),WT-1002高精度电子天平(杭州万特衡器有限公司),高精度温度计。
2 方法
2.1 温度对水蛭生长、摄食、存活的影响 选取0.19 g、活性较好、表面无伤痕的水蛭,共设置6个温度组,温度分别为18,22,26,30,34,38 ℃。密度为50条/L,投喂间隔为5 d,每个实验组3个重复。将放有水蛭的塑料瓶放入可调节温度的培养箱中,培养箱置于有自然光散射的房间内。初始温度均设置成22 ℃,待水蛭适应5 d后,按照2 ℃·d-1的速率将各瓶子水体温度升高或降低到实验设置温度。
2.2 密度对水蛭生长,摄食,存活的影响 选取0.15 g,活性较好,表面无伤痕的水蛭,共设置5个密度组,分别为30,60,120,180,240条/L。实验在室温下进行,水温变化为17.6~23.5 ℃,光照为自然光,投喂间隔为5 d。每个实验组3个重复。
2.3 投喂周期对水蛭生长、摄食、存活的影响 选取0.18 g、活性较好、表面无伤痕的水蛭,共设置4个投喂周期组,投喂周期分别为2,5,10,20 d。密度为50条/L,实验在室温下进行,水温变化范围为17.6~23.5 ℃,光照为自然光,每个实验组3个重复。
2.4 抗凝血酶活性测定 实验结束后的第8天,从各试验组中随机挑选适量的水蛭,置于阳光下晒干。根据《中国药典》2015年版中的方法进行测量[11]。
将水蛭干品磨成粉,过3号筛。精确称量1 g粉末放入烧杯中,在烧杯中加入5 mL,浓度为0.9%的氯化钠溶液。静置30 min,期间每隔10 min用玻璃棒将混合物搅拌1次;将上清液倒入试管中(8 mm×38 mm),离心10 min。离心后将100 μL上清液和200 μL 包含0.5%纤维蛋白原(以固体计算)的三羟甲基氨基甲烷盐酸缓冲液(需要时再配置)精確加入玻璃试管中,摇匀,水浴5 min。水浴后将凝血酶溶液(40 U· mL-1)逐滴加入玻璃试管中,每分钟加1次,每次加5 μL,整个过程始终保持在水浴箱(37±5) ℃中进行;边滴加边轻轻摇匀,直至玻璃管内的溶液凝固。记录消耗的凝血酶溶液体积,并计算水蛭抗凝血酶活性(U)。
式中,U代表每1 g水蛭抗凝血酶活性;C1代表凝血酶溶液浓度(U·mL-1);C2代表样品溶液浓度(g·mL-1);V1代表凝固状态时消耗的凝血酶溶液体积(μL);V2代表加入到试管中的样品溶液体积(μL)。
2.5 日常管理 所有水蛭均投放于塑料瓶中,用胶圈将80目的过滤网套在瓶口上,以防止水蛭逃跑。实验周期为60 d,每天清洗瓶子并换水,以保证水体清洁。需要注意的是,温度实验中换水时需将温差控制在±1 ℃。每次投喂足够量的新鲜牛血,每次喂食后记录喂食数据;每天巡查各塑料瓶,发现死亡的水蛭及时移到瓶外,并记录存活率;最后一次投喂后的第5 天称末体重。
2.6 参数计算 本研究从增重率(weight gain rate)、特定增长率(specific growth rate)、单条进食总量(total weight of food consumed)、饵料系数(feed conversion rate)、存活率(survival rate)等5个方面来考察温度、密度、投喂周期对水蛭生长和摄食的影响。
增重率(WGR) =(末体重-初始体重)/初始体重×100%
特定增长率(SGR)=(Ln末体重-Ln初始体重)/试验周期×100%
单条进食总量(TWFC)= 水蛭进食总量/水蛭条数
饵料系数(FCR)=单条进食总量/(末体重-初始体重)
存活率(SR)=试验结束时剩余条数/投放条数×100%
实验结果均采用SPSS 19.0 进行单因素方差分析,不同组间采用Duncan法比较差异,显著性水平设置为P<0.05。
3 结果
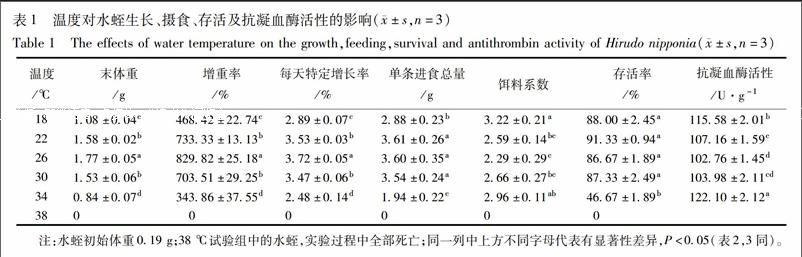
3.1 温度对水蛭生长、摄食、存活及抗凝血酶活性的影响 当温度在18~26 ℃时,水蛭末体重、增重率、特定增长率均随着温度的升高而升高,当温度超过26 ℃后,又随着温度的升高而降低。当温度为26 ℃时,末体重、增重率、特定增长率显著高于其他温度试验组(P<0.05)(表1)。回归分析表明,特定增长率与温度之间存在显著二次函数关系(P<0.05),且回归方程为y=-0.016 5x2+0.836 9x-6.847 5(R2=0.990 8)。从回归方程可知,当温度为25.36 ℃时,水蛭特定增长率最大,达到3.76。
饵料系数先随着温度的升高而降低,当温度超过26 ℃时,随着温度升高,饵料系数呈上升趋势(表1)。当温度介于22~30 ℃,水蛭单条进食总量无差异,且显著高于18,34 ℃实验组(P<0.05)。
当温度介于18~30 ℃时,存活率较高,均达到85%以上,且相互之间无显著差异(P<0.05)。当温度高于30 ℃时,随着温度升高,存活率急剧下降,当温度为38 ℃时,水蛭在实验过程中全部死亡。当温度为34 ℃时,抗凝血酶活性最大,显著高于18,22,26,30 ℃(P<0.05)
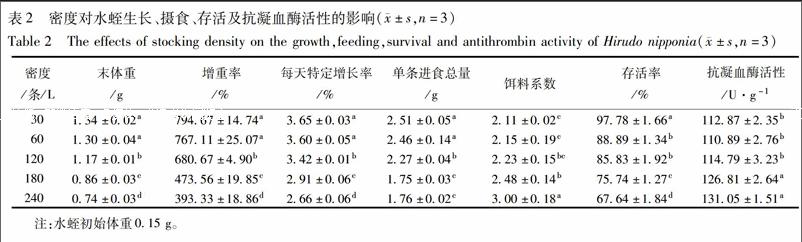
3.2 密度对水蛭生长、摄食、存活及抗凝血酶活性的影响 水蛭的末体重、增重率、特定增长率均随着密度的增大而减小,且低密度组(30,60条/L)的末体重、增重率、特定增长率显著高于高密度组(120,180,240条/L)(P<0.05)。当密度为30条/L时,水蛭的特定增长率达到最大值,为3.65(表2)。
饵料系数随着密度的增加而增大,低密度组(30条/L)的存活率能达到90%以上,且显著高于其他试验组(P<0.05)。240条/L密度组抗凝血酶活性最大,达到131.05 U·g-1,与180条/L无显著差异(P<0.05),且显著高于30,60,120条/L密度组(P<0.05)。
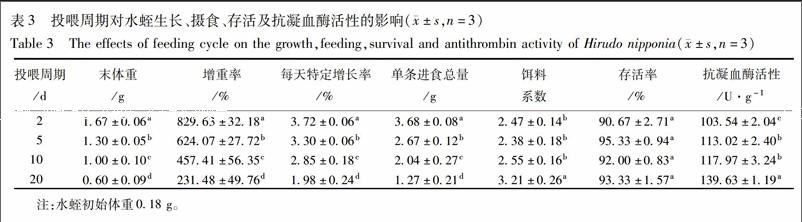
3.3 投喂周期对水蛭生长、摄食、存活及抗凝血酶活性的影响 末体重、增重率、特定增长率均随着投喂周期的增大而呈现下降的趋势(表3),且相互之间差异显著(P<0.05)。回归分析表明,投喂周期与特定增长率之间存在着显著负相关关系(P<0.05),且线性方程为:y=-0.094 1x+3.832 9(R2=0.992 7)。单条进食总量随着投喂周期的增大而呈现下降趋势,投喂周期对水蛭存活率无影响。抗凝血酶活性随着投喂周期的增加而增加,投喂周期为20 d时,抗凝活性最大,显著高于其他试验组(P<0.05)。
4 讨论
4.1 温度对水蛭的影响 水体温度作为一个重要的环境因子,对水生动物的生长、发育、存活具有重要影响[12-13]。不同水温会导致水生生物在代谢率、生理活动方面存在差异[14-15],进而影响其生长、摄食及蛋白质合成等。本研究中,在18~26 ℃,水蛭末体重、增重率、特定增长率均随着温度的升高而升高,当温度超过26 ℃后,水蛭末体重、增重率、特定增长率均随着温度的升高而呈现出降低的趋势。刘鉴毅等[16]在研究中指出,水生动物生长和温度之间通常存在多元回归方程关系。回归分析表明,水蛭特定增长率与温度之间呈二次函数关系,经计算可知,当温度为25.36 ℃时,水蛭的特定增长率最大,达到3.76。当温度介于22~26 ℃时,水蛭的单条进食总量较高;当温度超过26 ℃时,单条进食总量随着温度的升高而降低。实验期间可观察到,当温度介于22~26 ℃时,水蛭活性较好,当水体温度为18 ℃时,水蛭大多沉于瓶底、行动缓慢,耗能较少,且食欲较低。当水体温度达到34 ℃时,水蛭活动过于频繁,可能处于不适状态,该温度可能超出水蛭最适生长温度,从而导致摄食率降低[17]。
饵料系数,即饵料用量与体重增量的比值,比值越低,说明增加单位体重所用饵料的量越小。本研究中,饵料系数随着温度的升高呈现先降低后升高的趋势,并在26 ℃达到最低。有研究表明,在一定温度范围内,水生动物的消化酶活性随着温度升高而上升,当温度超过最适温度后,呈下降趋势[18-19];因此可推测水蛭在26 ℃时酶活性较好使得消化速度加快、食物转换效率较高,从而导致在进食量无差异的情况下,水蛭在26 ℃时的生长较22,30 ℃好。关于温度对水蛭消化系统酶活性的影响还需进一步研究。
本研究中,温度对存活率的影响较为显著,当温度超过30 ℃时,水蛭的存活率显著下降。温度为34 ℃时,60 d后水蛭存活率不足一半,仅为46.67%;当温度达到38 ℃时,水蛭在实验过程中全部死亡。说明此温度段已超出水蛭能耐受的高温范围。杨潼[1]在《动物志》一书中记载,水蛭耐高温能力较差,高温暴晒即可致死。与本研究结果相符。18~30 ℃,水蛭存活率无显著差异,均达到85%以上。据野外考察所知,水蛭在我国分布较广,北起东北各省南至两广地区均有发现,因此水蛭对低温耐受力较强,关于其耐受低温还需进一步研究。
在适宜生长温度范围内,水生动物的生长率会随着温度的升高而升高,当环境温度超过最适生长温度范围后,水生动物生长逐渐减缓、甚至停滞[20]。本研究中,当温度介于22~26 ℃时,水蛭生长相对较快、增重相对较大、存活率较高,同时在该温度范围内,水蛭抗凝血酶活性达到《中国药典》2015年版标准。综上所述,22~26 ℃为最适生长温度。此研究结果与温度对蚂蟥生长影响研究的结果基本一致[21]。
4.2 密度对水蛭的影响 养殖密度对水生动物的生长发育、生存有着重要的影响[22-23]。虹鳟鱼在高密度下呈现出较低的生长率[24];同样地,随着密度的增加,杂交鲟幼鱼生长减缓[25]。本研究中水蛭生长率随着养殖密度的增大而减小,与上述研究结果一致。在高密度环境下,水生动物的生长影响机制较为复杂[26]。本研究中,随着养殖密度的增加,水蛭的饵料系数也随之增加。说明在高密度环境下,水蛭的食物转换效率較低,从而影响其生长。分析原因可能为:密度对水生动物的生理生化有较大的影响[27],由于密度过高而发生的竞争行为会引起机体生理活动加强[28],所以高密度环境下的水蛭会消耗更多能量来产生一系列生理生化的变化来适应胁迫压力,从而生长缓慢。另外,在高密度环境下,种群内会形成一种“社会阶层”,阶层的形成会导致处于低阶层的个体进食受到影响,进而影响生长[29]。
当密度高于临界养殖密度时,随着密度的增大,会产生个体间相互残杀、疾病的发生等消极影响[27,30]。本研究高密度组中,不定期会发现有个体较大的水蛭撕咬个体较小的水蛭,分析原因可能为高密度环境下“种群胁迫”加剧,个体间相互攻击的机会增加。当密度为30条/L时,水蛭存活率最大,当密度大于120条/L时,水蛭存活率显著下降,各密度条件下水蛭抗凝血酶活性均能达到《中国药典》2015年版标准。因此可推测30~120条/L的密度较适合水蛭生长发育。
4.3 投喂周期对水蛭的影响 已有研究表明,投喂周期可以显著影响鱼类的生长发育和饵料利用[31]。星斑川鲽幼鱼、银鲫的生长率均随着投喂周期的增大而减小[32-33]。本研究中,投喂周期与特定增长率之间存在着显著负相关关系,随着投喂周期增大,特定增长率呈下降趋势。当投喂周期为2~10 d时,各组间饵料系数、存活率无显著差异,单条进食总量随投喂周期增大而呈现下降的趋势,说明摄食不足是引起低投喂频率组水蛭生长缓慢的主要原因。水蛭耐饥能力较强,其用于消化的盲囊向体两侧伸展占据了大部分体积,食物能在体内存储。而且水蛭消化道内的消化酶较少,这导致了水蛭的消化与吸收是个缓慢过程,所以水蛭饱食1次能维持生命较长时间[1],所以各组间存活率无显著差异。本研究中,随着投喂周期增大,水蛭抗凝血酶活性随之增大,且各投喂周期条件下抗凝血酶活性均达到《中国药典》2015年版标准。因此,生产上建议每隔2~5 d投喂1次水蛭,确保药材品质的同时,水蛭生长更好。
[参考文献]
[1] 杨潼. 中国动物志·环节动物门·蛭纲[M]. 北京:科学出版社,1996:120.
[2] 吴志军,张灵霞,于立华. 四种不同品种水蛭生物活性的研究与比较[J]. 中成药,2006,28(2):232.
[3] 张彬,汪波,龚元,等. 几种水蛭抗凝血物质提取及活性分析[J]. 中山大学学报:自然科学版,2012,51(4):92.
[4] 梁文艳. 水蛭的临床应用概况[J]. 吉林中医药,2005,25(10):58.
[5] 吕明远. 近年来中药水蛭的研究概况[J]. 天津药学,2005,17(3):62.
[6] 刘坤. 医用蛭在治疗耳廓撕脱伤中的应用[J]. 中国中西医结合耳鼻咽喉科杂志,2004,12(4):180.
[7] 丁立威. 水蛭资源匮乏后市价格看涨——2000~2007年水蛭市场走势浅析[J]. 中国现代中药,2008,10(2):45.
[8] Li Y B,Huang W H,Xiang Y. Three new pteridines, hirudinoidines A-C, from Hirudo nipponica Whitman[J].Helv Chim Acta,2008,91(2):303.
[9] 李友宾,相宇,黄卫华,等. 日本医蛭化学成分研究[J]. 海峡药学,2009,21(5):75.
[10] Liu F,Guo Q S,Shi H Z,et al. Genetic variation in Whitmania pigra, Hirudo nipponica and Poecilobdella manillensis, three endemic and endangered species in China using SSR and TRAP markers[J]. Gene,2015,579 (2):172.
[11] 中国药典.四部[S].2015.
[12] 孙德文,詹勇,许梓荣. 环境温度在鱼类养殖业中的重要作用研究[J]. 水产养殖,2003,24(2):36.
[13] 许友卿,陈哲,丁兆坤. 低温对鱼类的影响及其预防[J]. 广东农业科学,2012,39(15):132.
[14] Almeida Val V M F D,Gomes A R C,Lopes N P. Metabolic and physiological adjustments to low oxygen and high temperature in fishes of the Amazon[J]. Fish Physiol Biochem,2005(5):443.
[15] 刘江华,区又君,李加儿,等. 温度和pH对驼背鲈消化酶活力的影响[J]. 中山大学学报:自然科学版, 2014,53(3):95.
[16] 刘鉴毅,宋志明,王妤,等. 温度对点篮子鱼幼鱼生长、摄食和消化酶活性的影响[J]. 海洋渔业,2015,37(5):442.
[17] 杨发群,周秋白,张燕萍,等. 水温对黄颡鱼摄食的影响[J]. 淡水渔业,2003,33(5):19.
[18] 沈文英,祝尧荣,钱科亮. 温度和pH对澳洲宝石鱼消化酶活性的影响[J]. 大连海洋大学学报,2006, 21(2):189.
[19] 田宏杰,庄平,高露姣. 生态因子对鱼类消化酶活力影响的研究进展[J]. 海洋渔业,2006,28(2):158.
[20] 高淳仁,王印庚,马爱军,等. 温度对大菱鲆幼鱼生长、成活率和体内蛋白酶活性的影响[J]. 渔业科学进展,2006,27(6):33.
[21] 史红专,刘飞,郭巧生. 温度对蚂蟥生长及摄食规律影响的初步研究[J]. 中国中药杂志,2006,31(23):1944.
[22] 郝玉江,张国红,贾艳菊,等. 种群密度对鱼类影响的研究概述[J]. 河北师范大学学报:自然科学版,2003,27(4):397.
[23] 刘宝良,雷霁霖,贾睿,等. 养殖密度对鱼类福利影响研究进展[J]. 中国工程科学,2014,16(9):100.
[24] Leatherland J F. Stocking density and cohort sampling effects on endocrine interactions in rainbow trout[J]. Aquacult Int,1993,1(2):137.
[25] 程佳佳,李吉方,溫海深,等. 养殖密度对杂交鲟幼鱼生长、肌肉组分和血液生理生化指标的影响[J]. 中国水产科学,2015,22(3):433.
[26] 廖锐,区又君,勾效伟. 养殖密度对鱼类福利影响的研究进展Ⅰ.死亡率、生长、摄食以及应激反应[J].南方水产科学,2006,2(6):76.
[27] Bolasina S,Tagawa M,Yamashita Y,et al. Effect of stocking density on growth, digestive enzyme activity and cortisol level in larvae and juveniles of Japanese flounder, Paralichthys olivaceus[J]. Aquaculture,2006,259 (1):432.
[28] Li H W,Brocksen R W. Approaches to the analysis of energetic costs of intraspecific competition for space by rainbow trout ( Salmo gairdneri)[J]. J Fish Biol,1977,11(4):329.
[29] Jorgensen E H,Christiansen J S,Jobling M. Effects of stocking density on food intake, growth performance and oxygen consumption in Arctic charr (Salvelinus alpinus)[J]. Aquaculture,1993,110 (2):191.
[30] 刘洪军,官曙光,于道德,等. 鱼类自残行为研究进展[J]. 海洋通报,2010,29(5):594.
[31] 房景辉,刘相全,赵海峰,等. 投喂频率对刺参(Apostichopus japonicus)生长、体成分组成和能量收支的影响[J]. 渔业科学进展,2014(5):55.
[32] 孙丽慧,王际英,丁立云,等. 投喂频率对星斑川鲽幼鱼生长和体组成影响的初步研究[J]. 上海海洋大学学报,2010,19(2)190.
[33] Zhou Z G,Cui Y N,Xie S,et al. Effect of feeding frequency on growth, feed utilization, and size variation of juvenile gibel carp (Carassius auratus gibelio) [J]. J Appl Ichthyol,2003,19(4):244.
[责任编辑 吕冬梅]
