岗梅根中1个新的齐墩果烷型三萜皂苷
2017-07-31文思管希锋黄晓君范春林叶文才王
文思+管希锋+黄晓君+范春林+叶文才+王英
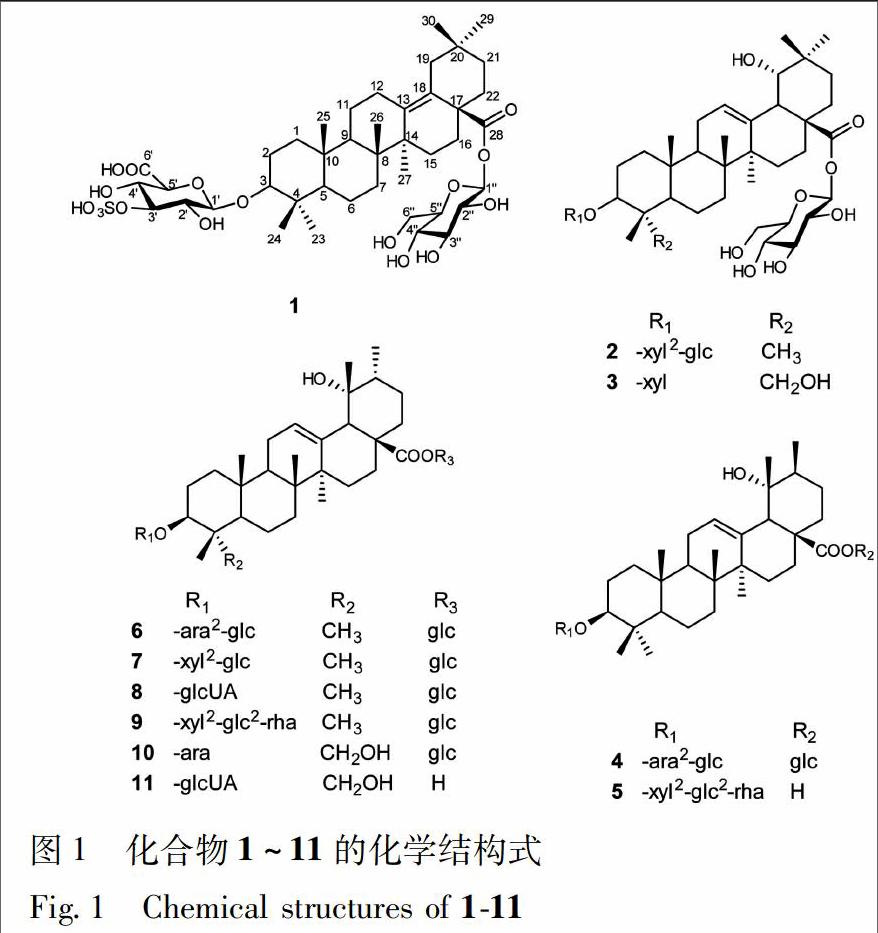
[摘要] 岗梅根为广东凉茶的常用组方药材,三萜皂苷类化合物为其主要和特征性成分。该研究采用硅胶,ODS,Sephadex LH-20,Pre-HPLC等色谱分离技术从岗梅根75%乙醇提取物中分离得到11个三萜皂苷类化合物,经多种波谱技术和化学方法鉴定了它们的结构,分别为3-O-(3-O-sulfo)-β-D-glucopyranosiduronic acid 3β-hydroxy-13(18)-oleanen-28-oic acid 28-O-β-D-glucopyranosyl ester (1)、rotundinoside A (2)、oblonganoside M (3)、3-O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyranosyl 3β,19α-dihydroxy-20α-urs-12-en-28-oic acid 28-O-β-D-glucopyranosyl ester (4)、毛冬青皂苷B2 (5)、ilexside II (6)、rotundinoside B (7)、ilekudinoside B (8)、ilexpublesnin E (9)、ilekudinoside D (10)和ilexpernoside D (11)。其中,化合物1为1个新的δ-齐墩果酸型三萜皂苷,化合物2~11为首次从该植物中分离得到。
[关键词] 冬青科;岗梅根;三萜皂苷
[Abstract] A new δ-oleanane-type triterpenoid glycoside, 3-O-(3-O-sulfo)-β-D-glucopyranosiduronic acid 3β-hydroxy-13(18)-oleanen- 28-oic acid 28-β-D-glucopyranosyl ester (1), along with ten known triterpenoid glycosides, rotundinoside A (2), oblonganoside M (3), 3-O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyranosyl 3β,19α-dihydroxy-20α- urs-12-en-28-oic acid 28-O-β-D- glucopyranosyl ester (4), ilexsaponin B2 (5), ilexside Ⅱ (6), rotundinoside B (7), ilekudinoside B (8), ilexpublesnin E (9), ilekudinoside D (10) and ilexpernoside D (11), was isolated from the 75% ethanol extract of the roots of Ilex asprella by various chromatographic separation. Their structures were identified on the basis of MS, NMR spectroscopic analysis and chemical methods. In addition, 2-11 were isolated from I. asprella for the first time.
[Key words] Aquifoliaceae;Ilex asprella;triterpenoid glycoside
岗梅根为冬青科Aquifoliaceae冬青属植物梅叶冬青Ilex asprella(Hook. et Arn.) Champ. ex Benth.的干燥根,主产于广东、广西、湖南、江西等省区。岗梅根具清热解毒、生津止渴、消肿散瘀等功效[1],可用于治疗感冒发热、肺热咳嗽和咽喉肿痛等[2],是岭南地区常用中草药品种,也是广东凉茶(如王老吉凉茶和沙溪凉茶)的重要组方药材。前期的化学成分研究表明,三萜及其皂苷、黄酮、木脂素和酚酸类为其主要化学成分[3-14],其中三萜皂苷类化合物是其特征性成分[2,4]。本课题组曾报道从岗梅根中分离鉴定了一系列三萜及其皂苷类化合物[11-12],在进一步的研究中,又从岗梅根75%乙醇提取物中分离得到11个三萜皂苷化合物,利用各种波谱技术和化学方法并结合其理化常数鉴定了它们的结构,分别为3-O-(3-O-sulfo)-β-D-glucopyranosiduronic acid 3β-hydroxy-13(18)-oleanen-28-oic acid 28-β-D-glucopyranosyl ester(1),rotundinoside A(2),oblonganoside M(3),3-O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyranosyl 3β,19α-dihydroxy-20α-urs-12-en-28-oic acid 28-O-β-D-glucopyranosyl ester(4),毛冬青皂苷B2(5),ilexside II(6),rotundinoside B(7),ilekudinoside B(8),ilexpublesnin E(9),ilekudinoside D(10),ilexpernoside D(11)。以上化合物中,1為1个新的δ-齐墩果酸型三萜皂苷类化合物,这也是首次报道从岗梅根中发现了该类型三萜皂苷,2~11均为首次从该植物中分离得到。
1 材料
JASCO FT/IR-4600 Fourier Transform型红外光谱仪(KBr压片);JASCO P-2000旋光仪;Agilent 6210 LC/MSD TOF型质谱仪;Bruker AV-400/500 FT型核磁共振仪(TMS内标);Agilent 1260型分析型高效液相色谱仪;Agilent 1260型制备型高效液相色谱仪;硅胶GF254薄层预制板(烟台化学工业研究所);硅胶200~300目(青岛海洋化工有限公司);D101型大孔树脂(安徽三星树脂科技有限公司);YMC反相ODS柱色谱填料;Pharmacia Sephadex LH-20色谱填料;Cosmosil 5 C18-MS-Ⅱ(4.6 mm × 250 mm,5 μm);Cosmosil 5 C18-MS-Ⅱ(20 mm × 250 mm,5 μm);色谱纯甲醇(山东禹王和天下新材料有限公司)、色谱纯乙腈(Merck,Darmstadt,Germany);其他均为分析纯试剂(天津大茂化学试剂厂)。
实验用药材岗梅根于2007年5月采自广东省广州市从化森林公园,经广东药科大学李书渊教授鉴定为梅叶冬青I. asprella 的根,标本(2007050601)现保存于暨南大学中药及天然药物研究所。
2 提取与分离
2.1 三萜皂苷的提取与分离 干燥的岗梅根25 kg,粉碎,用75%乙醇室温浸渍提取3次,合并提取液并减压浓缩得粗提物2.3 kg。粗提物经水混悬,依次用乙酸乙酯和正丁醇萃取,得正丁醇萃取部位370 g。正丁醇萃取部位经D101大孔树脂柱色谱,乙醇-水系统(0∶100~95∶5)梯度洗脱,收集50%乙醇洗脱部位(91 g)。50%乙醇部位经硅胶柱色谱(200~300目),氯仿-甲醇系统(90∶10,80∶20,75∶25,72∶28,70∶30,65∶35,50∶50)梯度洗脱,得18个主流分(Fr. 1~Fr. 18)。Fr. 6经ODS柱色谱,甲醇-水(15%~50%)梯度洗脱,得15个子流分(Fr. 6-1~Fr. 6-15)。Fr. 6-5经Sephadex LH-20凝胶柱色谱,70%甲醇洗脱得化合物11(16 mg);Fr. 6-11经制備型HPLC分离[流动相为乙腈-水(31∶69),流速为6 mL·min-1,检测波长为210 nm]得化合物2(8 mg),4(98 mg),6(75 mg),7(15 mg);Fr 6-14经制备型HPLC分离[流动相为乙腈-水(35∶65),流速为6 mL·min-1,检测波长为210 nm]得化合物5(18 mg)。Fr. 7经ODS柱色谱,甲醇-水(20∶80~60∶40)梯度洗脱,得6个子流分(Fr. 7-1~Fr. 7-6)。Fr. 7-3经制备型HPLC分离[流动相为乙腈-水(60∶40),流速为6 mL·min-1,检测波长为210 nm]得化合物3(13 mg)和10(11 mg)。Fr. 9经ODS柱色谱,甲醇-水(16∶85~50∶50)梯度洗脱,得4个子流分(Fr. 9-1~Fr. 9-4)。Fr. 9-4经制备型HPLC分离[流动相为乙腈-水(68∶32),流速为6 mL·min-1,检测波长为210 nm]得化合物9(31 mg)。Fr. 11经ODS柱色谱,甲醇-水(10∶90~50∶50)梯度洗脱,得12个子流分(Fr. 11-1~Fr. 11-12)。Fr. 11-6经制备型HPLC分离[流动相为乙腈-水(30∶70),流速为6 mL·min-1,检测波长为210 nm]得化合物8(60 mg)。Fr. 11-10经制备型HPLC分离[流动相为乙腈-水(30∶70),流速为6 mL·min-1,检测波长为210 nm]得化合物1(37 mg)。所得化合物结构式见图1。
2.2 化合物1的酸水解和糖绝对构型的确定[15] 取样品(3 mg),加入10 mL 盐酸水溶液(2 mol·L-1),水浴90 ℃加热回流5 h。反应完毕后减压回收溶剂,用适量的水溶解,用氯仿萃取。取水层,减压浓缩后,加入1 mL无水吡啶溶解,随后加入3 mg·L-1-半胱氨酸甲酯盐酸盐(L-cysteine methyl esterhydrochloride),60 ℃下反应1 h,再加入3 mL邻苯甲基异硫代异氰酸酯,继续在60 ℃下反应1 h。取出反应液,放冷,经微孔滤膜过滤,进行HPLC分析。取D-葡萄糖、L-葡萄糖和D-葡萄糖醛酸对照品,按上述方法衍生化后,进行HPLC分析。色谱条件为:COSMOSIL 5C18-MS-Ⅱ(4.6 mm×250 mm,5.0 μm)色谱柱,检测波长250 nm,柱温35 ℃,流动相为乙腈-0.05%甲酸水(25∶75),流速0.8 mL·min-1。结果显示,D-葡萄糖衍生物保留时间为18.82 min,L-葡萄糖衍生物保留时间为17.25 min,D-葡萄糖醛酸衍生物保留时间为19.21 min,化合物1酸水解后糖部分衍生物的保留时间分别为18.51和19.47 min,说明化合物1中含有D-葡萄糖和D-葡萄糖醛酸。
3 结构鉴定
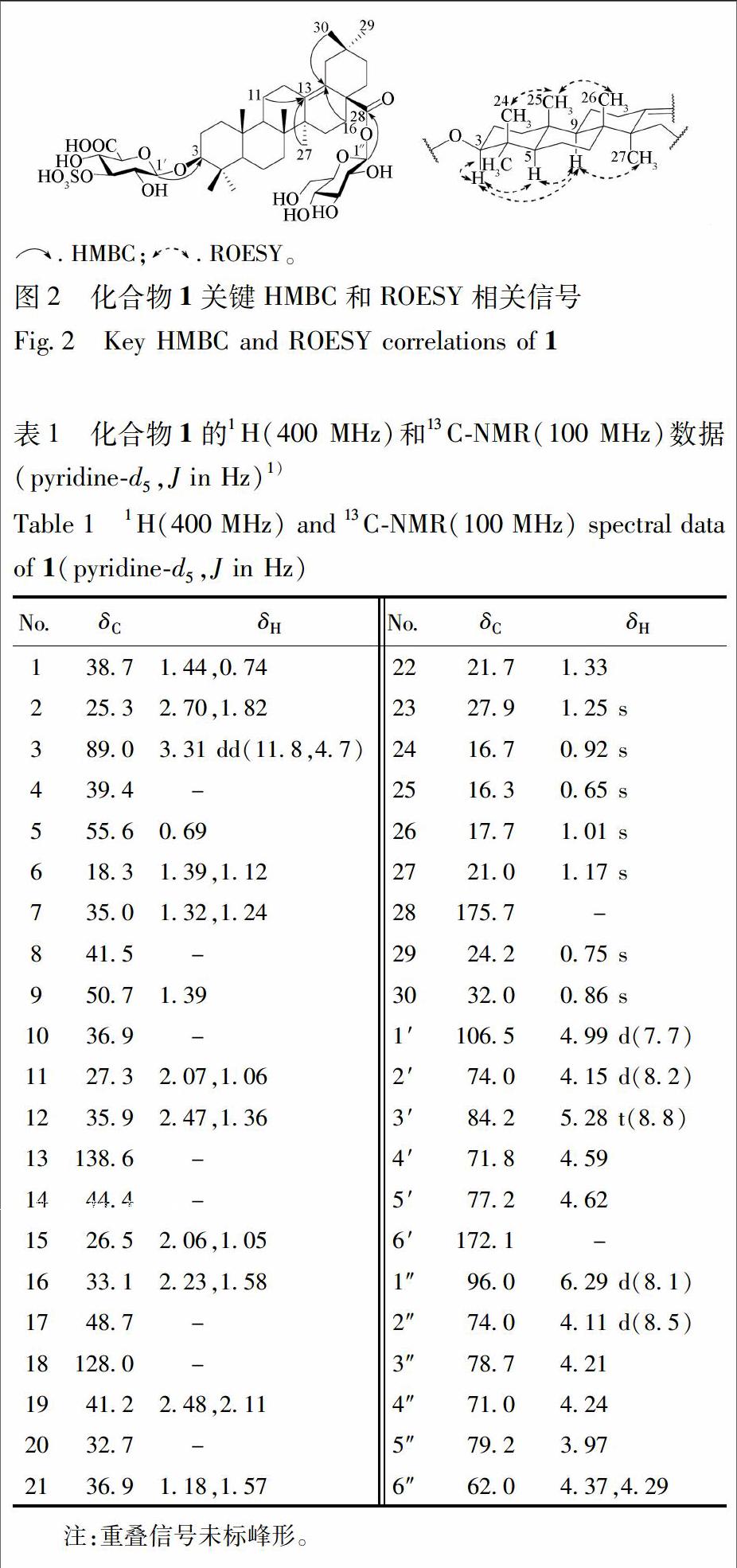
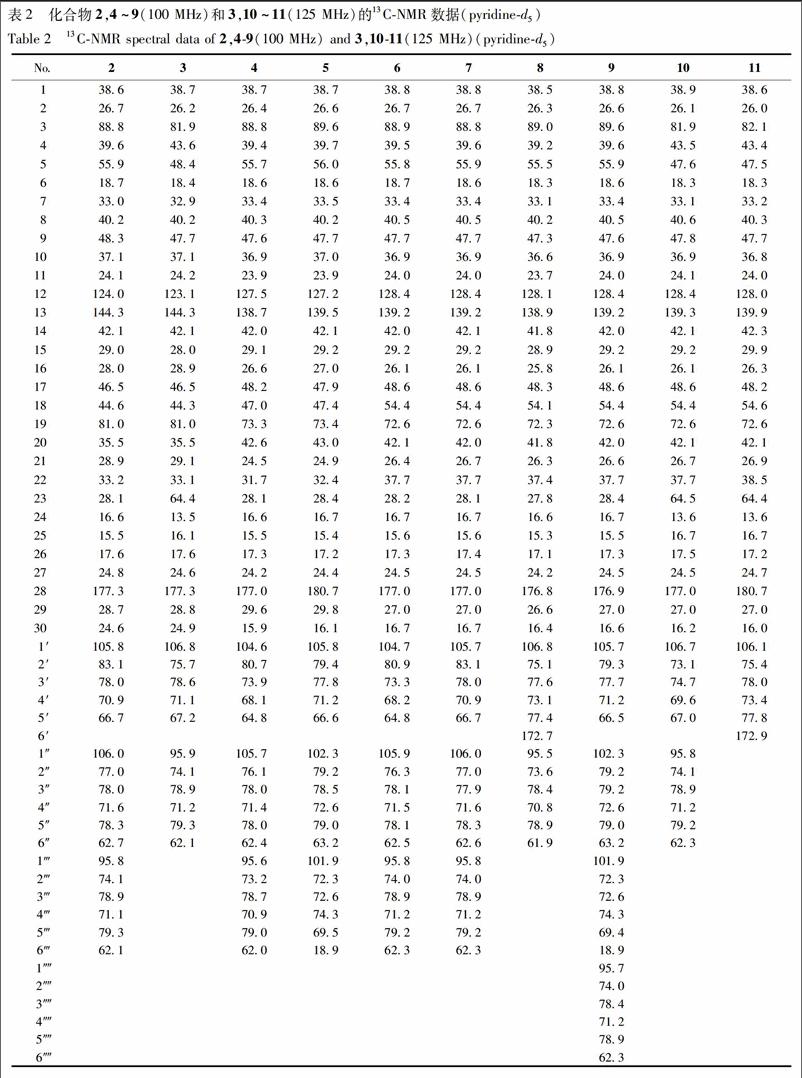
化合物1 无定形粉末,[a]25D-41.7°(c 1.0,MeOH);Liebermann-Burchard反应和 Molish 反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示化合物1为三萜皂苷类化合物。IR谱显示结构中含有羟基(3 407 cm-1)、羰基(1 680 cm-1)和S-O(1 204 cm-1)。HR-ESI-MS谱显示准分子离子峰m/z 873.394 2 [M-H]- (C42H65O17S,计算值 873.394 8),可推断该化合物分子式为C42H66O17S。化合物1的1H-NMR谱显示出1个连氧的次甲基质子信号[δH 3.31(1H,dd,J=11.8,4.7 Hz)]和7个角甲基的质子信号[δH 1.25,1.17,1.01,0.92,0.86,0.75和0.65(各3H,s,7×CH3)]。化合物1的13C-NMR谱共显示出42个碳信号,结合DEPT 135谱,可知其中包含1个酯羰基碳信号(δC 175.7)、1对烯烃碳信号(δC 138.6,128.0)、1个连氧次甲基碳信号(δC 89.0)及7个甲基碳信号(δC 32.0,27.9,24.2,21.0,17.7,16.7,16.3)。此外,化合物1的1H和13C-NMR谱中还显示出2个糖残基的端基质子信号[δH 6.29(1H,d,J=8.1 Hz)和4.99(1H,d,J=7.7 Hz)]和端基碳信号(δC 106.3,96.0)。酸水解实验说明化合物1中含有D-葡萄糖和D-葡萄糖醛酸,进一步结合端基氢的偶合常数,可确定2个糖单元分别为β-D-葡萄糖和β-D-葡萄糖醛酸。以上波谱数据提示化合物1为含有2个糖残基的三萜皂苷类化合物。综合化合物的1D和2D NMR谱信息,对其碳氢谱进行了全归属,见表1。化合物1苷元部分的核磁数据与文献报道的已知化合物scoparianoside C[16]苷元部分数据一致,提示它们具有相同的苷元部分结构。在HMBC谱中,可观察到H2-11(δH 2.07,1.06)/H3-27(δH 1.17)与C-13(δC 138.6),H-16(δH 2.23)/H-30(δH 0.86)与C-18(δC 128.0)分别有远程相关,说明C-13和C-18位成双键;在ROESY谱中,可观察到H-3(δH 3.31)与H3-23(δH 1.25)/H-5(δH 0.69)/H-9(δH 1.39)有相关,H-5(δH 0.69)与H-9(δH 1.39)有相关,H-9(δH 1.39)与H3-27(δH 1.17)有相关;H3-24(δH 0.92)与H3-25(δH 0.65)有相关,H3-25(δH 0.65)与H3-26(δH 1.01)有相关;提示H-3为α构型,A/B和B/C为反式骈合。以上信息进一步确定了化合物1苷元部分的结构为δ-齐墩果酸[3β-hydroxy-olean-13(18)-en-28-oic acid]。在HMBC谱中可观察到葡萄糖醛酸的端基质子信号H-1′(δH 4.99)与苷元的C-3(δC 89.0)有远程相关,葡萄糖的端基质子信号H-1″(δH 6.29)与苷元的C-28(δC 175.7)有远程相关,因此,可确定葡萄糖醛酸与苷元的C-3位相连,葡萄糖与苷元的C-28位相连,见图2。结合质谱信息和红外谱中1 204 cm-1处的S-O伸缩振动特征吸收峰,可确定化合物1中含有1个磺酸基团。与已知化合物ilekudinoside B[17]比较,化合物1中葡萄糖醛酸片段中的C-3′明显向低场位移(Δδ+6.0)而C-2′和C-4′则分别向高场位移(Δδ-1.6,-1.7),故可确定化合物1中的磺酸基应与葡萄糖醛酸的C-3′位相连。综合以上解析,可确定化合物1的结构为3-O-(3-O-sulfo)-β-D-glucopyranosiduronic acid 3β-hydroxy-13(18)-oleanen-28-oic acid 28-O-β-D-glucopyranosyl ester,为1个新的δ-齐墩果酸型三萜皂苷类化合物,这也是首次从岗梅根中发现该类型三萜苷元。
化合物2 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 403,1 732和1 593 cm-1;ESI-MS m/z 951 [M+Na]+,分子式为C47H76O18;1H-NMR(pyridine-d5,400 MHz)δ: 6.37(1H,d,J=8.1 Hz,glc-H-1),5.50(1H,br s,H-12),5.38(1H,d,J=7.7 Hz,glc-H-1″),4.82(1H,d,J=6.6 Hz,xyl-H-1′),3.60(1H,s,H-18),3.23(1H,dd,J=11.7,4.4 Hz,H-3),1.62(3H,s,H3-27),1.25(3H,s,H3-23),1.14(3H,s,H3-29),1.13(3H,s,H3-26),1.10(3H,s,H3-24),0.98(3H,s,H3-30),0.90(3H,s,H3-25);13C-NMR(pyridine-d5,100 MHz)数据见表2。以上波谱数据与文献[18]报道的数据对比,故鉴定化合物2为rotundinoside A。
化合物3 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 425,1 651 cm-1;ESI-MS m/z 805 [M+Na]+,分子式为C41H66O14;1H-NMR(pyridine-d5,500 MHz)δ:6.39(1H,d,J=8.0 Hz,glc-H-1″),5.51(1H,br s,H-12),5.07(1H,d,J=7.5 Hz,xyl-H-1′),4.33(1H,m,H-3),3.53(1H,br s,H-18),1.58(3H,s,H3-27),1.18(3H,s,H3-29),1.15(3H,s,H3-26),1.00(3H,s,H3-25),0.99(3H,s,H3-30),0.97(3H,s,H3-24);13C-NMR(pyridine-d5,125 MHz)数据见表2。以上波谱数据与文献[19]报道的数据对比,故鉴定化合物3为oblonganoside M。
化合物4 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 312,1 732,1 645 cm-1;ESI-MS m/z 951 [M+Na]+,分子式为C47H76O18;1H-NMR(pyridine-d5,400 MHz)δ:6.27(1H,d,J=7.3 Hz,glc-H-1),5.47(1H,br s,H-12),5.13(1H,d,J=7.9 Hz,glc-H-1″),4.89(1H,d,J=5.8 Hz,ara-H-1′),3.13(1H,s,H-18),3.17(1H,dd,J=11.8,4.6 Hz,H-3),1.66(3H,s,H3-27),1.37(3H,s,H3-29),1.16(3H,s,H3-23),1.14(3H,s,H3-26),1.01(3H,s,H3-24),0.95(3H,d,J=5.5 Hz,H3-30),0.87(3H,s,H3-25);13C-NMR(pyridine-d5,100 MHz)数据见表2。以上波谱数据与文献[20] 报道的数据对比,故鉴定化合物4为3-O-β-D-glucopyranosyl-(1→2)-α-L-arabinopyranosyl 3β,19α-dihydroxy-20α-urs-12-en-28-oic acid 28-O-β-D-glucopyranosyl ester。
化合物5 无定形粉末,Liebermann-Burchard反应和Molish 反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 412,1 679 cm-1;ESI-MS m/z 935 [M+Na]+,分子式为C47H76O17;1H-NMR(pyridine-d5,400 MHz)δ:6.40(1H,br s,rha-H-1),5.80(1H,d,J=7.4 Hz,glc-H-1″),5.55(1H,br s,H-12),4.89(1H,d,J=7.0 Hz,xyl-H-1′),3.29(1H,s,H-18),1.78(3H,d,J=6.1 Hz,rha-H-6),1.75(3H,s,H3-27),1.43(3H,s,H3-29),1.32(3H,s,H3-23),1.12(3H,d,J=7.1 Hz,H3-30),1.07(3H,s,H3-26),1.06(3H,s,H3-24),0.84(3H,s,H3-25);13C-NMR(pyridine-d5,100 MHz)數据见表2。以上波谱数据与文献[21]报道的数据对比,故鉴定化合物5为毛冬青皂苷B2(ilexsaponin B2)。
化合物6 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 371,1 732,1 681 cm-1;ESI-MS m/z 951 [M+Na]+,分子式为C47H76O18;1H NMR(pyridine-d5,400 MHz)δ:6.29(1H,d,J=8.0 Hz,glc-H-1),5.54(1H,br s,H-12),5.16(1H,d,J=7.7 Hz,glc-H-1″),4.94(1H,d,J=5.8 Hz,ara-H-1′),3.18(1H,dd,J=11.6,4.5 Hz,H-3),2.93(1H,s,H-18),1.67(3H,s,H3-27),1.39(3H,s,H3-29),1.20(3H,s,H3-23),1.18(3H,s,H3-26),1.06(3H,d,J=6.3 Hz,H3-30),1.04(3H,s,H3-24),0.90(3H,s,H3-25);13C-NMR(pyridine-d5,100 MHz)数据见表2。以上波谱数据与文献[22] 报道的数据对比,故鉴定化合物6为ilexside II。
化合物7 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 400,1 732,1 600 cm-1;ESI-MS m/z 951 [M+Na]+,分子式为C47H76O18;1H-NMR(pyridine-d5,400 MHz)δ:6.28(1H,d,J=8.1 Hz,glc-H-1),5.54(1H,br s,H-12),5.36(1H,d,J=7.7 Hz,glc-H-1″),4.90(1H,d,J=6.7 Hz,xyl-H-1′),3.23(1H,dd,J=11.7,4.5 Hz,H-3),2.92(1H,s,H-18),1.63(3H,s,H3-27),1.39(3H,s,H3-29),1.24(3H,s,H3-23),1.18(3H,s,H3-26),1.10(3H,s,H3-24),1.06(3H,d,J=6.7 Hz,H3-30),0.91(3H,s,H3-25);13C-NMR(pyridine-d5,100 MHz)数据见表2。以上波谱数据与文献[18] 报道的数据对比,故鉴定化合物7为rotundinoside B。
化合物8 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 418,1 729,1 671 cm-1;ESI-MS m/z 833 [M+Na]+,分子式为C42H66O15;1H-NMR(pyridine-d5,400 MHz)δ:6.14(1H,d,J=8.1 Hz,glcUA-H-1″),5.44(1H,br s,H-12),4.94(1H,d,J=7.7 Hz,glc-H-1′),3.29(1H,dd,J=11.7,4.6 Hz,H-3),2.80(1H,s,H-18),1.61(3H,s,H3-27),1.32(3H,s,H3-29),1.21(3H,s,H3-23),1.04(3H,s,H3-26),1.00(3H,d,J=6.3 Hz,H3-30),0.90(3H,s,H3-24),0.78(3H,s,H-25);13C-NMR(pyridine-d5,100 MHz)數据见表2。以上波谱数据与文献[17] 报道的数据对比,故鉴定化合物8为ilekudinoside B。
化合物9 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 411,1 685 cm-1;ESI-MS m/z 1 097 [M+Na]+,分子式为C53H86O22;1H-NMR(pyridine-d5,400 MHz)δ:6.39(1H,br s,rha-H-1),6.29(1H,d,J=7.9 Hz,glc-H-1″″),5.80(1H,d,J=7.3 Hz,glc-H-1″),5.53(1H,br s,H-12),4.89(1H,d,J=7.0 Hz,xyl-H-1′),3.27(1H,dd,J=11.6,4.5 Hz,H-3),2.92(1H,s,H-18),1.77(3H,d,J=6.4 Hz,rha-H-6),1.69(3H,s,H3-27),1.38(3H,s,H3-29),1.33(3H,s,H3-23),1.17(3H,s,H3-26),1.09(3H,s,H3-24),1.06(3H,d,J=6.6 Hz,H3-30),0.88(3H,s,H3-25);13C-NMR(pyridine-d5,100 MHz)数据见表2。以上波谱数据与文献[23] 报道的数据对比,故鉴定化合物9为ilexpublesnin E。
化合物10 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 412,1 650 cm-1;ESI-MS m/z 805 [M+Na]+,分子式为C41H66O14;1H-NMR(pyridine-d5,500 MHz)δ:6.30(1H,d,J=8.1 Hz,glc-H-1″),5.55(1H,br s,H-12),4.98(1H,d,J=7.1 Hz,ara-H-1′),4.29(1H,m,H-3),2.93(1H,s,H-18),1.64(3H,s,H3-27),1.38(3H,s,H3-29),1.22(3H,s,H3-26),1.06(3H,d,J=7.5 Hz,H3-30),1.01(3H,s,H3-25),0.94(3H,s,H3-24);13C-NMR(pyridine-d5,125 MHz)数据见表2。以上波谱数据与文献[24]报道的数据对比,故鉴定化合物10为ilekudinoside D。
化合物11 无定形粉末,Liebermann-Burchard反应和Molish反应均呈阳性,香草醛-浓硫酸反应(TLC)显紫红色,提示为三萜皂苷类化合物;IR(KBr) νmax 3 414,1 690 cm-1;ESI-MS m/z 663 [M-H]-,分子式为C36H56O11;1H-NMR(pyridine-d5,500 MHz)δ:5.57(1H,br s,H-12),5.26(1H,d,J=7.8 Hz,glcUA-H-1′),4.34(1H,m,H-3),3.00(1H,s,H-18),1.69(3H,s,H3-27),1.42(3H,s,H3-29),1.11(3H,d,J=6.5 Hz,H3-30),1.09(3H,s,H3-26),0.95(3H,s,H3-24),0.91(3H,s,H3-25);13C-NMR(pyridine-d5,125 MHz)数据见表2。以上波谱数据与文献[25] 报道的数据对比,故鉴定化合物11为ilexpernoside D。
[参考文献]
[1] 中国科学院中国植物志编辑委员会.中国植物志.第45卷[M].北京:科学出版社,1999:258.
[2] 祁银德,任玉凤. 岭南地区习用中药岗梅研究进展[J]. 亚太传统医药,2009,5(3):29.
[3] 辛晓芳,林爱华,梅全喜,等. 广东地产药材岗梅的药理作用及临床应用研究进展[J]. 时珍国医国药,2015,26(1):196.
[4] 杜冰曌,杨鑫瑶,冯晓,等. 岗梅的化学成分和药理作用研究进展[J]. 中国中药杂志,2017,42(1):12.
[5] Zhou M, Xu M, Ma X X, et al. Antiviral triterpenoid saponins from the roots of Ilex asprella [J].
Planta Med, 2012, 78(15): 1702.
[6] Lei Y, Shi S P, Song Y L, et al. Triterpene saponins from the roots of Ilex asprella [J]. Chem Biodivers, 2014, 11(5): 767.
[7] Jiang K, Bai J Q, Chang J, et al. Three new 24-nortriterpenoids from the roots of Ilex asprella [J]. Helv Chim Acta, 2014, 97(1): 64.
[8] Wang C, Li J, Tu P. Chemical constituents from the leaves of Ilex asprella (Hook. et Arn.) Champ. Ex Benth [J]. J Chin Pharm Sci, 2014, 23(11): 778.
[9] Zhang Z X, Fu Q, Zheng K Y. Three new triterpene glycosides from Ilex asprella [J]. J Asian Nat Prod Res, 2013, 15(5): 453.
[10] Wen Q, Lu Y, Chao Z, et al. Anticomplement triterpenoids from the roots of Ilex asprella [J]. Bioorg Med Chem Lett, 2017, 27: 880.
[11] Wang L, Cai Y, Zhang X Q, et al. New triterpenoid glycosides from the roots of Ilex asprella [J]. Carbohyd Res, 2012, 349: 39.
[12] 蔡艷,张庆文,李旨君,等. 岗梅根化学成分的研究[J]. 中草药,2010,41(9):1426.
[13] 黄锦茶,陈丰连,陈海明,等. 岗梅根的化学成分研究[J]. 中草药,2012,43(8):639.
[14] 邓桂球,彭敏桦,沈雅婕,等. 岗梅根中酚类化学成分研究[J]. 广东药学院学报,2015,31(3):321.
[15] Tanaka T, Nakashima T, Ueda T, et al. Facile discrimination of aldose enantiomers by reversed-phase HPLC [J]. Chem Pharm Bull, 2007, 55(6): 899.
[16] Yoshikawa M, Shimada H, Morikawa T, et al. Medicinal Foodstuffs. VII. On the saponin constituents with glucose and alcohol absorption-inhibitory activity from a food garnish"Tonburi", the fruit of Japanese Kochia Scoparia (L.) Schrad.: structures of scoparianosides A, B, and C [J]. Chem Pharm Bull, 1997, 45(8): 1300.
[17] Nishimura K, Miyase T, Noguchi H. Triterpenoid saponins from Ilex kudincha [J]. J Nat Prod, 1999, 62(8): 1128.
[18] Fan Z, Zhou L, Xiong T, et al. Antiplatelet aggregation triterpene saponins from the barks of Ilex rotunda [J]. Fitoterapia, 2015, 101: 19.
[19] Wu Z J, Ouyang M A, Wang C Z, et al. Anti-tobacco mosaic virus (TMV) triterpenoid saponins from the leaves of Ilex oblonga [J]. J Agric Food Chem, 2007, 55(5): 1712.
[20] Li S, Zhao J, Liu Y, et al. New triterpenoid saponins from Ilex cornuta and their protective effects against H2O2-induced myocardial cell injury [J]. J Agric Food Chem, 2014, 62(2): 488.
[21] Hidaka K, Ito M, Matsuda Y, et al. New triterpene saponins from Ilex pubescens [J]. Chem Pharm Bull, 1987, 35(2): 524.
[22] Nakanishi T, Terai H, Nasu M, et al. Two triterpenoid glycosides from leaves of Ilex cornuta [J]. Phytochemistry, 1982, 21(6): 1373.
[23] Zhou Y, Chai X Y, Zeng K W, et al. Ilexpublesnins C-M, eleven new triterpene saponins from the roots of Ilex pubescens [J]. Plant Med, 2013, 79(1): 70.
[24] Keiichi N, Toshio M, Hiroshi N. Triterpenoid Saponins from Ilex kudincha[J]. J Nat Prod, 1999, 62(8): 1128.
[25] Xie G B, Zheng J, Tu P F, et al. Triterpene saponins from the leaves of Ilex pernyi [J]. Helv Chim Acta, 2008, 91: 1630.
[責任编辑 丁广治]
