掌叶半夏凝集素蛋白刺激巨噬细胞的致炎作用研究
2017-07-31毛善虎郁红礼吴皓王卫李晓楠
毛善虎+郁红礼+吴皓+王卫+李晓楠

[摘要] 为探索掌叶半夏凝集素蛋白(PPL)刺激巨噬细胞诱导炎症的作用与炎症小体NLRP3的相关性。采用凝胶色谱纯化掌叶半夏凝集素蛋白并采用SDS-PAGE凝胶电泳分析其纯度;采用ELISA法以IL-1β为指标考察PPL刺激巨噬细胞释放炎症因子的影响;采用荧光探针DCFH-DA荧光酶标仪检测PPL刺激巨噬细胞后活性氧ROS的水平变化;以ROS抑制剂NAC(N-乙酰半胱氨酸)预处理巨噬细胞,考察PPL刺激ROS的过量生成与炎症因子IL-1β大量释放的相关性;采用Western Blot方法检测PPL对炎症小体生成相关的Caspase-1 p20,NLRP3,TXNIP,ASC等蛋白的表达水平变化。结果显示分离纯化的PPL达到电泳纯;PPL刺激巨噬细胞后引起ROS过量释放,引起强烈的氧化应激反应,胞内炎症因子IL-1β含量显著升高;NAC可抑制PPL导致的ROS过量生成,且IL-1β释放也显著降低。同时PPL可诱导胞内Caspase-1 p20,NLRP3,ASC蛋白表达升高,TXNIP表达显著降低。研究结果表明,PPL刺激巨噬细胞可导致强烈的氧化应激反应,同时能够激活炎症小体NLRP3,导致IL-1β大量生成释放,即PPL能够通过ROS-TXNIP-NLRP3-IL-1β信号通路促进IL-1β的成熟和分泌,导致炎症级联反应。
[关键词] 掌叶半夏;凝集素;炎症;ROS;NLRP3;IL-1β;NAC
[Abstract] To investigate the mechanism of lectin from Pinellia pedatisecta(PPL) on macrophage-induced inflammation and its association with inflammatory corpuscles NLRP3. Lectin from P. pedatisecta was isolated and purified by gel chromatography, and its purity was analyzed by using SDS-PAGE gel electrophoresis. ELISA was used to investigate the effect of PPL on inflammatory cytokines released by macrophages, with IL-1β as indicators;and fluorescence probe DCFH-DA fluorometer was used to determine changes in active oxygen ROS of macrophages after application of lectin from P. pedatisecta.RAW264.7 cells were pre-treated with ROS inhibitor N-acetylcysteine (NAC) to investigate the effect on ROS and the release of inflammatory factor IL-1β from macrophages to research the relationship between them. The protein levels of NLRP3, Caspase-1 p20, ASC and TXNIP were determined by Western blot.The results showed that isolated and purified PPL could reach electrophoretic purity;PPL stimulated macrophages and induced the excessive release of ROS, leading to strong oxidative stress reaction, and the levels of intracellular inflammatory factorsIL-1β were significantly increased. NAC could inhibit PPL-induced ROS excessive production and significantly reduce the release of IL-1β. In addition, PPL could induce the increase in protein expression levels of Caspase-1 p20, NLRP3 and ASC, and significantly reduce TXNIP expression. The results showed that PPL could cause a strong oxidative stress response by stimulating macrophages, activate inflammatory corpuscles NLRP3, and result in large amount of IL-1β release. That is, PPL could lead to inflammatory cascade reaction by promoting the maturation and secretion of IL-1β through ROS-TXNIP-NLRP3-IL-1β signaling pathway.
[Key words] Pinellia pedatisecta;lectin;inflammation;ROS;NLRP3;IL-1β;NAC
掌葉半夏为天南星科植物掌叶半夏Pinellia pedatisecta Schott.的干燥块茎[1],为有毒中药,对口腔、咽喉等具有强烈的刺激性,甚者可致人死亡[2]。本课题组前期研究发现,凝集素蛋白为其致炎的主要成分[3],且其诱导炎症的作用与巨噬细胞介导密切相关[4]。
前期研究发现,天南星科凝集素蛋白能够刺激巨噬细胞诱导胞内ROS(reactive oxygen species)大量生成与IL-1β(interleukin-1β)过量释放[5]。文献研究发现ROS是调控 NLRP3 (NACHT,LRR and PYD domains-containing protein 3)炎性小体活化的关键信号分子[6]。NLRP3的活化可促进白介素1β的剪切成熟,IL-1β进一步与细胞受体结合,促进炎症发生发展[7]。故PPL促进ROS的水平变化,可能进一步激活炎症小体NLRP3,活化炎症因子IL-1β,从而诱导强烈的炎症刺激。本研究在细胞分子水平对天南星科有毒中药掌叶半夏的致炎作用与ROS水平及炎性小体活化相关性进行深入研究,探索其产生刺激性炎症毒性作用的机制,为天南星科有毒中药炮制方法的改进与创新提供理论支持。
1 材料
1.1 药材
掌叶半夏鲜品药材,购自河南省禹州市,经江苏省食品药品检验所胡浩彬主任药师鉴定为天南星科植物掌叶半夏P. pedatisecta的新鲜块茎,冷藏备用。
1.2 细胞株
RAW264.7细胞株,购自中国科学院上海细胞库。
1.3 试剂
乙醇(色譜纯,国药集团化学试剂有限公司);硫酸铵(分析纯,国药集团化学试剂有限公司);填料:Phenyl SepharoseTMHigh Performance、Q SepharoseTMHigh Performance(美国GE公司);胎牛血清(美国WISENT 公司);RPMI 1640培养液、Phosphate Buffered Saline(PBS)(美国Hyclone公司);胰蛋白酶(美国Promega公司);LPS(美国SIGMA公司);活性氧ROS检测试剂盒(南京建成生物技术有限公司);IL-1β ELISA试剂盒(南京翼飞雪生物科技有限公司);BCA蛋白浓度测定试剂盒(增强型)(碧云天生物技术研究所);SDS-PAGE蛋白上样缓冲液(5x)(碧云天生物技术研究所);NLRP3(武汉BOSTER公司)、Caspase-1 p20(美国SANTA公司)、ASC(美国CST公司)、TXNIP(美国CST公司)、GAPDH、Goat Anti-Rabbit lgG(H+L)HRP、Goat Anti-Mouse lgG(H+L)HRP(南京翼飞雪生物科技有限公司)、TEMED(美国Biosharp公司);BlueRAYPrestained Protein Ladder 10-170kD(美国Thermo公司);Immobilon-P Transfer Membranes,Immobilon Western Chemiluminescent HRP Substrate(美国Millipore公司);Tris-HCl,Tween-20(南京翼飞雪生物科技有限公司),其他试剂均为分析纯。
1.4 仪器
BP211D电子天平(德国Sartorius公司);LDZ-2(Y)低速离心机(北京京立有限公司);AKTA Purifier 900D(瑞典GE公司);Labconco冷冻干燥仪(美国Labconco公司);LEICA MPS 60 DM显微镜系统(德国莱卡公司);高速冷冻离心机(德国Sigma公司);CO2细胞培养箱(德国Memmer公司);倒置荧光电子显微镜(日本尼康公司);荧光酶标仪(美国Bio-tek公司);垂直凝胶电泳仪、湿转装置、凝胶成像系统(美国BIO-RAD公司)。
2 方法
2.1 PPL的提取纯化及SDS-PAGE分析
2.1.1 PPL的提取纯化 取鲜品掌叶半夏适量,去皮切碎后匀浆;离心(8 000 r·min-1,30 min)后取上清液,计算体积,缓慢加饱和硫酸铵,磁力搅拌,至硫酸铵饱和度为45%;再离心(8 000 r·min-1,15 min),取沉淀,得到PPL粗提产物;加入0.6 mol·L-1的硫酸铵溶液至完全溶解离心取上清,重复3~4次。疏水色谱(流速2 mL·min-1,每次上样量5~10 mL,洗脱剂:60 min内0.6~0 mol·L-1的硫酸铵溶液)后收集主峰;再经离子交换色谱(洗脱剂:60 min内0~1 mol·L-1的氯化钠溶液,流速为2 mL·min-1)后收集主峰。透析后冻干,即得纯化的PPL。
2.1.2 PPL的电泳分析 使用15%的凝胶配方配制SDS-PAGE凝胶。上样时蛋白Marker上样8 μL,PPL上样量为30 μg,根据BCA测定浓度调整上样体积;恒压100 V至Marker条带基本分离为止。
2.2 PPL对巨噬细胞ROS生成的影响
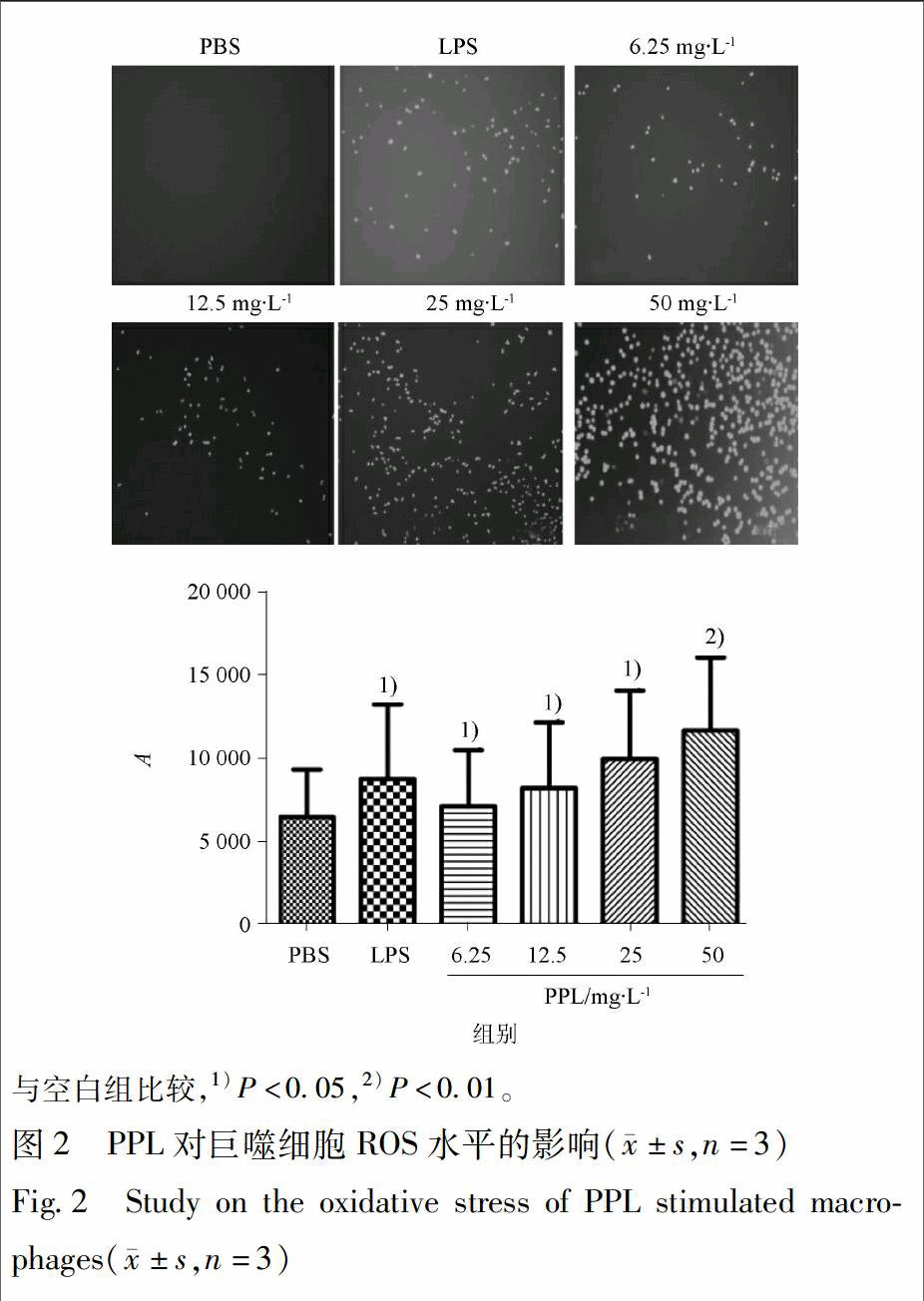
RAW264.7细胞以1×104个/mL的密度接种于48孔培养板中,PPL用PBS配成溶液,ROS荧光探针使用RPMI 1640培养液稀释3 000倍。细胞分为6组,每组设置3个复孔,其中4组分别给予相同体积不同浓度的PPL溶液(使其终浓度为6.25,12.5,25,50 mg·L-1),1组给予LPS 溶液(质量浓度为5 mg·L-1)作为阳性对照组组,另1组给予相同体积的PBS缓冲液作为空白组。轻轻晃动混匀后于37 ℃,5%CO2环境中孵育1 h,弃上清;加入ROS荧光探针孵育30 min,100放大倍数下观察ROS的生成情况并拍摄照片。随机使用荧光酶标仪(激发波长500 nm,发射波长525 nm)定量检测探针发光量,并扣除空白孔吸收本底值。
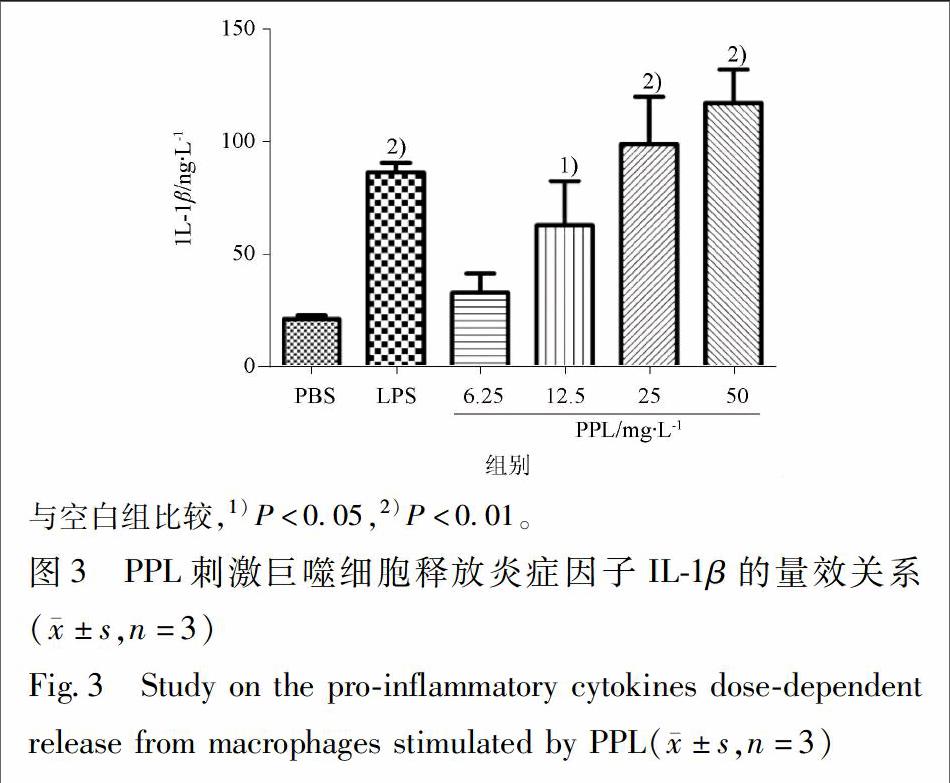
2.3 PPL对巨噬细胞IL-1β释放的影响
巨噬细胞RAW264.7以1×106个/mL的密度接种于48孔培养板中,分组、给药同2.2项。收集细胞上清液,按照ELISA试剂盒操作方法对培养液中炎症因子IL-1β的水平进行检测。
2.4 PPL刺激巨噬细胞后胞内ROS水平与IL-1β释放的相关性研究
2.4.1 NAC对PPL刺激巨噬细胞后细胞内ROS水平的影响 细胞培养、处理及分组同2.2项。预先用不同浓度(浓度分别为0.1,0.5,2.5,12.5 mmol·L-1)的ROS清除剂NAC预处理0.5 h后,每组加入相同体积相同浓度的PPL(50 mg·L-1),其余操作同2.2项。
2.4.2 NAC对PPL刺激巨噬细胞后细胞内IL-1β释放的影响 细胞培养、处理及分组同2.3项。预先用不同浓度(浓度分别为0.1,0.5,2.5,12.5 mmol·L-1)的ROS清除剂NAC预处理0.5 h后,每组加入相同体积相同浓度的PPL(50 mg·L-1),其余操作同2.3项。
2.5 Western blot 法测定PPL刺激后巨噬细胞内Caspase-1 p20,NLRP3,ASC,TXNIP蛋白水平表达变化
2.5.1 分组 分组同2.2项。
2.5.2 提取细胞总蛋白 PPL刺激巨噬细胞1 h后,弃上清,PBS溶液清洗2次,刮下细胞,1 200 r·min-1离心5~6 min,加入相同体积裂解液(RIPA-PMSF 100∶1),吹打均匀,4 ℃冰上振荡1 h,16 000×g离心10 min以上,取上清液即得。经BCA蛋白含量测定,调节上样体积保证各组上样量一致。
2.5.3 蛋白样品的制备 取40 μL总蛋白,加入10 μL SDS-PAGE蛋白上样缓冲液(5×),100 ℃煮沸10 min,-20 ℃保存备用。
2.5.4 电泳 同2.2项下操作,样品按各自上样量分别上样。
2.5.5 转膜与免疫杂交 转膜:采用湿转法转膜(恒压100 V,60 min)。封闭:5%脱脂奶粉溶液中封闭2 h。免疫杂交:在适当的位置将PVDF膜剪开,将目标蛋白和内参GAPDH的分开,并分别进行免疫杂交。孵一抗:用5%BSA溶液对所需抗体进行稀释,将一抗、内参GAPDH一抗以及羊抗兔二抗分别稀释成1 000,1 500,7 500倍;含有目标蛋白的PVDF膜分别加入目标蛋白一抗和内参GAPDH一抗,4 ℃冰箱孵育过夜;PVDF膜使用TBST清洗3次,每次10 min。孵二抗:分别加入二抗,置于摇床,室温孵育2 h。PVDF膜使用TBST清洗3次,每次10 min。
2.5.6 程序曝光并计算灰度值 将曝光显色剂按比例配制,摇匀备用。将PVDF膜平铺于洁净皿中,加入曝光液采用凝胶成像系统进行程序曝光。采用Quality one软件对曝光条带进行分析,扣除背景,测定灰度值,并计算目的蛋白/内参的比值。
2.6 统计学处理
采用统计软件 SPSS 16.0 进行数据处理,数据均以±s表示,组间比较采用两独立样本t检验。
3 结果
3.1 PPL的定量及鉴定
PPL經BCA试剂盒检测,蛋白纯度为75.61%;再经SDS-PAGE凝胶电泳检测,PPL达到电泳纯,实验结果见图1。
3.2 PPL对巨噬细胞ROS释放的影响
PPL对巨噬细胞ROS释放的影响见图2。结果显示,PPL(质量浓度为6.25,12.5,25,50 mg·L-1)刺激巨噬细胞1 h后,与空白组比较,ROS的表达明显增强(P<0.01),且呈一定的剂量依赖性;结果表明,PPL刺激巨噬细胞可以引起强烈的氧化应激反应,释放大量的ROS。
3.3 PPL对巨噬细胞释放IL-1β的影响
PPL对巨噬细胞释放IL-1β的影响见图3。结果显示不同浓度的PPL(质量浓度为6.25,12.5,25,50 mg·L-1)刺激巨噬细胞1 h后,与空白组相比,IL-1β的含量显著增加(P<0.01),并呈剂量依赖性。
3.4 NAC对PPL刺激巨噬细胞后ROS生成与IL-1β释放水平的影响
3.4.1 NAC预处理后PPL刺激巨噬细胞引起胞内ROS水平的变化 不同浓度的NAC(浓度为0.1,0.5,2.5,12.5 mmol·L-1)对PPL刺激巨噬细胞后细胞内ROS的影响见图4。结果显示,NAC中高剂量组能够显著抑制PPL刺激巨噬细胞引起的细胞内活性氧ROS的大量生成(P<0.01)。
3.4.2 NAC预处理后PPL刺激巨噬细胞引起胞内IL-1β水平的变化 NAC预处理后PPL刺激巨噬细胞引起胞内IL-1β水平的变化见图5。结果显示,NAC中高剂量组能够显著抑制PPL刺激巨噬细胞引起的炎症因子IL-1β的大量释放(P<0.01)。
3.5 PPL刺激巨噬细胞胞内NLRP3,Caspase-1 p20,ASC,TXNIP等蛋白水平表达的变化
PPL(质量浓度为6.25,12.5,25,50 mg·L-1)刺激巨噬细胞后,对胞内NLRP3,Caspase-1 p20,ASC,TXNIP等蛋白水平表达的影响见图6。不同浓度的PPL刺激巨噬细胞1 h后,与空白组相比,Caspase-1 p20,NLRP3及表达上升,ASC表达升高,均呈剂量依赖性;TXNIP表达下降,中高剂量有显著性差异(P<0.01)。结果表明,PPL刺激巨噬细胞1 h后,细胞内Caspase-1被活化,表明NLRP3炎性小体被激活。
4 讨论
掌叶半夏为临床有毒中药,误服可致人体强烈的炎症毒性反应,故临床多用其炮制品。前期实验研究发现,PPL刺激巨噬细胞引起ROS的大量生成与IL-1β的大量释放。文献研究发现二者与NLRP3存在相关性。NLRP3是一种存在于细胞质中的蛋白复合物,依赖 Caspase-1的分子平台促进IL-1β的成熟和释放,并引起炎症反应[8]。ROS是调控NLRP3炎性小体活化的关键信号。当ROS增加时,硫氧还蛋白(TRX)充当氧化物的清道夫,发生自身氧化,而硫氧还蛋白结合蛋白(TXNIP)与氧化的TRX分离后结合至NLRP3 上,从而募集ASC(apoptosis-associated speck-like protein containing a caspase recruitment domain)和胱天蛋白酶(caspase-1)前体完成炎性小体的组装活化,促进caspase-1活化,进而促进炎症因子白介素1β(Interleukin-1β)的剪切成熟[9-11]。IL-1β进一步与细胞IL-1受体结合,导致炎症级联反应,促进炎症发生发展。
本文研究发现,不同浓度的PPL刺激巨噬细胞能够引起巨噬细胞生成过量的ROS和释放大量的IL-1β;不同浓度的ROS抑制剂NAC预处理巨噬细胞后,PPL刺激导致的ROS和IL-1β过量生成均显著下降,表明NAC抑制PPL导致的ROS过量生成,进一步会抑制IL-1β的释放,即PPL诱导的炎症因子IL-1β大量释放与ROS生成相关。研究同时发现,不同浓度的PPL刺激巨噬细胞后胞内与炎症小体相关的蛋白Caspase-1 p20,NLRP3,ASC蛋白表达升高、TXNIP表达显著降低。NLRP3炎性小体相关的蛋白表达变化及IL-1β的释放降低,表明PPL可激活炎症小体,且ROS过量生成可能参与了PPL激活NLRP3炎症小体的过程。
上述研究表明,掌叶半夏块茎中毒针晶引起强烈的炎症刺激,除了与其所含的针晶引起的物理损伤有关,还与其所含的凝集素蛋白激活ROS-TXNIP-NLRP3-IL-1β信号通路,促进IL-1β的成熟和分泌,引发炎症级联反应,导致强烈的炎症刺激有关。
本论文的研究结果发现了PPL致炎与NLRP3炎症小体信号通路的相关性,進一步阐明了天南星科有毒中药掌叶半夏引起炎症毒性的机制,将为天南星科有毒中药炮制方法的改进与创新提供一定的借鉴,为有毒中药临床安全使用提供依据。
[参考文献]
[1] 神农本草经[M].孙星衍,孙冯翼辑.北京:商务印书馆,1959:101.
[2] 吴皓,钟凌云.天南星科有毒中药的刺激性作用比较研究[J].中国中药杂志,2008,33(4):380.
[3] 郁红礼,朱法根,吴皓,等.半夏及掌叶半夏毒针晶中共性毒蛋白的研究[J].中华中医药杂志,2011,26(5):1037.
[4] 潘耀宗,郁红礼,吴皓,等.掌叶半夏毒针晶及凝集素蛋白的致炎作用与巨噬细胞的相关性研究[J].中华中医药杂志,2014(5):1397.
[5] 郁红礼,毛善虎,赵腾斐,等.姜辣素拮抗半夏凝集素蛋白刺激巨噬细胞所致炎症因子TNF-α释放增加、ROS过量生成及RIP3表达增高[J]. 中国中药杂志,2015,40(18):3630.
[6] Dostert C, Pétrilli V, Van Bruggen R, et al. Innate immune activation through Nalp3 inflamma -some sensing of asbestos and silica[J]. Science, 2008, 320(5876): 674.
[7] Dinarellot C A.Interleukin-1[J]. Cytokine Grow Fact Rev,1997,8(4):253.
[8] Latz E.The inflammasomes: mechanisms of activation and function[J]. Curr Opin Immunol,2010,22(1):28.
[9] Pétrilli V, Dostert C, Muruve D A,et al. The inflammasome: a danger sensing complex triggering innate immunity[J].Curr Opin Immunol, 2007,19(6): 615.
[10] Wang X,Jiang W,Yan Y,et al. RNA viruses promote activation of the NLRP3 inflammasome through a RIP1-RIP3-DRP1 signaling pathway[J].Nat Immunol,2014,15(12): 1126.
[11] Rapsinski G J,Wynosky-Dolfi M A,Oppong G O,et al. Toll-like receptor 2 and NLRP3 cooperate to recognize a functional bacterial amyloid,curli[J]. Infect Immun,2015, 83(2):693.
[责任编辑 孔晶晶]
