金银花配方颗粒的位点特异性PCR鉴别研究
2017-07-31蒋超屠李婵袁媛黄璐琦高伟金艳
蒋超+屠李婵+袁媛+黄璐琦+高伟+金艳

[摘要] 中药配方颗粒已失去所有形态学辨识特征,传统鉴定方法无法有效鉴定其真伪。该文使用位点特异性PCR鉴别技术,根据金银花trnL-trnF的一个SNP位点设计特异性鉴别引物,对金银花基原植物及配方颗粒进行鉴定。经过优化DNA 提取方法后,药材与配方颗粒均成功提取到DNA,金银花基原植物及配方颗粒均可扩增获得约110 bp的条带,混伪品无条带。且BLAST结果比对证明PCR产物序列为金银花trnL-trnF序列。該文研究结果表明,DNA分子鉴定方法可弥补性状、显微鉴别局限性,对中药配方颗粒真实性进行快速准确的鉴定,为其生产、流通、用药安全提供科学依据和保障。
[关键词] 金银花;配方颗粒;位点特异性PCR;分子鉴定
[Abstract] Traditional authentication method is hard to identify herb′s authenticity of traditional Chinese medicine(TCM) formula granules because they have lost all their morphological characteristics. In this study, a new allele-specific PCR method was established for identifying the authentication of Jinyinhua formula granule (made from Lonicerae Japonicae Flos) based on an SNP site in trnL-trnF fragment. Genomic DNA was successfully extracted from Lonicerae Japonicae Flos and its formula granules by using an improved spin column method and then PCR was performed with the designed primer. Approximately 110 bp specific bands was obtained only in the authentic Lonicerae Japonicae Flos and its formula granules, while no bands were found in fake mixed products. In addition, the PCR product sequence was proved from Lonicerae Japonicae Flos trnL-trnF sequence by using BLAST method. Therefore, DNA molecular authentication method could make up the limitations of character identification method and microscopic identification, and quickly identify herb′s authenticity of TCM formula granules, with enormous potential for market supervision and quality control.
[Key words] Lonicerae Japonicae Flos;formula granule;allele-specific PCR;molecular authentication
中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成,在中医临床配方后,供患者冲服使用的粉状或颗粒状产品。配方颗粒具有携带方便、服用简单、易于调制、适合工业化生产的特点,同时实现了中药同批内产品物质基础的均质性要求,解决了中药长期以来质量不均的问题[1]。自2001年7月,国家食品药品监督管理总局制定了《中药配方颗粒管理暂行规定》规定配方颗粒纳入中药饮片管理范畴以来,中药配方颗粒快速发展,经过10余年的试点,中药配方颗粒已超过600多品种,并广泛应用于600多家医院中[2]。
然而,由于中药配方颗粒已完全失去了传统中药饮片的鉴别特征,其鉴别与监管已成为制约配方颗粒产业的瓶颈问题之一。由于生产、控制工艺的不同,中药配方颗粒一直处于“试点”阶段,尚缺乏统一可控的质量标准,在生产、流通、使用环节上技术监管难度较大[3],导致中药配方颗粒存在出现以伪充真、以次充好现象的风险,影响配方颗粒的临床功效。
作为质量控制的上游环节,配方颗粒的基原鉴定直接决定了其质量与疗效。由于配方颗粒系经提取加工形成的颗粒状制剂,已失去所有形态学辨识特征,无法通过性状和显微检测的方式进行鉴别;而在理化鉴别方面目前配方颗粒一般只通过薄层色谱和高效液相色谱进行鉴别,但使用个别指标成分进行定性分析对于近似种、尤其是同属近缘物种的鉴定具有很大困难;且对一些配方颗粒品种,因尚无专属性指标性成分而难以建立化学鉴定方法。因此,目前急需建立准确性高、稳定性好的方法用于配方颗粒原料物种的鉴定。
DNA分子鉴定是指通过比较药材、饮片的DNA差异来鉴别药材、饮片的方法。分子鉴定具有稳定、准确、特异性好、不受生物发展阶段与储藏加工影响等特点,受到了国内外研究者广泛关注,已建立多种中药材及中药饮片的分子鉴定方法[4-11],甚至也有对中成药乃至其汤剂进行分子鉴定的报道[12-16]。其中蕲蛇、乌梢蛇饮片分子鉴别方法已经作为国家标准率先收录于2010年版《中国药典》中[17]。2016年8月国家药典委员会发布的《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》也明确提出“对于来源复杂的原料药材,必要时采用DNA分子鉴别技术进行物种真伪鉴别”。
选择合适的分子标记,建立特异性DNA分子鉴定手段,可解决配方颗粒物种基原鉴别的难题,有助于建立统一可控的配方颗粒质量标准,规范其生产、流通、用药过程的监管,为产品追溯及仲裁提供依据。金银花配方颗粒(Jinyinhua formula granule)由金银花药材水提后加工而成,是临床最为常用的配方颗粒之一。本研究以金银花配方颗粒为例,运用位点特异性PCR技术对金银花的基原植物及配方颗粒进行鉴定,分析DNA分子鑒定技术对配方颗粒基原鉴定的适用性,以期为中药配方颗粒质量控制与标准制定研究提供依据,为配方颗粒生产、流通、用药安全提供保障。
1 材料
1.1 植物材料
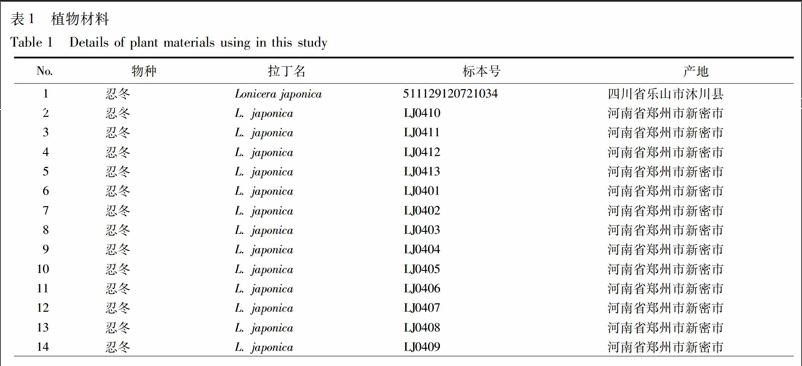
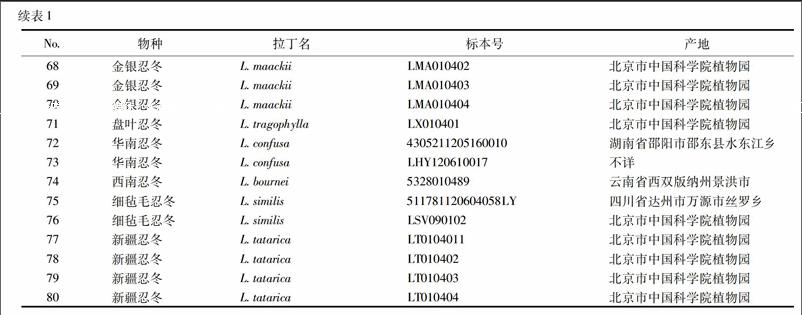
依托第四次全国中药资源普查标本库,收集金银花配方颗粒正品基原植物忍冬Lonicera japonica Thunb.及其同属混伪品短柄忍冬、红腺忍冬、华南忍冬、黄褐毛忍冬、灰毡毛忍冬、金银忍冬、盘叶忍冬、华南忍冬、西南忍冬、细毡毛忍冬、新疆忍冬原植物材料,使用硅胶干燥,凭证标本保存于中国中医科学院中药资源中心,见表1。
1.2 配方颗粒
从华润三九医药股份有限公司、北京中医药大学附属东直门医院、中国中医科学院附属西苑医院购买金银花配方颗粒样品,共计17批,见表2。
1.3 仪器
VeritiTM96孔梯度PCR仪(Applied Biosystems公司);5810R型高速冷冻离心机(Eppendorf公司);DYY-12型电脑三恒多用电泳仪(北京六一仪器厂);SYNGENE凝胶成像系统(GENE公司)。
1.4 试剂
SpeedSTAR HS Taq DNA聚合酶、MightyAmp DNA聚合酶和DL2000 DNA Marker均购自Takara公司。
2 方法
2.1 DNA提取
2.1.1 植物DNA提取 使用改良CTAB法[19]提取金银花及其混伪品基原植物DNA,使用200 μL dd H2O溶解,-20 ℃保存。
2.1.2 配方颗粒DNA提取 使用改进的硅胶吸附柱法进行提取,取20 mg配方颗粒置于2.0 mL微量离心管中,加入1 000 μL提取缓冲液,充分漩涡混匀至配方颗粒全部溶解,56 ℃水浴15 min;取出,冷却至室温,5 000×g离心5 min;取750 μL上清,加入至G2硅胶吸附柱,12 000×g离心1 min;弃穿透液,加入700 μL漂洗缓冲液,12 000×g离心1 min;取出离心柱转移至一新的2.0 mL微量离心管中,使用50 μL洗脱液洗脱。
2.2 鉴别引物设计
基于金银花基原植物忍冬及其同属混伪品间SNP鉴别位点(trnL-trnF序列625G/A)[18-20],设计金银花配方颗粒特异性鉴别引物Jinyinhua-1.F/R和Jinyinhua-2.F/R。使用Primer Premier 5.0 设计引物,参数为:引物长18~25 nt,GC为40%~60%,Tm位于50~60 ℃,扩增产物大小为100~200 bp,引物由生工生物工程(上海)股份有限公司合成,见表3。
2.3 金银花真伪鉴别方法的建立
取金银花及其混伪品DNA,使用设计的鉴别引物进行扩增,用于确定位点特异性PCR反应条件。25 μL PCR反应体系包含2× MightyAmp Buffer Ver.2预混液 12.5 μL,MightyAmp DNA Polymerase (1.25 U·μL-1) 0.6 μL、10 μmol·L-1上游及下游引物各0.25 μL,20% 聚乙烯吡咯烷酮-40(PVP-40)溶液1 μL,10 g·L-1牛血清蛋白(BSA)溶液0.5 μL[21],DNA 模板1 μL(约10 ng)。PCR反应在VeritiTM型96孔梯度PCR扩增仪上进行。初始反应程序见表3。取PCR反应产物,加入5 μL 6× Loading buffer (Takara 公司) 混匀后于溴化乙锭(EB)染色的2.0%琼脂糖凝胶电泳检测,SYNGENE凝胶成像系统观察、成像。根据文献[19]方法对PCR反应条件进行考察,确定可鉴别金银花及其混伪品的位点特异性PCR退火温度、循环数和DNA浓度范围。
2.4 金银花配方颗粒真伪方法的建立
根据2.3项的结果,筛选出特异性鉴别引物Jinyinhua-1.F/Jinyinhua-1.R,取金银花基原植物、混伪品及配方颗粒DNA,考察①退火温度:57,59,61,63,65 ℃;②PCR循环数:35,40,45,50个循环;③Taq种类:SpeedSTAR HS Taq DNA聚合酶、MightyAmp DNA Polymerase;④不同Taq酶量:0.25,0.75,1.25 U对PCR鉴别结果稳定性的影响。筛选出最适鉴别条件,对金银花配方颗粒进行位点特异性PCR鉴别。
2.5 序列测定及分析
金银花配方颗粒特异性PCR扩增阳性产物,使用Sanger法进行测序,由北京睿博兴科科技有限公司完成。对获得的序列,使用BLASTn程序在NCBI核酸数据库中进行比对,以判断鉴别结果的准确性。
2.6 检出限
调整金银花、混伪品及配方颗粒的总DNA至50 mg·L-1,并进行逐级稀释依次获得浓度分别为50,10,2,0.4 mg·L-1的DNA。以所稀释的DNA为模板进行位点特异性PCR,以扩出条带的最低浓度确定检测限。
3 结果与分析
3.1 金银花位点特异性PCR鉴别结果
凝胶电泳结果表明,所有样品仅金银花特异性鉴别引物Jinyinhua-1.F/R在退火温度>53 ℃扩出条带,当退火温度为59,61,63 ℃时仅金银花出现特异性鉴别条带,混伪品无条带。大于30个循环时,金银花样品均出现明显条带,30~45循环时,金银花出现特异性鉴别条带。DNA浓度在0.5~100 mg·L-1时均可获得扩增。因此,本文最终确定的金银花特异性PCR的反应参数为95 ℃预变性5 min 后,(95 ℃ 20 s,63 ℃ 20 s,72 ℃ 20 s)共40个循环,并使用该条件对金银花及其同属混伪品进行扩增,结果金银花均出现条带,混伪品无条带,见图1。
3.2 金银花配方颗粒的位点特异性PCR鉴别
根据3.1项获得的金银花位点特异性PCR鉴别体系,对金银花配方颗粒PCR鉴别反应参数进行筛选和优化,见表3。使用优化后的PCR反应条件对不同来源金银花配方颗粒或基原植物进行扩增,均可获得约100 bp的特异性条带,配方颗粒扩增条带亮度较基原植物条带弱;配方颗粒特异性PCR产物测序峰图与基原植物峰图一致,且与金银花trnL-trnF序列完全相同,见图2。
BLAST结果表明,配方颗粒特异性扩增产物序列与GenBank数据库中相似性最高的是金银花trnL-trnF(KU298636.1),一致性为98%,仅有1个T/A变异,经核对引物序列表明,该SNP位点位于引物倒数第二位,是为了增加特异性而人为引入的错配。
3.3 检出限
使用优化后的PCR反应条件,对不同浓度的金银花配方颗粒DNA模板进行位点特异性PCR扩增。DNA模板浓度在50~10 mg·L-1时,金银花配方颗粒均能扩增出约110 bp的特异性鉴别条带;降低至2 mg·L-1后,部分厂商配方颗粒无法扩增,见图3。
4 讨论与展望
中药配方颗粒是一种经水煮沸提取1 h以上并加入辅料制成的颗粒状饮片,已完全失去了原药材的性状与显微鉴别特征,难以用传统鉴定方法对其真实性进行有效鉴定,无法满足《中药配方颗粒质量控制与标准定技术要求(征求意见稿)》提出的“对栽培、养殖或野生采集的药用动植物,应准确鉴定其种,不同种的中药材不可相互混用”的要求。本研究运用位点特异性PCR技术,对金银花配方颗粒及其基原植物进行鉴别。经过优化DNA 提取方法后,药材与配方颗粒均成功提取到DNA,采用凝胶电泳或测序比对均能成功鉴定到物种。动植物DNA经长时间煮沸提取后会发生严重降解,DNA降解程度类似古DNA样品,难以存留超过200 bp的DNA片段[22-23]。本研究使用了3對不同扩增长度的鉴别引物进行PCR反应,仅Jinyinhua-1.F/R引物在金银花配方颗粒中获得扩增产物,长度约100 bp,其结果与崔占虎等在水提液中获得的片段长度类似[13]。
本研究结果证明,即使在长时间煮沸提取的中药配方颗粒中,也有短片段DNA存留,可以使用特异性PCR的方式对其物种基原进行鉴定。由于不同中药品种具有不同性质,其配方颗粒加热提取时间、加水用量、辅料用量、干燥方法均有不同,应根据配方颗粒的性质和制备工艺,考察并选择合适的DNA提取方法,寻找高稳定性DNA片段,遵循中药分子鉴定使用原则[24],使用短片段扩增与鉴定的方式建立配方颗粒DNA分子鉴别方法,并测试方法对原料药的适用性,从而建立覆盖原料、中间体、成品的配方颗粒真实性鉴别及溯源体系。由于配方颗粒DNA片段短,辅料干扰性大,基于SNP或短序列扩增的特异性鉴别技术,如位点特异性PCR、快速PCR、实时荧光定量PCR、环介导等温核酸扩增技术及高分辨率熔解曲线鉴别技术等在中药配方颗粒产业的原料收购、加工及市场流通、产品追溯与仲裁等方面将起到更好的控制和监管的作用,发挥更大的经济效益和社会效益。
[参考文献]
[1] 李睿,翟华强,田伟兰,等. 中药煮散的历史源流及其与现代配方颗粒的对比性分析[J]. 中国中药杂志, 2016, 41(5): 965.
[2] 刘晖晖,李盛青,詹若挺,等.中药配方颗粒发展现状与临床推广应用面临的主要问题分析[J]. 世界科学技术——中医药现代化, 2011, 13(1):9.
[3] 广东省食品药品监督管理局. 广东省中药配方颗粒标准[M]. 北京: 中国医药科技出版社, 2013:1.
[4] 蒋超, 袁媛, 刘贵明, 等. 基于EST-SSR的金银花分子鉴别方法研究[J]. 药学学报, 2012, 47(6): 803.
[5] Jiang C, Jin Y, Zhao X, et al. Rapid and robust authentication of deer antler velvet product by fast PCR-RFLP analysis[J]. Mitochondrial DNA Part A, 2017: 1.
[6] 张嘉丽,黄宇航,宋明,等.基于ITS序列鉴别真菌类药材马勃及其混伪品[J]. 世界中医药,2016,11(5):777.
[7] 胡峻, 詹志来, 袁媛, 等. 基于熔解曲线分析技术的木通类药材的分子鉴别[J]. 中国中药杂志, 2015, 40(12): 2304.
[8] Newmaster S G, Grguric M, Shanmughanandhan D, et al. DNA barcoding detects contamination and substitution in North American herbal products[J]. BMC Med, 2013, 11(1): 222.
[9] 蒋超, 崔占虎, 袁媛, 等. 菟丝子, 莱菔子与其易混淆品的快速PCR法鉴别研究[J]. 中国中药杂志, 2016, 41(2): 211.
[10] 马红梅,于静,戴明,等. 适用于冬虫夏草和新疆虫草鉴别的DNA条形码技术研究[J]. 世界科学技术——中医药现代化,2016,18 (5):826.
[11] Jiang C, Yuan Y, Chen M, et al. Molecular authentication of multi-species honeysuckle tablets[J]. Genet Mol Res, 2013, 12(4): 4827.
[12] 崔占虎,龙平,王颖莉,等.DNA 分子标记技术在中成药鉴定中的应用与展望[J]. 中草药, 2015,38(1):188.
[13] 崔占虎,蒋超,黄璐琦,等. 断肠草与金银花类药材水提液特异性PCR鉴定方法研究[J]. 中国中药杂志, 2013,38(16):2563.
[14] Lo Y T, Li M, Shaw P C. Identification of constituent herbs in ginseng decoctions by DNA markers[J]. Chin Med, 2015, 10(1): 1.
[15] 崔占虎, 蒋超, 李曼辉, 等. 连翘败毒丸中原料药材的分子鉴别[J]. 药学学报, 2013, 48(4): 590.
[16] Jiang C, Yuan Y, Yang G, et al. Fluorescence visual detection of herbal product substitutions at terminal herbal markets by CCP-based FRET technique[J]. Sci Rep, 2016, 6:33540.
[17] 中国药典. 一部[S]. 2015:372.
[18] 蒋超, 侯静怡, 黄璐琦, 等. 快速 PCR 方法在金银花真伪鉴别中的应用[J]. 中国中药杂志, 2014, 39(19): 3668.
[19] 蒋超, 张雅华, 陈敏, 等. 基于双向位点特异性 PCR 的金银花真伪鉴别方法研究[J]. 中国中药杂志, 2012, 37(24): 3752.
[20] Yuan Y, Jiang C, Liu L, et al. Convenient, sensitive and high-throughput method for screening botanic origin[J]. Sci Rep, 2014, 4: 5395.
[21] 蒋超, 崔占虎, 袁媛, 等. PCR 增强剂对药材 DNA分子鉴定的影响[J]. 中国中药杂志, 2013, 38(16): 2571.
[22] Pbo S, Gifford J A, Wilson A C. Mitochondrial DNA sequences from a 7000-year old brain[J]. Nucleic Acids Res, 1988, 16(20): 9775.
[23] Cooper A, Lalueza-Fox C, Anderson S, et al. Complete mitochondrial genome sequences of two extinct moas clarify ratite evolution[J]. Nature, 2001, 409(6821): 704.
[24] 黃璐琦, 袁媛, 袁庆军, 等. 中药分子鉴定发展中的若干问题探讨[J]. 中国中药杂志, 2014, 39(19): 3663.
[责任编辑 孔晶晶]
