异补骨脂素纳米结构脂质载体的制备及其体外透皮研究
2017-07-31庞建云刘肖申宝德沈成英连王权刘
庞建云+刘肖+申宝德+沈成英+连王权+刘娟+胡春晓+钟芮娜+许润春+袁海龙
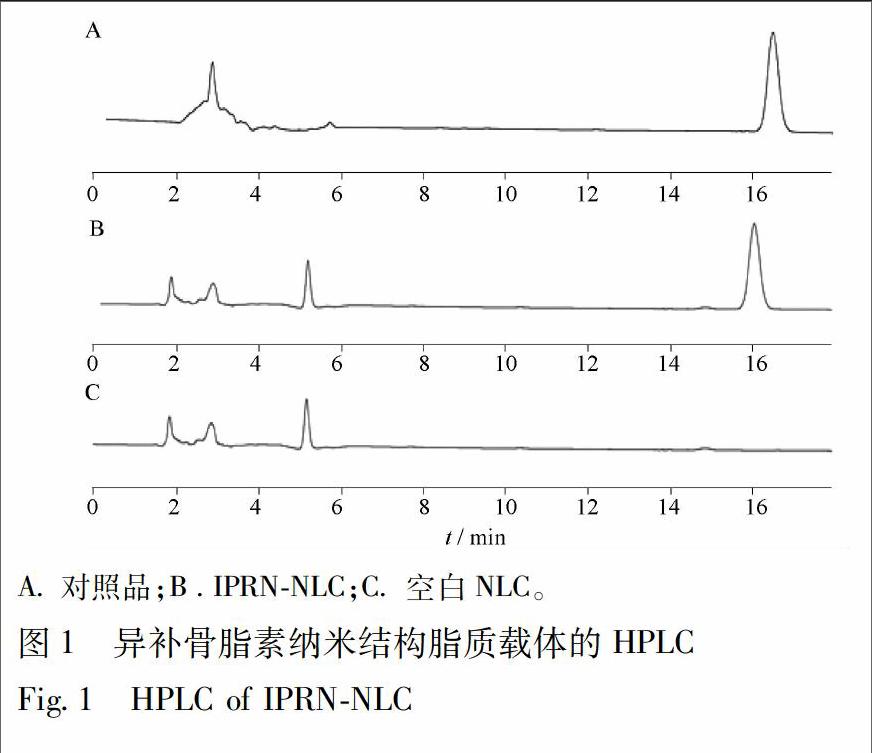
[摘要] 为增加异补骨脂素的皮肤透过量及滞留量,提高其生物利用度。该文采用高压均质法制备异补骨脂素纳米结构脂质载体(IPRN-NLC),以包封率、载药量及平均粒径为评价指标,运用正交实验优化最佳处方。采用Franze扩散池法考察IPRN-NLC的体外透皮。结果表明,最优处方固液脂质比为7∶3,药脂比1∶30,表面活性剂1%,制备的IPRN-NLC平均包封率为(90.25±0.73)%,平均载药量为(1.56±0.27)%,平均粒径为(305±1.57) nm;体外透皮实验显示IPRN-NLC提高了IPRN的皮肤透过量,且皮肤滞留量是IPRN(水)溶液的3倍。采用高压均质法制备的IPRN-NLC提高了IPRN的皮肤透过量及滞留量,在经皮给药领域具有广阔的应用前景。
[关键词] 异补骨脂素;纳米结构脂质载体;体外透皮;皮肤滞留量
[Abstract] To increase the permeation and retention of isopsoralen in skin, and improve its bioavailability.Isopsoralen loaded nanostructure liquid carrier (IPRN-NLC) was prepared by high pressure homogenization andoptimized by orthogonal experiment with the encapsulation efficiency, drug loading and average particle size as the evaluation indexes. The in vitro transdermal permeation of IPRN-NLC was evaluated by Franze diffusion cells.The results showed that solid-liquid lipid ratio of optimum IPRN-NLC formulation was 7∶3,drug-lipid ratio of 1∶30, 1% surfactant. Under these conditions, IPRN-NLC had an average encapsulation of (90.25±0.73)%,drug loading of (1.56±0.27)% and an average particle size of (305±1.57) nm.The in vitro transdermal permeation results showed that IPRN-NLC could increase the amount of IPRN permeated though skin, with 3 times of the epidermal retention as compared with IPRN solution. From the results we can know that the IPRN-NLC prepared by high pressure homogenization can improve the permeation andaccumulation of IPRN in the skin, with wide application prospects in the field of transdermal administration.
[Key words] isopsoralen;nanostructured lipid carrier;in vitro transdermal permeation;skin retention
白癜風是由皮肤和毛囊处的黑素细胞内酪氨酸酶的功能减退、丧失所引起的一种常见的色素障碍性皮肤疾病[1]。黑色素合成减少是白癜风发病的直接原因,而酪氨酸酶是皮肤黑素生物合成的关键酶,因此提高酪氨酸酶的活性是治疗白癜风的关键[2]。补骨脂为豆科植物补骨脂Psoralea corylifolia L.的干燥成熟果实,可用于治疗白癜风、斑秃、牛皮癣以及瘤样皮肤病[3-5]。补骨脂中香豆素类成分异补骨脂素(isopsoralen,IPRN)具有光敏性,可以提高酪氨酸酶的活性,促进黑色素合成,是治疗白癜风的主要药效成分[6]。然而,IPRN为难溶性物质,不易透皮且在皮肤表皮层滞留量少,生物利用度低,严重制约了其在皮肤领域的应用。
纳米结构脂质载体(nanostructured lipid carriers,NLC)是从固体脂质纳米粒(solid lipid nanoparticles,SLN)发展而来的一种新型纳米给药系统[7-8]。NLC是将差异较大的液体脂质加到固体脂质中,增加晶体的混乱度,为药物提供更多容纳空间,不仅提高了载药量,还避免了放置过程中药物泄漏、包封率的降低,提高了药物的稳定性[9-10]。同时,NLC具有良好的皮肤黏附性,覆盖于皮肤后会在皮肤表面形成一层稠密的薄膜,发挥水合效应,从而促进药物的透皮吸收,提高了药物的生物利用度,因此NLC是经皮给药的一种良好的载体,越来越受到广泛的关注[11]。
为增加其在皮肤的滞留量,提高药物的生物利用度,充分发挥药物的疗效,本实验采用高压均质法将IPRN制成纳米结构脂质载体,通过正交试验优化处方,并对IPRN-NLC的体外透皮性能进行评价。
1 材料
Agilent 1260型高效液相色谱仪(美国Agilent公司);TB-215D电子天平(1/10 万,丹佛仪器(北京有限公司);恒温磁力搅拌器(DF-101S集热式恒温加热磁力搅拌器);Winner802纳米激光粒度仪(济南微纳有限公司);TP-6智能透皮试验仪(天津市鑫洲科技有限公司)
IPRN原料药(质量分数98%,陕西金泰生物工程有限公司,批号xh20160415),IPRN对照品(中国食品药品检定研究院,批号110738-201614),单硬脂酸甘油酯(GMS,阿法埃莎化学有限公司),Miglyol 812(广州威希化工有限公司,批号150420),山嵛酸甘油酯(ATO888,法国嘉法狮,批号158355),大豆磷脂(上海太伟药业有限公司,批号20150201),中碳链三甘酯(MCT,北京风礼精求商贸有限责任公司,批号24561),聚氧乙烯氢化蓖麻油RH40(北京风礼精求商贸有限责任公司,批号19049768EO),蓖麻油(天津市光复精细化工研究所,批号141120),色谱甲醇、乙腈,其他试剂为分析纯。
2 方法与结果
2.1 含量测定的方法学建立
2.1.1 色谱条件
Kromasil 100-5C18(4.6 mm×250 mm,5 μm,82592),柱温25 ℃,流动相为乙腈-0.1%磷酸水(38∶62),检测波长246 nm,体积流量1.0 mL·min-1,进样量10 μL。
2.1.2 溶液的配制
2.1.2.1 供试品溶液的配制 精密量取1 mL IPRN-NLC至10 mL量瓶中,加甲醇破乳并定容至刻度,1万 r·min-1离心10 min,0.45 μm的微孔滤膜滤过后即得IPRN-NLC供试品溶液;同法制得空白NLC供试品溶液。
2.1.2.2 对照品贮备液的制备 精密称取IPRN对照品适量,置25 mL量瓶中,加甲醇溶解并定容至刻度线,即得0.404 g·L-1的IPRN对照品储备液,置4 ℃冰箱中保存备用。
2.1.3 专属性考察
分别取对照品溶液、供试品溶液,在上述色谱条件下分别进样10 μL,记录色谱图,结果见图1。IPRN-NLC的保留时间与对照品保留时间一致,在该检测条件下,空白NLC对IPRN的含量测定无干扰。
2.1.4 线性关系考察
精密吸取IPRN对照品贮备液适量,用甲醇分别配置成质量浓度为1.617,8.085,16.17,24.255,32.34 mg·L-1 IPRN溶液。按上述色谱条件进行测定,记录峰面积。以IPRN的质量浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,得线性回归方程Y=8 613.509 16X-0.091 94,R2=0.999 9,结果表明IPRN在1.617~32.34 mg·L-1线性关系良好。
2.1.5 精密度考察
精密吸取质量浓度为16.17 mg·L-1的IPRN对照品溶液,按2.1.1项下色谱条件进样,平行测定6次,计算精密度。结果精密度的RSD为0.22%,表明仪器的精密度良好。
2.1.6 重复性考察
按照2.1.2项下方法平行制备6份供试品溶液进样检测,记录峰面积,计算RSD。重复性RSD为0.080%(n=6),表明该试验方法重复性较好。
2.1.7 稳定性试验
取2.1.2项下的IPRN-NLC供试品溶液,分别在0,2,4,8,12,24 h进样测定,记录峰面积。结果RSD为0.36%,表明IPRN-NLC供试品在24 h内稳定。
2.1.8 回收率测定
精密吸取0.6,0.8,1.0 mL IPRN对照品溶液于10 mL量瓶中,分别加入0.5 mL空白NLC,加甲醇超声破乳0.5 h后定容至刻度线,即得质量浓度分别为0.970 2,1.293 6,1.617 mg·L-1供试品溶液。按2.1.1项色谱条件进样,分别测定3次,计算回收率。测得平均回收率分别为101.2%,98.62%,100.9%,RSD分别为0.65%,0.35%,0.33%,表明该方法回收率良好,制剂辅料对IPRN的测定无影响。
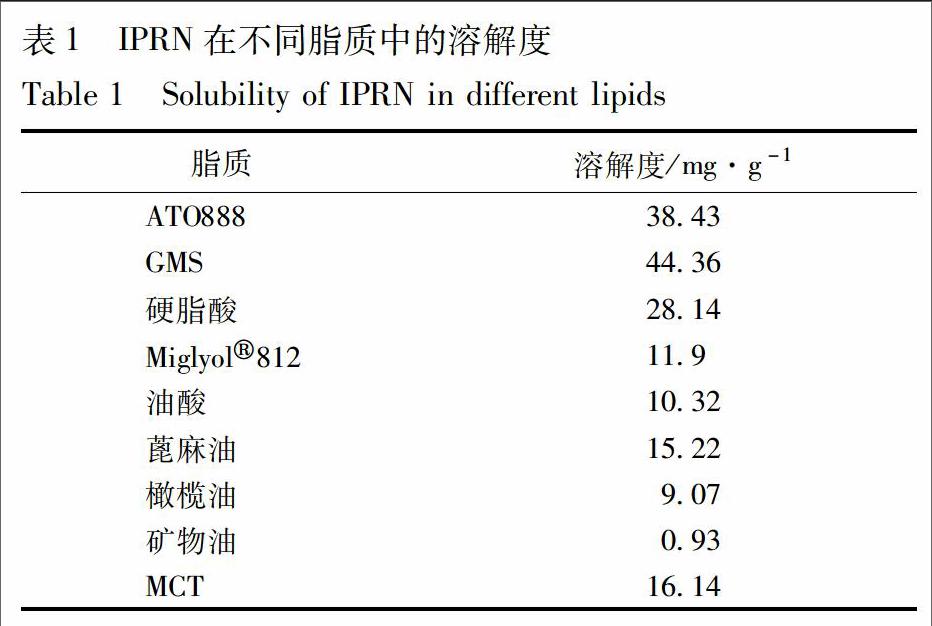
2.2 IPRN在不同固液脂质中溶解度的测定
测定IPRN在不同液体脂质、固体脂质中的溶解度。取过量IPRN原料药于安瓿瓶中,分别加入5 mL Miglyol 812、油酸、蓖麻油、MCT、橄榄油、矿物油,混匀,置恒温磁力搅拌器中,1 200 r·min-1搅拌24 h后,5 000 r·min-1离心10 min,取100 μL上清液于10 mL量瓶中,甲醇定容,过0.45 μm微孔滤膜,进行HPLC分析。分别将相同质量的不同固体脂质分别加热到75 ℃后,在搅拌的条件下向熔融基質中加入过量的IPRN,IPRN在不同脂质中的溶解度见表1。结果表明,IPRN在MCT和ATO888中溶解度较大,且MCT和ATO888有较强的亲和力,故选择MCT为液体脂质,ATO888为固体脂质。
2.3 IPRN-NLC的制备
2.3.1 高压均质法制备IPRN-NLC
采用高压均质法制备IPRN-NLC[12]。精密称取处方量ATO888,MCT于77 ℃水浴加热到熔融状态,再加入IPRN原料药35 mg,搅拌混匀溶解后作为油相。另称取处方量聚氧乙烯氢化蓖麻油RH40、大豆卵磷脂于100 mL烧杯中,加入70 mL蒸馏水,水浴加热至与油相相同的温度,作为水相。在77 ℃条件下,用1 mL注射器将水相缓慢匀速注入到搅拌速度为1 200 r·min-1的油相中,继续搅拌0.5 h,将得到的初乳在1万 r·min-1下高速剪切3次,每次1 min,然后在88 MPa条件下,高压均质循环6次,在室温下冷却,即得IPRN-NLC。同法制得不含IPRN的空白NLC。
2.3.2 粒径及多分散指数(PI)的测定
在室温条件下取IPRN-NLC 适量,经过稀释后,采用Winner-802纳米激光粒度仪测定IPRN-NLC的粒径及PI,测定温度25 ℃(n=3)。
2.3.3 包封率及载药量的测定
本实验采用超滤离心法测定IPRN-NLC的包封率和载药量。精密量取IPRN-NLC分散液0.5 mL,置3万截留相对分子质量的离心超滤管内管中,于1万 r·min-1离心10 min,外管滤液置于2 mL量瓶中,甲醇定容至刻度,过0.45 μm微孔滤膜,按HPLC条件进行测定含药量,为W离。另取0.5 mL分散液置10 mL量瓶内,甲醇超声破乳30 min,定容至刻度,过0.45 μm微孔滤膜,按HPLC条件进行测定含药量,为W总。包封率和载药量计算如下。
包封率 =(W总-W游)/W总×100%
载药量 =(W总-W游)/(W脂质总量+W总-W离)×100%
式中,W总为异补骨脂素纳米脂质载体分散液中的总药量,W游为游离药物量,W脂质总量为固体脂质及液体脂质的总量。
2.3.4 IPRN-NLC处方优化
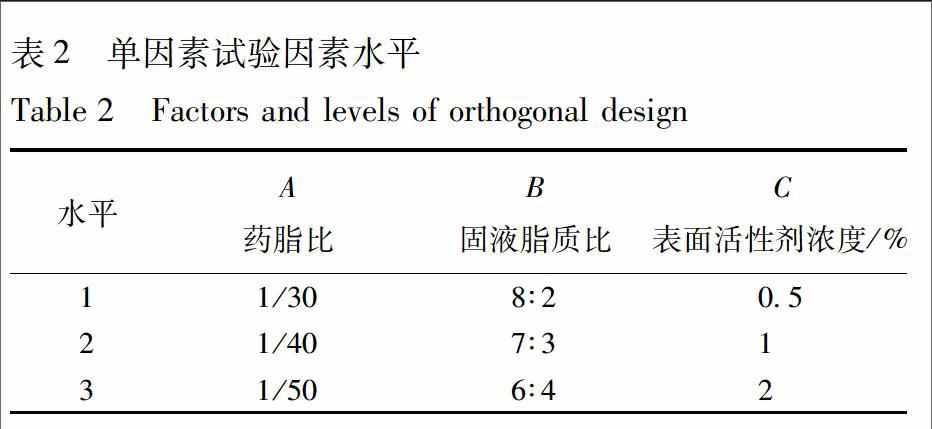
2.3.4.1 试验设计 在单因素考察结果的基础上,选择药脂比(A)、固液脂质比(B)、表面活性剂浓度(C)为考察因素,以粒径、载药量及包封率为评价指标,采用L9(34)正交实验优化IPRN-NLC处方。因本实验为多评价指标的优化试验,包封率及载药量越大越好,而粒径较小时为好,因此,利用综合评分法,将各指标统一综合考察。L9(34)正交试验因素水平表见表2,结果见表3,以载药量,包封率和粒径为评价指标,利用综合加权评分法筛选最佳处方。载药量在制剂中占重要地位,其加权为50;包封率和粒径次之,分别为30,20,总分为100分,以此分为标准对正交试验进行综合加权分析,综合评分=50×(yi1-y1min)/(y1max-y1min)+30×(yi2-y2min)/(y2max-y2min)+20×(yi3-y3min)/(y3max-y3min)。
方差分析见表4,结果表示,极值R反应各因素对实验结果的影响程度,R越大,影响就越大,
即A>C>B>D,其中各因素水平影响度为A1>A3>A2,B2>B3>B1,C2> C3>C1。药脂比(A)和表面活性剂浓度(C)对实验结果有显著影响(P<0.05),为主要影响因素,固液脂质比(B)影响不大。最终确定最优处方为A1B2C2,即药脂比为1∶30,固液脂质比为7∶3,表面活性剂的浓度为1%。
2.3.4.2 处方验证 以最优处方制备3批IPRN-NLC,分别测其包封率、载药量、及粒径。结果显示平均包封率为(90.25±0.73)%、载药量为(1.56±0.27)%、粒径为(305±1.57) nm,表明具有较好的重复性。
2.3.5 X 射线衍射分析(XRD)
采用X射线衍射(XRD)对IPRN 原料药、IPRN-NLC、固态脂质ATO888及IPRN的物理混合物进行表征。分别取适量的上述样品,置于载玻片上压实后,进行XRD分析,结果见图2。由图可知,IPRN在0~40°有多个衍射峰,固体脂质ATO888在20~25°有2个衍射峰,与IPRN原料药XRD图相比,IPRN物理混合物在0~40°的衍射峰显著减弱,可能是一部分IPRN已包裹于脂质中,而从IPRN-NLC的XRD峰形中可以看出IPRN的衍射峰完全消失,表明IPRN已被包裹于NLC中,以无定型状态存在。
2.4 体外透皮试验
2.4.1 离体皮肤处理方法
取SD大鼠,用10%水合氯醛麻醉后,剃毛,剥离腹部皮肤,小心剔除皮下脂肪和结缔组织及血管后,用生理盐水冲洗干净,检查其完整性后即可用。
2.4.2 透皮扩散试验方法
采用改良的Franz扩散池进行试验。将制备好的离体皮肤用滤纸吸干表面水分后固定于Franz扩散池的供给池和接受池之间,角质层面向供给池。接受池中加入13 mL 含20%乙醇的pH 7.4磷酸盐缓冲液,在接受池中加入磁力搅拌子并排出气泡,使皮肤和接受液充分接触,转速为350 r·min-1,水浴温度为(37±0.2)℃,扩散池的有效透皮面积为1.418 cm2。供给池分别注入适量IPRN-NLC和IPRN(水)溶液后开始计时,于0.083,0.25,0.5,0.75,1,2,3,5,7,10,12,24 h從接受池中取样1 mL,同时补加同温等量的空白接受液。样品过0.45 μm滤膜后进样分析,并计算单位面积的累计透过量(Qt),将Qt对时间t进行线性回归,即得透皮动力学方程,所得斜率为透皮速率常数(Js,μg·h-1·cm-2),Qt的计算公式如下。
Qt=VrCt+t-1i=1VsCiA
式中Qt为t时间的累积透过量,Vr代表接受液的体积(13 mL),Ct为每个取样点质量浓度(g·L-1),Vs为取样体积(1 mL),Ci为第i次取样测得的接受液中药物浓度,A为扩散渗透面积(cm2)。
体外透皮试验结束后,分别取下鼠皮,用棉签轻轻擦拭皮肤表面,以去除残留药物,生理盐水反复冲洗,滤纸吸干水分,剪下有效皮肤面积,并将皮肤剪碎,移入5 mL离心管中,精密加2 mL无水甲醇,涡旋5 min后,超声30 min,3 000 r·min-1离心10 min,过0.45 μm滤膜进样检测。记录峰面积,计算IPRN-NLC和IPRN溶液皮肤滞留量。
IPRN溶液及其NLC的透皮结果见图3,表5。结果表明,IPRN溶液及其NLC的透皮吸收存在显著性差异,不仅IPRN-NLC 的Q24及Js明显高于IPRN溶液,且表皮滞留量是IPRN溶液的3倍,说明NLC促进了IPRN的透皮吸收,提高在的皮肤滞留量,有利于药物充分发挥疗效。
3 讨论
在IPRN-NLC的制备过程中,油相和水相的混合时的温度需要大于混合脂质熔点,如果油相加入到水相中,油相会先凝固,使油相分散不均匀,会有较大的粒子形成,而水相加入油相则形成的粒子较均匀,所以本实验采用水相加入到油相的方法[13]。制备NLC常用的几种固体脂质中,IPRN在GMS和ATO888中溶解度较大,但以GMS为固体脂质时,制备的NLC不稳定,放置过程中也会产生沉淀,而ATO888制备的NLC具有良好的稳定性,且IPRN在ATO888中有较高的溶解度,固本实验以ATO888为药物载体。
IPRN-NLC的包封率随固液脂质比的降低先增加后降低,可能因为固体脂质减少液体脂质适量增加,液体脂质扰乱固體脂质的固有晶格结构,为药物提供更多的容纳空间,提高药物的包封率;当固液脂质比降为1时,体系中形成纳米粒减少,不足以吸附表面活性剂,使多余的表面活性剂形成胶束,增加了药物在水相中的溶解度,导致包封率和载药量降低。
透皮实验研究表明,与IPRN溶液相比,IPRN-NLC显著增加了药物的皮肤透过量及在皮肤中的滞留量,可能是NLC可以与皮肤发生水合作用,进而促进药物的透皮吸收,也可能是NLC通过毛囊进入皮肤,在皮肤中形成药库,然后缓慢释放药物。此外,NLC中无刺激性辅料,对皮肤无刺激性,将IPRN包裹于NLC中不仅降低了其对皮肤的刺激性,而且提高了皮肤滞留量,使药物充分发挥疗效。因此将NLC作为IPRN的载体,应用于新型皮肤局部给药制剂,具有较大的研究价值。
[参考文献]
[1] Niu C,Pang G X,Li G,et al.Synthesis and biological evaluation of furocoumarin derivatives on melanin synthesis inmurine B16 cells for the treatment of vitiligo[J].Bioorg Med Chem,2016,(24):5960.
[2] Zhou J,Shi W,Li L H, et al.Detection of misdistribution of tyrosinase from melanosomes to lysosomes and its upregulation under psoralen/ultraviolet A with a melanosome-targeting tyrosinase fluorescent probe[J].Anal Chem,2016,88(8):4557.
[3] 中国药典.一部[S].2015:187.
[4] 白鸽,曹学丽,谭莉,等.补骨脂素和异补骨脂素的分离纯化研究[J].北京工商大学学报:自然科学版,2009,27(5):1.
[5] 陈小川,李紫微,唐慧娴,等. 基于UHPLC技术的补骨脂指纹图谱研究[J]. 世界科学技术——中医药现代化, 2014 (4) :865.
[6] Conforti F,Marrelli M,Menichini F,et al.Natural and synthetic furanocoumarins as treatment for vitiligo and psoriasis[J].Curr Drug Ther,2009,4(1):38.
[7] 郑娟,沈成英,庞建云,等.丹参酮ⅡA纳米结构脂质载体的处方优化及其体外透皮研究[J].中国中药杂志,2016,41(17):3232.
[8] Rhythm A,Sameer S,Katiyar,et al.Solid lipid nanoparticles and nanostructured lipid carrier-based nanotherapeutics in treatment of psoriasia:a comparative study[J].Expert Opin Drug Deliv,2017,14(2):165.
[9] Pardeike Jana,Hommoss Aiman,Muller R H.Lipid nanoparticles(SLN,NLC)in cosmetic and pharmaceutical dermal products[J]. Int J Pharm,2009,366(1/2):170.
[10] Lav K,Kamla P.Development of thermodynamically stable nanostructured lipid carrier system using central composition design for zero order permeation of econazole nitrate though epidermis[J].Pharm Dev Technol,2013,18(3):634.
[11] Pardeike J,Schwabe K,Muller R H. Influence of nanostructured lipid carriers(NLC)on the properties of the Cutanova Nanorepari Q10 cream and the in vivo skin hydration effect [J].Int J Pharm,2010,396(1/2):166.
[12] Jia L J, Zhang D R, Li Z Y, et al.Nanostructured Lipid carriers for parenteral delivery of silybin: biodistribution and pharmacokinetic studies [J]. Colloids Surface B, 2010, 80(2):213.
[13] 杜广胜.TPGS 乳化的尼美舒利纳米结构脂质载体的研究[D].天津:天津大学,2013.
[责任编辑 孔晶晶]
