快速PCR方法在哈蟆油真伪鉴别中的应用研究
2017-07-31何志一唐先明刘建辉袁媛蒋超赵玉
何志一+唐先明+刘建辉+袁媛+蒋超+赵玉洋+王洋

[摘要] 该研究依据哈蟆油Cyt b基因155位SNP位点设计位点特异性PCR引物,采用碱裂解法提取基因组DNA,2步循环 PCR 程序进行 PCR 反应,并对PCR反应条件进行优化,从而建立起一种哈蟆油及其4种常见混伪品的快速PCR鉴别方法。该方法在90 ℃变性3 s,62 ℃退火延伸20 s进行32个循环时,加入2 μL 100×SYBR Green Ⅰ染料,正品显示出明亮绿色荧光,而混淆品不显示荧光。该方法准确、简便,40 min内即可完成鉴别,为哈蟆油药材现场快速鉴定提供技术支持。
[关键词] 快速PCR;哈蟆油;分子鉴定;荧光检测
[Abstract] Rapid allele-specific PCR primer was designed base on Cytb 155 A/T single nucleotide polymorphism, DNA was extracted by alkaline lysis and the PCR reaction systems including denatured and annealing temperature and cycle numbers were optimized. The results were performed to authenticate Ranae Oviductus and its 4 adulterants. When 100×SYBR Green I was added in the PCR product at 90 ℃ denatured 3 s, 62 ℃ annealing 20 s and 32 cycle. Ranae Oviductus visualized strong green fluorescence under 365 nm UV lamp whereas adulterants appeared negative. The whole process can be completed in 40 minutes.The established method provides the technical support for authentication of the Ranae Oviductus.
[Key words] rapid PCR;Ranae Oviductus;molecular authentication
哈蟆油Ranae Oviductus为蛙科动物中国林蛙Rana temporaria chensinensis David雌蛙的輸卵管,经采制干燥而得。具有补肾益精,养阴润肺的功效,用于病后体弱,神疲乏力,心悸失眠,盗汗,痨嗽咳血[1]。是一种集食用药用于一身的名贵中药材。由于多方面原因导致哈蟆油严重的供不应求,致使伪品充斥于市。目前市场上的伪品哈蟆油主要有黑龙江林蛙油、青蛙油、蟾蜍油、牛蛙油 4类,其他伪品类型少见[2-3]。2015年版《中国药典》规定哈蟆油的鉴别方法为性状鉴定、高效液相色谱法鉴定及膨胀度测定法,但这些方法易受人为因素、环境条件或药材本身的限制,实践中哈蟆油的鉴定仍感到十分困难。
随着分子生药学的发展,分子鉴定技术在哈蟆油药材的鉴别中得到不断的应用[3-6],很大程度上弥补了传统鉴别方法的不足。但是,已建立的哈蟆油分子鉴别方法,从模板的提取、PCR 反应到最终结果分析,单个样品的鉴定步骤繁琐,耗时长,且需要电泳检测或序列分析比对,不利于现场快速鉴别的使用。
近年来,快速PCR方法已成功用于金银花[7],蛇类[8],太子参[9],人参、西洋参[10]等中药材的真伪鉴别,因此本项研究基于快速PCR方法对哈蟆油及其常见混伪品(黑龙江林蛙油、黑斑蛙油、蟾蜍油、牛蛙油)进行鉴别研究,有效的提高哈蟆油鉴别反应效率,为哈蟆油药材的鉴别提供更加符合实际需要、简便快捷的方法。
1 材料与仪器
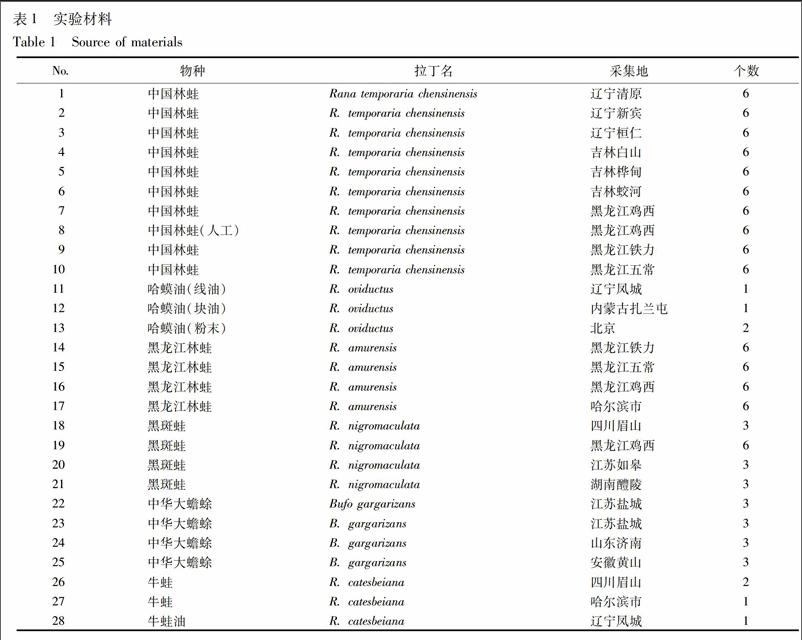
1.1 药材 收集不同产地中国林蛙10批、黑龙江林蛙4批、黑斑蛙4批、中华大蟾蜍4批、牛蛙2批,哈蟆油3批,牛蛙油1批。所有基原动物按传统加工方法分别制成哈蟆油、黑龙江林蛙油、黑斑蛙油、蟾蜍油、牛蛙油,另选取哈蟆油药材3批进行快速PCR方法研究。样品分别采自吉林、黑龙江、辽宁、内蒙古、山东、江苏、湖南、四川等地。经黑龙江中医药大学中药资源与开发教研室王振月教授鉴定,凭证标本保存于哈尔滨市食品药品检验检测中心,见表1。
1.2 仪器 S1000型梯度PCR仪(Bio-rad公司);ETC811型PCR仪(东胜兴业科学仪器有限公司);22R型高速冷冻微量离心机(Beckman公司);ZH-2型漩涡震荡器(天津药典标准仪器厂);MM400型球磨机(Retsch公司);DYY-6C型电泳仪(北京六一仪器厂);310型凝胶成像系统(UVP公司),2000C型分光光度计(NanoDrop公司)。
1.3 试剂 琼脂糖(西班牙 Biowest Agarose);GelRed购自 Biotium 公司;SpeedStar HS Taq DNA 聚合酶、rTaq DNA 聚合酶、DL 2000 DNAMarker 购自 TaKaRa 公司;Transfast Taq DNA 聚合酶购自Transgen公司,Phanta Max Super-Fidelity DNA 聚合酶购自 Vazyme公司;SYBR Green Ⅰ购自 Invitrogen 公司;其他试剂均为国产分析纯。
2 方法
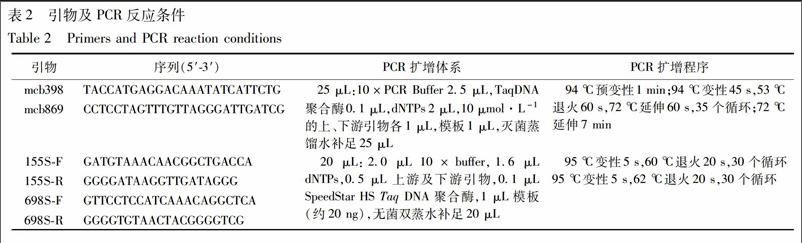
2.1 基因组DNA提取及检测 称取10 mg研磨好的药材粉末,使用碱裂解法[11]提取总DNA,采用10%的Chelex-100进行纯化,并用超微量分光光度计检测DNA的浓度及纯度。取不同样品DNA,分别将浓度稀释为20 mg·L-1用于PCR反应。选择通用引物mcb398,mcb869[12]对哈蟆油及其混伪品样品进行扩增。引物序列及扩增程序见表2。PCR 产物用1%琼脂糖凝胶电泳检测,在凝胶成像系统中观察并记录,并对PCR产物进行双向测序。
2.2 基于Cyt b序列的哈蟆油位点特异性鉴别引物设计 从GenBank中下载得到中国林蛙、黑龙江林蛙、黑斑蛙、中华大蟾蜍、牛蛙Cytb序列。测序所得序列使用软件CodonCode Aligner校对拼接,去除引物区,将下载和测序获得序列使用BioEdit软件进行比对,筛选出哈蟆油基原物种中国林蛙特有的变异位点,根据变异位点使用Primer 5.0软件进行引物设计,在引物3′末端倒数第二位引入人为错配。设计出2对鉴别引物,分别命名为155S-F/155S-R(扩增片段约为530 bp),698S-F/698S-R(扩增片段约为105 bp),由Invitrogen 公司合成,序列见表2。
2.3 PCR反应条件优化 根据引物的Tm及产物长度设置PCR反应的初始反应条件。取不同样品DNA用于确定快速PCR反应条件。PCR 反应在 S1000 型PCR仪上进行,反应体系和初始反应程序见表2。反应结束后取PCR 反应产物6 μL,加入 2 μL 6×Loading buffer 混匀后于GelRed染色的 1% 琼脂糖凝胶电泳,凝胶成像系统观察、成像。
利用哈蟆油SNP鉴别引物进行快速位点特异性PCR反应,并依次考察退火温度:65,64,62,61,60 ℃;循环数:35,32,30,28个循环;变性温度:95,90,88,86 ℃;变性时间: 5,3,1 s;退火延伸时间:20,18,16,10 s;引物终浓度:0.1,0.15,0.25 μmol·L-1;dNTP终浓度:125,200 μmol·L-1;哈蟆油模板DNA用量:10,20,40,60 ng;Taq酶种类:rTaq DNA 聚合酶,SpeedStar HS Taq DNA 聚合酶,Phanta Max Super-Fidelity DNA 聚合酶,Transfast Taq DNA 聚合酶;不同PCR仪:S1000型PCR 仪 (Bio-rad公司),ETC811型PCR仪(东胜兴业科学仪器有限公司),对PCR 反应稳定性的影响。
2.4 PCR产物检测 在PCR 扩增产物中加入 2 μL 100 × SYBR Green Ⅰ,并于365 nm 紫外波长下进行检测,出现绿色荧光为阳性扩增产物。
3 结果与分析
3.1 模板DNA提取质量 由于碱裂解法提取的 DNA 无法通过凝胶电泳检测[13],本文使用通用引物进行扩增,以检测所获得 DNA 质量。1%琼脂糖凝胶电泳检测结果表明,利用mcb398,mcb869引物,正品哈蟆油药材及其混淆品均获得约 500 bp 大小的扩增产物,见图 1,表明提取的DNA 可以满足PCR 反应的要求。
3.2 鉴别引物的设计及验证 按照2.2设计的2对位点特异性鉴别引物中,155S-F/155S-R的PCR扩增特异性较698S-F/698S-R引物好,故本研究选取155S-F/155S-R作为哈蟆油及其伪品的鉴别引物,结果见图2。
3.3 快速PCR反应条件的确定 在位点特异性PCR引物设计中人为的引入了错配位点,因此要求
严格的反应条件,兼顾快速PCR的扩增效率,本文采用两步法,30个循环进行PCR反应条件的优化。在此基础上依次对退火温度、循环数、变性温度、变性时间、退火时间、引物用量、dNTP用量、模板用量进行考察。结果显示:①在退火温度60~64 ℃,哈蟆油扩增条带随温度的升高逐渐减弱,在62 ℃时目的条带亮度较强,混伪品未检出条带,荧光检测结果与电泳结果一致,故本研究选择62 ℃作为退火延伸温度。②当循环数≥30时,哈蟆油样品可以得到目的条带,但是循环数为30时,荧光检测结果不明显,兼顾扩增产量与反应时间,故本文选择32次循环。③当变性温度≥88 ℃时,可以得到目的条带,随着变性温度的降低,PCR成功率随着降低,但是88 ℃时条带弱,故选择90 ℃作为变性温度。④变性时间为3 s 时仍然可以进行有效扩增,故选择3 s作为变性时间。⑤退火延伸时间对扩增成功率有着重要影响,退火时间超过18 s时才能获得有效的扩增,因此次选择20 s为退火时间。⑥当引物终浓度在0.1~0.25 μmol·L-1时,哈蟆油样品有目的条带,但是随着引物用量的提高,正品与混伪品的荧光检测结果区别越不明显,这可能是生成了引物二聚体,影响到荧光检测结果,故本文选择其用量为0.1 μmol·L-1。⑦当dNTP终浓度为125 μmol·L-1时,能够扩增出明亮的条带,随着其用量的增加条带逐渐变弱,因此将其用量定为125 μmol·L-1,引物和dNTP用量均不宜太高,這与学者报道相符[14]。⑧当模板用量10~60 ng时,均只有哈蟆油样品扩增出单一的目的条带,荧光检测结果与电泳结果一致。
综合以上优化结果,确定哈蟆油快速PCR鉴别方法为:PCR反应体系为20 μL:2.0 μL 10×buffer,1.0 μL dNTPs(2.5 mmol·L-1),0.2 μL 上游及下游引物(10 μmol ·L-1),0.1 μL SpeedStar HS Taq DNA聚合酶,1 μL(约20 ng)模板 DNA,无菌双蒸水补足至20 μL。PCR反应参数为90 ℃ 3 s,62 ℃ 20 s,32 个循环。
采用以上反应条件分别使用4种快速DNA聚合酶,其中SpeedStar HS Taq DNA 聚合酶,Phanta Max Super-Fidelity DNA 聚合酶均能实现对哈蟆油的真伪鉴别,rTaq DNA 聚合酶、Transfast Taq DNA 聚合酶未能得到有效扩增。使用不同厂家型号的PCR仪对哈蟆油及同属近缘种样品进行快速 PCR扩增,结果表明:S1000型PCR 仪 (Bio-rad公司),ETC811型PCR仪(东胜兴业科学仪器有限公司),电泳检测后均可获得样品的特异性目的条带,反应条件优化见表3。
3.4 快速PCR反应的荧光检测 选择优化的哈蟆油快速 PCR反应参数,对不同产地的哈蟆油及其混伪品样品进行快速 PCR 扩增,在扩增产物中加入 2 μL 100 × SYBR Green Ⅰ,于 365 nm 紫外波长下进行荧光检测。结果表明,哈蟆油样品均显示出明亮绿色荧光,而伪品不发出荧光,取6 μL PCR产物进行凝胶电泳检测,哈蟆油正品均扩增出目的条带,混伪品均无条带,见图3。
4 讨论
动物药材作为中药材的重要组成部分,被广泛应用于临床,具有疗效确切、经济价值高等特点,对其进行准确鉴定至关重要。传统的性状、理化鉴别需要经验丰富的专业人员,且动物药鉴定和分类学的专业人员较少,难免存在主观性强、重复性和稳定性差等缺陷等问题[15]。随着分子生物学的发展,分子鉴定技术已成为中药材传统鉴别方法的有益补充。
有关哈蟆油的PCR鉴别方法已有报道,但是由于哈蟆油药材本身遇水膨胀,给哈蟆油的DNA提取带来一定的困难,提取过程复杂,成功率低,已建立的PCR方法操作复杂,耗时长,这些因素制约了该方法的深入应用。碱裂解法适用于中药材DNA的快速提取,需要样品量少,提取试剂简单,操作简便,5 min即可完成DNA提取,快速PCR技术可以在确保PCR反应灵敏度和特异性的前提下尽可能缩短PCR时间、提高检测效率[16]。采用碱裂解法进行DNA提取,快速PCR进行哈蟆油鉴别较经典PCR鉴别方法具有准确、快速、简便等优势。
本项研究采用碱裂解法成功提取各样品的基因组DNA,但DNA纯度不高,为了得到满足于后续试验要求的模板DNA,本研究使用Chelex-100对碱裂解提取得到DNA进行了纯化,提高了DNA纯度与PCR扩增效率,为后续快速PCR方法的建立奠定了基础。通过对位点特异性 PCR 进行条件优化,结合DNA快速提取与荧光检测技术,建立了一种哈蟆油的快速PCR检测方法,实现了在 40 min 内简单、快速、直观的鉴别哈蟆油及其常见混伪品的目的。该方法对鉴别人员的专业及仪器要求不高,实用性强,有助于实现哈蟆油药材现场、准确、快速鉴定的推广与应用。本研究对哈蟆油最常见的4种蛙类混伪品进行了鉴别研究,对于哈蟆油非蛙类的伪品如:鳕鱼精巢及琼脂蛋白胨、马铃薯加工品没有涉及,因此本研究所建立方法对非蛙类伪品的适用性有待于进一步研究。
[参考文献]
[1] 中国药典.一部[S].2015:255.
[2] 朱键勋. 哈蟆油药材学及其与生态环境质量相关性的研究[D]. 长春:长春中医药大学,2013.
[3] 陈丽娟. 哈蟆油PCR鉴别方法的建立[D]. 长春:吉林农业大学,2012:9.
[4] 杨学干,王义权,周开亚,等.中药材哈蟆油PCR鉴定的初步研究[J].应用与环境生物学报,2000,6(2):166.
[5] 郭立宏,杜智恒,宁方勇,等.中国林蛙真伪品的PCR鉴别[J]. 中国畜牧兽医,2010,37(5):96.
[6] 高晓晨,刘冬,白俊武,等.哈蟆油基原物种DNA分子鉴定研究[J].吉林中医药,2014(11):1147.
[7] 蒋超,侯静宜,黄璐琦,等.快速PCR方法在金银花真伪鉴别中的应用[J].中国中药杂志,2014,39 (19):3668.
[8] 陈康,蒋超,袁媛,等.快速PCR方法在蛇类药材真伪鉴别中的应用[J].中国中药杂志,2014,39 (19):3673.
[9] 赵丹,周涛,江维克,等.太子参药材的快速分子鉴定[J].中国中药杂志,2014,39 (19):3689.
[10] 崔占虎,袁媛,张景景,等.基于快速PCR方法的人参属药用植物鉴别研究[J].中药材,2015,38(8):1634.
[11] 蒋超,黄璐琦,袁媛,等.使用碱裂解法快速提取药材DNA方法的研究[J].药物分析杂志,2013(7):1081.
[12] Verma S K, Singh L. Novel universal primers establish identity of an enormous number of animal species for forensic application[J].Mol Ecol Notes, 2003, 3(1):28.
[13] 鐘罗宝,陈谷.一种适用于人规模转基因作物PCR检测的简易DNA提取方法[J].现代食品科技,2008 (8):794.
[14] Wang H,Kim M K,Kwon W S,et al Molecular authentication of Panax ginseng and ginseng products using robust SNP markers in ribosomal external transcribed spacer region[J]. J Pharm Biomed Anal,2011,55(5):972.
[15] 崔丽娜,杜鹤,张辉.我国药用动物分子遗传标记鉴别研究进展[J].吉林中医药,2011,31(1):86.
[16] 杨文超,张晓东. 快速PCR研究进展[J]. 中国生物工程杂志,2007(4): 99.
[责任编辑 吕冬梅]
